Proair Inhaler 100mcg Salbutamol Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é ProAir e como é usado?
ProAir é um medicamento de prescrição usado para tratar os sintomas de asma aguda, grave ou induzida por exercício (broncoespasmo). ProAir pode ser usado sozinho ou com outros medicamentos.
ProAir pertence a uma classe de medicamentos chamados PAH, inibidores de PDE-5, inibidores da enzima fosfodiesterase-5.
Não se sabe se o ProAir é seguro e eficaz em crianças com menos de 4 anos de idade.
Quais são os possíveis efeitos colaterais do ProAir?
ProAir pode causar efeitos colaterais graves, incluindo:
- chiado,
- asfixia,
- outros problemas respiratórios,
- dor no peito,
- ritmo cardíaco acelerado,
- batimentos cardíacos batendo ou vibrando em seu peito,
- dor de cabeça severa,
- batendo em seu pescoço ou ouvidos,
- dor ou ardor ao urinar,
- aumento da sede,
- aumento da micção,
- boca seca,
- odor de hálito frutado,
- cãibras nas pernas,
- constipação,
- batimentos cardíacos irregulares,
- aumento da sede ou micção,
- dormência ou formigamento, e
- fraqueza muscular ou sensação de claudicação
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do ProAir incluem:
- dor no peito,
- batimentos cardíacos rápidos ou acelerados,
- tontura,
- sentindo-se trêmulo ou nervoso,
- dor de cabeça,
- dor nas costas,
- dores no corpo,
- dor de estômago,
- dor de garganta,
- dor sinusal e
- nariz escorrendo ou entupido
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do ProAir. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
O ingrediente ativo do ProAir HFA (sulfato de albuterol) Aerossol de inalação é o sulfato de albuterol, um sal racêmico de albuterol. Sulfato de albuterol tem o nome químico α -[(terc-butilamino) metil]-4-hidroxi-m-xileno-α,α'-diol sulfato (2:1) (sal), e tem a seguinte estrutura química:
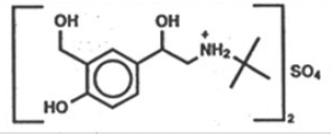
peso molecular do sulfato de albuterol é 576,7 e a fórmula empírica é (C13H21NO3)2 •H2SO4. O sulfato de albuterol é um pó cristalino branco a esbranquiçado. É solúvel em água e ligeiramente solúvel em etanol. Sulfato de albuterol é o nome genérico oficial nos Estados Unidos, e sulfato de salbutamol é o nome genérico recomendado pela Organização Mundial da Saúde. O Aerossol de Inalação ProAir HFA é uma unidade pressurizada de aerossol de dose medida com um contador de doses. ProAir HFA é apenas para inalação oral. Contém uma suspensão microcristalina de sulfato de albuterol em propulsor HFA-134a (1, 1, 1, 2-tetrafluoroetano) e etanol.
Prepare o inalador antes de usar pela primeira vez e nos casos em que o inalador não tenha sido usado por mais de 2 semanas, liberando três sprays no ar, longe do rosto. Após o priming, cada atuação libera 108 mcg de sulfato de albuterol, do bocal do atuador (equivalente a 90 mcg de base de albuterol). Cada recipiente fornece 200 atuações (inalações).
Este produto não contém clorofluorcarbonos (CFCs) como propulsor.
INDICAÇÕES
Broncoespasmo
PROAIR HFA Inalation Aerosol é indicado para o tratamento ou prevenção de broncoespasmo em pacientes com 4 anos de idade ou mais com doença obstrutiva reversível das vias aéreas.
Broncoespasmo Induzido por Exercício
PROAIR HFA Inalation Aerosol é indicado para a prevenção do broncoespasmo induzido pelo exercício em pacientes com 4 anos de idade ou mais.
DOSAGEM E ADMINISTRAÇÃO
Broncoespasmo
Para tratamento de episódios agudos de broncoespasmo ou prevenção de sintomas associados a broncoespasmo, a dosagem usual para adultos e crianças com 4 anos ou mais é de duas inalações repetidas a cada 4 a 6 horas. A administração mais frequente ou um número maior de inalações não é recomendado. Em alguns pacientes, uma inalação a cada 4 horas pode ser suficiente.
Broncoespasmo Induzido por Exercício
A dosagem usual para adultos e crianças com 4 anos de idade ou mais é de duas inalações 15 a 30 minutos antes do exercício.
Informações de administração
Administrar PROAIR HFA apenas por inalação oral. Agite bem antes de cada pulverização. Para manter o uso adequado deste produto e evitar acúmulo e bloqueio de medicamentos, é importante seguir cuidadosamente as instruções de limpeza.
Preparação
Prepare o inalador antes de usar pela primeira vez e nos casos em que o inalador não tenha sido usado por mais de 2 semanas, liberando três sprays no ar, longe do rosto.
Limpeza
Tal como acontece com todos os inaladores de albuterol contendo HFA, para manter o uso adequado deste produto e para evitar acúmulo e bloqueio de medicamentos, é importante limpar o bocal de plástico regularmente. O inalador pode deixar de administrar a medicação se o bocal do atuador de plástico não estiver devidamente limpo e seco. Para limpar: Lave o bocal de plástico com água corrente morna por 30 segundos, sacuda o excesso de água e seque ao ar completamente pelo menos uma vez por semana. Se o paciente tiver mais de um inalador PROAIR HFA, o paciente deve lavar cada um separadamente para evitar conectar o recipiente errado ao atuador de plástico errado. Desta forma, o paciente pode ter certeza de saber sempre o número correto de doses restantes. Nunca conecte um recipiente de medicamento de qualquer outro inalador ao atuador PROAIR HFA e nunca conecte o recipiente PROAIR HFA a um atuador de qualquer outro inalador. Se o bocal ficar bloqueado, lavá-lo removerá o bloqueio. Se for necessário usar o inalador antes que esteja completamente seco, sacuda o excesso de água, recoloque o recipiente, borrife duas vezes no ar longe do rosto e tome a dose prescrita. Após esse uso, o bocal deve ser lavado novamente e deixado secar completamente ao ar. [Vejo Rotulagem de Paciente Aprovada pela FDA ].
Contador de dose
PROAIR HFA possui um contador de doses acoplado ao atuador. Quando o paciente recebe o inalador, um ponto preto aparecerá na janela de visualização até que ele tenha sido injetado 3 vezes, momento em que o número 200 será exibido. O contador de doses fará uma contagem regressiva cada vez que um spray for liberado. Quando o contador de doses atingir 20, a cor dos números mudará para vermelho para lembrar o paciente de entrar em contato com seu farmacêutico para um reabastecimento de medicamento ou consultar seu médico para um reabastecimento de receita.
Quando o contador de doses atingir 0, o fundo mudará para vermelho sólido. O inalador PROAIR HFA deve ser descartado quando o contador de doses exibir 0 ou após a data de validade do produto, o que ocorrer primeiro.
COMO FORNECIDO
Formas de dosagem e pontos fortes
PROAIR HFA é um aerossol de inalação. O PROAIR HFA é fornecido em lata de alumínio pressurizado de 8,5 g/200 atuações com atuador de plástico vermelho com contador de doses e tampa de proteção branca, cada um em caixas de um. Cada atuação fornece 120 mcg de sulfato de albuterol da válvula do canister e 108 mcg de sulfato de albuterol do bocal do atuador (equivalente a 90 mcg de base de albuterol).
Armazenamento e manuseio
PROAIR HFA (sulfato de albuterol) Aerossol de inalação é fornecido como um recipiente de alumínio pressurizado com um atuador de plástico vermelho com um contador de doses e tampa de poeira branca, cada um em caixas de um. Cada vasilha contém 8,5 g da formulação e fornece 200 atuações ( NDC 59310-579-22). Cada atuação fornece 120 mcg de sulfato de albuterol da válvula do canister e 108 mcg de sulfato de albuterol do bocal do atuador (equivalente a 90 mcg de base de albuterol).
AGITAR ANTES DE USAR. Armazenar entre 15° e 25°C (59° e 77°F). Conteúdo sobre pressão. Não perfure ou incinere. Proteger de temperaturas congelantes e exposição prolongada à luz solar direta. A exposição a temperaturas acima de 120°F pode causar explosão. Para melhores resultados, o recipiente deve estar à temperatura ambiente antes do uso. Evite borrifar nos olhos. Mantenha fora do alcance de crianças.
Ver Rotulagem de Paciente Aprovada pela FDA para instruções de preparação e limpeza.
O atuador vermelho fornecido com o aerossol de inalação PROAIR HFA não deve ser usado com o recipiente de qualquer outro produto de aerossol de inalação. O recipiente de aerossol de inalação PROAIR HFA não deve ser usado com o atuador de qualquer outro produto de aerossol de inalação.
inalador PROAIR HFA possui um contador de doses acoplado ao atuador. Os pacientes nunca devem tentar alterar os números do contador de doses ou adulterar o mecanismo do pino dentro do atuador. Descarte o inalador PROAIR HFA quando o contador exibir 0 ou após a data de validade do produto, o que ocorrer primeiro. A quantidade de medicamento rotulada em cada acionamento não pode ser assegurada após o contador exibir 0, mesmo que o recipiente não esteja completamente vazio e continue funcionando. Nunca mergulhe o recipiente na água para determinar o quão cheio o recipiente está (“teste de flutuação”).
O aerossol de inalação PROAIR HFA não contém clorofluorcarbonos (CFCs) como propulsor.
Fabricada por: Teva Respiratory, LLC, Frazer, PA 19355. Fabricada por: IVAX Pharmaceuticals Ireland Waterford, Irlanda. Revisado: fevereiro de 2019
EFEITOS COLATERAIS
O uso do PROAIR HFA pode estar associado ao seguinte:
- Broncoespasmo paradoxal [ver AVISOS E PRECAUÇÕES ]
- Efeitos Cardiovasculares [ver AVISOS E PRECAUÇÕES ]
- Reações de hipersensibilidade imediata [ver AVISOS E PRECAUÇÕES ]
- Hipocalemia [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Um total de 1.090 indivíduos foram tratados com PROAIR HFA Inalation Aerosol, ou com a mesma formulação de albuterol do PROAIR HFA Inhalation Aerosol, durante o programa mundial de desenvolvimento clínico.
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Adultos e adolescentes com 12 anos ou mais
As informações de reações adversas apresentadas na tabela abaixo sobre o aerossol de inalação PROAIR HFA são derivadas de um estudo cego de 6 semanas que comparou o aerossol de inalação PROAIR HFA (180 mcg quatro vezes ao dia) com um placebo duplo-cego combinado com aerossol de inalação HFA e um Comparador ativo HFA-134a inalador de albuterol comercializado cego para avaliador em 172 pacientes asmáticos de 12 a 76 anos de idade. A tabela lista a incidência de todos os eventos adversos (sejam considerados pelo investigador relacionados ao medicamento ou não relacionados ao medicamento) deste estudo que ocorreram a uma taxa de 3% ou mais no grupo de tratamento com aerossol de inalação PROAIR HFA e com mais frequência no grupo de tratamento PROAIR HFA Grupo de tratamento com aerossol de inalação do que no grupo placebo pareado. No geral, a incidência e a natureza dos eventos adversos relatados para PROAIR HFA Inalation Aerosol e o comparador ativo HFA-134a albuterol inalador foram comparáveis.
Incidências de Experiência Adversa (% de Pacientes) em um Ensaio Clínico de Seis Semanas*
Eventos adversos relatados por menos de 3% dos pacientes que receberam PROAIR HFA Aerossol para inalação, mas por uma proporção maior de pacientes com PROAIR HFA para aerossol para inalação do que os pacientes com placebo pareados, que têm o potencial de estar relacionados ao PROAIR HFA Aerossol para inalação, incluindo dor no peito, infecção, diarréia, glossite, lesão acidental (sistema nervoso), ansiedade, dispnéia, distúrbio do ouvido, dor de ouvido e infecção do trato urinário.
Em estudos de pequenas doses cumulativas, tremor, nervosismo e dor de cabeça foram os eventos adversos mais frequentes.
Pacientes pediátricos de 4 a 11 anos de idade
Eventos adversos relatados em um ensaio clínico pediátrico de 3 semanas comparando a mesma formulação de albuterol como no aerossol de inalação PROAIR HFA (180 mcg de albuterol quatro vezes ao dia) com um aerossol de inalação de HFA placebo correspondente ocorreu em uma baixa taxa de incidência (não superior a 2% no grupo de tratamento ativo) e foram semelhantes aos observados em estudos de adultos e adolescentes.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de PROAIR HFA. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. Os relatórios incluíram casos raros de broncoespasmo agravado, falta de eficácia, exacerbação da asma (relatada fatal em um caso), cãibras musculares e vários efeitos colaterais orofaríngeos, como irritação na garganta, alteração do paladar, glossite, ulceração da língua e engasgos.
Os seguintes eventos adversos foram observados no uso pós-aprovação de albuterol inalado: urticária, angioedema, erupção cutânea, broncoespasmo, rouquidão, edema orofaríngeo e arritmias (incluindo fibrilação atrial, taquicardia supraventricular, extrassístoles). Além disso, o albuterol, como outros agentes simpaticomiméticos, pode causar reações adversas como: angina, hipertensão ou hipotensão, palpitações, estimulação do sistema nervoso central, insônia, dor de cabeça, nervosismo, tremores, cãibras musculares, ressecamento ou irritação da orofaringe, hipocalemia, hiperglicemia e acidose metabólica.
INTERAÇÕES MEDICAMENTOSAS
Outros broncodilatadores aerossóis simpaticomiméticos de ação curta não devem ser usados concomitantemente com PROAIR HFA Inalation Aerosol. Se drogas adrenérgicas adicionais forem administradas por qualquer via, elas devem ser usadas com cautela para evitar efeitos cardiovasculares deletérios.
Bloqueadores beta
Os agentes bloqueadores dos receptores beta-adrenérgicos não apenas bloqueiam o efeito pulmonar dos beta-agonistas, como o Aerossol de Inalação PROAIR HFA, mas também podem produzir broncoespasmo grave em pacientes asmáticos. Portanto, os pacientes com asma normalmente não devem ser tratados com betabloqueadores. Entretanto, sob certas circunstâncias, por exemplo, como profilaxia após infarto do miocárdio, pode não haver alternativas aceitáveis ao uso de agentes bloqueadores beta-adrenérgicos em pacientes com asma. Nesse cenário, considerar betabloqueadores cardiosseletivos, embora devam ser administrados com cautela.
Diuréticos
As alterações no ECG e/ou hipocalemia que podem resultar da administração de diuréticos não poupadores de potássio (como diuréticos de alça ou tiazídicos) podem ser agudamente agravadas por beta-agonistas, especialmente quando a dose recomendada de beta-agonista é excedida. Embora o significado clínico desses efeitos não seja conhecido, recomenda-se cautela na coadministração de beta-agonistas com diuréticos não poupadores de potássio. Considere monitorar os níveis de potássio.
Digoxina
Decréscimos médios de 16% e 22% nos níveis séricos de digoxina foram demonstrados após administração intravenosa e oral de dose única de albuterol, respectivamente, a voluntários normais que receberam digoxina por 10 dias. O significado clínico desses achados para pacientes com doença obstrutiva das vias aéreas que estão recebendo albuterol e digoxina de forma crônica não é claro. No entanto, seria prudente avaliar cuidadosamente os níveis séricos de digoxina em pacientes que estão atualmente recebendo digoxina e PROAIR HFA Inalation Aerosol.
Inibidores da Monoamina Oxidase ou Antidepressivos Tricíclicos
O aerossol de inalação de PROAIR HFA deve ser administrado com extrema cautela a pacientes em tratamento com inibidores da monoaminoxidase ou antidepressivos tricíclicos, ou dentro de 2 semanas após a descontinuação de tais agentes, porque a ação do albuterol no sistema cardiovascular pode ser potencializada. Considerar terapia alternativa em pacientes tomando inibidores da MAO ou antidepressivos tricíclicos.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Broncoespasmo Paradoxal
PROAIR HFA Inalação Aerossol pode produzir broncoespasmo paradoxal que pode ser fatal. Se ocorrer broncoespasmo paradoxal, PROAIR HFA Inalation Aerosol deve ser descontinuado imediatamente e uma terapia alternativa instituída. Deve-se reconhecer que o broncoespasmo paradoxal, quando associado a formulações inalatórias, ocorre frequentemente com o primeiro uso de uma nova vasilha.
Deterioração da asma
asma pode deteriorar-se agudamente ao longo de um período de horas ou cronicamente ao longo de vários dias ou mais. Se o paciente necessitar de mais doses de Aerossol de Inalação de PROAIR HFA do que o habitual, isso pode ser um marcador de desestabilização da asma e requer reavaliação do paciente e regime de tratamento, dando atenção especial à possível necessidade de tratamento anti-inflamatório, por exemplo, corticosteróides.
Uso de agentes anti-inflamatórios
O uso isolado de broncodilatadores agonistas beta-adrenérgicos pode não ser adequado para o controle da asma em muitos pacientes. Deve-se considerar precocemente a adição de agentes anti-inflamatórios, por exemplo, corticosteróides, ao regime terapêutico.
Efeitos cardiovasculares
aerossol de inalação de PROAIR HFA, como outros agonistas beta-adrenérgicos, pode produzir efeitos cardiovasculares clinicamente significativos em alguns pacientes, conforme medido pela frequência de pulso, pressão arterial e/ou sintomas. Embora tais efeitos sejam incomuns após a administração de PROAIR HFA Inalation Aerosol nas doses recomendadas, se ocorrerem, o medicamento pode precisar ser descontinuado. Além disso, foi relatado que os beta-agonistas produzem alterações no ECG, como achatamento da onda T, prolongamento do intervalo QTc e depressão do segmento ST. O significado clínico destes resultados é desconhecido. Portanto, PROAIR HFA Inalation Aerosol, como todas as aminas simpaticomiméticas, deve ser usado com cautela em pacientes com distúrbios cardiovasculares, especialmente insuficiência coronariana, arritmias cardíacas e hipertensão.
Não exceda a dose recomendada
Fatalidades foram relatadas em associação com o uso excessivo de drogas simpaticomiméticas inalatórias em pacientes com asma. A causa exata da morte é desconhecida, mas suspeita-se de parada cardíaca após o desenvolvimento inesperado de uma crise asmática aguda grave e hipóxia subsequente.
Reações de hipersensibilidade imediata
Reações de hipersensibilidade imediata podem ocorrer após a administração de sulfato de albuterol, como demonstrado por casos raros de urticária, angioedema, erupção cutânea, broncoespasmo, anafilaxia e edema orofaríngeo. O potencial de hipersensibilidade deve ser considerado na avaliação clínica de pacientes que apresentam reações de hipersensibilidade imediata enquanto recebem PROAIR HFA Inalation Aerosol.
Condições coexistentes
aerossol de inalação PROAIR HFA, como todas as aminas simpaticomiméticas, deve ser usado com cautela em pacientes com distúrbios cardiovasculares, especialmente insuficiência coronariana, arritmias cardíacas e hipertensão; em pacientes com distúrbios convulsivos, hipertireoidismo ou diabetes mellitus; e em pacientes que são excepcionalmente responsivos a aminas simpaticomiméticas. Alterações clinicamente significativas na pressão arterial sistólica e diastólica foram observadas em pacientes individuais e podem ocorrer em alguns pacientes após o uso de qualquer broncodilatador beta-adrenérgico. Foi relatado que grandes doses de albuterol intravenoso agravam diabetes mellitus e cetoacidose preexistentes.
Hipocalemia
Tal como acontece com outros beta-agonistas, o Aerossol de Inalação PROAIR HFA pode produzir hipocalemia significativa em alguns pacientes, possivelmente por meio de derivação intracelular, que tem o potencial de produzir efeitos cardiovasculares adversos. A diminuição geralmente é transitória, não necessitando de suplementação.
Informações de Aconselhamento do Paciente
Ver Rotulagem de Paciente Aprovada pela FDA
Os pacientes devem receber as seguintes informações:
Frequência de uso
A ação do Aerossol Inalatório PROAIR HFA deve durar de 4 a 6 horas. Não use o Aerossol de Inalação PROAIR HFA com mais frequência do que o recomendado. Instruir os pacientes a não aumentar a dose ou a frequência das doses de PROAIR HFA Inalation Aerosol sem consultar o médico. Se os pacientes acharem que o tratamento com PROAIR HFA Inalation Aerosol se torna menos eficaz para o alívio sintomático, os sintomas piorarem e/ou precisarem usar o produto com mais frequência do que o habitual, devem procurar atendimento médico imediatamente.
Primário e Limpeza
Preparação
A preparação é essencial para garantir o teor adequado de albuterol em cada atuação. Instrua os pacientes a preparar o inalador antes de usá-lo pela primeira vez e nos casos em que o inalador não tenha sido usado por mais de 2 semanas, liberando três sprays no ar, longe do rosto.
Limpeza
Para garantir a dosagem adequada e evitar o bloqueio do orifício do atuador, instrua os pacientes a lavar o bocal de plástico vermelho do atuador e secar completamente pelo menos uma vez por semana. Instrua os pacientes que, se tiverem mais de um inalador PROAIR HFA, eles devem lavar cada um em momentos separados para evitar conectar o recipiente errado ao atuador de plástico errado. Dessa forma, eles podem ter certeza de que sempre saberão o número correto de doses restantes. Os pacientes devem ser instruídos a nunca conectar um recipiente de medicamento de qualquer outro inalador ao atuador PROAIR HFA e nunca conectar o recipiente PROAIR HFA a um atuador de qualquer outro inalador. Os pacientes não devem remover o recipiente do atuador, exceto durante a limpeza, pois a recolocação pode liberar uma dose no ar e o contador de doses fará uma contagem regressiva cada vez que um spray for liberado. As instruções de limpeza detalhadas estão incluídas no folheto informativo ilustrado para o paciente.
Contador de dose
Os pacientes devem ser informados de que o PROAIR HFA possui um contador de doses acoplado ao atuador. Quando o paciente recebe o inalador, um ponto preto aparecerá na janela de visualização até que ele tenha sido injetado 3 vezes, momento em que o número 200 será exibido. O contador de doses fará uma contagem regressiva cada vez que um spray for liberado. A janela do contador de doses exibe o número de sprays restantes no inalador em unidades de dois (por exemplo, 200, 198, 196, etc). Quando o contador exibir 20, a cor dos números mudará para vermelho para lembrar o paciente de entrar em contato com seu farmacêutico para um reabastecimento de medicamento ou consultar seu médico para um reabastecimento de receita. Quando o contador de doses atingir 0, o fundo mudará para vermelho sólido. Os pacientes devem ser informados para descartar o inalador PROAIR HFA quando o contador de doses exibir 0 ou após a data de validade do produto, o que ocorrer primeiro.
Broncoespasmo Paradoxal
Informe os pacientes que o aerossol de inalação de PROAIR HFA pode produzir broncoespasmo paradoxal. Instrua os pacientes a descontinuar o aerossol de inalação PROAIR HFA se ocorrer broncoespasmo paradoxal.
Uso concomitante de drogas
Enquanto os pacientes estiverem tomando PROAIR HFA Inalation Aerosol, outros medicamentos inalatórios e medicamentos para asma devem ser tomados apenas conforme indicado por um médico.
Eventos Adversos Comuns
Os efeitos adversos comuns do tratamento com albuterol inalado incluem palpitações, dor no peito, ritmo cardíaco acelerado, tremor ou nervosismo.
Gravidez
Pacientes grávidas ou amamentando devem entrar em contato com seu médico sobre o uso de PROAIR HFA Inalation Aerosol.
Existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas a medicamentos para asma durante a gravidez [ver Uso em populações específicas ].
Informações gerais sobre uso
O uso eficaz e seguro do Aerossol de Inalação PROAIR HFA inclui a compreensão da forma como deve ser administrado.
Agite bem antes de cada pulverização.
Use o Aerossol de Inalação PROAIR HFA somente com o atuador fornecido com o produto. Descarte o inalador PROAIR HFA quando o contador de doses exibir 0 ou após a data de validade do produto, o que ocorrer primeiro. Nunca mergulhe o recipiente em água para determinar o quão cheio o recipiente está (“teste de flutuação”).
Em geral, a técnica de administração do Aerossol Inalatório PROAIR HFA em crianças é semelhante à de adultos. As crianças devem usar o Aerossol de Inalação PROAIR HFA sob supervisão de um adulto, conforme as instruções do médico do paciente.
Rotulagem de Paciente Aprovada pela FDA
Veja o destaque ilustrado Informações para o Paciente folheto.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Em um estudo de 2 anos em ratos Sprague-Dawley, o sulfato de albuterol causou um aumento relacionado à dose na incidência de leiomiomas benignos do mesovário em e acima de doses dietéticas de 2 mg/kg (aproximadamente 15 vezes e 6 vezes o máximo recomendado para humanos dose inalatória diária (MRHDID) para adultos e crianças, respectivamente, na base de mg/m²). Em outro estudo, esse efeito foi bloqueado pela coadministração de propranolol, um antagonista beta-adrenérgico não seletivo. Em um estudo de 18 meses em camundongos CD-1, o sulfato de albuterol não mostrou evidência de tumorigenicidade em doses dietéticas de até 500 mg/kg (aproximadamente 1.900 vezes e 740 vezes o MRHDID para adultos e crianças, respectivamente, em um mg/m² base). Em um estudo de 22 meses em Golden Hamsters, o sulfato de albuterol não mostrou evidência de tumorigenicidade em doses dietéticas de até 50 mg/kg (aproximadamente 250 vezes e 100 vezes o MRHDID para adultos e crianças, respectivamente, na base de mg/m²) .
sulfato de albuterol não foi mutagênico no teste de Ames ou em um teste de mutação em levedura. O sulfato de albuterol não foi clastogênico em um ensaio de linfócitos periféricos humanos ou em um ensaio de micronúcleo de camundongo da cepa AH1.
Estudos de reprodução em ratos não demonstraram evidência de diminuição da fertilidade em doses orais de até 50 mg/kg (aproximadamente 380 vezes o MRHDID para adultos com base em mg/m²).
Uso em populações específicas
Gravidez
Registro de Exposição à Gravidez
Existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas a medicamentos para asma durante a gravidez. Para obter mais informações, entre em contato com os estudos de gravidez de mães para bebês conduzidos pela Organização de Especialistas em Informações de Teratologia em 1-877-311-8972 ou visite http://mothertobaby.org/pregnancystudies/.
Resumo do risco
Não há estudos clínicos randomizados de uso de albuterol durante a gravidez. Os dados disponíveis de estudos epidemiológicos publicados e relatos de casos pós-comercialização de resultados de gravidez após o uso de albuterol inalado não demonstram consistentemente um risco de defeitos congênitos graves ou aborto espontâneo. Existem considerações clínicas com o uso de albuterol em mulheres grávidas [ver Considerações Clínicas ]. Em estudos de reprodução animal, quando o sulfato de albuterol foi administrado por via subcutânea a camundongos prenhes, houve evidência de fenda palatina em menos e até 9 vezes a dose máxima de inalação humana diária recomendada (MRHDID) [ver Dados ].
O risco de fundo estimado de defeitos congênitos graves e aborto para a(s) população(ões) indicada(s) é desconhecido. Na população geral dos EUA, o risco estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2 a 4% e 15 a 20%, respectivamente.
Considerações Clínicas
Risco Materno e/ou Embrião/Fetal Associado à Doença
Em mulheres com asma mal ou moderadamente controlada, há um risco aumentado de pré-eclâmpsia na mãe e prematuridade, baixo peso ao nascer e pequeno para a idade gestacional no recém-nascido. As mulheres grávidas devem ser monitoradas de perto e a medicação ajustada conforme necessário para manter o controle ideal.
Mão de obra ou entrega
Devido ao potencial de interferência do beta-agonista na contratilidade uterina, o uso de PROAIR HFA Inalation Aerosol para alívio do broncoespasmo durante o trabalho de parto deve ser restrito às pacientes em que os benefícios superam claramente o risco. O aerossol de inalação PROAIR HFA não foi aprovado para o manejo do trabalho de parto prematuro. Reações adversas graves, incluindo edema pulmonar, foram relatadas durante ou após o tratamento de parto prematuro com beta2-agonistas, incluindo albuterol.
Dados
Dados de animais
Em um estudo de reprodução de camundongos, sulfato de albuterol administrado por via subcutânea produziu a formação de fenda palatina em 5 de 111 (4,5%) fetos em uma exposição de nove décimos do MRHDID para adultos (em uma base de mg/m² em uma dose materna de 0,25 mg/kg ) e em 10 de 108 (9,3%) fetos em aproximadamente 9 vezes o MRHDID (em uma base de mg/m² em uma dose materna de 2,5 mg/kg). Efeitos semelhantes não foram observados em aproximadamente um décimo primeiro da MRHDID para adultos (em uma base de mg/m² em uma dose materna de 0,025 mg/kg). A fissura palatina também ocorreu em 22 dos 72 (30,5%) fetos de fêmeas tratadas por via subcutânea com isoproterenol (controle positivo).
Em um estudo de reprodução em coelhos, sulfato de albuterol administrado por via oral induziu craniosquise em 7 de 19 fetos (37%) em aproximadamente 750 vezes o MRHDID (em uma base de mg/m² em uma dose materna de 50 mg/kg).
Em um estudo de reprodução em ratos, uma formulação de sulfato de albuterol/HFA-134a administrada por inalação não produziu efeitos teratogênicos em exposições aproximadamente 80 vezes o MRHDID (em uma base de mg/m² em uma dose materna de 10,5 mg/kg).
Um estudo no qual ratas grávidas receberam doses de sulfato de albuterol radiomarcado demonstrou que o material relacionado à droga é transferido da circulação materna para o feto.
Lactação
Resumo do risco
Não existem dados disponíveis sobre a presença de albuterol no leite humano, os efeitos na criança amamentada ou os efeitos na produção de leite. No entanto, os níveis plasmáticos de albuterol após doses terapêuticas inaladas são baixos em humanos e, se presente no leite materno, o albuterol tem uma baixa biodisponibilidade oral [ver FARMACOLOGIA CLÍNICA ].
Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica de albuterol da mãe e quaisquer efeitos adversos potenciais do albuterol na criança amamentada ou da condição materna subjacente.
Uso Pediátrico
segurança e eficácia de PROAIR HFA Inalation Aerosol para o tratamento ou prevenção de broncoespasmo em crianças com 12 anos de idade ou mais com doença obstrutiva reversível das vias aéreas baseia-se em um ensaio clínico de 6 semanas em 116 pacientes com 12 anos de idade ou mais com asma comparando doses de 180 mcg quatro vezes ao dia com placebo e um estudo cruzado de dose única comparando doses de 90, 180 e 270 mcg com placebo em 58 pacientes [ver Estudos clínicos ]. A segurança e eficácia de PROAIR HFA Inalation Aerosol para tratamento de broncoespasmo induzido por exercício em crianças com 12 anos de idade ou mais é baseada em um estudo cruzado de dose única em 24 adultos e adolescentes com broncoespasmo induzido por exercício comparando doses de 180 mcg com placebo [Vejo Estudos clínicos ].
segurança do PROAIR HFA Inalation Aerosol em crianças de 4 a 11 anos de idade é baseada em um ensaio clínico de 3 semanas em 50 pacientes de 4 a 11 anos de idade com asma usando a mesma formulação de albuterol que no PROAIR HFA Inalation Aerosol comparando as doses de 180 mcg quatro vezes ao dia com placebo. A eficácia de PROAIR HFA Inalation Aerosol em crianças de 4 a 11 anos de idade é extrapolada de estudos clínicos em pacientes com 12 anos de idade ou mais com asma e broncoespasmo induzido por exercício, com base em dados de um estudo de dose única comparando o efeito broncodilatador de PROAIR HFA 90 mcg e 180 mcg com placebo em 55 pacientes com asma e um ensaio clínico de 3 semanas usando a mesma formulação de albuterol que em PROAIR HFA Inalação Aerossol em 95 crianças asmáticas de 4 a 11 anos comparando uma dose de 180 mcg de albuterol quatro vezes ao dia com placebo [ver Estudos clínicos ].
segurança e eficácia de PROAIR HFA Inalation Aerosol em pacientes pediátricos com idade inferior a 4 anos não foram estabelecidas.
Uso Geriátrico
Os estudos clínicos do aerossol de inalação PROAIR HFA não incluíram um número suficiente de pacientes com 65 anos ou mais para determinar se eles respondem de forma diferente dos pacientes mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre pacientes idosos e mais jovens. Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, geralmente começando na extremidade inferior da faixa de dosagem, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa [ver AVISOS E PRECAUÇÕES ].
Todos os agonistas beta2-adrenérgicos, incluindo o albuterol, são substancialmente excretados pelos rins, e o risco de reações tóxicas pode ser maior em pacientes com função renal comprometida. Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se ter cuidado na seleção da dose e pode ser útil monitorar a função renal.
SOBREDOSAGEM
Os sintomas esperados com superdosagem são aqueles de estimulação beta-adrenérgica excessiva e/ou ocorrência ou exagero de qualquer um dos sintomas listados em REAÇÕES ADVERSAS, por exemplo, convulsões, angina, hipertensão ou hipotensão, taquicardia com frequências de até 200 batimentos por minuto, arritmias, nervosismo , dor de cabeça, tremor, boca seca, palpitação, náusea, tontura, fadiga, mal-estar e insônia.
Hipocalemia também pode ocorrer. Tal como acontece com todos os medicamentos simpaticomiméticos, a paragem cardíaca e até a morte podem estar associadas ao abuso do aerossol de inalação PROAIR HFA.
tratamento consiste na descontinuação de PROAIR HFA Inalation Aerosol juntamente com terapia sintomática apropriada. O uso criterioso de um betabloqueador cardiosseletivo pode ser considerado, tendo em vista que tal medicação pode produzir broncoespasmo. Não há evidências suficientes para determinar se a diálise é benéfica para a superdosagem de PROAIR HFA Inalation Aerosol.
dose letal oral mediana de sulfato de albuterol em camundongos é superior a 2.000 mg/kg (aproximadamente 6.800 vezes a dose inalatória diária máxima recomendada para adultos com base em mg/m² e aproximadamente 3.200 vezes a dose inalatória diária máxima recomendada para crianças em um mg base /m²). Em ratos maduros, a dose letal mediana subcutânea de sulfato de albuterol é de aproximadamente 450 mg/kg (aproximadamente 3.000 vezes a dose inalatória diária máxima recomendada para adultos com base em mg/m² e aproximadamente 1.400 vezes a dose inalatória diária máxima recomendada para crianças em um base mg/m²). Em ratos jovens, a dose letal mediana subcutânea é de aproximadamente 2.000 mg/kg (aproximadamente 14.000 vezes a dose inalatória diária máxima recomendada para adultos com base em mg/m² e aproximadamente 6.400 vezes a dose inalatória diária máxima recomendada para crianças em mg/m² base). A dose letal mediana por inalação não foi determinada em animais.
CONTRA-INDICAÇÕES
PROAIR HFA Inalation Aerosol é contraindicado em pacientes com histórico de hipersensibilidade ao albuterol e a qualquer outro componente do PROAIR HFA Inalation Aerosol. Casos raros de reações de hipersensibilidade, incluindo urticária, angioedema e erupção cutânea, foram relatados após o uso de sulfato de albuterol. AVISOS E PRECAUÇÕES ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
sulfato de albuterol é um agonista beta 2-adrenérgico. Os efeitos farmacológicos do sulfato de albuterol são atribuíveis à ativação de receptores beta 2-adrenérgicos no músculo liso das vias aéreas. A ativação dos receptores beta2-adrenérgicos leva à ativação da adenilciclase e a um aumento na concentração intracelular de monofosfato cíclico-3', 5'-adenosina (AMP cíclico). Esse aumento do AMP cíclico está associado à ativação da proteína quinase A, que por sua vez inibe a fosforilação da miosina e diminui as concentrações de cálcio iônico intracelular, resultando em relaxamento muscular. O albuterol relaxa o músculo liso de todas as vias aéreas, desde a traqueia até os bronquíolos terminais. O albuterol atua como um antagonista funcional para relaxar as vias aéreas, independentemente do espasmogênico envolvido, protegendo assim contra todos os desafios broncoconstritores. Concentrações aumentadas de AMP cíclico também estão associadas à inibição da liberação de mediadores de mastócitos nas vias aéreas. Embora se reconheça que os receptores beta2adrenérgicos são os receptores predominantes no músculo liso brônquico, os dados indicam que existem beta-receptores no coração humano, 10% a 50% dos quais são receptores beta2-adrenérgicos cardíacos. A função precisa desses receptores não foi estabelecida [ver AVISOS E PRECAUÇÕES ].
albuterol demonstrou na maioria dos ensaios clínicos controlados ter mais efeito no trato respiratório, na forma de relaxamento do músculo liso brônquico, do que o isoproterenol em doses comparáveis, produzindo menos efeitos cardiovasculares. No entanto, o albuterol inalado, como outros fármacos agonistas beta-adrenérgicos, pode produzir um efeito cardiovascular significativo em alguns pacientes, conforme medido pela frequência cardíaca, pressão arterial, sintomas e/ou alterações eletrocardiográficas [ver AVISOS E PRECAUÇÕES ].
Farmacocinética
Os níveis sistêmicos de albuterol são baixos após a inalação das doses recomendadas. Em um estudo cruzado realizado em voluntários saudáveis do sexo masculino e feminino, altas doses cumulativas de PROAIR HFA Inalation Aerosol (1.080 mcg de albuterol base administrados durante uma hora) produziram concentrações plasmáticas máximas médias (Cmax) e exposição sistêmica (AUCinf) de aproximadamente 4.100 pg/ mL e 28.426 pg/mL*h, respectivamente, em comparação com aproximadamente 3.900 pg/mL e 28.395 pg/mL*h, respectivamente, após a mesma dose de um inalador HFA-134a ativo comparador de albuterol. A meia-vida plasmática terminal do albuterol entregue pelo PROAIR HFA Inalation Aerosol foi de aproximadamente 6 horas. A comparação dos parâmetros farmacocinéticos não demonstrou diferenças entre os produtos.
perfil farmacocinético de PROAIR HFA Inalation Aerosol foi avaliado em um estudo cruzado de duas vias em 11 voluntários pediátricos saudáveis, de 4 a 11 anos de idade. Uma administração de dose única de Aerossol de Inalação de PROAIR HFA (180 mcg de albuterol base) rendeu uma média dos quadrados mínimos (SE) Cmax e AUC0-∞ de 1.100 (1,18) pg/mL e 5.120 (1,15) pg/mL*hr, respectivamente. A meia-vida plasmática terminal média dos mínimos quadrados (SE) do albuterol administrado pelo Aerossol de Inalação PROAIR HFA foi de 166 (7,8) minutos.
Metabolismo e eliminação
As informações disponíveis na literatura publicada sugerem que a principal enzima responsável pelo metabolismo do albuterol em humanos é a SULTIA3 (sulfotransferase). Quando o albuterol racêmico foi administrado por via intravenosa ou por inalação após a administração oral de carvão, houve uma diferença de 3 a 4 vezes na área sob as curvas de concentração-tempo entre os enantiômeros (R) e (S) albuterol, com (S) )-albuterol sendo consistentemente maiores. No entanto, sem pré-tratamento com carvão, após administração oral ou inalatória, as diferenças foram de 8 a 24 vezes, sugerindo que o (R)-albuterol é metabolizado preferencialmente no trato gastrointestinal, presumivelmente por SULTIA3.
principal via de eliminação do albuterol é através da excreção renal (80% a 100%) do composto original ou do metabólito primário. Menos de 20% da droga é detectada nas fezes. Após a administração intravenosa de albuterol racêmico, entre 25% e 46% da fração (R)-albuterol da dose foi excretada como (R)-albuterol inalterado na urina.
Insuficiência Geriátrica, Pediátrica, Hepática/Renal
Não foram realizados estudos farmacocinéticos para o Aerossol de Inalação de PROAIR HFA em recém-nascidos ou idosos.
O efeito da insuficiência hepática na farmacocinética de PROAIR HFA Inalação Aerossol não foi avaliado.
efeito da insuficiência renal na farmacocinética do albuterol foi avaliado em 5 indivíduos com depuração de creatinina de 7 a 53 mL/min, e os resultados foram comparados com os de voluntários saudáveis. A doença renal não teve efeito sobre a meia-vida, mas houve um declínio de 67% na depuração de albuterol. Deve-se ter cuidado ao administrar doses altas de Aerossol para inalação PROAIR HFA a pacientes com insuficiência renal [ver Uso em populações específicas ].
Toxicologia e/ou Farmacologia Animal
Pré-clínico
Estudos intravenosos em ratos com sulfato de albuterol demonstraram que o albuterol atravessa a barreira hematoencefálica e atinge concentrações cerebrais de aproximadamente 5% das concentrações plasmáticas. Em estruturas fora da barreira hematoencefálica (glândulas pineal e pituitária), as concentrações de albuterol foram 100 vezes maiores do que em todo o cérebro.
Estudos em animais de laboratório (miniporcos, roedores e cães) demonstraram a ocorrência de arritmias cardíacas e morte súbita (com evidência histológica de necrose miocárdica) quando β-agonistas e metilxantinas foram administrados concomitantemente. O significado clínico destes resultados é desconhecido.
O propulsor HFA-134a é desprovido de atividade farmacológica, exceto em doses muito altas em animais (380-1300 vezes a exposição humana máxima com base em comparações de valores de AUC), produzindo principalmente ataxia, tremores, dispneia ou salivação. Estes são semelhantes aos efeitos produzidos pelos clorofluorcarbonetos estruturalmente relacionados (CFCs), que têm sido amplamente utilizados em inaladores dosimetrados.
Em animais e humanos, o propulsor HFA-134a foi rapidamente absorvido e rapidamente eliminado, com uma meia-vida de eliminação de 3-27 minutos em animais e 5-7 minutos em humanos. O tempo até a concentração plasmática máxima (Tmax) e o tempo médio de residência são extremamente curtos, levando a um aparecimento transitório de HFA-134a no sangue sem evidência de acúmulo.
Estudos clínicos
Broncoespasmo Associado Com Asma
Pacientes adultos e adolescentes com 12 anos de idade ou mais
Em um estudo de 6 semanas, randomizado, duplo-cego, controlado por placebo, o aerossol de inalação PROAIR HFA (58 pacientes) foi comparado a um aerossol de inalação de HFA placebo correspondente (58 pacientes) em pacientes asmáticos de 12 a 76 anos de idade em uma dose de 180 mcg de albuterol quatro vezes ao dia. Um braço de inalador de albuterol HFA-134a comercializado para o avaliador cego (56 pacientes) foi incluído.
As medições seriadas de VEF1, mostradas abaixo como alteração percentual da linha de base do dia de teste no Dia 1 e no Dia 43, demonstraram que duas inalações de Aerossol de Inalação PROAIR HFA produziram uma melhora significativamente maior no VEF1 em relação ao valor de pré-tratamento do que o placebo correspondente, bem como um efeito broncodilatador comparável ao inalador de albuterol HFA-134a comparador ativo comercializado.
FEV1 como Alteração Percentual Média da Pré-Dose do Dia de Teste em um Teste Clínico de 6 Semanas Dia 1
INFORMAÇÃO DO PACIENTE
PROAIR® HFA (pro'ar) (sulfato de albuterol) Inalação Aerossol
Leia estas informações do paciente antes de começar a usar o PROAIR HFA e sempre que receber uma recarga. Pode haver novas informações. Esta informação não substitui a conversa com o seu médico sobre a sua condição médica ou o seu tratamento.
O que é o PROAIR HFA?
PROAIR HFA é um medicamento de prescrição usado em pessoas com 4 anos de idade ou mais para:
- tratar ou prevenir broncoespasmo em pessoas com doença obstrutiva reversível das vias aéreas
- prevenir broncoespasmo induzido pelo exercício
Não se sabe se PROAIR HFA é seguro e eficaz em crianças menores de 4 anos de idade.
Quem não deve usar o PROAIR HFA?
Não use PROAIR HFA se você são alérgicos ao sulfato de albuterol ou a qualquer um dos ingredientes do PROAIR HFA. Consulte o final deste folheto para obter uma lista completa dos ingredientes do PROAIR HFA.
O que devo dizer ao meu médico antes de usar PROAIR HFA?
Antes de utilizar PROAIR HFA, informe o seu médico se:
- tem problemas cardíacos
- tem pressão alta (hipertensão)
- tem convulsões (convulsões)
- tem problemas de tireóide
- tem diabetes
- tem níveis baixos de potássio no sangue
- estão grávidas ou planejam engravidar. Não se sabe se PROAIR HFA prejudicará o feto. Fale com o seu médico se estiver grávida ou planeia engravidar.
- está amamentando ou planeja amamentar. Não se sabe se PROAIR HFA passa para o leite materno. Converse com seu médico sobre a melhor maneira de alimentar seu bebê se estiver usando PROAIR HFA.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas.
PROAIR HFA e outros medicamentos podem afetar uns aos outros e causar efeitos colaterais. PROAIR HFA pode afetar a forma como outros medicamentos atuam, e outros medicamentos podem afetar a forma como PROAIR HFA atua.
Informe especialmente o seu médico se estiver a tomar:
- outros medicamentos inalados ou medicamentos para asma
- medicamentos beta bloqueadores
- diuréticos
- digoxina
- inibidores da monoaminoxidase
- antidepressivos tricíclicos
Peça ao seu médico ou farmacêutico uma lista destes medicamentos se não tiver a certeza.
Conheça os medicamentos que você toma. Mantenha uma lista deles para mostrar ao seu médico e farmacêutico quando receber um novo medicamento.
Como devo usar o PROAIR HFA?
- Para instruções detalhadas, consulte "Instruções de uso" no final desta Informação do Paciente.
- Use PROAIR HFA exatamente como seu médico lhe disse para usá-lo.
- Se seu filho precisar usar PROAIR HFA, observe-o atentamente para garantir que ele use o inalador corretamente. O seu médico irá mostrar-lhe como o seu filho deve utilizar PROAIR HFA.
- Cada dose de PROAIR HFA deve durar até 4 horas a 6 horas.
- Não faça aumente a sua dose ou tome doses extras de PROAIR HFA sem falar primeiro com o seu médico.
- Obtenha ajuda médica imediatamente se o PROAIR HFA não ajudar mais seus sintomas.
- Obtenha ajuda médica imediatamente se os sintomas piorarem ou se você precisar usar o inalador com mais frequência.
- Enquanto estiver usando PROAIR HFA, não use outros medicamentos inalatórios de resgate e medicamentos para asma, a menos que seu médico lhe diga para fazê-lo.
- Ligue para o seu médico se os sintomas de asma, como chiado e dificuldade para respirar, piorarem em algumas horas ou dias. O seu médico pode precisar de lhe dar outro medicamento (por exemplo, corticosteroides) para tratar os seus sintomas.
Quais são os possíveis efeitos colaterais do PROAIR HFA?
PROAIR HFA pode causar efeitos colaterais graves, incluindo:
- agravamento da dificuldade em respirar, tosse e pieira (broncospasmo paradoxal). Se isso acontecer, pare de usar PROAIR HFA e ligue para o seu médico ou procure ajuda de emergência imediatamente. O broncoespasmo paradoxal é mais provável de acontecer com o primeiro uso de uma nova lata de medicamento.
- problemas cardíacos, incluindo frequência cardíaca mais rápida e pressão arterial mais alta
- possível morte em pessoas com asma que usam muito PROAIR HFA
- Reações alérgicas. Ligue para o seu médico imediatamente se tiver os seguintes sintomas de uma reação alérgica:
- comichão na pele
- inchaço sob a pele ou na garganta
- irritação na pele
- agravamento da dificuldade para respirar
- níveis baixos de potássio no sangue
- agravamento de outros problemas médicos em pessoas que também usam PROAIR HFA, incluindo aumentos de açúcar no sangue
Os efeitos colaterais mais comuns do PROAIR HFA incluem:
- seu coração parece que está batendo ou acelerado (palpitações)
- dor no peito
- frequência cardíaca rápida
- tremor
- nervosismo
- dor de cabeça
- tontura
- dor de garganta
- nariz a pingar
Informe o seu médico se tiver algum efeito secundário que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do PROAIR HFA. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o PROAIR HFA?
- Armazene o PROAIR HFA em temperatura ambiente entre 15° C e 25° C (59° F e 77° F).
- Evite a exposição ao calor e frio extremos.
- Agite bem o recipiente PROAIR HFA antes de usar.
- Não faça perfure o recipiente PROAIR HFA.
- Não faça armazene o recipiente PROAIR HFA perto de calor ou chamas. Temperaturas acima de 120° F podem fazer com que o recipiente estoure.
- Não faça jogue o recipiente PROAIR HFA no fogo ou em um incinerador.
- Evite borrifar PROAIR HFA em seus olhos.
Mantenha PROAIR HFA e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz do PROAIR HFA
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use PROAIR HFA para uma condição para a qual não foi prescrito. Não dê PROAIR HFA a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Estas informações do paciente resumem as informações mais importantes sobre o PROAIR HFA. Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu farmacêutico ou médico informações sobre o PROAIR HFA que foi escrito para profissionais de saúde.
Para obter mais informações, acesse www.ProAirHFA.com ou ligue para 1-888-482-9522.
Quais são os ingredientes do PROAIR HFA?
Princípio ativo: sulfato de albuterol
Ingredientes inativos: propulsor HFA-134a e etanol.
Instruções de uso
PROAIR® HFA (pro'ar) (sulfato de albuterol) Inalação Aerossol
Leia estas Instruções de Uso antes de começar a usar o PROAIR HFA e sempre que receber uma recarga. Pode haver novas informações. Esta informação não substitui a conversa com o seu médico sobre a sua condição médica ou o seu tratamento.
As partes do seu dispositivo inalador PROAIR HFA:
Existem 2 partes principais do seu dispositivo inalador PROAIR HFA, incluindo:
- atuador de plástico vermelho que pulveriza o medicamento da vasilha. Veja a Figura A.
- tampa protetora contra poeira que cobre o bocal do atuador. Veja a Figura A.
Há também uma vasilha de metal que contém o medicamento. Veja a Figura A.
Há também um contador de doses preso à parte de trás do atuador com uma janela de visualização que mostra quantas pulverizações de medicamento ainda restam. Veja a Figura B.
Você verá um ponto preto na janela de visualização do atuador até que o dispositivo tenha sido escorvado 3 vezes. Consulte a Figura B e “Preparando seu dispositivo PROAIR HFA” abaixo.
Figura A e Figura B 
- Não faça use o atuador PROAIR HFA com um recipiente de medicamento de qualquer outro inalador.
- Não faça use um recipiente PROAIR HFA com um atuador de qualquer outro inalador, incluindo outro inalador PROAIR HFA.
Preparando seu dispositivo PROAIR HFA:
O seu dispositivo PROAIR deve ser preparado antes de o utilizar pela primeira vez ou se o seu dispositivo não tiver sido utilizado durante mais de 14 dias seguidos. Não faça prepare seu dispositivo PROAIR HFA todos os dias.
- Retire o seu dispositivo PROAIR HFA da embalagem.
- Remova a tampa protetora contra poeira do bocal.
- Agite bem o inalador e borrife-o no ar longe do seu rosto. Veja a Figura C.
Figura C 
- Agite e borrife o inalador assim mais 2 vezes para terminar de prepará-lo. O contador de doses no atuador deve exibir o número 200 após você preparar o atuador pela primeira vez. Veja a Figura D.
Figura D 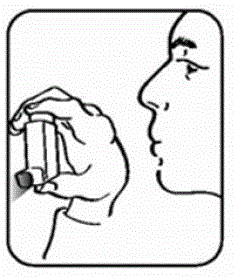
Cada vez que você usa seu dispositivo PROAIR HFA:
- Certifique-se de que o recipiente se encaixe firmemente no atuador de plástico.
- Olhe dentro do bocal para certificar-se de que não há objetos estranhos, especialmente se a tampa não tiver sido usada para cobrir o bocal.
Lendo o contador de dose em seu atuador PROAIR HFA
- O contador de doses fará uma contagem regressiva cada vez que um spray for liberado. A janela do contador de doses mostra o número de pulverizações restantes no seu inalador em unidades de 2 pulverizações. Por exemplo, restam 190 pulverizações se a seta estiver exatamente oposta ao número 190, ou 189 pulverizações restantes se a seta apontar entre 190 e 188. Veja a Figura D.
- Quando o contador de doses chegar a 0, continuará mostrando 0 e você deverá substituir seu dispositivo PROAIR HFA.
- O contador de doses não pode ser reinicializado e está permanentemente conectado ao atuador. Nunca altere os números do contador de doses ou toque no pino dentro do atuador.
- Não faça remova o recipiente do atuador de plástico, exceto durante a limpeza. Reconectar o recipiente ao atuador pode liberar acidentalmente uma dose de PROAIR HFA no ar. O contador de doses fará uma contagem regressiva cada vez que um spray for liberado.
Usando seu dispositivo PROAIR HFA:
Passo 1. Agite bem o inalador antes de cada pulverização. Retire a tampa do bocal do atuador.
Etapa 2. Segure o inalador com o bocal para baixo. Veja a Figura E.
Figura E 
Etapa 3. Expire pela boca e empurre o máximo de ar de seus pulmões que puder. Coloque o bocal na boca e feche os lábios ao redor dele. Veja a Figura F.
Passo 4. Empurre a parte superior do recipiente para baixo enquanto inspira profunda e lentamente pela boca. Veja a Figura F.
Figura F 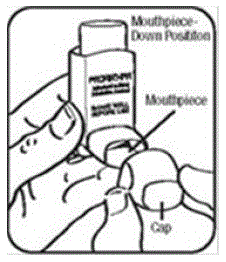
Etapa 5. Logo após o spray sair, retire o dedo do recipiente. Depois de inspirar completamente, retire o inalador da boca e feche a boca.
Etapa 6. Segure a respiração o máximo que puder, até 10 segundos, depois respire normalmente.
Se o seu médico lhe disse para usar mais sprays, aguarde 1 minuto e agite o inalador novamente. Repita as Etapas 2 a Etapa 6.
Passo 7. Volte a colocar a tampa no bocal após cada utilização do inalador. Certifique-se de que a tampa se encaixe firmemente no lugar.
Limpando seu dispositivo PROAIR HFA:
É muito importante manter o atuador de plástico limpo para que o medicamento não se acumule e bloqueie o spray. Consulte a Figura G e a Figura H.
Figura G e Figura H 
- Não tente limpar o recipiente de metal ou deixá-lo molhado. O inalador pode parar de pulverizar se não for limpo corretamente.
- Se você tiver mais de 1 inalador PROAIR HFA, lave cada dispositivo em momentos separados para evitar colocar o recipiente errado junto com o atuador de plástico errado. Desta forma, você pode ter certeza de que sempre saberá o número correto de doses restantes de PROAIR HFA.
- Lave o atuador pelo menos 1 vez por semana da seguinte forma:
- Retire o recipiente do atuador e retire a tampa do bocal.
- Segure o atuador sob a torneira e deixe correr água morna por cerca de 30 segundos. Veja a Figura I.
Figura I 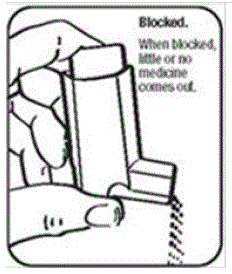
- Vire o atuador de cabeça para baixo e passe água morna pelo bocal por cerca de 30 segundos. Veja a Figura J.
Figura J 
- Sacuda o máximo de água possível do atuador. Olhe para o bocal para certificar-se de que qualquer acúmulo de medicamento foi completamente removido. Se houver qualquer acúmulo, repita as instruções de lavagem.
- Deixe o atuador secar completamente, como durante a noite. Veja a Figura K.
Figura K 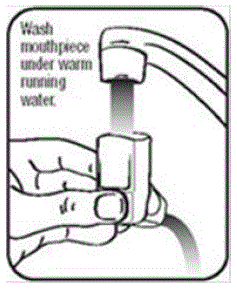
- Quando o atuador estiver seco, coloque o recipiente no atuador e certifique-se de que ele se encaixe firmemente. Agite bem o inalador e pulverize-o duas vezes no ar, longe do seu rosto. Coloque a tampa de volta no bocal.
Se você precisar usar seu inalador antes que o atuador esteja completamente seco:
- Sacuda o máximo de água possível do atuador.
- Coloque o recipiente no atuador e certifique-se de que ele se encaixe firmemente.
- Agite bem o inalador e pulverize-o duas vezes no ar, longe do seu rosto.
- Tome sua dose de PROAIR HFA conforme prescrito.
- Siga as instruções de limpeza acima.
Substituindo seu dispositivo PROAIR HFA
- Quando o contador de doses do atuador indicar o número 20, cor dos números mudará para vermelho. Os números vermelhos são para lembrá-lo de reabastecer sua receita ou pedir ao seu médico outra receita para o PROAIR HFA. Quando o contador de doses atingir 0, a cor de fundo mudará para vermelho sólido.
- Jogue fora o inalador PROAIR HFA assim que o contador de doses indicar 0 ou após a data de validade na embalagem do PROAIR HFA, o que ocorrer primeiro. Você não deve continuar usando o inalador após 200 pulverizações, mesmo que o recipiente não esteja completamente vazio. Você não pode ter certeza de que receberá qualquer medicamento após usar 200 pulverizações.
- Não use o inalador após a data de validade na embalagem do PROAIR HFA.
Estas Informações ao Paciente e Instruções de Uso foram aprovadas pela Food and Drug Administration dos EUA.
