Spiriva 9mcg Tiotropium Bromide Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Spiriva 9mcg HandiHaler e como é usado?
Spiriva HandiHaler (brometo de tiotrópio) para inalação em pó é um medicamento anticolinérgico usado para prevenir broncoespasmo (estreitamento das vias aéreas nos pulmões) em pessoas com bronquite, enfisema ou DPOC (doença pulmonar obstrutiva crônica).
Quais são os efeitos colaterais do Spiriva 9mcg HandiHaler?
Os efeitos colaterais comuns do Spiriva 9mcg HandiHaler incluem:
- boca seca,
- constipação,
- dor de estômago,
- vômito,
- sintomas de resfriado (nariz entupido, espirros, dor de garganta),
- sangramento nasal, ou
- dor muscular.
Informe o seu médico se tiver quaisquer efeitos secundários graves de Spiriva 9mcg HandiHaler, incluindo:
- micção difícil ou dolorosa, ou
- batimento cardíaco acelerado.
DESCRIÇÃO
SPIRIVA 9mcg HANDIHALER consiste em cápsulas SPIRIVA e um dispositivo HANDIHALER. Cada cápsula de gelatina dura verde clara SPIRIVA 9mcg contém um pó seco composto por 18 mcg de tiotrópio (equivalente a 22,5 mcg de brometo de tiotrópio monohidratado) misturado com lactose monohidratada (que pode conter proteínas do leite).
conteúdo das cápsulas de SPIRIVA destina-se apenas à inalação oral e destina-se à administração apenas com o dispositivo HANDIHALER.
O componente ativo de SPIRIVA HANDIHALER é o tiotrópio. O fármaco, brometo de tiotrópio monohidratado, é um anticolinérgico com especificidade para receptores muscarínicos. É quimicamente descrito como (1α, 2β, 4β, 5α, 7β)-7-[(Hidroxidi-2-tienilacetil)oxi]-9,9-dimetil-3-oxa-9-azoniatriciclo[3.3.1.02,4] monohidrato de brometo de nonano. É um composto de amônio quaternário sintético, não quiral. O brometo de tiotrópio é um pó branco ou amarelado. É pouco solúvel em água e solúvel em metanol.
A fórmula estrutural é:
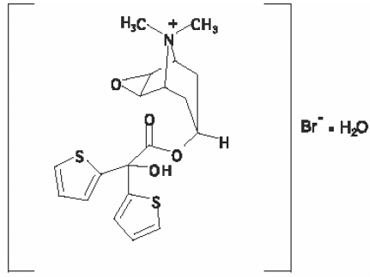
O brometo de tiotrópio (monohidrato) tem massa molecular de 490,4 e fórmula molecular de C19H22NO4S2Br • H2O.
dispositivo HANDIHALER é um dispositivo de inalação utilizado para inalar o pó seco contido na cápsula SPIRIVA 9mcg. O pó seco é fornecido do dispositivo HANDIHALER em taxas de fluxo tão baixas quanto 20 L/min. Em testes padronizados in vitro, o dispositivo HANDIHALER fornece uma média de 10,4 mcg de tiotrópio quando testado a uma taxa de fluxo de 39 L/min por 3,1 segundos (2 L no total). Em um estudo com 26 pacientes adultos com DPOC e função pulmonar gravemente comprometida [média de VEF1 1,02 L (intervalo de 0,45 a 2,24 L); 37,6% do previsto (intervalo de 16% a 65%)], o pico de fluxo inspiratório (PIF) mediano pelo dispositivo HANDIHALER foi de 30,0 L/min (intervalo de 20,4 a 45,6 L/min). A quantidade de fármaco entregue aos pulmões irá variar dependendo de fatores do paciente, como fluxo inspiratório e fluxo inspiratório máximo através do dispositivo HANDIHALER, que pode variar de paciente para paciente e pode variar com o tempo de exposição da cápsula SPIRIVA 9mcg fora do blister pacote.
INDICAÇÕES
SPIRIVA HANDIHALER (pó para inalação de brometo de tiotrópio) é indicado para o tratamento de manutenção a longo prazo, uma vez ao dia, de broncoespasmo associado à doença pulmonar obstrutiva crônica (DPOC), incluindo bronquite crônica e enfisema. SPIRIVA 9mcg HANDIHALER é indicado para reduzir as exacerbações em pacientes com DPOC.
DOSAGEM E ADMINISTRAÇÃO
Apenas para inalação oral. Não engula as cápsulas de SPIRIVA 9mcg, pois os efeitos pretendidos nos pulmões não serão obtidos. O conteúdo das cápsulas SPIRIVA só deve ser usado com o dispositivo HANDIHALER [Vejo SOBREDOSAGEM ].
A dose recomendada de SPIRIVA HANDIHALER é de duas inalações do conteúdo de pó de uma cápsula de SPIRIVA, uma vez ao dia, com o dispositivo HANDIHALER [ver INFORMAÇÃO DO PACIENTE ]. Não tome mais de uma dose em 24 horas.
Para administração de SPIRIVA HANDIHALER, uma cápsula de SPIRIVA 9mcg é colocada na câmara central do dispositivo HANDIHALER. A cápsula SPIRIVA 9mcg é perfurada pressionando e soltando o botão de perfuração verde na lateral do dispositivo HANDIHALER. A formulação de tiotrópio é dispersa na corrente de ar quando o paciente inala pelo bocal [ver INFORMAÇÃO DO PACIENTE ].
Nenhum ajuste de dose é necessário para pacientes geriátricos, com insuficiência hepática ou com insuficiência renal. No entanto, pacientes com insuficiência renal moderada a grave que recebem SPIRIVA 9mcg HANDIHALER devem ser monitorados de perto quanto aos efeitos anticolinérgicos [ver AVISOS E PRECAUÇÕES , Uso em populações específicas , e FARMACOLOGIA CLÍNICA ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
Pó para inalação
SPIRIVA 9mcg HANDIHALER consiste em cápsulas SPIRIVA contendo pó de tiotrópio para inalação oral e um dispositivo HANDIHALER. As cápsulas de SPIRIVA 9mcg contêm 18 mcg de tiotrópio em uma cápsula de gelatina dura verde-clara com TI 01 impresso em um lado e o logotipo da empresa Boehringer Ingelheim no outro. O dispositivo HANDIHALER destina-se apenas a ser utilizado com as cápsulas SPIRIVA.
Armazenamento e manuseio
SPIRIVA HANDIHALER consiste em cápsulas SPIRIVA 9mcg e o dispositivo HANDIHALER. As cápsulas SPIRIVA 9mcg contêm 18 mcg de tiotrópio e são verdes claras, com o logotipo da empresa Boehringer Ingelheim na tampa da cápsula SPIRIVA e TI 01 no corpo da cápsula SPIRIVA, ou vice-versa.
dispositivo HANDIHALER é de cor cinza com um botão de perfuração verde. É impresso com SPIRIVA HANDIHALER (pó para inalação de brometo de tiotrópio), o logotipo da empresa Boehringer Ingelheim. Também está impresso para indicar que as cápsulas SPIRIVA não devem ser armazenadas no dispositivo HANDIHALER e que o dispositivo HANDIHALER deve ser usado apenas com cápsulas SPIRIVA 9mcg.
As cápsulas de SPIRIVA 9mcg são embaladas em um blister de alumínio/alumínio e unidas ao longo de uma linha de corte perfurado. As cápsulas de SPIRIVA 9mcg devem ser sempre armazenadas no blister e removidas apenas imediatamente antes do uso. O medicamento deve ser usado imediatamente após a abertura da embalagem de uma cápsula individual de SPIRIVA.
Os seguintes pacotes estão disponíveis:
- embalagem contendo 5 cápsulas de SPIRIVA 9mcg (1 blister de dose unitária) e 1 dispositivo de inalação HANDIHALER ( NDC 0597-0075-75) (pacote institucional)
- embalagem contendo 30 cápsulas de SPIRIVA 9mcg (3 cartelas de dose unitária) e 1 dispositivo de inalação HANDIHALER ( NDC 0597-0075-41)
- embalagem contendo 90 cápsulas de SPIRIVA (9 cartelas de dose unitária) e 1 dispositivo de inalação HANDIHALER ( NDC 0597-0075-47)
Mantenha fora do alcance de crianças. Não coloque pó nos olhos.
Armazenar
Armazenar a 25°C (77°F); excursões permitidas de 15° a 30°C (59° a 86°F) [consulte Temperatura ambiente controlada pela USP].
As cápsulas de SPIRIVA não devem ser expostas a temperaturas ou umidade extremas. Não guarde as cápsulas de SPIRIVA 9mcg no dispositivo HANDIHALER.
Distribuído por: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 EUA. Revisado: fevereiro de 2018
EFEITOS COLATERAIS
As seguintes reações adversas são descritas, ou descritas em mais detalhes, em outras seções:
- Reações de hipersensibilidade imediata [ver AVISOS E PRECAUÇÕES ]
- Broncoespasmo paradoxal [ver AVISOS E PRECAUÇÕES ]
- Agravamento do glaucoma de ângulo estreito [ver AVISOS E PRECAUÇÕES ]
- Agravamento da retenção urinária [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, a incidência de reações adversas observadas nos ensaios clínicos de um medicamento não pode ser diretamente comparada com as incidências nos ensaios clínicos de outro medicamento e pode não refletir as incidências observadas na prática.
Testes de 6 meses a 1 ano
Os dados descritos abaixo refletem a exposição ao SPIRIVA 9mcg HANDIHALER em 2.663 pacientes. SPIRIVA 9mcg HANDIHALER foi estudado em dois estudos controlados por placebo de 1 ano, dois estudos controlados por ativo de 1 ano e dois estudos controlados por placebo de 6 meses em pacientes com DPOC. Nesses estudos, 1.308 pacientes foram tratados com SPIRIVA HANDIHALER na dose recomendada de 18 mcg uma vez ao dia. A população tinha idade variando de 39 a 87 anos, sendo 65% a 85% do sexo masculino, 95% caucasiano, e apresentava DPOC com volume expiratório forçado médio pré-broncodilatador em um segundo (VEF1) por cento previsto de 39% a 43%. Pacientes com glaucoma de ângulo fechado, hipertrofia prostática sintomática ou obstrução da saída da bexiga foram excluídos desses estudos. Um estudo adicional de 6 meses realizado em um ambiente de Assuntos de Veteranos não está incluído neste banco de dados de segurança porque apenas eventos adversos graves foram coletados.
reação adversa ao medicamento mais comumente relatada foi boca seca. A boca seca foi geralmente leve e muitas vezes resolvida durante o tratamento continuado. Outras reações relatadas em pacientes individuais e consistentes com possíveis efeitos anticolinérgicos incluíram constipação, taquicardia, visão turva, glaucoma (novo início ou piora), disúria e retenção urinária.
Quatro estudos multicêntricos, de 1 ano, controlados por placebo e controlados por ativos avaliaram SPIRIVA HANDIHALER em pacientes com DPOC. A Tabela 1 mostra todas as reações adversas que ocorreram com uma frequência ≥3% no grupo SPIRIVA 9mcg HANDIHALER nos estudos controlados por placebo de 1 ano onde as taxas no grupo SPIRIVA HANDIHALER excederam o placebo em ≥1%. A frequência das reações correspondentes nos estudos controlados com ipratrópio é incluída para comparação.
Artrite, tosse e sintomas semelhantes aos da gripe ocorreram a uma taxa de ≥3% no grupo de tratamento com SPIRIVA 9mcg HANDIHALER, mas foram
Outras reações que ocorreram no grupo SPIRIVA HANDIHALER com uma frequência de 1% a 3% nos estudos controlados por placebo, onde as taxas excederam as do grupo placebo, incluem:
Corpo como um todo: reação alérgica, dor nas pernas;
Sistema Nervoso Central e Periférico: disfonia, parestesia;
Distúrbios do Sistema Gastrointestinal: distúrbio gastrointestinal sem outra especificação (NOS), refluxo gastroesofágico, estomatite (incluindo estomatite ulcerativa);
Distúrbios metabólicos e nutricionais: hipercolesterolemia, hiperglicemia;
Distúrbios do sistema musculoesquelético: dor esquelética;
Eventos cardíacos: angina pectoris (incluindo angina pectoris agravada);
Desordem psiquiátrica: depressão; Infecções: herpes zoster;
Distúrbio do Sistema Respiratório (Superior): laringite;
Distúrbio da Visão: catarata.
Além disso, entre as reações adversas observadas nos ensaios clínicos com incidência
Nos ensaios de 1 ano, a incidência de boca seca, constipação e infecção do trato urinário aumentou com a idade. Uso em populações específicas ].
Dois estudos multicêntricos, controlados de 6 meses, avaliaram SPIRIVA 9mcg HANDIHALER em pacientes com DPOC. As reações adversas e as taxas de incidência foram semelhantes às observadas nos ensaios controlados de 1 ano.
Teste de 4 anos
Os dados descritos abaixo refletem a exposição ao SPIRIVA 9mcg HANDIHALER em 5.992 pacientes com DPOC em um estudo controlado por placebo de 4 anos. Neste estudo, 2.986 pacientes foram tratados com SPIRIVA 9mcg HANDIHALER na dose recomendada de 18 mcg uma vez ao dia. A população tinha uma faixa etária de 40 a 88 anos, era 75% do sexo masculino, 90% caucasiano e tinha DPOC com um por cento médio de VEF1 pré-broncodilatador previsto de 40%. Pacientes com glaucoma de ângulo fechado, hipertrofia prostática sintomática ou obstrução da saída da bexiga foram excluídos desses estudos. Quando as reações adversas foram analisadas com uma frequência de ≥3% no grupo SPIRIVA 9mcg HANDIHALER, onde as taxas no grupo SPIRIVA 9mcg HANDIHALER excederam o placebo em ≥1%, as reações adversas incluíram (SPIRIVA 9mcg HANDIHALER, placebo): faringite (12,5% , 10,8%), sinusite (6,5%, 5,3%), dor de cabeça (5,7%, 4,5%), constipação (5,1%, 3,7%), boca seca (5,1%, 2,7%), depressão (4,4%, 3,3%) , insônia (4,4%, 3,0%) e artralgia (4,2%, 3,1%).
Reações Adversas Adicionais
Outras reações adversas não listadas anteriormente que foram relatadas com mais frequência em pacientes com DPOC tratados com SPIRIVA 9mcg HANDIHALER do que com placebo incluem: desidratação, úlcera de pele, estomatite, gengivite, candidíase orofaríngea, pele seca, infecção da pele e inchaço das articulações.
Experiência pós-marketing
As reações adversas foram identificadas durante o uso pós-aprovação mundial de SPIRIVA HANDIHALER. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. Essas reações adversas são: irritação no local da aplicação (glossite, ulceração na boca e dor faringolaríngea), tontura, disfagia, rouquidão, obstrução intestinal incluindo íleo paralítico, aumento da pressão intraocular, candidíase oral, palpitações, prurido, taquicardia, irritação na garganta e urticária.
INTERAÇÕES MEDICAMENTOSAS
Simpaticomiméticos, Metilxantinas, Esteróides
SPIRIVA 9mcg HANDIHALER tem sido usado concomitantemente com broncodilatadores simpaticomiméticos de curta e longa ação (beta-agonistas), metilxantinas e esteroides orais e inalatórios sem aumento nas reações adversas.
Anticolinérgicos
Existe potencial para uma interação aditiva com medicamentos anticolinérgicos usados concomitantemente. Portanto, evite a coadministração de SPIRIVA 9mcg HANDIHALER com outros medicamentos contendo anticolinérgicos, pois isso pode levar a um aumento dos efeitos adversos anticolinérgicos [ver AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS ].
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Não para uso agudo
SPIRIVA 9mcg HANDIHALER destina-se ao tratamento de manutenção uma vez ao dia para a DPOC e não deve ser usado para alívio dos sintomas agudos, ou seja, como terapia de resgate para o tratamento de episódios agudos de broncoespasmo.
Reações de hipersensibilidade imediata
Reações de hipersensibilidade imediata, incluindo urticária, angioedema (incluindo inchaço dos lábios, língua ou garganta), erupção cutânea, broncoespasmo, anafilaxia ou coceira, podem ocorrer após a administração de SPIRIVA 9mcg HANDIHALER. Se tal reação ocorrer, a terapia com SPIRIVA 9mcg HANDIHALER deve ser interrompida imediatamente e tratamentos alternativos devem ser considerados. Dada a fórmula estrutural semelhante da atropina ao tiotrópio, os pacientes com histórico de reações de hipersensibilidade à atropina ou seus derivados devem ser monitorados de perto para reações de hipersensibilidade semelhantes ao SPIRIVA HANDIHALER. Além disso, SPIRIVA HANDIHALER deve ser usado com cautela em pacientes com hipersensibilidade grave às proteínas do leite.
Broncoespasmo Paradoxal
Medicamentos inalados, incluindo SPIRIVA HANDIHALER, podem causar broncoespasmo paradoxal. Se isso ocorrer, deve ser tratado imediatamente com um beta2-agonista de curta ação inalado, como o albuterol. O tratamento com SPIRIVA HANDIHALER deve ser interrompido e outros tratamentos considerados.
Agravamento do Glaucoma de Ângulo Estreito
SPIRIVA 9mcg HANDIHALER deve ser usado com cautela em pacientes com glaucoma de ângulo estreito. Os prescritores e os pacientes devem estar alertas para sinais e sintomas de glaucoma agudo de ângulo estreito (por exemplo, dor ou desconforto ocular, visão turva, halos visuais ou imagens coloridas em associação com olhos vermelhos por congestão conjuntival e edema corneano). Instrua os pacientes a consultar um médico imediatamente caso algum desses sinais ou sintomas se desenvolvam.
Piora da retenção urinária
SPIRIVA HANDIHALER deve ser usado com cautela em pacientes com retenção urinária. Os prescritores e os pacientes devem estar alertas para sinais e sintomas de retenção urinária (por exemplo, dificuldade em urinar, dor ao urinar), especialmente em pacientes com hiperplasia prostática ou obstrução do colo da bexiga. Instrua os pacientes a consultar um médico imediatamente caso algum desses sinais ou sintomas se desenvolvam.
Insuficiência renal
Como um fármaco predominantemente excretado por via renal, os pacientes com insuficiência renal moderada a grave (clearance de creatinina FARMACOLOGIA CLÍNICA ].
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( INFORMAÇÕES DO PACIENTE e Instruções de Uso ).
Não para uso agudo
Instrua os pacientes que SPIRIVA HANDIHALER é um broncodilatador de manutenção uma vez ao dia e não deve ser usado para alívio imediato de problemas respiratórios (ou seja, como medicamento de resgate).
Reações de hipersensibilidade imediata
Informe os pacientes que pode ocorrer anafilaxia, angioedema (incluindo inchaço dos lábios, língua ou garganta), urticária, erupção cutânea, broncoespasmo ou coceira após a administração de SPIRIVA 9mcg HANDIHALER. Aconselhe o paciente a interromper imediatamente o tratamento e consultar um médico caso algum desses sinais ou sintomas se desenvolvam.
Broncoespasmo Paradoxal
Informe os pacientes que SPIRIVA HANDIHALER pode produzir broncoespasmo paradoxal. Avise os pacientes que, se ocorrer broncoespasmo paradoxal, os pacientes devem descontinuar SPIRIVA HANDIHALER.
Agravamento do Glaucoma de Ângulo Estreito
Instrua os pacientes a ficarem alertas para sinais e sintomas de glaucoma de ângulo estreito (por exemplo, dor ou desconforto ocular, visão turva, halos visuais ou imagens coloridas em associação com olhos vermelhos de congestão conjuntival e edema de córnea). Instrua os pacientes a consultar um médico imediatamente caso algum desses sinais e sintomas se desenvolvam.
Informe os pacientes que devem ser tomados cuidados para não permitir que o pó entre nos olhos, pois isso pode causar turvação da visão e dilatação da pupila.
Uma vez que podem ocorrer tonturas e visão turva com o uso de SPIRIVA HANDIHALER, alerte os pacientes sobre a realização de atividades como dirigir veículos ou operar aparelhos ou máquinas.
Piora da retenção urinária
Instrua os pacientes a ficarem alertas para sinais e sintomas de retenção urinária (por exemplo, dificuldade em urinar, dor ao urinar). Instrua os pacientes a consultar um médico imediatamente caso algum desses sinais ou sintomas se desenvolvam.
Instruções para administrar SPIRIVA HANDIHALER
Instruir os pacientes sobre como administrar corretamente as cápsulas de SPIRIVA 9mcg usando o dispositivo HANDIHALER [ver INFORMAÇÃO DO PACIENTE ]. Instrua os pacientes que as cápsulas de SPIRIVA 9mcg devem ser administradas apenas através do dispositivo HANDIHALER e que o dispositivo HANDIHALER não deve ser usado para administrar outros medicamentos. Lembre aos pacientes que o conteúdo das cápsulas de SPIRIVA 9mcg é apenas para inalação oral e não deve ser ingerido.
Instruir os pacientes a sempre armazenar as cápsulas de SPIRIVA 9mcg em blisters selados e remover apenas uma cápsula de SPIRIVA imediatamente antes do uso ou sua eficácia pode ser reduzida. Instrua os pacientes a descartar cápsulas adicionais de SPIRIVA não utilizadas que estejam expostas ao ar (ou seja, não destinadas ao uso imediato).
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Nenhuma evidência de tumorigenicidade foi observada em um estudo de inalação de 104 semanas em ratos com doses de tiotrópio de até 59 mcg/kg/dia, em um estudo de inalação de 83 semanas em camundongos fêmeas com doses de até 145 mcg/kg/dia e em um estudo de inalação de 101 semanas em camundongos machos em doses de até 2 mcg/kg/dia. Essas doses correspondem a aproximadamente 30, 40 e 0,5 vezes a dose humana diária recomendada para inalação (MRHDID) na base de mcg/m2, respectivamente.
O brometo de tiotrópio não demonstrou evidência de mutagenicidade ou clastogenicidade nos seguintes ensaios: o ensaio de mutação genética bacteriana, o ensaio de mutagênese em células de hamster chinês V79, os ensaios de aberração cromossômica em linfócitos humanos in vitro e formação de micronúcleos de camundongo in vivo e a síntese de DNA não programada em hepatócitos primários de rato in vitro.
Em ratos, foram observadas diminuições no número de corpos lúteos e na porcentagem de implantes em doses de tiotrópio por inalação de 78 mcg/kg/dia ou mais (aproximadamente 40 vezes o MRHDID em uma base de mcg/m2). Nenhum desses efeitos foi observado com 9 mcg/kg/dia (aproximadamente 5 vezes o MRHDID em uma base de mcg/m2). O índice de fertilidade, no entanto, não foi afetado em doses de inalação de até 1689 mcg/kg/dia (aproximadamente 910 vezes o MRHDID em uma base de mcg/m2).
Uso em populações específicas
Gravidez
Resumo do risco
Os dados humanos limitados com o uso de SPIRIVA 9mcg HANDIHALER durante a gravidez são insuficientes para informar um risco associado ao medicamento de resultados adversos relacionados à gravidez. Com base em estudos de reprodução em animais, não foram observadas anormalidades estruturais quando o tiotrópio foi administrado por inalação a ratas e coelhas grávidas durante o período de organogênese em doses 790 e 8 vezes, respectivamente, a dose inalatória humana diária máxima recomendada (MRHDID). Aumento da perda pós-implantação foi observado em ratos e coelhos administrados com tiotrópio em doses maternas tóxicas 430 vezes e 40 vezes o MRHDID, respectivamente [ver Dados ].
O risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Dados
Dados de animais
Em 2 estudos separados de desenvolvimento embriofetal, ratas e coelhas grávidas receberam tiotrópio durante o período de organogênese em doses até aproximadamente 790 e 8 vezes o MRHDID, respectivamente (numa base de mcg/m2 em doses de inalação de 1471 e 7 mcg/kg /dia em ratos e coelhos, respectivamente). Nenhuma evidência de anormalidades estruturais foi observada em ratos ou coelhos. No entanto, em ratos, o tiotrópio causou reabsorção fetal, perda de ninhada, diminuição do número de filhotes vivos ao nascimento e do peso médio dos filhotes e um atraso na maturação sexual dos filhotes em doses de tiotrópio de aproximadamente 40 vezes o MRHDID (em um mcg/m2 base em uma dose de inalação materna de 78 mcg/kg/dia). Em coelhos, o tiotrópio causou um aumento na perda pós-implantação em uma dose de tiotrópio de aproximadamente 430 vezes a MRHDID (em uma base de mcg/m2 em uma dose de inalação materna de 400 mcg/kg/dia). Tais efeitos não foram observados em aproximadamente 5 e 95 vezes o MRHDID, respectivamente (numa base de mcg/m2 em doses de inalação de 9 e 88 mcg/kg/dia em ratos e coelhos, respectivamente).
Lactação
Resumo do risco
Não existem dados sobre a presença de tiotrópio no leite humano, os efeitos no lactente ou os efeitos na produção de leite. O tiotrópio está presente no leite de ratas lactantes; no entanto, devido a diferenças específicas da espécie na fisiologia da lactação, a relevância clínica desses dados não é clara [ver Dados ]. Os benefícios da amamentação para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de SPIRIVA 9mcg HANDIHALER e quaisquer potenciais efeitos adversos na criança amamentada por SPIRIVA HANDIHALER ou da condição materna subjacente.
Dados
A distribuição de brometo de tiotrópio no leite foi investigada após uma única administração intravenosa de 10 mg/kg em ratas lactantes. O tiotrópio e/ou os seus metabolitos estão presentes no leite de ratas lactantes em concentrações superiores às do plasma.
Uso Pediátrico
SPIRIVA HANDIHALER não é indicado para uso em crianças. A segurança e eficácia de SPIRIVA 9mcg HANDIHALER em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Com base nos dados disponíveis, não é necessário ajustar a dose de SPIRIVA HANDIHALER em pacientes geriátricos [ver FARMACOLOGIA CLÍNICA ].
Do número total de pacientes que receberam SPIRIVA 9mcg HANDIHALER nos ensaios clínicos de 1 ano, 426 tinham
Insuficiência renal
Pacientes com insuficiência renal moderada a grave (clearance de creatinina DOSAGEM E ADMINISTRAÇÃO , AVISOS E PRECAUÇÕES , e FARMACOLOGIA CLÍNICA ].
Insuficiência hepática
Os efeitos da insuficiência hepática na farmacocinética do tiotrópio não foram estudados.
SOBREDOSAGEM
Altas doses de tiotrópio podem levar a sinais e sintomas anticolinérgicos. No entanto, não houve efeitos adversos anticolinérgicos sistêmicos após uma dose única inalada de até 282 mcg de tiotrópio em 6 voluntários saudáveis. Em um estudo com 12 voluntários saudáveis, conjuntivite bilateral e boca seca foram observadas após inalação repetida uma vez ao dia de 141 mcg de tiotrópio.
O tratamento da superdosagem consiste na descontinuação de SPIRIVA HANDIHALER juntamente com a instituição de terapia sintomática e/ou de suporte apropriada.
Ingestão acidental
A intoxicação aguda por ingestão oral inadvertida de SPIRIVA cápsulas é improvável, uma vez que não é bem absorvido sistemicamente.
Um caso de superdosagem foi relatado na experiência pós-comercialização. Uma paciente do sexo feminino relatou ter inalado 30 cápsulas durante um período de 2,5 dias e desenvolvido estado mental alterado, tremores, dor abdominal e constipação grave. O paciente foi hospitalizado, SPIRIVA HANDIHALER foi descontinuado e a constipação foi tratada com enema. O paciente se recuperou e recebeu alta no mesmo dia.
CONTRA-INDICAÇÕES
SPIRIVA 9mcg HANDIHALER é contraindicado em pacientes com hipersensibilidade ao tiotrópio, ipratrópio ou a qualquer componente deste produto [ver AVISOS E PRECAUÇÕES ]. Em ensaios clínicos e experiência pós-comercialização com SPIRIVA 9mcg HANDIHALER, foram relatadas reações de hipersensibilidade imediata, incluindo angioedema (incluindo inchaço dos lábios, língua ou garganta), coceira ou erupção cutânea [ver AVISOS E PRECAUÇÕES ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
tiotrópio é um agente antimuscarínico de ação prolongada, muitas vezes referido como anticolinérgico. Tem afinidade semelhante aos subtipos de receptores muscarínicos, M1 a M5. Nas vias aéreas, exibe efeitos farmacológicos através da inibição dos receptores M3 no músculo liso levando à broncodilatação. A natureza competitiva e reversível do antagonismo foi demonstrada com receptores de origem humana e animal e preparações de órgãos isolados. Em estudos pré-clínicos in vitro e in vivo, a prevenção dos efeitos de broncoconstrição induzida por metacolina foi dose-dependente e durou mais de 24 horas. A broncodilatação após a inalação de tiotrópio é predominantemente um efeito específico do local.
Farmacodinâmica
Eletrofisiologia Cardíaca
Em um estudo multicêntrico, randomizado e duplo-cego usando pó seco de tiotrópio para inalação que envolveu 198 pacientes com DPOC, o número de indivíduos com alterações do intervalo QT corrigido da linha de base de 30 a 60 mseg foi maior no grupo SPIRIVA 9mcg HANDIHALER em comparação com placebo. Essa diferença foi aparente usando as correções de Bazett (QTcB) [20 (20%) pacientes versus 12 (12%) pacientes] e Fredericia (QTcF) [16 (16%) pacientes versus 1 (1%) paciente] de QT para a frequência cardíaca. Nenhum paciente em nenhum dos grupos apresentou QTcB ou QTcF > 500 mseg. Outros estudos clínicos com SPIRIVA HANDIHALER não detectaram efeito do medicamento nos intervalos QTc.
efeito do pó seco de tiotrópio para inalação no intervalo QT também foi avaliado em um estudo cruzado randomizado, controlado por placebo e positivo em 53 voluntários saudáveis. Os indivíduos receberam pó seco de tiotrópio para inalação de 18 mcg, 54 mcg (3 vezes a dose recomendada) ou placebo por 12 dias. As avaliações de ECG foram realizadas na linha de base e durante todo o intervalo de dosagem após a primeira e a última dose da medicação do estudo. Em relação ao placebo, a alteração média máxima da linha de base no intervalo QTc específico do estudo foi de 3,2 mseg e 0,8 mseg para pó seco de tiotrópio para inalação de 18 mcg e 54 mcg, respectivamente. Nenhum sujeito apresentou um novo início de QTc > 500 mseg ou alterações de QTc desde a linha de base de ≥60 mseg.
Farmacocinética
tiotrópio é administrado por inalação de pó seco. Alguns dos dados farmacocinéticos descritos abaixo foram obtidos com doses mais altas do que as recomendadas para terapia. Um estudo farmacocinético dedicado em pacientes com DPOC avaliando tiotrópio uma vez ao dia fornecido pelo inalador RESPIMAT (5 mcg) e como pó para inalação (18 mcg) do dispositivo HANDIHALER resultou em uma exposição sistêmica semelhante entre os dois produtos.
Absorção
Após a inalação de pó seco por voluntários jovens e saudáveis, a biodisponibilidade absoluta de 19,5% sugere que a fração que atinge o pulmão é altamente biodisponível. As soluções orais de tiotrópio têm uma biodisponibilidade absoluta de 2-3%. Não se espera que os alimentos influenciem a absorção do tiotrópio. As concentrações plasmáticas máximas de tiotrópio foram observadas 7 minutos após a inalação.
Distribuição
tiotrópio liga-se 72% às proteínas plasmáticas e teve um volume de distribuição de 32 L/kg após administração intravenosa a voluntários jovens e saudáveis. As concentrações locais no pulmão não são conhecidas, mas o modo de administração sugere concentrações substancialmente mais altas no pulmão. Estudos em ratos mostraram que o tiotrópio não penetra facilmente na barreira hematoencefálica.
Eliminação
A meia-vida terminal do tiotrópio em pacientes com DPOC após inalação uma vez ao dia de 5 mcg de tiotrópio foi de aproximadamente 25 horas. A depuração total foi de 880 mL/min após administração intravenosa em voluntários jovens e saudáveis. Após inalação crônica de pó seco uma vez ao dia por pacientes com DPOC, o estado de equilíbrio farmacocinético foi alcançado no dia 7, sem acúmulo posterior.
Metabolismo
extensão do metabolismo é pequena. Isto é evidente a partir de uma excreção urinária de 74% da substância inalterada após uma dose intravenosa em voluntários jovens e saudáveis. O tiotrópio, um éster, é clivado não enzimaticamente no álcool N-metilscopina e ácido ditienilglicólico, nenhum dos quais se liga aos receptores muscarínicos.
Experimentos in vitro com microssomas hepáticos humanos e hepatócitos humanos sugerem que uma fração da dose administrada (74% de uma dose intravenosa é excretada inalterada na urina, deixando 25% para o metabolismo) é metabolizada pela oxidação dependente do citocromo P450 e subsequente conjugação com glutationa a uma variedade de metabólitos de Fase II. Essa via enzimática pode ser inibida por inibidores do CYP450 2D6 e 3A4, como quinidina, cetoconazol e gestodeno. Assim, CYP450 2D6 e 3A4 estão envolvidos na via metabólica que é responsável pela eliminação de uma pequena parte da dose administrada. Estudos in vitro usando microssomas hepáticos humanos mostraram que o tiotrópio em concentrações supraterapêuticas não inibiu CYP450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ou 3A4.
Excreção
brometo de tiotrópio administrado por via intravenosa é excretado principalmente inalterado na urina (74%). Após a inalação de pó seco em pacientes com DPOC em estado de equilíbrio, a excreção urinária foi de 7% (1,3mcg) da dose inalterada em 24 horas. A depuração renal do tiotrópio excede a depuração da creatinina, indicando secreção na urina.
Populações Específicas
Pacientes Geriátricos
Como esperado para todos os medicamentos excretados predominantemente por via renal, o avanço da idade foi associado a uma diminuição da depuração renal de tiotrópio (365 mL/min em pacientes com DPOC
Insuficiência renal
Após a administração de 4 semanas de SPIRIVA 9mcg HANDIHALER ou SPIRIVA 9mcg RESPIMAT uma vez ao dia em pacientes com DPOC, insuficiência renal leve (clearance de creatinina 60-
Insuficiência hepática
Os efeitos da insuficiência hepática na farmacocinética do tiotrópio não foram estudados.
Interações medicamentosas
Foi realizado um estudo de interação com tiotrópio (infusão intravenosa de 14,4 mcg por 15 minutos) e cimetidina 400 mg três vezes ao dia ou ranitidina 300 mg uma vez ao dia. A administração concomitante de cimetidina com tiotrópio resultou em um aumento de 20% na AUC0-4h, uma diminuição de 28% na depuração renal de tiotrópio e nenhuma alteração significativa na Cmax e quantidade excretada na urina em 96 horas. A coadministração de tiotrópio com ranitidina não afetou a farmacocinética do tiotrópio.
Medicamentos concomitantes comuns (agonistas beta2-adrenérgicos de ação prolongada (LABA), corticosteroides inalatórios (ICS)) usados por pacientes com DPOC não alteraram a exposição ao tiotrópio.
Estudos clínicos
programa de desenvolvimento clínico SPIRIVA 9mcg HANDIHALER (pó para inalação de brometo de tiotrópio) consistiu em seis estudos de Fase 3 em 2663 pacientes com DPOC (1308 recebendo SPIRIVA 9mcg HANDIHALER): dois estudos de 1 ano, controlados por placebo, dois de 6 meses, controlados por placebo estudos e dois estudos de 1 ano, controlados com ipratrópio. Esses estudos incluíram pacientes com diagnóstico clínico de DPOC, idade igual ou superior a 40 anos, história de tabagismo superior a 10 anos-maço, volume expiratório forçado no primeiro segundo (VEF1) menor ou igual a 60% ou 65% do previsto e relação VEF1/CVF menor ou igual a 0,7.
Nesses estudos, SPIRIVA HANDIHALER, administrado uma vez ao dia pela manhã, proporcionou melhora na função pulmonar (VEF1), com pico de efeito ocorrendo dentro de 3 horas após a primeira dose.
Dois ensaios adicionais avaliaram exacerbações: um ensaio clínico multicêntrico, randomizado, duplo-cego, controlado por placebo, de 6 meses de 1829 pacientes com DPOC em um cenário de Assuntos de Veteranos dos EUA e um de 4 anos, randomizado, duplo-cego, controlado por placebo, multicêntrico, ensaio clínico de 5.992 pacientes com DPOC. Os efeitos a longo prazo na função pulmonar e outros resultados também foram avaliados no estudo multicêntrico de 4 anos.
Efeitos de 6 meses a 1 ano na função pulmonar
Nos estudos controlados por placebo de 1 ano, a melhora média no VEF1 em 30 minutos foi de 0,13 litros (13%) com um pico de melhora de 0,24 litros (24%) em relação à linha de base após a primeira dose (Dia 1). Outras melhorias no VEF1 e na capacidade vital forçada (CVF) foram observadas com o estado de equilíbrio farmacodinâmico alcançado no Dia 8 com tratamento uma vez ao dia. A melhora média do pico no VEF1, em relação à linha de base, foi de 0,28 a 0,31 litros (28% a 31%), após 1 semana (Dia 8) de tratamento uma vez ao dia. A melhora da função pulmonar foi mantida por 24 horas após uma dose única e mantida consistentemente durante o período de tratamento de 1 ano sem evidência de tolerância.
Nos dois ensaios controlados por placebo de 6 meses, avaliações espirométricas em série foram realizadas durante o dia no Ensaio A (12 horas) e limitadas a 3 horas no Ensaio B. Os valores de VEF1 em série ao longo de 12 horas (Ensaio A) são exibidos em Figura 1. Esses estudos apoiam ainda mais a melhora da função pulmonar (VEF1) com SPIRIVA 9mcg HANDIHALER, que persistiu durante o período de observação espirométrica. A eficácia foi mantida por 24 horas após a administração durante o período de tratamento de 6 meses.
Figura 1: VEF1 médio ao longo do tempo (antes e após a administração do medicamento em estudo) nos dias 1 e 169 para o Ensaio A (um estudo controlado por placebo de seis meses)* 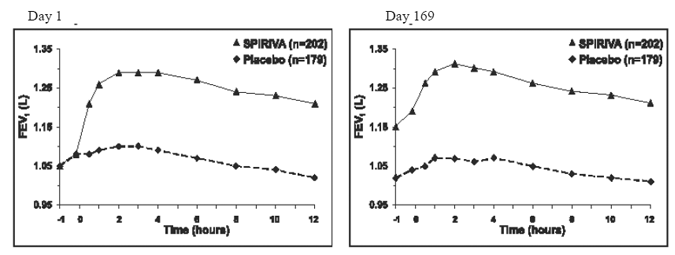
*Médias ajustadas para centro, tratamento e efeito de linha de base. No dia 169, um total de 183 e 149 pacientes nos grupos SPIRIVA HANDIHALER e placebo, respectivamente, completaram o estudo. Os dados para os demais pacientes foram imputados usando a última observação ou observação menos favorável realizada.
Os resultados de cada um dos estudos controlados por ipratrópio de 1 ano foram semelhantes aos resultados dos estudos controlados por placebo de 1 ano. Os resultados de um desses ensaios são mostrados na Figura 2.
Figura 2: VEF1 médio ao longo do tempo (0 a 6 horas após a dose) nos dias 1 e 92, respectivamente para um dos dois estudos controlados por ipratrópio* 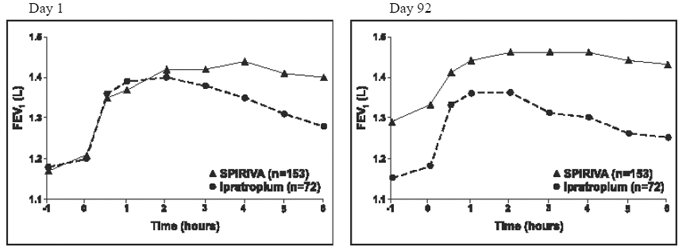
*Médias ajustadas para centro, tratamento e efeito de linha de base. No Dia 92 (ponto final primário), um total de 151 e 69 pacientes nos grupos SPIRIVA HANDIHALER e ipratrópio, respectivamente, completaram 3 meses de observação. Os dados para os demais pacientes foram imputados usando a última observação ou observação menos favorável realizada.
Um estudo clínico randomizado controlado por placebo em 105 pacientes com DPOC demonstrou que a broncodilatação foi mantida durante o intervalo de dosagem de 24 horas em comparação com placebo, independentemente de SPIRIVA 9mcg HANDIHALER ter sido administrado pela manhã ou à noite.
Ao longo de cada semana do período de tratamento de 1 ano nos dois estudos controlados com placebo, os pacientes que tomaram SPIRIVA 9mcg HANDIHALER tiveram uma necessidade reduzida de uso de agonistas beta2 de curta ação de resgate. A redução no uso de agonistas beta2 de curta ação de resgate, em comparação com placebo, foi demonstrada em um dos dois estudos de 6 meses.
Efeitos de 4 anos na função pulmonar
Um ensaio clínico multicêntrico, randomizado, duplo-cego, controlado por placebo, de 4 anos, envolvendo 5.992 pacientes com DPOC foi conduzido para avaliar os efeitos a longo prazo de SPIRIVA HANDIHALER na progressão da doença (taxa de declínio no VEF1). Os pacientes foram autorizados a usar todos os medicamentos respiratórios (incluindo beta-agonistas de curta e longa duração, esteróides inalatórios e sistêmicos e teofilinas), exceto anticolinérgicos inalatórios. Os pacientes tinham 40 a 88 anos de idade, 75% do sexo masculino e 90% caucasianos com diagnóstico de DPOC e um VEF1 pré-broncodilatador médio de 39% do previsto (variação = 9% a 76%) no início do estudo. Não houve diferença entre os grupos em nenhum dos desfechos de eficácia co-primária, taxa anual de declínio no VEF1 pré e pós-broncodilatador, conforme demonstrado por inclinações semelhantes de declínio do VEF1 ao longo do tempo (Figura 3).
SPIRIVA HANDIHALER manteve melhorias no vale (pré-dose) VEF1 (médias ajustadas ao longo do tempo: 87 a 103 mL) ao longo dos 4 anos do estudo (Figura 3).
Figura 3: Valores médios de VEF1 de vale (pré-dose) em cada ponto de tempo 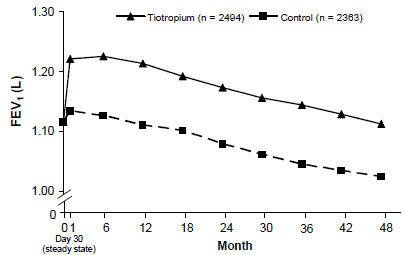
ANOVA de medida repetida foi usada para estimar as médias. As médias são ajustadas para medições de linha de base. Linha de base pelo VEF1 (média observada) = 1,12. Pacientes com ≥3 testes de função pulmonar aceitáveis após o Dia 30 e valor basal não ausente foram incluídos na análise.
Exacerbações
efeito de SPIRIVA 9mcg HANDIHALER nas exacerbações da DPOC foi avaliado em dois ensaios clínicos: um ensaio clínico de 4 anos descrito acima e um ensaio clínico de 6 meses de 1.829 pacientes com DPOC em um ambiente de Assuntos de Veteranos. No estudo de 6 meses, as exacerbações da DPOC foram definidas como um complexo de sintomas respiratórios (aumento ou novo início) de mais de um dos seguintes: tosse, expectoração, sibilos, dispneia ou aperto no peito com duração de pelo menos 3 dias que requerem tratamento com antibióticos, esteróides sistêmicos ou hospitalização. A população tinha idade variando de 40 a 90 anos, sendo 99% do sexo masculino, 91% caucasianos e DPOC com VEF1 médio pré-broncodilatador por cento previsto de 36% (variação = 8% a 93%). Os pacientes foram autorizados a usar medicamentos respiratórios (incluindo beta-agonistas de curta e longa duração, esteróides inalatórios e sistêmicos e teofilinas) além dos anticolinérgicos inalatórios. No estudo de 6 meses, os desfechos co-primários foram a proporção de pacientes com exacerbação da DPOC e a proporção de pacientes com hospitalização devido à exacerbação da DPOC. SPIRIVA 9mcg HANDIHALER reduziu significativamente a proporção de pacientes com DPOC que apresentaram exacerbações em comparação com placebo (27,9% vs. 32,3%, respectivamente; Odds Ratio (OR) (tiotrópio/placebo) = 0,81; IC 95% = 0,66, 0,99; p = 0,037 ). A proporção de pacientes com internação por exacerbação da DPOC em pacientes que usaram SPIRIVA 9mcg HANDIHALER em comparação ao placebo foi de 7,0% vs. 9,5%, respectivamente; OR = 0,72; IC 95% = 0,51, 1,01; p = 0,056.
As exacerbações foram avaliadas como um resultado secundário no estudo multicêntrico de 4 anos. Neste estudo, as exacerbações da DPOC foram definidas como um aumento ou novo aparecimento de mais de um dos seguintes sintomas respiratórios (tosse, expectoração, purulência do escarro, sibilos, dispneia) com duração de três ou mais dias exigindo tratamento com antibióticos e/ou esteróides sistêmicos (orais, intramusculares ou intravenosos). SPIRIVA HANDIHALER reduziu significativamente o risco de exacerbação em 14% (Hazard Ratio (HR) = 0,86; IC 95% = 0,81, 0,91; p
Mortalidade por todas as causas
No estudo de função pulmonar controlado por placebo de 4 anos descrito acima, foi avaliada a mortalidade por todas as causas em comparação com o placebo. Não houve diferenças significativas nas taxas de mortalidade por todas as causas entre SPIRIVA 9mcg HANDIHALER e placebo.
A mortalidade por todas as causas de SPIRIVA HANDIHALER também foi comparada ao spray de inalação de tiotrópio 5 mcg (SPIRIVA RESPIMAT 5 mcg) em um estudo adicional de longo prazo, randomizado, duplo-cego, duplo-dummy, controlado por ativos, com um período de observação de até 3 anos. A mortalidade por todas as causas foi semelhante entre SPIRIVA 9mcg HANDIHALER e SPIRIVA RESPIMAT.
INFORMAÇÃO DO PACIENTE
SPIRIVA 9mcgR® (speh REE vah) HANDIHALER® (brometo de tiotrópio) Pó para inalação, para uso por inalação oral
NÃO engula as cápsulas de SPIRIVA.
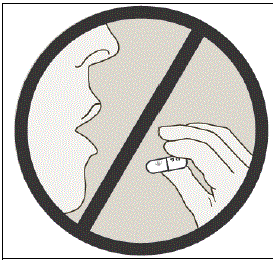
Informação importante: Não engula as cápsulas de SPIRIVA. As cápsulas de SPIRIVA 9mcg só devem ser usadas com o dispositivo HANDIHALER e inaladas pela boca (inalação oral).
Leia as informações que acompanham o SPIRIVA HANDIHALER antes de começar a usá-lo e sempre que reabastecer sua receita. Pode haver novas informações. Este folheto não substitui a conversa com o seu médico sobre a sua condição médica ou o seu tratamento.
O que é SPIRIVA HANDIHALER?
- SPIRIVA HANDIHALER é um medicamento de prescrição usado diariamente (um medicamento de manutenção) para controlar os sintomas da doença pulmonar obstrutiva crônica (DPOC), incluindo bronquite crônica e enfisema.
- SPIRIVA HANDIHALER ajuda a fazer seus pulmões funcionarem melhor por 24 horas. SPIRIVA 9mcg HANDIHALER relaxa as vias aéreas e ajuda a mantê-las abertas. Você pode começar a sentir que é mais fácil respirar no primeiro dia, mas pode demorar mais para sentir todos os efeitos do medicamento. SPIRIVA HANDIHALER funciona melhor e pode ajudar a facilitar a respiração quando você o usa todos os dias.
- SPIRIVA 9mcg HANDIHALER reduz a probabilidade de surtos e agravamento dos sintomas da DPOC (exacerbações da DPOC). Uma exacerbação da DPOC é definida como um aumento ou novo início de mais de um sintoma de DPOC, como tosse, muco, falta de ar e chiado no peito, que requer medicamentos além do medicamento de resgate.
SPIRIVA 9mcg HANDIHALER não é um medicamento de resgate e não deve ser usado para tratar problemas respiratórios súbitos. O seu médico pode receitar-lhe outros medicamentos para problemas respiratórios súbitos.
Não se sabe se SPIRIVA 9mcg HANDIHALER é seguro e eficaz em crianças.
Quem não deve tomar SPIRIVA 9mcg HANDIHALER?
Não use SPIRIVA 9mcg HANDIHALER se você:
- são alérgicos ao tiotrópio, ipratrópio (Atrovent®) ou a qualquer um dos ingredientes de SPIRIVA 9mcg HANDIHALER. Consulte o final deste folheto para obter uma lista completa dos ingredientes de SPIRIVA 9mcg HANDIHALER.
Os sintomas de uma reação alérgica grave ao SPIRIVA 9mcg HANDIHALER podem incluir:
- manchas vermelhas levantadas em sua pele (urticária)
- coceira
- irritação na pele
- inchaço da face, lábios, língua e garganta que pode causar dificuldade em respirar ou engolir
Se você tiver esses sintomas de uma reação alérgica, pare de tomar SPIRIVA HANDIHALER e ligue para o seu médico imediatamente ou dirija-se ao pronto-socorro do hospital mais próximo.
O que devo dizer ao meu médico antes de usar SPIRIVA HANDIHALER?
Antes de tomar SPIRIVA HANDIHALER, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem problemas renais.
- tem glaucoma. SPIRIVA HANDIHALER pode piorar o seu glaucoma.
- tem uma próstata aumentada, problemas para urinar ou um bloqueio na bexiga. SPIRIVA 9mcg HANDIHALER pode piorar esses problemas.
- estão grávidas ou planejam engravidar. Não se sabe se SPIRIVA HANDIHALER pode prejudicar o feto.
- está amamentando ou planeja amamentar. Não se sabe se SPIRIVA HANDIHALER passa para o leite materno. Você e seu médico decidirão se SPIRIVA 9mcg HANDIHALER é adequado para você enquanto amamenta.
- tem uma alergia grave às proteínas do leite. Pergunte ao seu médico se não tiver certeza.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e não prescritos e colírios, vitaminas e suplementos de ervas. Alguns dos seus outros medicamentos ou suplementos podem afetar a forma como SPIRIVA HANDIHALER funciona. SPIRIVA 9mcg HANDIHALER é um medicamento anticolinérgico. Você não deve tomar outros medicamentos anticolinérgicos enquanto estiver usando SPIRIVA 9mcg HANDIHALER, incluindo ipratrópio. Pergunte ao seu médico ou farmacêutico se não tiver certeza se um dos seus medicamentos é um anticolinérgico.
Conheça os medicamentos que você toma. Mantenha uma lista dos seus medicamentos consigo para mostrar ao seu médico e farmacêutico quando receber um novo medicamento.
Como devo tomar SPIRIVA 9mcg HANDIHALER?
- Use SPIRIVA 9mcg HANDIHALER exatamente como prescrito. Use SPIRIVA HANDIHALER uma vez por dia.
- Leia as “Instruções de Uso” no final deste folheto antes de usar SPIRIVA HANDIHALER. Fale com o seu médico se não compreender as instruções.
- Não engula as cápsulas de SPIRIVA 9mcg.
- Use apenas cápsulas SPIRIVA 9mcg com o dispositivo HANDIHALER.
- Não use o dispositivo HANDIHALER para tomar qualquer outro medicamento.
- SPIRIVA 9mcg HANDIHALER vem como um pó em uma cápsula SPIRIVA 9mcg que se encaixa no dispositivo HANDIHALER. Cada cápsula de SPIRIVA, contendo apenas uma pequena quantidade de pó de SPIRIVA, é uma dose completa de medicamento.
- Separe um blister do cartão blister. Em seguida, retire uma das cápsulas de SPIRIVA 9mcg da embalagem blister imediatamente antes de usá-la.
- Após a perfuração da cápsula, tome uma dose completa de SPIRIVA HANDIHALER inspirando o pó pela boca duas vezes, usando o dispositivo HANDIHALER (tome 2 inalações de uma cápsula de SPIRIVA). Veja o "Instruções de uso" no final deste folheto.
- Deite fora qualquer cápsula de SPIRIVA que não seja utilizada imediatamente após ser retirada do blister. Não deixe as cápsulas de SPIRIVA abertas ao ar; eles podem não funcionar tão bem.
- Se você esquecer de uma dose, tome-a assim que se lembrar. Não use SPIRIVA HANDIHALER mais de uma vez a cada 24 horas. ? Se você usar mais do que a dose prescrita de SPIRIVA HANDIHALER, ligue para seu médico ou para um centro de controle de intoxicações.
O que devo evitar ao usar SPIRIVA 9mcg HANDIHALER?
- Não deixe o pó da cápsula de SPIRIVA entrar em contato com seus olhos. Sua visão pode ficar embaçada e a pupila do olho pode ficar maior (dilatar). Se isso acontecer, ligue para o seu médico.
- SPIRIVA 9mcg HANDIHALER pode causar tonturas e visão turva. Se sentir estes sintomas, deve ter cuidado ao realizar atividades como conduzir um carro ou utilizar aparelhos ou outras máquinas.
Quais são os possíveis efeitos colaterais do SPIRIVA HANDIHALER?
SPIRIVA 9mcg HANDIHALER pode causar efeitos colaterais graves, incluindo: Reação alérgica. Os sintomas podem incluir:
- manchas vermelhas levantadas em sua pele (urticária)
- coceira
- irritação na pele
- inchaço dos lábios, língua ou garganta que pode causar dificuldade em respirar ou engolir
Se você tiver esses sintomas de uma reação alérgica, pare de tomar SPIRIVA HANDIHALER e ligue para o seu médico imediatamente ou dirija-se ao pronto-socorro do hospital mais próximo.
- Estreitamento e bloqueio súbitos das vias aéreas nos pulmões (broncoespasmo) . Sua respiração de repente piora.
Se você tiver esses sintomas de broncoespasmo, pare de tomar SPIRIVA 9mcg HANDIHALER e ligue para o seu médico imediatamente ou dirija-se ao pronto-socorro do hospital mais próximo.
- Aumento da pressão ocular nova ou agravada (glaucoma agudo de ângulo estreito). Os sintomas do glaucoma de ângulo estreito agudo podem incluir:
- dor nos olhos
- visão embaçada
- vendo halos (auréolas visuais) ou imagens coloridas junto com olhos vermelhos
Usar apenas colírios para tratar esses sintomas pode não funcionar. Se tiver estes sintomas, pare de tomar SPIRIVA HANDIHALER e contacte o seu médico imediatamente.
- Retenção urinária nova ou agravada. Os sintomas de obstrução na bexiga e/ou aumento da próstata podem incluir: dificuldade em urinar, dor ao urinar.
Se tiver estes sintomas de retenção urinária, pare de tomar SPIRIVA HANDIHALER e contacte o seu médico imediatamente.
Outros efeitos colaterais com SPIRIVA 9mcg HANDIHALER incluem:
- infecção do trato respiratório superior
- boca seca
- infecção do sinus
- dor de garganta
- dor torácica inespecífica
- infecção do trato urinário
- indigestão
- nariz a pingar
- constipação
- aumento da frequência cardíaca
- visão embaçada
Estes não são todos os efeitos colaterais possíveis com SPIRIVA HANDIHALER. Informe o seu médico se tiver algum efeito secundário que o incomode ou que não desapareça.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o SPIRIVA HANDIHALER?
- Não guarde as cápsulas de SPIRIVA no dispositivo HANDIHALER.
- Armazene as cápsulas de SPIRIVA na embalagem blister selada à temperatura ambiente 68°F a 77°F (20°C a 25°C).
- Mantenha as cápsulas de SPIRIVA longe do calor e do frio (não congele).
- Armazene as cápsulas de SPIRIVA 9mcg em local seco. Deite fora quaisquer cápsulas de SPIRIVA 9mcg não utilizadas que tenham estado abertas ao ar.
Pergunte ao seu médico ou farmacêutico se tiver alguma dúvida sobre como armazenar suas cápsulas de SPIRIVA 9mcg.
Mantenha SPIRIVA HANDIHALER, SPIRIVA 9mcg cápsulas e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre SPIRIVA HANDIHALER
Às vezes, os medicamentos são prescritos para outros fins que não os listados nos folhetos de informações ao paciente. Não use SPIRIVA 9mcg HANDIHALER para uma finalidade para a qual não foi prescrito. Não dê SPIRIVA HANDIHALER a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Para mais informações sobre SPIRIVA HANDIHALER, fale com o seu médico. Você pode pedir ao seu médico ou farmacêutico informações sobre o SPIRIVA 9mcg HANDIHALER que foi escrito para profissionais de saúde.
Para obter mais informações sobre o SPIRIVA 9mcg HANDIHALER, acesse www.SPIRIVA.com ou digitalize o código abaixo ou ligue para a Boehringer Ingelheim Pharmaceuticals, Inc. no número 1-800-542-6257 ou (TTY) 1-800-459-9906.
Quais são os ingredientes do SPIRIVA 9mcg HANDIHALER?
Ingrediente ativo: tiotrópio
Ingrediente inativo: lactose monohidratada
O que é DPOC (Doença Pulmonar Obstrutiva Crônica)?
A DPOC é uma doença pulmonar grave que inclui bronquite crônica, enfisema ou ambos. A maior parte da DPOC é causada pelo tabagismo. Quando você tem DPOC, suas vias aéreas ficam estreitas. Assim, o ar sai dos pulmões mais lentamente. Isso dificulta a respiração.
Esta informação do paciente foi aprovada pela Food and Drug Administration dos EUA.
INSTRUÇÕES DE USOSPIRIVA® (speh REE vah) HANDIHALER® (brometo de tiotrópio) pó para inalação, para uso por inalação oral
Não engula as cápsulas de SPIRIVA.
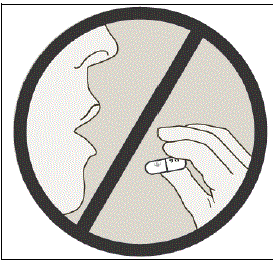
Informações importantes sobre o uso do SPIRIVA HANDIHALER
- Não engula as cápsulas de SPIRIVA 9mcg.
- As cápsulas de SPIRIVA só devem ser utilizadas com o dispositivo HANDIHALER e inaladas pela boca (inalação oral).
- Não utilize o seu dispositivo HANDIHALER para tomar qualquer outro medicamento.
Leia primeiro as Informações do Paciente, depois leia estas Instruções de Uso antes de começar a usar SPIRIVA HANDIHALER e sempre que reabastecer sua receita. Pode haver novas informações.
Familiarizando-se com o seu dispositivo HANDIHALER e as cápsulas SPIRIVA:
Seu SPIRIVA HANDIHALER vem com cápsulas SPIRIVA 9mcg em embalagem blister e um dispositivo HANDIHALER. Utilize o novo dispositivo HANDIHALER fornecido com o seu medicamento.
As partes do seu dispositivo HANDIHALER incluem:
(Veja a Figura A)
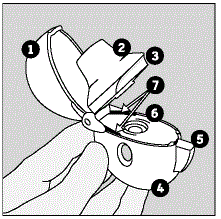
Figura A
Cada cápsula de SPIRIVA 9mcg é embalada em um blister. (Ver Figura B)
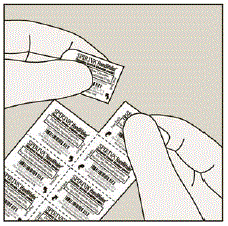
Figura B
- Cada cápsula de SPIRIVA contém apenas uma pequena quantidade de pó. (Ver Figura C) Esta é 1 dose completa.
- Não abra a cápsula de SPIRIVA 9mcg ou pode não funcionar.

Figura C
Tomar sua dose diária completa de medicamento requer 4 etapas principais.
Etapa 1. Abrindo seu dispositivo HANDIHALER:
Depois de retirar o seu dispositivo HANDIHALER da bolsa:
- Abra a tampa do pó (tampa) pressionando o botão de perfuração verde. (Ver Figura D)
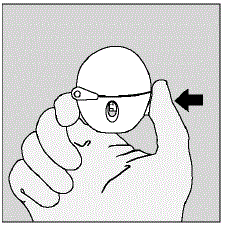
Figura D
- Puxe a tampa contra poeira (tampa) para cima, afastando-a da base para expor o bocal. (Ver Figura E)
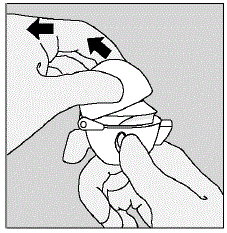
Figura E
- Abra o bocal puxando a crista do bocal para cima e afastando-a da base, de modo que a câmara central fique à mostra. (Ver Figura F)

Figura F
Etapa 2. Inserindo a cápsula SPIRIVA 9mcg em seu dispositivo HANDIHALER:
A cada dia, separe apenas 1 dos blisters do blister rasgando ao longo da linha perfurada. (Ver Figura G)
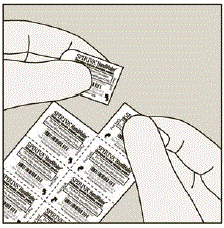
Figura G
Remova a cápsula de SPIRIVA do blister:
- Não faça corte a película ou utilize instrumentos afiados para retirar a cápsula de SPIRIVA do blister.
- Dobre 1 dos cantos do blister com uma seta e separe as camadas de papel alumínio.
- Retire a película impressa até ver toda a cápsula de SPIRIVA. (Ver Figura H)
- Se você abriu mais de 1 blister ao ar, a cápsula extra de SPIRIVA 9mcg não deve ser usada e deve ser jogada fora.
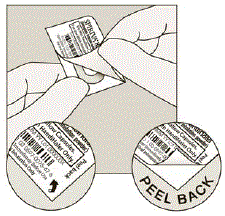
Figura H
Coloque a cápsula SPIRIVA 9mcg na câmara central do seu dispositivo HANDIHALER. (Veja a Figura I)
Figura I
Feche o bocal firmemente contra a base cinza até ouvir um clique. Deixe a tampa do pó (tampa) aberta. (Ver Figura J)
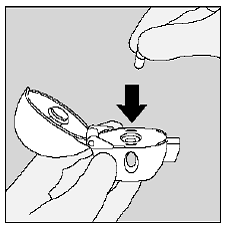
Figura J
Passo 3. Perfuração da cápsula SPIRIVA 9mcg:
- Segure o dispositivo HANDIHALER com o bocal apontado para cima. (Ver Figura K)
- Pressione o botão de perfuração verde uma vez até que fique plano (rente) contra a base, depois solte. É assim que você faz furos na cápsula de SPIRIVA para que você receba seu medicamento ao inspirar.
- Não faça pressione o botão verde mais de uma vez.
- Não faça agite seu dispositivo HANDIHALER.
- A perfuração da cápsula de SPIRIVA 9mcg pode produzir pequenas pedaços de gelatina. Alguns destes pequenos pedaços podem passar através do ecrã do seu dispositivo HANDIHALER para a boca ou garganta quando respira o medicamento. Isto é normal. Os pequenos pedaços de gelatina não devem prejudicá-lo.
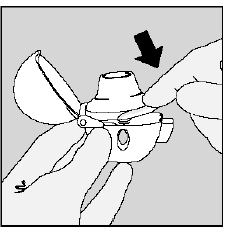
Figura K
Etapa 4. Tomar sua dose diária completa (2 inalações da mesma cápsula de SPIRIVA 9mcg):
Expire completamente em 1 respiração, esvaziando seus pulmões de qualquer ar. (Ver Figura L)
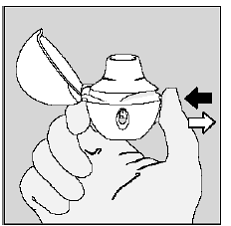
Figura L
Importante: não respire no seu dispositivo HANDIHALER.
Na próxima respiração, tome seu remédio:
- Mantenha a cabeça na posição vertical enquanto você está olhando para a frente. (Veja a Figura M)
- Levante o dispositivo HANDIHALER até a boca na posição horizontal. Não faça bloqueie as entradas de ar.
- Feche os lábios firmemente ao redor do bocal.
- Respire profundamente até que seus pulmões estejam cheios. Você deve ouvir ou sentir a vibração da cápsula SPIRIVA (chocalho). (Veja a Figura M)
- Prenda a respiração por alguns segundos e, ao mesmo tempo, tire o dispositivo HANDIHALER da boca.
- Respire normalmente novamente.
Figura M
O chocalho diz que você respirou corretamente. Se não ouvir ou sentir um chocalho, consulte a secção “Se não ouvir ou sentir o chocalho da cápsula de SPIRIVA enquanto respira o seu medicamento”.
Figura N
Para obter sua dose diária completa, você deve novamente expirar completamente (consulte a Figura N) e, pela segunda vez, inspirar (consulte a Figura O) da mesma cápsula de SPIRIVA.
Importante: não pressione o botão de perfuração verde novamente.
Figura O
Lembrar: Para receber a dose completa do medicamento todos os dias, você deve inspirar 2 vezes a partir da mesma cápsula de SPIRIVA 9mcg. Certifique-se de expirar completamente antes de inspirar a partir do dispositivo HANDIHALER.
Cuidados e armazenamento do seu SPIRIVA HANDIHALER:
Figura P
- Depois de tomar sua dose diária, abra o bocal e despeje a cápsula de SPIRIVA 9mcg usada na lixeira, sem tocá-la.
- Remova quaisquer pedaços de cápsulas SPIRIVA 9mcg ou acúmulo de pó SPIRIVA 9mcg virando o dispositivo HANDIHALER de cabeça para baixo e batendo suavemente, mas com firmeza. (Ver Figura P) Em seguida, feche o bocal e a tampa para armazenamento.
- Não faça guarde o seu dispositivo HANDIHALER e as cápsulas SPIRIVA 9mcg (blisters) num local húmido e húmido. Guarde sempre as cápsulas de SPIRIVA nos blisters selados.
Se você não ouvir ou sentir o barulho da cápsula de SPIRIVA 9mcg ao inspirar o medicamento:
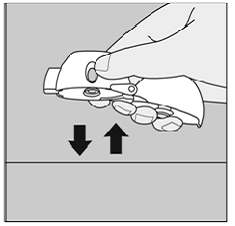
Figura Q
Não faça pressione o botão de perfuração verde novamente.
Segure o dispositivo HANDIHALER com o bocal apontado para cima e bata suavemente com o dispositivo HANDIHALER sobre uma mesa. (Veja a Figura Q)
Verifique se o bocal está completamente fechado. Expire completamente antes de inspirar profundamente novamente com o bocal na boca. (Veja a Figura O)
Se você ainda não ouvir ou sentir o chocalho da cápsula de SPIRIVA após repetir as etapas acima:
- Jogue fora a cápsula de SPIRIVA.
- Abra a base levantando o botão de perfuração verde e verifique se há pedaços da cápsula de SPIRIVA 9mcg na câmara central. Pedaços de cápsulas de SPIRIVA 9mcg na câmara central podem fazer com que uma cápsula de SPIRIVA 9mcg não balance.
- Vire o dispositivo HANDIHALER de cabeça para baixo e bata suavemente, mas com firmeza, para remover os pedaços da cápsula SPIRIVA. Ligue para o seu médico para obter instruções.
Limpar o seu dispositivo HANDIHALER:
Limpe seu dispositivo HANDIHALER conforme necessário. (Veja a Figura R)
- Leva 24 horas para secar ao ar o seu dispositivo HANDIHALER depois de limpá-lo.
- Não faça use agentes de limpeza ou detergentes.
- Não faça coloque o seu dispositivo HANDIHALER na máquina de lavar loiça para limpeza.
Etapas de limpeza:
- Abra a tampa contra poeira e o bocal.
- Abra a base levantando o botão de perfuração verde.
- Procure na câmara central por pedaços de cápsulas SPIRIVA 9mcg ou acúmulo de pó. Se visto, toque para fora.
- Enxágue seu dispositivo HANDIHALER com água morna, pressionando o botão verde de perfuração algumas vezes para que a câmara central e a agulha de perfuração fiquem sob a água corrente. Verifique se qualquer acúmulo de pó ou pedaços de cápsula de SPIRIVA foram removidos.
- Seque bem o seu dispositivo HANDIHALER, derramando o excesso de água em uma toalha de papel. Seque ao ar depois, deixando a tampa contra poeira, bocal e base abertos, espalhando-os completamente para que sequem completamente.
- Não faça use um secador de cabelo para secar o dispositivo HANDIHALER.
- Não faça use o seu dispositivo HANDIHALER quando estiver molhado. Se necessário, você pode limpar a parte externa do bocal com um pano limpo e úmido.
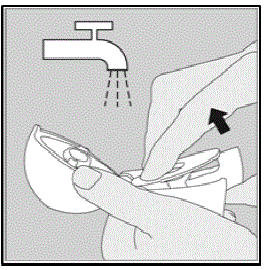
Figura R
Dicas úteis para ajudar a garantir que você esteja tomando adequadamente sua dose diária completa de SPIRIVA 9mcg HANDIHALER:
- Imprensa o botão de piercing verde vez; Inspire 2 vezes; Expire completamente antes de cada uma das 2 inalações.
- Utilize sempre o novo dispositivo HANDIHALER fornecido com o seu medicamento.
- Mantenha seu dispositivo HANDIHALER com o bocal apontado para cima ao pressionar o botão verde de perfuração.
- Pressione o botão de piercing verde 1 vez perfurar a cápsula SPIRIVA.
- Não expire no dispositivo HANDIHALER.
- Mantenha o seu dispositivo HANDIHALER na posição horizontal e mantenha a cabeça erguida, olhando para a frente, ao inspirar.
- Verifique a câmara central do seu dispositivo HANDIHALER quanto a pedaços de cápsulas SPIRIVA 9mcg ou acúmulo de pó. Se forem vistos pedaços ou pó, bata antes de usar.
- Limpe seu HANDIHALER conforme necessário e seque bem.
Para obter mais informações, pergunte ao seu médico ou farmacêutico ou acesse www.spiriva.com ou digitalize o código abaixo ou ligue para 1-800-542-6257 ou (TTY) 1-800-459-9906.
Estas Instruções de Uso foram aprovadas pela Food and Drug Administration dos EUA.
