Amaryl 1mg, 2mg, 4mg Glimepiride Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Amaryl 1mg e como é usado?
Amaryl 4mg é um medicamento de prescrição usado para tratar os sintomas do Diabetes Mellitus tipo 2. Amaryl 4mg pode ser usado sozinho ou com outros medicamentos.
Amaryl 2mg pertence a uma classe de medicamentos chamados antidiabéticos, sulfoniluréias.
Não se sabe se Amaryl é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Amaryl?
Amaryl pode causar efeitos colaterais graves, incluindo:
- pele pálida ou amarelada,
- urina de cor escura,
- confusão,
- fraqueza, e
- febre
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Amaryl incluem:
- dor de cabeça,
- tontura,
- fraqueza,
- náusea, e
- Baixo teor de açúcar no sangue
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Amaryl. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
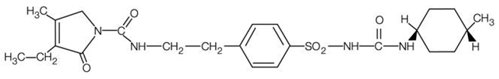
AMARYL é uma sulfonilureia oral que contém o ingrediente ativo glimepirida. Quimicamente, a glimepirida é identificada como 1-[[p-[2-(3-etil-4-metil-2-oxo-3-pirrolina-1-carboxamido) etil]fenil]sulfonil]-3-(trans-4- metilciclohexil)ureia (C24H34N4O5S) com um peso molecular de 490,62. A glimepirida é um pó branco a branco amarelado, cristalino, inodoro a praticamente inodoro e praticamente insolúvel em água. A fórmula estrutural é:
Os comprimidos de AMARYL contêm o ingrediente ativo glimepirida e os seguintes ingredientes inativos: lactose (hidratada), glicolato de amido sódico, povidona, celulose microcristalina e estearato de magnésio. Além disso, os comprimidos de AMARYL 1 mg contêm óxido férrico vermelho, os comprimidos de AMARYL 2 mg contêm amarelo de óxido férrico e laca de alumínio FD&C azul nº 2 e os comprimidos de AMARYL 4 mg contêm laca de alumínio FD&C azul nº 2.
INDICAÇÕES
AMARYL 2mg é indicado como adjuvante à dieta e exercícios para melhorar o controle glicêmico em adultos com diabetes mellitus tipo 2 [ver Estudos clínicos ].
Limitações importantes de uso
AMARYL não deve ser usado para o tratamento de diabetes mellitus tipo 1 ou cetoacidose diabética, pois não seria eficaz nessas situações.
DOSAGEM E ADMINISTRAÇÃO
Dosagem Recomendada
AMARYL 1mg deve ser administrado no café da manhã ou na primeira refeição principal do dia.
dose inicial recomendada de AMARYL é de 1 mg ou 2 mg uma vez ao dia. Pacientes com risco aumentado de hipoglicemia (por exemplo, idosos ou pacientes com insuficiência renal) devem iniciar 1 mg uma vez ao dia [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Após atingir uma dose diária de 2 mg, podem ser feitos novos aumentos de dose em incrementos de 1 mg ou 2 mg com base na resposta glicêmica do paciente. A titulação não deve ocorrer com mais frequência do que a cada 1-2 semanas. Um esquema de titulação conservador é recomendado para pacientes com risco aumentado de hipoglicemia [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
A dose máxima recomendada é de 8 mg uma vez ao dia.
Pacientes sendo transferidos para AMARYL 1mg de sulfonilureias de meia-vida mais longa (por exemplo, clorpropamida) podem ter efeito sobreposto da droga por 1-2 semanas e devem ser monitorados adequadamente para hipoglicemia.
Quando colesevelam é coadministrado com glimepirida, a concentração plasmática máxima e a exposição total à glimepirida são reduzidas. Portanto, AMARYL 2mg deve ser administrado pelo menos 4 horas antes do colesevelam.
COMO FORNECIDO
Formas de dosagem e pontos fortes
AMARYL 4mg é formulado em comprimidos de:
- 1 mg (rosa, face plana, oblonga com lados entalhados em bisect duplo, impresso com “AMA RYL” em um lado)
- 2 mg (verde, face plana, oblonga com lados entalhados em bisect duplo, impresso com “AMA RYL” em um lado)
- 4 mg (azul, face plana, oblonga com lados entalhados em bisect duplo, impresso com “AMA RYL” em um lado)
Armazenamento e manuseio
AMARIL comprimidos estão disponíveis nas seguintes dosagens e tamanhos de embalagem:
1 mg (rosa, face plana, oblonga com lados entalhados em bisect duplo, impresso com “AMA RYL” em um lado) em garrafas de 100 ( NDC 0039-0221-10)
2 mg (verde, face plana, oblonga com lados entalhados em bisect duplo, impresso com “AMA RYL” em um lado) em garrafas de 100 ( NDC 0039-0222-10)
4 mg (azul, face plana, oblonga com lados entalhados em bisect duplo, impresso com “AMA RYL” em um lado) em garrafas de 100 ( NDC 0039-0223-10)
Armazenar a 25°C (77°F); excursões permitidas para 20 - 25°C (68 - 77°F) (consulte Temperatura ambiente controlada USP ).
Dispensar em recipientes bem fechados com fechos de segurança.
sanofi-aventis US LLC, Bridgewater, NJ 08807, A SANOFI COMPANY. Revisado em dezembro de 2016
EFEITOS COLATERAIS
As seguintes reações adversas graves são discutidas com mais detalhes abaixo e em outras partes da bula:
- Hipoglicemia [ver AVISOS E PRECAUÇÕES ]
- Anemia hemolítica [ver AVISOS E PRECAUÇÕES ]
Em ensaios clínicos, as reações adversas mais comuns com AMARYL 4mg foram hipoglicemia, tontura, astenia, dor de cabeça e náusea.
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Aproximadamente 2.800 pacientes com diabetes tipo 2 foram tratados com AMARYL 4mg nos ensaios clínicos controlados. Nesses estudos, aproximadamente 1.700 pacientes foram tratados com AMARYL por pelo menos 1 ano.
A Tabela 1 resume os eventos adversos, além da hipoglicemia, que foram relatados em 11 estudos agrupados controlados por placebo, considerados ou não possivelmente ou provavelmente relacionados à medicação do estudo. A duração do tratamento variou de 13 semanas a 12 meses. Os termos relatados representam aqueles que ocorreram em uma incidência ≥ 5% entre os pacientes tratados com AMARYL e mais comumente do que em pacientes que receberam placebo.
Hipoglicemia
Em um estudo de monoterapia randomizado, duplo-cego e controlado por placebo de 14 semanas de duração, os pacientes que já estavam em terapia com sulfonilureia foram submetidos a um período de washout de 3 semanas e depois foram randomizados para AMARYL 1 mg, 4 mg, 8 mg ou placebo. Os pacientes randomizados para AMARYL 4 mg ou 8 mg foram submetidos à titulação forçada de uma dose inicial de 1 mg até essas doses finais, conforme tolerado [ver Estudos clínicos ]. A incidência geral de possível hipoglicemia (definida pela presença de pelo menos um sintoma que o investigador acredita estar relacionado à hipoglicemia; uma medição concomitante de glicose não foi necessária) foi de 4% para AMARYL 1 mg, 17% para AMARYL 4 mg, 16 % para AMARYL 8 mg e 0% para placebo. Todos esses eventos foram autotratados.
Em um estudo de monoterapia randomizado, duplo-cego e controlado por placebo com duração de 22 semanas, os pacientes receberam uma dose inicial de 1 mg de AMARYL ou placebo diariamente. A dose de AMARYL 2mg foi titulada para um alvo de glicose plasmática em jejum de 90-150 mg/dL. As doses diárias finais de AMARYL 2mg foram 1, 2, 3, 4, 6 ou 8 mg [ver Estudos clínicos ]. A incidência geral de possível hipoglicemia (conforme definido acima para o estudo de 14 semanas) para AMARYL versus placebo foi de 19,7% versus 3,2%. Todos esses eventos foram autotratados.
Ganho de peso: AMARYL, como todas as sulfonilureias, pode causar ganho de peso [ver Estudos clínicos ].
Reações alérgicas: Em ensaios clínicos, reações alérgicas, como prurido, eritema, urticária e erupções morbiliformes ou maculopapulares, ocorreram em menos de 1% dos pacientes tratados com AMARYL. Estes podem resolver apesar do tratamento continuado com AMARYL. Existem relatos pós-comercialização de reações alérgicas mais graves (por exemplo, dispneia, hipotensão, choque) [ver AVISOS E PRECAUÇÕES ].
Testes laboratoriais
Alanina Aminotransferase (ALT) sérica elevada: Em 11 estudos agrupados de AMARYL controlados por placebo, 1,9% dos pacientes tratados com AMARYL e 0,8% dos pacientes tratados com placebo desenvolveram ALT sérica superior a 2 vezes o limite superior do intervalo de referência.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de AMARYL. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
- Reações graves de hipersensibilidade, incluindo anafilaxia, angioedema e síndrome de Stevens-Johnson [ver AVISOS E PRECAUÇÕES ]
- Anemia hemolítica em pacientes com e sem deficiência de G6PD [ver AVISOS E PRECAUÇÕES ]
- Comprometimento da função hepática (por exemplo, com colestase e icterícia), bem como hepatite, que pode progredir para insuficiência hepática.
- Porfiria cutânea tardia, reações de fotossensibilidade e vasculite alérgica
- Leucopenia, agranulocitose, anemia aplástica e pancitopenia
- Trombocitopenia (incluindo casos graves com contagem de plaquetas inferior a 10.000/μL) e púrpura trombocitopênica
- Reações de porfiria hepática e reações do tipo dissulfiram
- Hiponatremia e síndrome de secreção inapropriada de hormônio antidiurético (SIADH), mais frequentemente em pacientes que estão tomando outros medicamentos ou que têm condições médicas conhecidas por causar hiponatremia ou aumentar a liberação de hormônio antidiurético
- Disgeusia
- Alopecia
INTERAÇÕES MEDICAMENTOSAS
Drogas que Afetam o Metabolismo da Glicose
Vários medicamentos afetam o metabolismo da glicose e podem exigir ajuste de dose de AMARYL 4mg e monitoramento particularmente rigoroso para hipoglicemia ou piora do controle glicêmico.
Os seguintes são exemplos de medicamentos que podem aumentar o efeito hipoglicemiante das sulfonilureias, incluindo AMARYL 2mg, aumentando a suscetibilidade e/ou intensidade da hipoglicemia: medicamentos antidiabéticos orais, acetato de pramlintida, insulina, inibidores da enzima conversora de angiotensina (ECA), Antagonistas do receptor H2, fibratos, propoxifeno, pentoxifilina, análogos da somatostatina, esteróides anabolizantes e andrógenos, ciclofosfamida, feniramidol, guanetidina, fluconazol, sulfinpirazona, tetraciclinas, claritromicina, disopiramida, quinolonas e aqueles medicamentos que são altamente ligados a proteínas, como fluoxetina, anti-inflamatórios não esteróides, salicilatos, sulfonamidas, cloranfenicol, cumarinas, probenecida e inibidores da monoaminoxidase. Quando esses medicamentos são administrados a um paciente recebendo AMARYL, monitore o paciente de perto quanto à hipoglicemia. Quando esses medicamentos são retirados de um paciente que recebe AMARYL 2mg, monitore o paciente de perto quanto à piora do controle glicêmico.
seguir estão exemplos de medicamentos que podem reduzir o efeito hipoglicemiante das sulfonilureias, incluindo AMARYL, levando a piora do controle glicêmico: danazol, glucagon, somatropina, inibidores de protease, medicamentos antipsicóticos atípicos (por exemplo, olanzapina e clozapina), barbitúricos, diazóxido, laxantes , rifampicina, tiazidas e outros diuréticos, corticosteroides, fenotiazinas, hormônios tireoidianos, estrogênios, contraceptivos orais, fenitoína, ácido nicotínico, simpaticomiméticos (por exemplo, epinefrina, albuterol, terbutalina) e isoniazida. Quando esses medicamentos são administrados a um paciente recebendo 2mg de AMARYL, monitore o paciente de perto quanto à piora do controle glicêmico. Quando esses medicamentos são retirados de um paciente recebendo AMARYL 2mg, monitore o paciente de perto quanto à hipoglicemia.
Betabloqueadores, clonidina e reserpina podem levar à potencialização ou ao enfraquecimento do efeito redutor de glicose do AMARYL.
Tanto a ingestão aguda quanto a crônica de álcool podem potencializar ou enfraquecer a ação hipoglicemiante de AMARYL 1mg de forma imprevisível.
Os sinais de hipoglicemia podem estar reduzidos ou ausentes em pacientes em uso de drogas simpatolíticas, como betabloqueadores, clonidina, guanetidina e reserpina.
Miconazol
Foi relatada uma potencial interação entre miconazol oral e sulfonilureias levando a hipoglicemia grave. Não se sabe se essa interação também ocorre com outras formas farmacêuticas de miconazol.
Interações do Citocromo P450 2C9
Pode haver uma interação entre glimepirida e inibidores (por exemplo, fluconazol) e indutores (por exemplo, rifampicina) do citocromo P450 2C9. O fluconazol pode inibir o metabolismo da glimepirida, causando aumento das concentrações plasmáticas de glimepirida que pode levar à hipoglicemia. A rifampicina pode induzir o metabolismo da glimepirida, causando diminuição das concentrações plasmáticas de glimepirida, o que pode levar a piora do controle glicêmico.
Administração concomitante de Colesevelam
O colesevelam pode reduzir a concentração plasmática máxima e a exposição total da glimepirida quando os dois são coadministrados. No entanto, a absorção não é reduzida quando a glimepirida é administrada 4 horas antes do colesevelam. Portanto, AMARYL deve ser administrado pelo menos 4 horas antes do colesevelam.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Hipoglicemia
Todas as sulfonilureias, incluindo AMARYL, podem causar hipoglicemia grave. REAÇÕES ADVERSAS ]. A capacidade do paciente de se concentrar e reagir pode ser prejudicada como resultado da hipoglicemia. Essas deficiências podem representar um risco em situações em que essas habilidades são especialmente importantes, como dirigir ou operar outras máquinas. A hipoglicemia grave pode levar à inconsciência ou convulsões e pode resultar em comprometimento temporário ou permanente da função cerebral ou morte.
Os pacientes devem ser educados para reconhecer e controlar a hipoglicemia. Tenha cuidado ao iniciar e aumentar as doses de AMARYL 2mg em pacientes que podem estar predispostos à hipoglicemia (por exemplo, idosos, pacientes com insuficiência renal, pacientes em uso de outros medicamentos antidiabéticos). Pacientes debilitados ou desnutridos e aqueles com insuficiência adrenal, pituitária ou hepática são particularmente suscetíveis à ação hipoglicemiante de medicamentos hipoglicemiantes. A hipoglicemia também é mais provável de ocorrer quando a ingestão calórica é deficiente, após exercícios intensos ou prolongados ou quando o álcool é ingerido.
Os sintomas de alerta precoce de hipoglicemia podem ser diferentes ou menos pronunciados em pacientes com neuropatia autonômica, idosos e em pacientes que estejam tomando medicamentos bloqueadores beta-adrenérgicos ou outros agentes simpatolíticos. Essas situações podem resultar em hipoglicemia grave antes que o paciente esteja ciente da hipoglicemia.
Reações de hipersensibilidade
Houve relatos pós-comercialização de reações de hipersensibilidade em pacientes tratados com AMARYL, incluindo reações graves, como anafilaxia, angioedema e síndrome de Stevens-Johnson. Se houver suspeita de reação de hipersensibilidade, interrompa imediatamente AMARYL, avalie outras causas potenciais para a reação e institua tratamento alternativo para diabetes.
Anemia hemolítica
As sulfoniluréias podem causar anemia hemolítica em pacientes com deficiência de glicose 6-fosfato desidrogenase (G6PD). Como AMARYL 4mg é uma sulfonilureia, tenha cuidado em pacientes com deficiência de G6PD e considere o uso de uma alternativa sem sulfonilureia. Há também relatos pós-comercialização de anemia hemolítica em pacientes recebendo AMARYL 1mg que não apresentavam deficiência de G6PD conhecida [ver REAÇÕES ADVERSAS ].
Aumento do risco de mortalidade cardiovascular com sulfoniluréias
administração de hipoglicemiantes orais tem sido associada ao aumento da mortalidade cardiovascular em comparação ao tratamento com dieta isolada ou dieta mais insulina. Este alerta é baseado no estudo realizado pelo University Group Diabetes Program (UGDP), um ensaio clínico prospectivo de longo prazo projetado para avaliar a eficácia de medicamentos hipoglicemiantes na prevenção ou retardo de complicações vasculares em pacientes com diabetes não insulino-dependente. diabetes. O estudo envolveu 823 pacientes que foram aleatoriamente designados para um dos quatro grupos de tratamento UGDP relatou que os pacientes tratados por 5 a 8 anos com dieta mais uma dose fixa de tolbutamida (1,5 gramas por dia) tiveram uma taxa de mortalidade cardiovascular aproximadamente 2 vezes e meia a dos pacientes tratados apenas com dieta. Não foi observado aumento significativo da mortalidade total, mas o uso de tolbutamida foi descontinuado com base no aumento da mortalidade cardiovascular, limitando a oportunidade de o estudo mostrar aumento da mortalidade geral. Apesar da controvérsia quanto à interpretação desses resultados, os achados do estudo UGDP fornecem uma base adequada para esse alerta. O paciente deve ser informado dos riscos e vantagens potenciais de AMARYL 4mg e de modos alternativos de terapia. Embora apenas um medicamento da classe das sulfonilureias (tolbutamida) tenha sido incluído neste estudo, é prudente, do ponto de vista da segurança, considerar que esta advertência também pode se aplicar a outros hipoglicemiantes orais dessa classe, em vista de suas semelhanças no modo de administração. ação e estrutura química.
Resultados Macrovasculares
Não houve estudos clínicos estabelecendo evidências conclusivas de redução do risco macrovascular com AMARYL ou qualquer outro medicamento antidiabético.
Toxicologia não clínica
Carcinogênese, mutagênese e comprometimento da fertilidade
Estudos em ratos com doses de até 5.000 partes por milhão (ppm) em ração completa (aproximadamente 340 vezes a dose humana máxima recomendada, com base na área de superfície) por 30 meses não mostraram evidências de carcinogênese. Em camundongos, a administração de glimepirida por 24 meses resultou em um aumento na formação de adenoma pancreático benigno que estava relacionado à dose e que se pensava ser o resultado de estimulação pancreática crônica. Nenhuma formação de adenoma em camundongos foi observada em uma dose de 320 ppm em ração completa, ou 46-54 mg/kg de peso corporal/dia. Isto é cerca de 35 vezes a dose humana máxima recomendada de 8 mg uma vez por dia com base na área de superfície.
glimepirida foi não mutagênica em uma bateria de estudos de mutagenicidade in vitro e in vivo (teste de Ames, mutação de células somáticas, aberração cromossômica, síntese de DNA não programada e teste de micronúcleo em camundongo).
Não houve efeito da glimepirida na fertilidade de camundongos machos em animais expostos até 2.500 mg/kg de peso corporal (> 1.700 vezes a dose humana máxima recomendada com base na área de superfície). A glimepirida não teve efeito na fertilidade de ratos machos e fêmeas administrados até 4.000 mg/kg de peso corporal (aproximadamente 4.000 vezes a dose humana máxima recomendada com base na área de superfície).
Uso em populações específicas
Gravidez
Gravidez Categoria C
Não existem estudos adequados e bem controlados de AMARYL 2mg em mulheres grávidas. Em estudos com animais não houve aumento de anomalias congênitas, mas ocorreu um aumento de mortes fetais em ratos e coelhos em doses de glimepirida 50 vezes (ratos) e 0,1 vezes (coelhos) a dose humana máxima recomendada (com base na área de superfície corporal). Acredita-se que esta fetotoxicidade, observada apenas em doses que induzem hipoglicemia materna, esteja diretamente relacionada à ação farmacológica (hipoglicêmica) da glimepirida e foi observada de forma semelhante com outras sulfonilureias. AMARYL deve ser usado durante a gravidez somente se o benefício potencial justificar o risco potencial para o feto. Como os dados sugerem que a glicemia anormal durante a gravidez está associada a uma maior incidência de anomalias congênitas, o tratamento do diabetes durante a gravidez deve manter a glicemia o mais próximo possível do normal.
Efeitos não teratogênicos
Hipoglicemia grave prolongada (4 a 10 dias) foi relatada em recém-nascidos de mães que receberam uma sulfonilureia no momento do parto.
Mães que amamentam
Não se sabe se AMARYL 1mg é excretado no leite humano. Durante os estudos pré e pós-natal em ratos, concentrações significativas de glimepirida estavam presentes no leite materno e no soro dos filhotes. Filhotes de ratos expostos a altos níveis de glimepirida durante a gravidez e lactação desenvolveram deformidades esqueléticas que consistem em encurtamento, espessamento e flexão do úmero durante o período pós-natal. Essas deformações esqueléticas foram determinadas como resultado da amamentação de mães expostas à glimepirida. Com base nesses dados de animais e no potencial de hipoglicemia em um lactente, deve-se decidir entre descontinuar a amamentação ou descontinuar AMARYL 2mg, levando em consideração a importância de AMARYL para a mãe.
Uso Pediátrico
farmacocinética, eficácia e segurança de AMARYL 4mg foram avaliadas em pacientes pediátricos com diabetes tipo 2, conforme descrito abaixo. AMARYL 4mg não é recomendado em pacientes pediátricos devido aos seus efeitos adversos no peso corporal e hipoglicemia.
A farmacocinética de uma dose única de 1 mg de AMARYL foi avaliada em 30 pacientes com diabetes tipo 2 (homens = 7; mulheres = 23) com idades entre 10 e 17 anos. A média (± SD) AUC (339±203 ng·h/mL), Cmax (102±48 ng/mL) e t½ (3,1±1,7 horas) para glimepirida foram comparáveis aos dados históricos de adultos (AUC(0-último ) 315±96 ng·h/mL, Cmax 103±34 ng/mL e t½ 5,3±4,1 horas).
segurança e eficácia de AMARYL em pacientes pediátricos foram avaliadas em um estudo duplo-cego de 24 semanas que randomizou 272 pacientes (8-17 anos de idade) com diabetes tipo 2 para AMARYL (n=135) ou metformina (n=137). ). Ambos os pacientes virgens de tratamento (aqueles tratados apenas com dieta e exercício por pelo menos 2 semanas antes da randomização) e pacientes previamente tratados (aqueles previamente tratados ou atualmente tratados com outros medicamentos antidiabéticos orais por pelo menos 3 meses) foram elegíveis para participar. Os pacientes que estavam recebendo agentes antidiabéticos orais no momento da entrada no estudo descontinuaram esses medicamentos antes da randomização sem um período de washout. AMARYL foi iniciado com 1 mg e, em seguida, titulado até 2, 4 ou 8 mg (última dose média de 4 mg) até a Semana 12, visando uma glicemia de punção digital em jejum automonitorada
Após 24 semanas, a diferença média geral do tratamento na HbA1c entre AMARYL 4mg e metformina foi de 0,2%, favorecendo a metformina (intervalo de confiança de 95% -0,3% a +0,6%). Com base nesses resultados, o estudo não atingiu seu objetivo principal de mostrar uma redução semelhante na HbA1c com AMARYL 4mg em comparação com a metformina.
O perfil de reações adversas em pacientes pediátricos tratados com AMARYL 2mg foi semelhante ao observado em adultos [ver REAÇÕES ADVERSAS ].
Eventos hipoglicêmicos documentados por valores de glicose no sangue
Uso Geriátrico
Em ensaios clínicos de AMARYL 2mg, 1.053 de 3.491 pacientes (30%) tinham > 65 anos de idade. Não foram observadas diferenças gerais na segurança ou eficácia entre esses pacientes e pacientes mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada.
Não houve diferenças significativas na farmacocinética da glimepirida entre pacientes com diabetes tipo 2 ≤ 65 anos (n=49) e aqueles > 65 anos (n=42) [ver FARMACOLOGIA CLÍNICA ].
A glimepirida é substancialmente excretada pelos rins. Pacientes idosos são mais propensos a ter insuficiência renal. Além disso, a hipoglicemia pode ser difícil de reconhecer em idosos [ver DOSAGEM E ADMINISTRAÇÃO e AVISOS E PRECAUÇÕES ]. Tenha cuidado ao iniciar AMARYL e aumentar a dose de AMARYL 1mg nesta população de pacientes.
Insuficiência renal
Para minimizar o risco de hipoglicemia, a dose inicial recomendada de AMARYL é de 1 mg por dia para todos os pacientes com diabetes tipo 2 e insuficiência renal. DOSAGEM E ADMINISTRAÇÃO e AVISOS E PRECAUÇÕES ].
Um estudo de titulação de múltiplas doses foi realizado em 16 pacientes com diabetes tipo 2 e insuficiência renal usando doses variando de 1 mg a 8 mg diariamente por 3 meses. A depuração de creatinina basal variou de 10-60 mL/min. A farmacocinética de AMARYL foi avaliada no estudo de titulação de dose múltipla e os resultados foram consistentes com os observados em pacientes incluídos em um estudo de dose única. Em ambos os estudos, a depuração total relativa de AMARYL aumentou quando a função renal estava comprometida. Ambos os estudos também demonstraram que a eliminação dos dois principais metabólitos foi reduzida em pacientes com insuficiência renal [ver FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Uma superdosagem de AMARYL 2mg, como com outras sulfonilureias, pode produzir hipoglicemia grave. Episódios leves de hipoglicemia podem ser tratados com glicose oral. As reações hipoglicêmicas graves constituem emergências médicas que requerem tratamento imediato. Hipoglicemia grave com coma, convulsão ou comprometimento neurológico pode ser tratada com glucagon ou glicose intravenosa. A observação contínua e a ingestão adicional de carboidratos podem ser necessárias porque a hipoglicemia pode recorrer após a aparente recuperação clínica [ver AVISOS E PRECAUÇÕES ].
CONTRA-INDICAÇÕES
AMARYL é contraindicado em pacientes com histórico de reação de hipersensibilidade a:
- Glimepirida ou qualquer um dos ingredientes do produto [ver AVISOS E PRECAUÇÕES ].
Derivados de sulfonamida: Pacientes que desenvolveram uma reação alérgica a derivados de sulfonamida podem desenvolver uma reação alérgica a AMARYL. Não use AMARYL 4mg em pacientes com histórico de reação alérgica a derivados de sulfonamida.
As reações de hipersensibilidade relatadas incluem erupções cutâneas com ou sem prurido, bem como reações mais graves (por exemplo, anafilaxia, angioedema, síndrome de Stevens-Johnson, dispneia) [ver AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
A glimepirida reduz principalmente a glicose no sangue, estimulando a liberação de insulina das células beta pancreáticas. As sulfoniluréias ligam-se ao receptor de sulfonilureia na membrana plasmática da célula beta pancreática, levando ao fechamento do canal de potássio sensível ao ATP, estimulando assim a liberação de insulina.
Farmacodinâmica
Em indivíduos saudáveis, o tempo para atingir o efeito máximo (concentrações mínimas de glicose no sangue) foi de aproximadamente 2-3 horas após doses orais únicas de AMARYL. Os efeitos de AMARYL na HbA1c, glicemia de jejum e glicemia pós-prandial foram avaliados em ensaios clínicos [ver Estudos clínicos ].
Farmacocinética
Absorção
Estudos com doses orais únicas de glimepirida em indivíduos saudáveis e com doses orais múltiplas em pacientes com diabetes tipo 2 mostraram concentrações máximas do medicamento (Cmax) 2 a 3 horas após a dose. Quando a glimepirida foi administrada com as refeições, a Cmax média e a AUC (área sob a curva) diminuíram em 8% e 9%, respectivamente.
A glimepirida não se acumula no soro após doses múltiplas. A farmacocinética da glimepirida não difere entre indivíduos saudáveis e pacientes com diabetes tipo 2. A depuração da glimepirida após administração oral não se altera no intervalo de dose de 1 mg a 8 mg, indicando farmacocinética linear.
Em indivíduos saudáveis, as variabilidades intra e interindividuais dos parâmetros farmacocinéticos da glimepirida foram de 15-23% e 24-29%, respectivamente.
Distribuição
Após administração intravenosa em indivíduos saudáveis, o volume de distribuição (Vd) foi de 8,8 L (113 mL/kg) e a depuração corporal total (CL) foi de 47,8 mL/min. A ligação às proteínas foi superior a 99,5%.
Metabolismo
glimepirida é completamente metabolizada por biotransformação oxidativa após uma dose intravenosa ou oral. Os principais metabólitos são o derivado ciclohexil hidroxi metil (M1) e o derivado carboxil (M2). O citocromo P450 2C9 está envolvido na biotransformação da glimepirida em M1. M1 é posteriormente metabolizado em M2 por uma ou várias enzimas citosólicas. M2 está inativo. Em animais, M1 possui cerca de um terço da atividade farmacológica da glimepirida, mas não está claro se M1 resulta em efeitos clinicamente significativos sobre a glicose no sangue em humanos.
Excreção
Quando a 14C-glimepirida foi administrada oralmente a 3 indivíduos saudáveis do sexo masculino, aproximadamente 60% da radioatividade total foi recuperada na urina em 7 dias. M1 e M2 foram responsáveis por 80-90% da radioatividade recuperada na urina. A proporção de M1 para M2 na urina foi de aproximadamente 3:2 em dois indivíduos e 4:1 em um indivíduo. Aproximadamente 40% da radioatividade total foi recuperada nas fezes. M1 e M2 representaram cerca de 70% (a razão de M1 para M2 foi de 1:3) da radioatividade recuperada nas fezes. Nenhum fármaco original foi recuperado da urina ou fezes. Após administração intravenosa em pacientes, não foi observada excreção biliar significativa de glimepirida ou de seu metabólito M1.
Pacientes Geriátricos
Uma comparação da farmacocinética da glimepirida em pacientes com diabetes tipo 2 ≤ 65 anos e aqueles > 65 anos foi avaliada em um estudo de dose múltipla usando AMARYL 6 mg por dia. Não houve diferenças significativas na farmacocinética da glimepirida entre os dois grupos etários. A AUC média no estado de equilíbrio para os pacientes mais velhos foi aproximadamente 13% menor do que para os pacientes mais jovens; a depuração média ajustada ao peso para os pacientes mais velhos foi aproximadamente 11% maior do que para os pacientes mais jovens.
Gênero
Não houve diferenças entre homens e mulheres na farmacocinética da glimepirida quando o ajuste foi feito para diferenças no peso corporal.
Corrida
Não foram realizados estudos para avaliar os efeitos da raça na farmacocinética da glimepirida, mas em estudos controlados por placebo de AMARYL 2mg em pacientes com diabetes tipo 2, a redução da HbA foi comparável em caucasianos (n = 536), negros (n = 63) e hispânicos (n = 63).
Insuficiência renal
Um estudo aberto de dose única AMARYL 3 mg foi administrado a pacientes com insuficiência renal leve, moderada e grave, conforme estimado pela depuração de creatinina (CLcr): Grupo I consistiu de 5 pacientes com insuficiência renal leve (CLcr > 50 mL/min ), o Grupo II foi composto por 3 pacientes com insuficiência renal moderada (CLcr = 20-50 mL/min) e o Grupo III foi composto por 7 pacientes com insuficiência renal grave (CLcr
Insuficiência hepática
Não se sabe se existe um efeito da insuficiência hepática na farmacocinética de AMARYL 1mg porque a farmacocinética de AMARYL 1mg não foi adequadamente avaliada em pacientes com insuficiência hepática.
Pacientes obesos
A farmacocinética da glimepirida e seus metabólitos foram medidos em um estudo de dose única envolvendo 28 pacientes com diabetes tipo 2 que tinham peso corporal normal ou eram obesos mórbidos. Enquanto o tmax, a depuração e o volume de distribuição da glimepirida nos pacientes obesos mórbidos foram semelhantes aos do grupo de peso normal, os obesos mórbidos apresentaram Cmax e AUC mais baixos do que os de peso corporal normal. Os valores médios de Cmax, AUC0-24, AUC0-∞ de glimepirida em pacientes normais vs. obesos mórbidos foram 547 ± 218 ng/mL vs. 410 ± 124 ng/mL, 3210 ± 1030 horas·ng/mL vs. 2820 ± 1110 horas·ng/mL e 4000 ± 1320 horas·ng/mL vs. 3280 ± 1360 horas·ng/mL, respectivamente.
Interações medicamentosas
Aspirina: Em um estudo cruzado, randomizado, duplo-cego, de dois períodos, indivíduos saudáveis receberam placebo ou aspirina 1 grama três vezes ao dia por um período total de tratamento de 5 dias. No Dia 4 de cada período de estudo, foi administrada uma dose única de 1 mg de AMARYL 4mg. As doses de AMARYL 4mg foram separadas por um período de washout de 14 dias. A coadministração de aspirina e 4 mg de AMARYL resultou em uma diminuição de 34% na AUC média da glimepirida e de 4% na Cmax média da glimepirida.
Colesevelam: A administração concomitante de colesevelam e glimepirida resultou em reduções na AUC0-∞ e Cmax da glimepirida de 18% e 8%, respectivamente. Quando a glimepirida foi administrada 4 horas antes do colesevelam, não houve alteração significativa na AUC0-∞ e Cmax da glimepirida, -6% e 3%, respectivamente [ver DOSAGEM E ADMINISTRAÇÃO e INTERAÇÕES MEDICAMENTOSAS ].
Cimetidina e Ranitidina: Em um estudo randomizado, aberto e cruzado de 3 vias, indivíduos saudáveis receberam uma dose única de 4 mg de AMARYL sozinho, AMARYL com ranitidina (150 mg duas vezes ao dia por 4 dias; AMARYL 2mg foi administrado no Dia 3) ou AMARYL 2 mg com cimetidina (800 mg diariamente por 4 dias; AMARYL foi administrado no Dia 3). A coadministração de cimetidina ou ranitidina com uma dose oral única de 4 mg de AMARYL 4 mg não alterou significativamente a absorção e a disposição da glimepirida.
Propranolol: Em um estudo cruzado, randomizado, duplo-cego, de dois períodos, indivíduos saudáveis receberam placebo ou propranolol 40 mg três vezes ao dia por um período total de tratamento de 5 dias. No Dia 4 ou em cada período de estudo, foi administrada uma dose única de 2 mg de AMARYL 4 mg. As doses de AMARYL 4mg foram separadas por um período de washout de 14 dias. A administração concomitante de propranolol e 1mg de AMARYL aumentou significativamente a Cmax, AUC e T½ da glimepirida em 23%, 22% e 15%, respectivamente, e diminuiu o CL/f da glimepirida em 18%. A recuperação de M1 e M2 da urina não foi alterada.
Varfarina: Em um estudo cruzado, aberto, de duas vias, indivíduos saudáveis receberam 4 mg de AMARYL 2 mg diariamente por 10 dias. Doses únicas de 25 mg de varfarina foram administradas 6 dias antes do início do AMARYL e no dia 4 da administração do AMARYL. A administração concomitante de AMARYL não alterou a farmacocinética dos enantiômeros R e S-varfarina. Não foram observadas alterações na ligação às proteínas plasmáticas da varfarina. AMARYL 1mg resultou em uma diminuição estatisticamente significativa na resposta farmacodinâmica à varfarina. As reduções na área média sob a curva do tempo de protrombina (TP) e os valores máximos de PT durante o tratamento com AMARYL foram de 3,3% e 9,9%, respectivamente, e é improvável que sejam clinicamente relevantes.
Estudos clínicos
Monoterapia
Um total de 304 pacientes com diabetes tipo 2 já tratados com terapia com sulfonilureia participaram de um estudo de 14 semanas, multicêntrico, randomizado, duplo-cego, controlado por placebo, avaliando a segurança e eficácia da monoterapia com 1mg de AMARYL. Os pacientes descontinuaram a terapia com sulfonilureia e entraram em um período de eliminação de placebo de 3 semanas seguido de randomização em 1 de 4 grupos de tratamento: placebo (n=74), AMARYL 1 mg (n=78), AMARYL 4 mg (n=76) e AMARYL 8 mg (n=76). Todos os pacientes randomizados para AMARYL 4mg iniciaram 1mg ao dia. Os pacientes randomizados para AMARYL 4 mg ou 8 mg tiveram titulação cega e forçada da dose de AMARYL 2 mg em intervalos semanais, primeiro para 4 mg e depois para 8 mg, desde que a dose fosse tolerada, até que a dose randomizada fosse alcançada. Os doentes aleatorizados para a dose de 4 mg atingiram a dose atribuída na Semana 2. Os doentes aleatorizados para a dose de 8 mg atingiram a dose atribuída na Semana 3. Uma vez atingido o nível de dose aleatorizado, os doentes deveriam ser mantidos nessa dose até à Semana 14. Aproximadamente 66% dos pacientes tratados com placebo completaram o estudo em comparação com 81% dos pacientes tratados com glimepirida 1 mg e 92% dos pacientes tratados com glimepirida 4 mg ou 8 mg. Comparado ao placebo, o tratamento com 1 mg, 4 mg e 8 mg diários de AMARYL proporcionou melhorias estatisticamente significativas na HbA1c em comparação ao placebo (Tabela 3).
Um total de 249 pacientes virgens de tratamento ou que receberam tratamento limitado com terapia antidiabética no passado foram randomizados para receber 22 semanas de tratamento com AMARYL (n=123) ou placebo (n=126) em um estudo multicêntrico, randomizado , duplo-cego, controlado por placebo, titulação de dose. A dose inicial de AMARYL foi de 1 mg por dia e foi titulada para cima ou para baixo em intervalos de 2 semanas para uma meta de GP de 90-150 mg/dL. Os níveis de glicose no sangue para FPG e PPG foram analisados no laboratório. Após 10 semanas de ajuste de dose, os pacientes foram mantidos em sua dose ideal (1, 2, 3, 4, 6 ou 8 mg) pelas 12 semanas restantes do estudo. O tratamento com AMARYL 2mg proporcionou melhorias estatisticamente significativas em HbA1c e FPG em comparação com placebo (Tabela 4).
INFORMAÇÃO DO PACIENTE
Informar os pacientes sobre a importância da adesão às instruções dietéticas, de um programa regular de exercícios e de testes regulares de glicemia.
Informe os pacientes sobre os potenciais efeitos colaterais de AMARYL 1mg, incluindo hipoglicemia e ganho de peso.
Explicar os sintomas e o tratamento da hipoglicemia, bem como as condições que predispõem à hipoglicemia. Os pacientes devem ser informados de que a capacidade de concentração e reação pode ser prejudicada como resultado da hipoglicemia. Isso pode representar um risco em situações em que essas habilidades são especialmente importantes, como dirigir ou operar outras máquinas.
Pacientes com diabetes devem ser aconselhados a informar seu médico se estiverem grávidas, pensando em engravidar, amamentando ou pensando em amamentar.
