Maxalt 5mg, 10mg Rizatriptan Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Maxalt e como é usado?
Maxalt é um medicamento de prescrição usado para tratar os sintomas da enxaqueca. Maxalt 10mg pode ser usado sozinho ou com outros medicamentos.
Maxalt pertence a uma classe de medicamentos chamados Agonistas do Receptor de Serotonina 5-HT; Agentes anti-enxaqueca.
Não se sabe se Maxalt 5mg é seguro e eficaz em crianças menores de 6 anos de idade.
Quais são os possíveis efeitos colaterais do Maxalt?
Maxalt pode causar efeitos colaterais graves, incluindo:
- dor de estômago súbita e grave,
- diarreia sanguinolenta,
- sensação de frio,
- dormência nos pés e nas mãos,
- dor de cabeça severa,
- visão embaçada,
- batendo em seu pescoço ou ouvidos,
- dor ou pressão no peito,
- dor se espalhando para sua mandíbula ou ombro,
- náusea,
- sudorese,
- agitação,
- alucinações,
- febre,
- tremendo,
- ritmo cardíaco acelerado,
- rigidez muscular,
- contraindo-se,
- perda de coordenação,
- náusea,
- perda de coordenação,
- vômito,
- diarréia,
- dormência ou fraqueza repentina (especialmente em um lado do corpo),
- dor de cabeça súbita e intensa,
- fala arrastada e
- problemas com visão ou equilíbrio
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Maxalt incluem:
- tontura,
- sonolência,
- sentindo-se cansado e
- dor ou sensação de pressão na garganta ou no peito
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Maxalt. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
MAXALT 10mg contém benzoato de rizatriptano, um agonista seletivo do receptor 5-hidroxitriptamina1B/1D (5-HT1B/1D).
O benzoato de rizatriptano é descrito quimicamente como: N,N-dimetil-5-(1H-1,2,4-triazol-1-ilmetil)-1Hindole-3-etanamina monobenzoato e sua fórmula estrutural é:
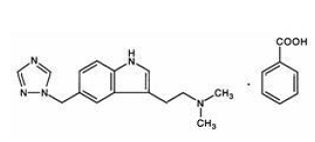
Sua fórmula empírica é C15H19N5•C7H6O2, representando um peso molecular da base livre de 269,4. O benzoato de rizatriptano é um sólido cristalino branco a esbranquiçado que é solúvel em água a cerca de 42 mg por mL (expresso como base livre) a 25°C.
MAXALT 5mg comprimidos e MAXALT-MLT comprimidos de desintegração oral estão disponíveis para administração oral em dosagens de 5 e 10 mg (correspondendo a 7,265 mg ou 14,53 mg do sal benzoato, respectivamente). Cada comprimido contém os seguintes ingredientes inativos: lactose monohidratada, celulose microcristalina, amido pré-gelatinizado, óxido férrico (vermelho) e estearato de magnésio. Cada comprimido liofilizado de desintegração oral contém os seguintes ingredientes inativos: gelatina, manitol, glicina, aspartame e aroma de hortelã-pimenta.
INDICAÇÕES
MAXALT® e MAXALT-MLT® são indicados para o tratamento agudo da enxaqueca com ou sem aura em adultos e em pacientes pediátricos de 6 a 17 anos.
Limitações de uso
- MAXALT só deve ser usado quando um diagnóstico claro de enxaqueca foi estabelecido. Se um paciente não apresentar resposta à primeira crise de enxaqueca tratada com MAXALT 10mg, o diagnóstico de enxaqueca deve ser reconsiderado antes de MAXALT 5mg ser administrado para tratar quaisquer crises subsequentes.
- MAXALT 10mg não é indicado para uso no tratamento da enxaqueca hemiplégica ou basilar [ver CONTRA-INDICAÇÕES ].
- MAXALT 10mg não é indicado para a prevenção de crises de enxaqueca.
- A segurança e a eficácia de MAXALT 5mg não foram estabelecidas para a cefaleia em salvas.
DOSAGEM E ADMINISTRAÇÃO
Informações de dosagem em adultos
A dose inicial recomendada de MAXALT é de 5 mg ou 10 mg para o tratamento agudo de enxaquecas em adultos. A dose de 10 mg pode proporcionar um efeito maior do que a dose de 5 mg, mas pode ter um risco maior de reações adversas [ver Estudos clínicos ].
Redosagem em Adultos
Embora a eficácia de uma segunda dose ou doses subsequentes não tenha sido estabelecida em estudos controlados por placebo, se a enxaqueca retornar, uma segunda dose pode ser administrada 2 horas após a primeira dose. A dose diária máxima não deve exceder 30 mg em qualquer período de 24 horas. A segurança de tratar, em média, mais de quatro dores de cabeça em um período de 30 dias não foi estabelecida.
Informações de dosagem em pacientes pediátricos (6 a 17 anos)
A dosagem em pacientes pediátricos é baseada no peso corporal do paciente. A dose recomendada de MAXALT 10mg é de 5 mg em pacientes com peso inferior a 40 kg (88 lb) e 10 mg em pacientes com peso igual ou superior a 40 kg (88 lb).
A eficácia e segurança do tratamento com mais de uma dose de MAXALT em 24 horas em pacientes pediátricos de 6 a 17 anos de idade não foram estabelecidas.
Administração de comprimidos de desintegração oral de MAXALT-MLT
Para MAXALT-MLT comprimidos de desintegração oral, a administração com líquido não é necessária. Os comprimidos de desintegração oral são embalados em um blister dentro de uma bolsa externa de alumínio e os pacientes não devem remover o blister da bolsa externa até pouco antes da administração. A embalagem blister deve então ser aberta com as mãos secas e o comprimido de desintegração oral colocado na língua, onde se dissolverá e será engolido com a saliva.
Ajuste de dosagem para pacientes em uso de propranolol
Pacientes adultos
Em pacientes adultos em uso de propranolol, apenas a dose de 5 mg de MAXALT 5 mg é recomendada, até um máximo de 3 doses em qualquer período de 24 horas (15 mg) [ver INTERAÇÕES MEDICAMENTOSAS e FARMACOLOGIA CLÍNICA ].
Pacientes pediátricos
Para pacientes pediátricos com peso igual ou superior a 40 kg (88 lb) em uso de propranolol, recomenda-se apenas uma dose única de 5 mg de MAXALT (dose máxima de 5 mg em um período de 24 horas). MAXALT não deve ser prescrito para pacientes pediátricos tratados com propranolol que pesem menos de 40 kg (88 lb) [ver INTERAÇÕES MEDICAMENTOSAS e FARMACOLOGIA CLÍNICA ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
MAXALT Comprimidos
- Os comprimidos de 5 mg são comprimidos comprimidos de cor rosa pálido, em forma de cápsula, codificados como MRK numa das faces e 266 na outra.
- Os comprimidos de 10 mg são comprimidos comprimidos cor-de-rosa pálido, em forma de cápsula, codificados como MAXALT 5 mg numa das faces e MRK 267 na outra.
MAXALT-MLT comprimidos de desintegração oral
- Os comprimidos de desintegração oral de 5 mg são comprimidos liofilizados redondos, brancos a esbranquiçados, gravados com um triângulo modificado num dos lados.
- Os comprimidos de desintegração oral de 10 mg são comprimidos liofilizados redondos, brancos a esbranquiçados, gravados com um quadrado modificado num dos lados.
Armazenamento e manuseio
Nº 3732 - MAXALT Comprimidos, 5 mg , são comprimidos comprimidos de cor rosa pálido, em forma de cápsula, codificados
MRK de um lado e 266 do outro:
NDC 0006-0266-18, embalagem de 18 comprimidos.
Nº 3733 - MAXALT 5mg Comprimidos, 10mg , são comprimidos comprimidos rosa pálido, em forma de cápsula, codificados MAXALT 10mg de um lado e MRK 267 do outro:
NDC 0006-0267-18, embalagem de 18 comprimidos.
Nº 3800 - MAXALT-MLT Comprimidos de Desintegração Oral, 5 mg são comprimidos de desintegração oral liofilizados, redondos, brancos a esbranquiçados, gravados com um triângulo modificado em um dos lados e medindo 10,0-11,5 mm (lado a lado) com sabor de hortelã-pimenta. Cada comprimido de desintegração oral é embalado individualmente em um blister dentro de uma bolsa de alumínio (sachê). Eles são fornecidos da seguinte forma:
NDC 0006-3800-18, 6 x unidade de uso estojo de transporte de 3 comprimidos de desintegração oral (total de 18 comprimidos).
Nº 3801 - MAXALT-MLT Comprimidos de Desintegração Oral, 10 mg , são comprimidos de desintegração oral liofilizados, redondos, brancos a esbranquiçados, gravados com um quadrado modificado em um dos lados e medindo 12,0-13,8 mm (lado a lado) com sabor de hortelã-pimenta. Cada comprimido de desintegração oral é embalado individualmente em um blister dentro de uma bolsa de alumínio (sachê). Eles são fornecidos da seguinte forma:
NDC 0006-3801-18, 6 x unidade de uso estojo de transporte de 3 comprimidos de desintegração oral (total de 18 comprimidos).
Armazenar
Armazene os comprimidos de MAXALT 5mg à temperatura ambiente, 15°C-30°C (59°F-86°F).
Armazene os comprimidos de desintegração oral de MAXALT-MLT à temperatura ambiente, 15°C-30°C (59°F-86°F).
Distribuído por: Merck Sharp & Dohme Corp., uma subsidiária da MERCK & CO.,INC., Whitehouse Station, NJ 08889, EUA. Revisado: outubro de 2019
EFEITOS COLATERAIS
As seguintes reações adversas são discutidas com mais detalhes em outras seções da bula:
- Isquemia do Miocárdio, Infarto do Miocárdio e Angina de Prinzmetal [ver AVISOS E PRECAUÇÕES ].
- Arritmias [ver AVISOS E PRECAUÇÕES ].
- Dor/Aperto/Pressão no Peito, Garganta, Pescoço e/ou Maxilar [ver AVISOS E PRECAUÇÕES ].
- Eventos cerebrovasculares [ver AVISOS E PRECAUÇÕES ].
- Outras reações de vasoespasmo [ver AVISOS E PRECAUÇÕES ].
- Cefaleia por uso excessivo de medicamentos [ver AVISOS E PRECAUÇÕES ].
- Síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES ].
- Aumento da Pressão Arterial [ver AVISOS E PRECAUÇÕES ].
Experiência de Ensaios Clínicos
Como os estudos clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos estudos clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Adultos
Incidência em Ensaios Clínicos Controlados
As reações adversas ao MAXALT foram avaliadas em ensaios clínicos controlados que incluíram mais de 3.700 pacientes adultos que receberam doses únicas ou múltiplas de MAXALT comprimidos. As reações adversas mais comuns durante o tratamento com MAXALT (≥5% em qualquer grupo de tratamento e superior ao placebo) foram astenia/fadiga, sonolência, sensação de dor/pressão e tontura. Estas reações adversas pareciam estar relacionadas com a dose.
Tabela 1 lista as reações adversas (incidência ≥2% e maior que placebo) após uma dose única de MAXALT 5mg em adultos.
As frequências de reações adversas em ensaios clínicos não aumentaram quando foram tomadas até três doses em 24 horas. As frequências de reações adversas também permaneceram inalteradas pelo uso concomitante de medicamentos comumente tomados para profilaxia da enxaqueca (incluindo propranolol), contraceptivos orais ou analgésicos. As incidências de reações adversas não foram afetadas pela idade ou sexo. Não havia dados suficientes para avaliar o impacto da raça na incidência de reações adversas.
Outros eventos observados em associação com a administração de MAXALT em adultos
Na seção a seguir, são apresentadas as frequências de eventos adversos relatados com menos frequência que não foram relatados em outras seções da bula. Como os relatórios incluem eventos observados em estudos abertos, o papel de MAXALT 5mg em sua causa não pode ser determinado com segurança. Além disso, a variabilidade associada à notificação de eventos adversos, a terminologia usada para descrever eventos adversos, limita o valor das estimativas quantitativas de frequência fornecidas. As frequências de eventos são calculadas como o número de pacientes que usaram MAXALT e relataram um evento dividido pelo número total de pacientes expostos a MAXALT (N=3716). Todos os eventos relatados ocorreram com uma incidência ≥1%, ou acredita-se que estejam razoavelmente associados ao uso do medicamento. Os eventos são ainda classificados em categorias de sistemas corporais e enumerados em ordem decrescente de frequência usando as seguintes definições: eventos adversos frequentes são aqueles definidos como aqueles que ocorrem em pelo menos (>)1/100 pacientes; experiências adversas infrequentes são aquelas que ocorrem em 1/100 a 1/1.000 pacientes; e experiências adversas raras são aquelas que ocorrem em menos de 1/1.000 pacientes.
Em geral: Infrequente foi o edema facial. Raros foram síncope e edema/inchaço.
Sensações Atípicas: Frequentes eram as sensações de calor.
Cardiovascular: Freqüente era a palpitação. Infrequentes foram taquicardia, extremidades frias e bradicardia.
Digestivo: Freqüentes foram diarréia e vômitos. Infrequentes foram dispepsia, edema de língua e distensão abdominal.
Musculoesquelético: Infrequentes foram fraqueza muscular, rigidez, mialgia e cãibras/espasmo muscular.
Neurológico/Psiquiátrico: Frequentes foram hipoestesia, euforia e tremor. Infrequentes foram vertigem, insônia, confusão/desorientação, anormalidade na marcha, comprometimento da memória e agitação.
Respiratório: Freqüente era a dispnéia. Infrequente foi o edema de faringe.
Sentidos Especiais: Pouco frequentes foram visão turva e zumbido. Raro era o inchaço dos olhos.
Pele e Apêndice da Pele: Freqüente era rubor. Infrequentes foram sudorese, prurido, erupção cutânea e urticária. Raro era eritema, ondas de calor.
perfil de reações adversas observado com MAXALT-MLT comprimidos de desintegração oral foi semelhante ao observado com MAXALT 10 mg comprimidos.
Pacientes pediátricos de 6 a 17 anos de idade
Incidência em Ensaios Clínicos Controlados em Pacientes Pediátricos
As reações adversas ao MAXALT-MLT foram avaliadas em um ensaio clínico controlado no tratamento agudo de enxaquecas (Estudo 7) que incluiu um total de 1.382 pacientes pediátricos de 6 a 17 anos de idade, dos quais 977 (72%) administraram pelo menos uma dose do tratamento do estudo (MAXALT-MLT e/ou placebo) [ver Estudos clínicos ]. A incidência de reações adversas relatadas em pacientes pediátricos no ensaio clínico agudo foi semelhante em pacientes que receberam MAXALT para aqueles que receberam placebo. Espera-se que o padrão de reações adversas em pacientes pediátricos seja semelhante ao dos adultos.
Outros eventos observados em associação com a administração de MAXALT-MLT em pacientes pediátricos
Na seção a seguir, são apresentadas as frequências de eventos adversos relatados com menos frequência. Como os relatórios incluem eventos observados em estudos abertos, o papel de MAXALT-MLT em sua causa não pode ser determinado com segurança. Além disso, a variabilidade associada à notificação de eventos adversos, a terminologia usada para descrever eventos adversos, limita o valor das estimativas quantitativas de frequência fornecidas.
As frequências de eventos são calculadas como o número de pacientes pediátricos de 6 a 17 anos de idade que usaram MAXALT-MLT e relataram um evento dividido pelo número total de pacientes expostos a MAXALT-MLT (N=1068). Todos os eventos relatados ocorreram com uma incidência ≥1%, ou acredita-se que estejam razoavelmente associados ao uso do medicamento. Os eventos são ainda classificados dentro da classe de sistemas de órgãos e enumerados em ordem decrescente de frequência usando as seguintes definições: eventos adversos frequentes são aqueles que ocorrem em (>)1/100 pacientes pediátricos; experiências adversas infrequentes são aquelas que ocorrem em 1/100 a 1/1.000 pacientes pediátricos; e experiências adversas raras são aquelas que ocorrem em menos de 1/1.000 pacientes.
Em geral: Freqüente era a fadiga.
Distúrbios do ouvido e do labirinto: Infrequente foi hipoacusia.
Problemas gastrointestinais: Frequente era o desconforto abdominal.
Distúrbios do sistema nervoso: Infrequentes foram coordenação anormal, distúrbio na atenção e pré-síncope.
Distúrbios psiquiátricos: Infrequente era a alucinação.
Experiência pós-marketing
seção a seguir enumera eventos adversos potencialmente importantes que ocorreram na prática clínica e que foram relatados espontaneamente a vários sistemas de vigilância. Os eventos enumerados incluem todos, exceto aqueles já listados em outras seções da rotulagem ou aqueles muito gerais para serem informativos. Como os relatos citam eventos relatados espontaneamente a partir da experiência pós-comercialização em todo o mundo, a frequência dos eventos e o papel de MAXALT 5mg em sua causa não podem ser determinados com segurança.
Neurológico/Psiquiátrico: Apreensão.
Em geral: Condições alérgicas incluindo anafilaxia/reação anafilactóide, angioedema, sibilos e necrólise epidérmica tóxica [ver CONTRA-INDICAÇÕES ].
Sentidos Especiais: Disgeusia.
INTERAÇÕES MEDICAMENTOSAS
Propranolol
A dose de MAXALT 5mg deve ser ajustada em pacientes tratados com propranolol, pois o propranolol demonstrou aumentar a AUC plasmática de rizatriptano em 70% [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
Medicamentos contendo Ergot
Medicamentos contendo ergot foram relatados como causadores de reações vasoespásticas prolongadas. Como esses efeitos podem ser aditivos, o uso de medicamentos contendo ergotamina ou do tipo ergot (como diidroergotamina ou metisergida) e MAXALT 5mg em 24 horas é contraindicado [ver CONTRA-INDICAÇÕES ].
Outros Agonistas de 5-HT1
Como seus efeitos vasoespásticos podem ser aditivos, a coadministração de MAXALT 10mg e outros agonistas 5-HT1 dentro de 24 horas um do outro é contraindicada [ver CONTRA-INDICAÇÕES ].
SSRIs/SNRIs e síndrome serotoninérgica
Casos de síndrome serotoninérgica foram relatados durante a coadministração de triptanos e inibidores seletivos da recaptação da serotonina (ISRSs) ou inibidores da recaptação da serotonina norepinefrina (IRSNs) [ver AVISOS E PRECAUÇÕES ].
Inibidores da Monoamina Oxidase
MAXALT é contraindicado em pacientes em uso de inibidores da MAO-A e inibidores da MAO não seletivos. Um inibidor específico da MAO-A aumentou a exposição sistêmica de rizatriptano e seu metabólito [ver CONTRA-INDICAÇÕES e FARMACOLOGIA CLÍNICA ].
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Isquemia do Miocárdio, Infarto do Miocárdio e Angina de Prinzmetal
MAXALT não deve ser administrado a pacientes com doença arterial coronariana isquêmica ou vasoespástica. Houve relatos raros de reações adversas cardíacas graves, incluindo infarto agudo do miocárdio, ocorrendo poucas horas após a administração de MAXALT. Algumas dessas reações ocorreram em pacientes sem doença arterial coronariana (DAC) conhecida. Agonistas 5-HT1, incluindo MAXALT 5mg, podem causar vasoespasmo da artéria coronária (Angina de Prinzmetal), mesmo em pacientes sem história de DAC.
Pacientes virgens de triptano que apresentam múltiplos fatores de risco cardiovascular (p. Se houver evidência de DAC ou vasoespasmo da artéria coronária, MAXALT não deve ser administrado [ver CONTRA-INDICAÇÕES ]. Para pacientes com avaliação cardiovascular negativa, deve-se considerar a administração da primeira dose de MAXALT em um ambiente com supervisão médica e a realização de um eletrocardiograma (ECG) imediatamente após a administração de MAXALT 10mg. A avaliação cardiovascular periódica deve ser considerada em usuários intermitentes de longo prazo de MAXALT que tenham fatores de risco cardiovascular.
Arritmias
Distúrbios do ritmo cardíaco com risco de vida, incluindo taquicardia ventricular e fibrilação ventricular levando à morte, foram relatados dentro de algumas horas após a administração de agonistas 5-HT1. Descontinuar MAXALT 10mg se ocorrerem esses distúrbios.
Dor no peito, garganta, pescoço e/ou mandíbula/aperto/pressão
Assim como com outros agonistas 5-HT1, sensações de aperto, dor, pressão e peso no precórdio, garganta, pescoço e mandíbula ocorrem comumente após o tratamento com MAXALT 5mg e geralmente são de origem não cardíaca. No entanto, se houver suspeita de origem cardíaca, os pacientes devem ser avaliados. Pacientes com DAC e aqueles com angina variante de Prinzmetal não devem receber agonistas 5-HT1.
Eventos cerebrovasculares
Hemorragia cerebral, hemorragia subaracnóidea e acidente vascular cerebral ocorreram em pacientes tratados com agonistas 5-HT1, e alguns resultaram em fatalidades. Em vários casos, parece possível que os eventos cerebrovasculares tenham sido primários, tendo o agonista 5-HT1 sido administrado na crença incorreta de que os sintomas experimentados eram uma consequência da enxaqueca, quando não eram. Além disso, pacientes com enxaqueca podem apresentar risco aumentado de certos eventos cerebrovasculares (por exemplo, acidente vascular cerebral, hemorragia, ataque isquêmico transitório). Descontinuar MAXALT se ocorrer um evento cerebrovascular.
Assim como em outras terapias para enxaqueca aguda, antes de tratar cefaleias em pacientes não diagnosticados anteriormente como enxaquecas e em enxaquecas que apresentam sintomas atípicos, deve-se ter cuidado para excluir outras condições neurológicas potencialmente graves. MAXALT não deve ser administrado a pacientes com histórico de acidente vascular cerebral ou ataque isquêmico transitório [ver CONTRA-INDICAÇÕES ].
Outras reações de vasoespasmo
Os agonistas 5-HT1, incluindo MAXALT, podem causar reações vasoespásticas não coronarianas, como isquemia vascular periférica, isquemia vascular gastrointestinal e infarto (apresentando-se com dor abdominal e diarreia sanguinolenta), infarto esplênico e síndrome de Raynaud. Em pacientes que apresentarem sintomas ou sinais sugestivos de reação de vasoespasmo não coronariano após o uso de qualquer agonista 5-HT1, a suspeita de reação de vasoespasmo deve ser descartada antes de receber doses adicionais de MAXALT 10mg.
Relatos de cegueira transitória e permanente e perda parcial significativa da visão foram relatados com o uso de agonistas 5-HT1. Como os distúrbios visuais podem fazer parte de um ataque de enxaqueca, uma relação causal entre esses eventos e o uso de agonistas 5-HT1 não foi claramente estabelecida.
Cefaleia por uso excessivo de medicamentos
O uso excessivo de medicamentos para enxaqueca aguda (por exemplo, ergotamina, triptanos, opioides ou uma combinação de medicamentos por 10 ou mais dias por mês) pode levar à exacerbação da cefaleia (cefaleia por uso excessivo de medicamentos). A cefaleia por uso excessivo de medicamentos pode se apresentar como dores de cabeça diárias semelhantes à enxaqueca ou como um aumento acentuado na frequência de ataques de enxaqueca. A desintoxicação dos pacientes, incluindo a retirada dos medicamentos usados em excesso, e o tratamento dos sintomas de abstinência (que geralmente incluem um agravamento transitório da cefaleia) podem ser necessários.
Síndrome da serotonina
síndrome da serotonina pode ocorrer com triptanos, incluindo MAXALT 10mg, particularmente durante a coadministração com inibidores seletivos da recaptação da serotonina (ISRSs), inibidores da recaptação da serotonina norepinefrina (IRSNs), antidepressivos tricíclicos (ATCs) e inibidores da MAO [ver INTERAÇÕES MEDICAMENTOSAS ]. Os sintomas da síndrome serotoninérgica podem incluir alterações do estado mental (p. ex., agitação, alucinações, coma), instabilidade autonômica (p. ex., taquicardia, pressão arterial instável, hipertermia), aberrações neuromusculares (p. , vômitos, diarréia). O início dos sintomas pode ocorrer dentro de minutos a horas após receber uma nova ou uma dose maior de um medicamento serotoninérgico. O tratamento com MAXALT deve ser descontinuado se houver suspeita de síndrome serotoninérgica [ver INTERAÇÕES MEDICAMENTOSAS e INFORMAÇÃO DO PACIENTE ].
Aumento da Pressão Arterial
Elevação significativa da pressão arterial, incluindo crise hipertensiva com comprometimento agudo dos sistemas orgânicos, foi relatada em raras ocasiões em pacientes com e sem histórico de hipertensão recebendo agonistas 5-HT1, incluindo MAXALT. Em pacientes adultos jovens e saudáveis do sexo masculino e feminino que receberam doses máximas de MAXALT (10 mg a cada 2 horas por 3 doses), foram observados ligeiros aumentos na pressão arterial (aproximadamente 2-3 mmHg). MAXALT é contraindicado em pacientes com hipertensão não controlada [ver CONTRA-INDICAÇÕES ].
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( INFORMAÇÃO DO PACIENTE ).
Risco de isquemia e/ou infarto do miocárdio, angina de Prinzmetal, outros eventos relacionados ao vasoespasmo e eventos cerebrovasculares
Informe os pacientes que MAXALT pode causar efeitos colaterais cardiovasculares graves, como infarto do miocárdio ou acidente vascular cerebral. Embora eventos cardiovasculares graves possam ocorrer sem sintomas de alerta, os pacientes devem estar alertas para os sinais e sintomas de dor no peito, falta de ar, fraqueza, fala arrastada e devem procurar orientação médica ao observar qualquer sinal ou sintoma indicativo. Os pacientes devem ser informados sobre a importância deste acompanhamento [ver AVISOS E PRECAUÇÕES ].
Síndrome da serotonina
Os pacientes devem ser alertados sobre o risco de síndrome serotoninérgica com o uso de MAXALT 10mg ou outros triptanos, particularmente durante o uso combinado com inibidores seletivos da recaptação da serotonina (ISRSs) ou inibidores da recaptação da serotonina norepinefrina (IRSNs) [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS , e FARMACOLOGIA CLÍNICA ].
Gravidez
Informe as pacientes que MAXALT não deve ser usado durante a gravidez, a menos que o benefício potencial justifique o risco potencial para o feto [ver Uso em populações específicas ].
Lactação
Aconselhe as pacientes a notificarem seu médico se estiverem amamentando ou planejam amamentar [ver Uso em populações específicas ].
Capacidade de executar tarefas complexas
Como as enxaquecas ou o tratamento com MAXALT 10mg podem causar sonolência e tontura, instrua os pacientes a avaliar sua capacidade de realizar tarefas complexas durante as crises de enxaqueca e após a administração de MAXALT.
Cefaleia por uso excessivo de medicamentos
Informar os pacientes que o uso de medicamentos para enxaqueca aguda por 10 ou mais dias por mês pode levar a uma exacerbação da cefaleia e encorajá-los a registrar a frequência da cefaleia e o uso de medicamentos (p. AVISOS E PRECAUÇÕES ].
Manuseio de embalagens de comprimidos de desintegração oral
Instrua os pacientes a não removerem o blister da bolsa de alumínio externa até que estejam prontos para usar o comprimido de desintegração oral dentro [ver DOSAGEM E ADMINISTRAÇÃO ].
Pacientes com Fenilcetonúria
Informe os pacientes fenilcetonúricos que MAXALT-MLT comprimidos de desintegração oral contém fenilalanina (um componente do aspartame). Cada comprimido de desintegração oral de 5 mg contém 1,1 mg de fenilalanina e cada comprimido de desintegração oral de 10 mg contém 2,1 mg de fenilalanina [ver Uso em populações específicas ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Estudos de carcinogenicidade oral de rizatriptano foram conduzidos em camundongos (100 semanas) e ratos (106 semanas) em doses de até 125 mg/kg/dia. Não houve evidência de aumento na incidência de tumores relacionados ao rizatriptano em nenhuma das espécies. As exposições plasmáticas (AUC) na dose mais alta testada foram aproximadamente 150 (camundongos) e 240 vezes (ratos) que em humanos na dose humana máxima recomendada (MRHD) de 30 mg/dia.
Mutagênese
O rizatriptano não foi mutagénico nem clastogénico numa bateria de estudos de toxicidade genética in vitro e in vivo, incluindo: o ensaio de mutagénese microbiana (Ames), ensaios in vitro de mutagénese em células de mamífero e de aberrações cromossómicas e o ensaio de aberrações cromossómicas in vivo em ratinhos.
Prejuízo da Fertilidade
administração oral de rizatriptano (0, 2, 10 ou 100 mg/kg/dia) a ratas antes e durante o acasalamento e continuando durante a gestação e lactação não resultou em efeito sobre a fertilidade; no entanto, a ciclicidade do estro alterada e atrasos no tempo para o acasalamento foram observados na dose mais alta testada. A exposição do plasma na dose sem efeito (10 mg/kg/dia) para toxicidade reprodutiva foi aproximadamente 15 vezes maior do que em humanos na MRHD.
A administração oral de rizatriptano (0, 5, 35 ou 250 mg/kg/dia) a ratos machos antes e durante o acasalamento não resultou em prejuízo da fertilidade ou desempenho reprodutivo. A exposição ao plasma (AUC) na dose mais alta testada foi aproximadamente 550 vezes maior do que em humanos no MRHD.
Uso em populações específicas
Gravidez
Resumo do risco
Os dados humanos disponíveis sobre o uso de MAXALT em mulheres grávidas não são suficientes para tirar conclusões sobre o risco associado ao medicamento para defeitos congênitos graves e aborto espontâneo.
Em estudos com animais, a toxicidade no desenvolvimento foi observada após a administração oral de rizatriptano durante a gravidez (diminuição do peso corporal fetal em ratos) ou durante a gravidez e lactação (aumento da mortalidade, diminuição do peso corporal e comprometimento neurocomportamental na prole de ratos) em exposições plasmáticas maternas superiores àquelas. esperado em doses terapêuticas em humanos [ver Dados de animais ].
Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e de aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente. A taxa relatada de defeitos congênitos graves entre partos de mulheres com enxaqueca varia de 2,2% a 2,9% e a taxa relatada de aborto espontâneo foi de 17%, que são semelhantes às taxas relatadas em mulheres sem enxaqueca.
Considerações Clínicas
Risco Materno e/ou Embrio/Fetal Associado à Doença
Em mulheres com enxaqueca, há um risco aumentado de resultados perinatais adversos na mãe, incluindo pré-eclâmpsia e hipertensão gestacional.
Dados
Dados humanos
Registro de Gravidez para MAXALT não identificou nenhum padrão de anomalias congênitas ou outros desfechos adversos no parto no período de 1998 a 2018. No entanto, a falta de identificação de qualquer padrão deve ser vista com cautela, pois o número de relatórios prospectivos com informações de desfecho foi baixa e não forneceu poder suficiente para detectar um risco aumentado de defeitos congênitos individuais associados ao uso de MAXALT. Além disso, houve perda significativa de acompanhamento nos relatórios prospectivos de gravidez, complicando ainda mais esta avaliação de uma associação entre MAXALT e qualquer padrão de anomalias congênitas ou outros resultados adversos ao nascimento.
Em um estudo usando dados do Registro Médico Sueco de Nascimentos, nascidos vivos de mulheres que relataram usar triptanos ou ergot durante a gravidez foram comparados com os de mulheres que não o fizeram. Dos 157 nascimentos com exposição ao rizatriptano no primeiro trimestre, 7 crianças nasceram com malformações (risco relativo 1,01 [IC 95%: 0,40 a 2,08]). Um estudo usando dados vinculados do Registro Médico de Nascimento da Noruega com o Banco de Dados de Prescrição Norueguês comparou os resultados da gravidez em mulheres que resgataram prescrições de triptanos durante a gravidez, bem como um grupo de comparação de enxaqueca que resgatou prescrições de triptanos apenas antes da gravidez, em comparação com um grupo controle populacional. Das 310 mulheres que resgataram prescrições de rizatriptana durante o primeiro trimestre, 10 tiveram bebês com malformações congênitas maiores (OR 1,03 [IC 95%: 0,55 a 1,93]), enquanto para as 271 mulheres que resgataram prescrições de rizatriptana antes, mas não durante , gravidez, 12 tiveram bebês com malformações congênitas maiores (OR 1,48 [IC 95%: 0,83 a 2,64]), cada um em comparação com o grupo de comparação da população.
Dados de animais
Quando rizatriptano (0, 2, 10 ou 100 mg/kg/dia) foi administrado oralmente a ratas grávidas durante a organogênese, uma diminuição no peso corporal fetal foi observada nas doses mais altas testadas. Na dose média (10 mg/kg/dia), que foi uma dose sem efeito para efeitos adversos no desenvolvimento embriofetal, a exposição plasmática (AUC) foi aproximadamente 15 vezes maior do que em humanos na dose humana máxima recomendada (MRHD) de 30 mg/dia. Quando o rizatriptano (0, 5, 10 ou 50 mg/kg/dia) foi administrado oralmente a coelhas grávidas durante a organogênese, não foram observados efeitos fetais adversos. A exposição plasmática (AUC) na dose mais alta testada foi 115 vezes maior do que em humanos no MRHD. A transferência placentária da droga para o feto foi demonstrada em ambas as espécies.
administração oral de rizatriptano (0, 2, 10 ou 100 mg/kg/dia) a ratas antes e durante o acasalamento e continuando ao longo da gestação e lactação resultou na redução do peso corporal da prole desde o nascimento e durante toda a lactação, exceto o mais baixo. dose testada (2 mg/kg/dia). A exposição plasmática (AUC) na dose sem efeito (2 mg/kg/dia) para efeitos adversos no desenvolvimento pós-natal foi semelhante à de humanos no MRHD.
A administração oral de rizatriptano (0, 5, 100 ou 250 mg/kg/dia) durante a organogênese e lactação resultou em mortalidade neonatal, peso corporal reduzido (que persistiu até a idade adulta) e função neurocomportamental prejudicada na prole, exceto na dose mais baixa testado. A exposição plasmática (AUC) na dose sem efeito para efeitos adversos no desenvolvimento pós-natal (5 mg/kg/dia) foi aproximadamente 8 vezes maior do que em humanos na MRHD.
Lactação
Resumo do risco
Não existem dados sobre a presença de rizatriptano ou quaisquer metabolitos ativos no leite humano, ou sobre os efeitos do rizatriptano no lactente ou na produção de leite.
O rizatriptano foi excretado no leite de rato, com níveis no leite aproximadamente 6 vezes superiores aos do plasma materno.
Os benefícios da amamentação para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de MAXALT ou MAXALT-MLT e quaisquer potenciais efeitos adversos no lactente de MAXALT ou MAXALT-MLT ou da condição materna subjacente.
Dados
Após a administração oral de rizatriptano a ratas lactantes na dose de 100 mg/kg/dia, as concentrações do fármaco de rizatriptano em amostras de leite excederam as concentrações do fármaco no plasma materno em aproximadamente 6 vezes.
Uso Pediátrico
segurança e eficácia em pacientes pediátricos com menos de 6 anos de idade não foram estabelecidas. A eficácia e segurança de MAXALT 5mg no tratamento agudo da enxaqueca em pacientes com idades entre 6 e 17 anos foi estabelecida em um estudo adequado e bem controlado [ver Estudos clínicos ].
A incidência de reações adversas relatadas em pacientes pediátricos no ensaio clínico agudo foi semelhante nos pacientes que receberam MAXALT 5mg aos que receberam placebo. Espera-se que o padrão de reações adversas em pacientes pediátricos seja semelhante ao dos adultos.
Uso Geriátrico
Os estudos clínicos de MAXALT 5mg não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente dos indivíduos mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os mais jovens.
Embora a farmacocinética da rizatriptana tenha sido semelhante em idosos (≥65 anos) e em adultos mais jovens (n=17), em geral, a seleção da dose para um paciente idoso deve ser cautelosa, começando no limite inferior da faixa de dosagem. Isso reflete a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa.
Pacientes geriátricos com outros fatores de risco cardiovascular (por exemplo, diabetes, hipertensão, tabagismo, obesidade, forte histórico familiar de doença arterial coronariana) devem fazer uma avaliação cardiovascular antes de receber MAXALT [ver AVISOS E PRECAUÇÕES ].
Pacientes com Fenilcetonúria
Os comprimidos de desintegração oral contêm fenilalanina (um componente do aspartame). Os comprimidos de desintegração oral de 5 e 10 mg contêm 1,1 e 2,1 mg de fenilalanina, respectivamente.
SOBREDOSAGEM
Não foram notificadas sobredosagens de MAXALT durante os ensaios clínicos em adultos.
Alguns pacientes adultos que receberam 40 mg de MAXALT 5 mg em dose única ou em duas doses com intervalo entre as doses de 2 horas apresentaram tontura e sonolência.
Em um estudo de farmacologia clínica no qual 12 indivíduos adultos receberam MAXALT 5mg, em doses cumulativas totais de 80 mg (administradas dentro de quatro horas), dois dos indivíduos apresentaram síncope, tontura, bradicardia incluindo bloqueio AV de terceiro grau, vômito e/ou incontinência. .
No estudo aberto de longo prazo, envolvendo 606 pacientes com enxaqueca pediátrica de 12 a 17 anos de idade (dos quais 432 foram tratados por pelo menos 12 meses), 151 pacientes (25%) tomaram duas doses de 10 mg de MAXALT-MLT em um período de 24 horas. As reações adversas para 3 desses pacientes incluíram desconforto abdominal, fadiga e dispneia.
Além disso, com base na farmacologia de MAXALT 10mg, pode ocorrer hipertensão ou isquemia miocárdica após superdosagem. A descontaminação gastrointestinal (ou seja, lavagem gástrica seguida de carvão ativado) deve ser considerada em pacientes com suspeita de superdosagem com MAXALT. A monitorização clínica e eletrocardiográfica deve ser continuada por pelo menos 12 horas, mesmo que não sejam observados sintomas clínicos.
Os efeitos da hemodiálise ou diálise peritoneal nas concentrações séricas de rizatriptano são desconhecidos.
CONTRA-INDICAÇÕES
MAXALT 5mg é contraindicado em pacientes com:
- Doença isquêmica da artéria coronária (angina pectoris, história de infarto do miocárdio ou isquemia silenciosa documentada) ou outra doença cardiovascular subjacente significativa [ver AVISOS E PRECAUÇÕES ].
- Vasoespasmo da artéria coronária incluindo angina de Prinzmetal [ver AVISOS E PRECAUÇÕES ].
- História de acidente vascular cerebral ou ataque isquêmico transitório (AIT) [ver AVISOS E PRECAUÇÕES ].
- Doença vascular periférica (DVP) [ver AVISOS E PRECAUÇÕES ].
- Doença isquêmica do intestino [ver AVISOS E PRECAUÇÕES ].
- Hipertensão não controlada [ver AVISOS E PRECAUÇÕES ].
- Uso recente (ou seja, dentro de 24 horas) de outro agonista 5-HT1, medicamento contendo ergotamina ou medicamento do tipo ergot (como diidroergotamina ou metisergida) [ver INTERAÇÕES MEDICAMENTOSAS ].
- Enxaqueca hemiplégica ou basilar [ver INDICAÇÕES ].
- Administração concomitante ou descontinuação recente (ou seja, dentro de 2 semanas) de um inibidor da MAO-A [ver INTERAÇÕES MEDICAMENTOSAS e FARMACOLOGIA CLÍNICA ].
- Hipersensibilidade ao rizatriptano ou a qualquer um dos excipientes (observados angioedema e anafilaxia) [ver REAÇÕES ADVERSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
O rizatriptano liga-se com alta afinidade aos receptores 5-HT1B/1D clonados humanos. MAXALT 10mg presumivelmente exerce seus efeitos terapêuticos no tratamento da enxaqueca, ligando-se aos receptores 5-HT1B/1D localizados nos vasos sanguíneos intracranianos e nos nervos sensoriais do sistema trigêmeo.
Farmacocinética
Absorção
rizatriptano é completamente absorvido após administração oral. A biodisponibilidade oral absoluta média do comprimido de MAXALT 10mg é de cerca de 45%, e as concentrações plasmáticas máximas médias (Cmax) são atingidas em aproximadamente 1-1,5 horas (Tmax). A presença de enxaqueca não pareceu afetar a absorção ou farmacocinética do rizatriptano. Os alimentos não têm efeito significativo na biodisponibilidade do rizatriptano, mas atrasam em uma hora o tempo para atingir o pico de concentração. Em ensaios clínicos, MAXALT 10mg foi administrado independentemente da alimentação.
A biodisponibilidade e Cmax de rizatriptano foram semelhantes após a administração de MAXALT comprimidos e MAXALT-MLT comprimidos de desintegração oral, mas a taxa de absorção é um pouco mais lenta com MAXALT-MLT, com Tmax atrasado em até 0,7 hora. A AUC do rizatriptano é aproximadamente 30% mais elevada nas mulheres do que nos homens. Não ocorreu acúmulo em doses múltiplas.
Distribuição
volume médio de distribuição é de aproximadamente 140 litros em indivíduos do sexo masculino e 110 litros em indivíduos do sexo feminino. O rizatriptano liga-se minimamente (14%) às proteínas plasmáticas.
Metabolismo
A principal via de metabolismo do rizatriptano é via desaminação oxidativa pela monoamina oxidase-A (MAO-A) para o metabólito do ácido indol acético, que não é ativo no receptor 5-HT1B/1D. N-monodesmetil-rizatriptano, um metabólito com atividade semelhante à do composto original no receptor 5-HT1B/1D, é formado em menor grau. As concentrações plasmáticas de N-monodesmetil-rizatriptano são aproximadamente 14% das do composto original, e é eliminado a uma taxa semelhante. Outros metabólitos menores, o N-óxido, o composto 6-hidroxi e o conjugado sulfato do metabólito 6-hidroxi não são ativos no receptor 5-HT1B/1D.
Eliminação
radioatividade total da dose administrada recuperada em 120 horas na urina e nas fezes foi de 82% e 12%, respectivamente, após uma administração oral única de 10 mg de 14C-rizatriptano. Após a administração oral de 14C-rizatriptano, o rizatriptano representou cerca de 17% da radioatividade plasmática circulante. Aproximadamente 14% de uma dose oral é excretada na urina como rizatriptano inalterado, enquanto 51% é excretado como metabólito de ácido indol acético, indicando metabolismo de primeira passagem substancial.
A meia-vida plasmática do rizatriptano em homens e mulheres é em média de 2-3 horas.
Isoformas do Citocromo P450
O rizatriptano não é um inibidor das atividades das isoformas 3A4/5, 1A2, 2C9, 2C19 ou 2E1 do citocromo P450 do fígado humano; O rizatriptano é um inibidor competitivo (Ki=1400 nM) do citocromo P450 2D6, mas apenas em concentrações elevadas e clinicamente irrelevantes.
Populações Especiais
Geriátrico
farmacocinética do rizatriptano em voluntários idosos saudáveis sem enxaqueca (idade 65-77 anos) foi semelhante à dos voluntários sem enxaqueca mais jovens (idade 18-45 anos).
Pediátrico
A farmacocinética do rizatriptano foi determinada em pacientes pediátricos com enxaqueca de 6 a 17 anos de idade. As exposições após a administração de dose única de 5 mg de MAXALT-MLT a pacientes pediátricos pesando 20-39 kg (44-87 lb) ou 10 mg de MAXALT-MLT a pacientes pediátricos pesando ≥40 kg (88 lb) foram semelhantes às observadas após dose única administração de 10 mg de MAXALT-MLT a adultos.
Gênero
A AUC0-∞ e Cmax médias de rizatriptano (10 mg por via oral) foram cerca de 30% e 11% superiores nas mulheres em comparação com os homens, respetivamente, enquanto o Tmax ocorreu aproximadamente ao mesmo tempo.
Insuficiência hepática
Após administração oral em pacientes com insuficiência hepática causada por cirrose hepática alcoólica leve a moderada, as concentrações plasmáticas de rizatriptana foram semelhantes em pacientes com insuficiência hepática leve em comparação com um grupo controle de indivíduos com função hepática normal; as concentrações plasmáticas de rizatriptano foram aproximadamente 30% maiores em pacientes com insuficiência hepática moderada.
Insuficiência renal
Em pacientes com insuficiência renal (clearance de creatinina 10-60 mL/min/1,73 m2), a AUC0-∞ de rizatriptano não foi significativamente diferente daquela em indivíduos com função renal normal. Em pacientes em hemodiálise (clearance de creatinina
Corrida
Os dados farmacocinéticos não revelaram diferenças significativas entre indivíduos afro-americanos e caucasianos.
Interações medicamentosas
[Veja também INTERAÇÕES MEDICAMENTOSAS ]
Inibidores da Monoamina Oxidase
rizatriptano é metabolizado principalmente através da monoamina oxidase, subtipo 'A' (MAO-A). As concentrações plasmáticas de rizatriptano podem ser aumentadas por medicamentos que são inibidores seletivos da MAO-A (por exemplo, moclobemida) ou inibidores não seletivos da MAO [tipo A e B] (por exemplo, isocarboxazida, fenelzina, tranilcipromina e pargilina). Em um estudo de interação medicamentosa, quando MAXALT 10 mg foi administrado a indivíduos (n=12) recebendo terapia concomitante com o inibidor seletivo e reversível da MAO-A, moclobemida 150 mg três vezes ao dia, houve aumentos médios na AUC e Cmax de rizatriptano de 119% e 41% respectivamente; e a AUC do metabólito N-monodesmetil ativo de rizatriptano aumentou mais de 400%. Espera-se que a interação seja maior com inibidores irreversíveis da MAO. Nenhuma interação farmacocinética é esperada em pacientes recebendo inibidores seletivos da MAO-B [ver CONTRA-INDICAÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Propranolol
Em um estudo de administração concomitante de propranolol 240 mg/dia e uma dose única de rizatriptano 10 mg em indivíduos adultos saudáveis (n=11), a AUC plasmática média de rizatriptano aumentou 70% durante a administração de propranolol, e um aumento de quatro vezes foi observado em um sujeito. A AUC do metabólito N-monodesmetil ativo do rizatriptano não foi afetada pelo propranolol [ver DOSAGEM E ADMINISTRAÇÃO e INTERAÇÕES MEDICAMENTOSAS ].
Nadolol/Metoprolol
Em um estudo de interações medicamentosas, os efeitos de doses múltiplas de nadolol 80 mg ou metoprolol 100 mg a cada 12 horas na farmacocinética de uma dose única de 10 mg de rizatriptano foram avaliados em indivíduos saudáveis (n=12). Não foram observadas interações farmacocinéticas.
Paroxetina
Em um estudo de interação entre o inibidor seletivo da recaptação de serotonina (ISRS) paroxetina 20 mg/dia por duas semanas e uma dose única de MAXALT 10 mg em indivíduos saudáveis (n=12), nem as concentrações plasmáticas de rizatriptano nem seu perfil de segurança foram afetados pela paroxetina [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS , e INFORMAÇÃO DO PACIENTE ].
Contraceptivos orais
Em um estudo de administração concomitante de um contraceptivo oral durante 6 dias de administração de MAXALT (10-30 mg/dia) em voluntárias saudáveis (n=18), o rizatriptano não afetou as concentrações plasmáticas de etinilestradiol ou noretindrona.
Estudos clínicos
Adultos
eficácia de MAXALT 5mg comprimidos foi estabelecida em quatro estudos multicêntricos, randomizados e controlados por placebo. Os pacientes incluídos nesses estudos eram principalmente do sexo feminino (84%) e caucasianos (88%), com idade média de 40 anos (variação de 18 a 71). Os pacientes foram instruídos a tratar uma dor de cabeça moderada a grave. A resposta da cefaleia, definida como uma redução da dor de cabeça moderada ou intensa para nenhuma ou leve dor de cabeça, foi avaliada por até 2 horas (Estudo 1) ou até 4 horas após a dosagem (Estudos 2, 3 e 4). Sintomas associados de náusea, fotofobia e fonofobia e manutenção da resposta até 24 horas após a dose foram avaliados. Uma segunda dose de MAXALT 10mg comprimidos foi permitida 2 a 24 horas após a dosagem para tratamento de cefaleia recorrente nos estudos 1 e 2. Analgésicos e/ou antieméticos adicionais foram permitidos 2 horas após o tratamento inicial para resgate em todos os quatro estudos.
Em todos os estudos, a porcentagem de pacientes que obtiveram resposta à cefaleia 2 horas após o tratamento foi significativamente maior nos pacientes que receberam MAXALT 5 ou 10 mg em comparação com aqueles que receberam placebo. Em um estudo separado, as doses de 2,5 mg não foram diferentes do placebo. Doses superiores a 10 mg foram associadas a um aumento da incidência de efeitos adversos. Os resultados dos quatro estudos controlados estão resumidos na Tabela 2.
As comparações de desempenho de medicamentos com base em resultados obtidos em diferentes ensaios clínicos podem não ser confiáveis. Como os estudos são conduzidos em momentos diferentes, com amostras diferentes de pacientes, por pesquisadores diferentes, empregando critérios diferentes e/ou interpretações diferentes dos mesmos critérios, sob condições diferentes (dose, regime posológico etc.), estimativas quantitativas de resposta ao tratamento e pode-se esperar que o tempo de resposta varie consideravelmente de estudo para estudo.
probabilidade estimada de alcançar uma resposta inicial de dor de cabeça dentro de 2 horas após o tratamento nos Estudos agrupados 1, 2, 3 e 4 é descrita na Figura 1.
Figura 1: Probabilidade estimada de obter uma resposta inicial de dor de cabeça em 2 horas em estudos agrupados 1, 2, 3 e 4* 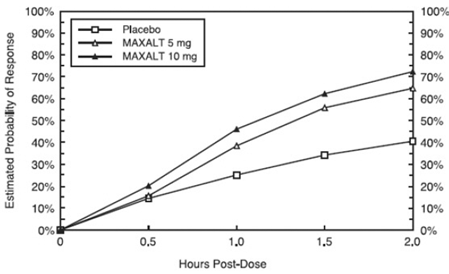
Para pacientes com fotofobia, fonofobia e náusea associadas à enxaqueca no início do estudo, houve uma diminuição da incidência desses sintomas após a administração de MAXALT em comparação ao placebo.
Duas a 24 horas após a dose inicial do tratamento do estudo, os pacientes foram autorizados a usar tratamento adicional para resposta à dor na forma de uma segunda dose do tratamento do estudo ou outra medicação. A probabilidade estimada de pacientes tomando uma segunda dose ou outro medicamento para enxaqueca nas 24 horas após a dose inicial do tratamento do estudo está resumida na Figura 2.
Figura 2: Probabilidade estimada de pacientes que tomam uma segunda dose de MAXALT 10mg comprimidos ou outro medicamento para enxaqueca nas 24 horas após a dose inicial do tratamento do estudo em estudos agrupados 1, 2, 3 e 4* 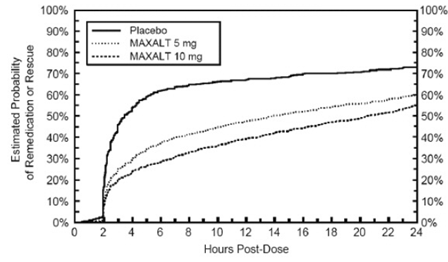
A eficácia não foi afetada pela presença de aura; pelo sexo ou idade do paciente; ou pelo uso concomitante de medicamentos profiláticos comuns para enxaqueca (por exemplo, betabloqueadores, bloqueadores dos canais de cálcio, antidepressivos tricíclicos) ou contraceptivos orais. Em dois estudos semelhantes adicionais, a eficácia não foi afetada pela relação com a menstruação. Não havia dados suficientes para avaliar o impacto da raça na eficácia.
MAXALT-MLT comprimidos de desintegração oral
A eficácia de MAXALT-MLT foi estabelecida em dois estudos multicêntricos, randomizados e controlados por placebo que foram semelhantes em desenho aos estudos de MAXALT Tablets (Estudos 5 e 6). Os pacientes foram instruídos a tratar uma dor de cabeça moderada a grave. Os pacientes tratados nesses estudos eram principalmente do sexo feminino (88%) e caucasianos (95%), com idade média de 42 anos (variação de 18-72).
Em ambos os estudos, a porcentagem de pacientes que obtiveram resposta à cefaleia 2 horas após o tratamento foi significativamente maior nos pacientes que receberam MAXALT-MLT 5 ou 10 mg em comparação com aqueles que receberam placebo. Os resultados dos Estudos 5 e 6 estão resumidos na Tabela 3.
A probabilidade estimada de atingir uma resposta inicial de cefaleia em 2 horas após o tratamento com MAXALT-MLT nos estudos agrupados 5 e 6 está representada na Figura 3.
Figura 3: Probabilidade Estimada de Alcançar uma Resposta Inicial de Cefaleia com MAXALT-MLT em 2 Horas em Estudos Agrupados 5 e 6* 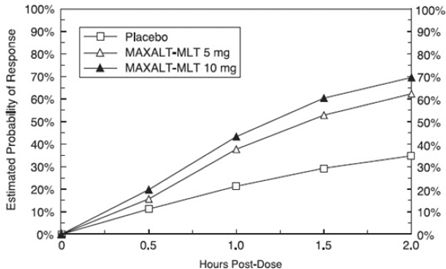
Para pacientes com fotofobia e fonofobia associadas à enxaqueca no início do estudo, houve uma diminuição da incidência desses sintomas após a administração de MAXALT-MLT em comparação ao placebo.
Duas a 24 horas após a dose inicial do tratamento do estudo, os pacientes foram autorizados a usar tratamento adicional para resposta à dor na forma de uma segunda dose do tratamento do estudo ou outra medicação. A probabilidade estimada de pacientes tomarem uma segunda dose ou outro medicamento para enxaqueca nas 24 horas após a dose inicial do tratamento do estudo está resumida na Figura 4.
Figura 4: Probabilidade estimada de pacientes que tomam uma segunda dose de MAXALT-MLT ou outro medicamento para enxaqueca nas 24 horas após a dose inicial do tratamento do estudo em estudos agrupados 5 e 6* 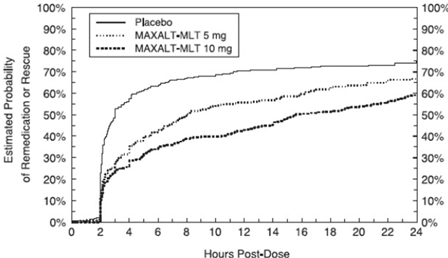
Pacientes pediátricos de 6 a 17 anos de idade
eficácia de MAXALT-MLT em pacientes pediátricos de 6 a 17 anos foi avaliada em um ensaio clínico multicêntrico, randomizado, duplo-cego, controlado por placebo, de grupos paralelos (Estudo 7). Os pacientes tinham que ter pelo menos 6 meses de história de crises de enxaqueca (com ou sem aura) geralmente com duração de 3 horas ou mais (quando não tratadas). A população de pacientes foi historicamente não responsiva à terapia com AINEs e paracetamol.
Os pacientes foram instruídos a tratar uma única crise de enxaqueca com dor de cabeça de intensidade moderada a grave. A fase de tratamento do estudo teve duas etapas. O estágio 1 foi usado para identificar os não respondedores ao placebo, que então entraram no estágio 2, no qual os pacientes foram randomizados para MAXALT-MLT ou placebo. Usando uma estratégia de dosagem baseada no peso, pacientes de 20 kg a
média de idade para a população de pacientes estudada foi de 13 anos. Sessenta e um por cento dos pacientes eram caucasianos e cinqüenta e seis por cento dos pacientes eram do sexo feminino. A porcentagem de pacientes que atingiram o desfecho primário de eficácia de ausência de dor de cabeça 2 horas após o tratamento foi significativamente maior nos pacientes que receberam MAXALT-MLT, em comparação com aqueles que receberam placebo (33% vs. 24%). Os resultados do Estudo 7 estão resumidos na Tabela 4.
A porcentagem observada de pacientes pediátricos que não apresentaram dor de cabeça dentro de 2 horas após o tratamento inicial com MAXALT-MLT é mostrada na Figura 5.
Figura 5: Porcentagem observada de pacientes que relatam ausência de dor de cabeça em 2 horas após a dose no estudo 7 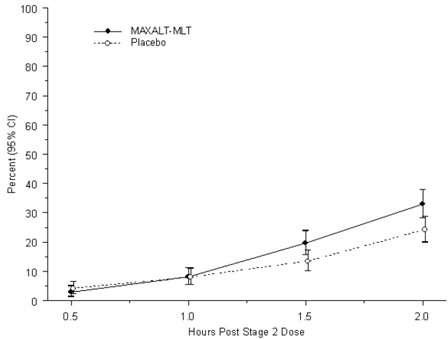
A prevalência dos desfechos exploratórios de ausência de sintomas associados à enxaqueca (náusea, fotofobia e fonofobia) em 2 horas após a administração da dose não foi estatisticamente significativa entre os pacientes que receberam MAXALT-MLT e aqueles que receberam placebo.
INFORMAÇÃO DO PACIENTE
MAXALT® (max-awlt)
MAXALT-MLT® (benzoato de rizatriptano) comprimidos e comprimidos de desintegração oral
Leia esta Informação do Paciente antes de começar a tomar MAXALT® e cada vez que receber uma recarga. Pode haver novas informações. Esta informação não substitui a conversa com o seu médico sobre a sua condição médica ou o seu tratamento.
Salvo indicação em contrário, as informações contidas neste folheto informativo do paciente se aplicam tanto a MAXALT 10mg comprimidos quanto a MAXALT-MLT® comprimidos de desintegração oral.
O que é MAXALT?
MAXALT é um medicamento de prescrição que pertence a uma classe de medicamentos chamados Triptanos. MAXALT está disponível como comprimido tradicional (MAXALT) e como comprimido de desintegração oral (MAXALT-MLT).
MAXALT 5mg e MAXALT-MLT são usados para tratar crises de enxaqueca com ou sem aura em adultos e em crianças de 6 a 17 anos de idade.
MAXALT 5mg não deve ser usado para prevenir ataques de enxaqueca.
MAXALT não se destina ao tratamento de enxaquecas hemiplégicas ou basilares.
Não se sabe se MAXALT é seguro e eficaz para o tratamento de cefaleias em salvas.
Não se sabe se tomar mais de 1 dose de MAXALT em 24 horas é seguro e eficaz em crianças de 6 a 17 anos de idade.
Não se sabe se MAXALT é seguro e eficaz em crianças com menos de 6 anos de idade.
Quem não deve tomar MAXALT?
Não tome MAXALT se você:
- tem ou teve problemas cardíacos
- tem ou teve um acidente vascular cerebral ou um ataque isquêmico transitório (TIA)
- tem ou teve problemas nos vasos sanguíneos, incluindo doença isquêmica do intestino
- tem pressão alta descontrolada
- tomou outros medicamentos Triptan nas últimas 24 horas
- tomou medicamentos contendo ergot nas últimas 24 horas
- tem enxaqueca hemiplégica ou basilar
- tomar inibidor da monoamina oxidase (MAO) ou ter tomado um inibidor da MAO nas últimas 2 semanas
- é alérgico ao benzoato de rizatriptano ou a qualquer um dos ingredientes de MAXALT. Consulte o final deste folheto para obter uma lista completa dos ingredientes de MAXALT.
Fale com o seu médico antes de tomar este medicamento se tiver alguma das condições listadas acima ou se não tiver a certeza se está a tomar algum destes medicamentos.
O que devo dizer ao meu médico antes de tomar MAXALT?
Antes de tomar MAXALT, informe o seu médico se você:
- tem ou teve problemas cardíacos, pressão alta, dor no peito ou falta de ar
- tem quaisquer fatores de risco para problemas cardíacos ou problemas nos vasos sanguíneos, tais como:
- pressão alta
- colesterol alto
- fumar
- obesidade
- diabetes
- história familiar de problemas cardíacos
- você está na pós-menopausa
- você é um homem com mais de 40 anos
- tem fenilcetonúria (PKU). Os comprimidos de desintegração oral de MAXALT-MLT contêm fenilalanina.
- tem problemas renais ou hepáticos
- tem qualquer outra condição médica
- estão grávidas ou planejam engravidar. Não se sabe se MAXALT prejudicará o feto. Se você engravidar enquanto estiver tomando MAXALT 5mg, converse com seu médico.
- está amamentando ou planeja amamentar. Não se sabe se MAXALT 10mg passa para o leite materno. Fale com o seu médico sobre a melhor forma de alimentar o seu bebé se estiver a tomar MAXALT.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas.
MAXALT 10mg e outros medicamentos podem afetar uns aos outros causando efeitos colaterais. MAXALT pode afetar a forma como outros medicamentos atuam, e outros medicamentos podem afetar a forma como MAXALT 5mg atua.
Informe especialmente o seu médico se estiver a tomar:
- medicamentos contendo propranolol, como Inderal®, Inderal® LA ou Innopran® XL
- medicamentos usados para tratar distúrbios do humor, incluindo inibidores seletivos da recaptação da serotonina (ISRSs) ou inibidores da recaptação da serotonina norepinefrina (IRSNs).
Peça ao seu médico ou farmacêutico uma lista destes medicamentos, se não tiver a certeza.
Conheça os medicamentos que você toma. Mantenha uma lista deles para mostrar ao seu médico e farmacêutico quando receber um novo medicamento.
Como devo tomar Maxalt?
- Tome MAXALT exatamente como seu médico lhe disse para tomá-lo.
- seu médico dir-lhe-á a quantidade de MAXALT 5 mg que deve tomar e quando deve tomá-lo.
- Para tomar MAXALT-MLT:
- Deixe os comprimidos de desintegração oral de MAXALT-MLT na embalagem até que esteja pronto para tomá-los. Quando estiver pronto para tomá-lo:
- Remova o blister da bolsa de alumínio. Não empurre o comprimido de desintegração oral de MAXALT-MLT através do blister.
- Abra o blister com as mãos secas e coloque o comprimido de desintegração oral de MAXALT-MLT na língua. O comprimido dissolve-se e é engolido com a saliva. Nenhum líquido é necessário para tomar o comprimido de desintegração oral.
- Deixe os comprimidos de desintegração oral de MAXALT-MLT na embalagem até que esteja pronto para tomá-los. Quando estiver pronto para tomá-lo:
- Se a dor de cabeça voltar após a primeira dose de MAXALT 10mg:
- Para adultos: uma segunda dose pode ser tomada 2 horas após a primeira dose. Não tome mais de 30 mg de MAXALT em um período de 24 horas (por exemplo, não tome mais de 3 comprimidos de 10 mg em um período de 24 horas).
- Para crianças de 6 a 17 anos de idade: Não se sabe se tomar mais de 1 dose de MAXALT 5mg em 24 horas é seguro e eficaz. Converse com seu médico sobre o que fazer se sua dor de cabeça não desaparecer ou voltar.
- Se você tomar muito MAXALT 5mg, ligue para o seu médico ou dirija-se imediatamente ao pronto-socorro do hospital mais próximo.
O que devo evitar ao tomar MAXALT?
MAXALT 5mg pode causar tontura, fraqueza ou desmaio. Se você tiver esses sintomas, não dirija, use máquinas ou faça qualquer coisa que precise que você esteja alerta.
Quais são os possíveis efeitos colaterais de MAXALT 5mg?
MAXALT 5mg pode causar efeitos colaterais graves. Ligue para o seu médico ou dirija-se imediatamente ao pronto-socorro do hospital mais próximo se achar que está tendo algum dos efeitos colaterais graves de MAXALT, incluindo:
- ataque cardíaco. Os sintomas de um ataque cardíaco podem incluir:
- desconforto no peito no centro do peito que dura mais do que alguns minutos ou que desaparece e volta
- desconforto no peito que se sente como pressão desconfortável, aperto, plenitude ou dor
- dor ou desconforto nos braços, costas, pescoço, mandíbula ou estômago
- falta de ar com ou sem desconforto no peito
- saindo em um suor frio
- náusea ou vômito
- sentindo-se tonto
- derrame. Os sintomas de um acidente vascular cerebral podem incluir os seguintes sintomas repentinos:
- dormência ou fraqueza no rosto, braço ou perna, especialmente em um lado do corpo
- confusão, problemas para falar ou entender
- problemas para ver em 1 ou ambos os olhos
- problemas ao andar, tonturas, perda de equilíbrio ou coordenação
- dor de cabeça severa sem causa conhecida
- problemas nos vasos sanguíneos. Os sintomas de problemas nos vasos sanguíneos podem incluir:
- dor de estômago
- diarreia sanguinolenta
- problemas de visão
- frieza e dormência das mãos e pés
- síndrome serotoninérgica. Uma condição chamada síndrome serotoninérgica pode ocorrer quando medicamentos Triptanos, como MAXALT, são tomados com outros medicamentos. Os sintomas da síndrome da serotonina podem incluir:
- agitação
- alucinações
- coma
- batimento cardíaco rápido
- mudanças rápidas na sua pressão arterial
- aumento da temperatura corporal
- espasmo muscular
- perda de coordenação
- náuseas, vómitos ou diarreia
- pressão arterial aumentada.
Os efeitos colaterais mais comuns de MAXALT em adultos incluem:
- sentindo-se sonolento ou cansado
- dor ou pressão no peito ou na garganta
- tontura
Informe o seu médico se tiver algum efeito secundário que o incomode ou que não desapareça.
Se você tomar MAXALT 10mg com muita frequência, isso pode resultar em dores de cabeça crônicas. Nesses casos, deve contactar o seu médico, uma vez que poderá ter de parar de tomar MAXALT.
Estes não são todos os possíveis efeitos colaterais de MAXALT. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA1088.
Como devo armazenar o Maxalt?
- Armazene MAXALT em temperatura ambiente entre 15°C e 30°C (59°F a 86°F).
- Jogue fora com segurança os medicamentos que estão desatualizados ou não são mais necessários.
Mantenha MAXALT 10mg e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de MAXALT.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um folheto de informações ao paciente. Não use MAXALT para uma condição para a qual não foi prescrito. Não dê MAXALT a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este folheto informativo do paciente resume as informações mais importantes sobre MAXALT. Se quiser mais informações, fale com o seu médico. Você pode pedir ao seu farmacêutico ou médico informações sobre MAXALT que são escritas para profissionais de saúde.
Para mais informações, acesse www.maxalt.com.
Quais são os ingredientes de MAXALT?
Ingrediente ativo em comprimidos de desintegração oral MAXALT 10mg e MAXALT-MLT:
benzoato de rizatriptana.
Ingredientes inativos em MAXALT: lactose monohidratada, celulose microcristalina, amido pré-gelatinizado, óxido férrico (vermelho) e estearato de magnésio.
Ingredientes inativos em comprimidos de desintegração oral de MAXALT-MLT: gelatina, manitol, glicina, aspartame e aroma de menta.
MAXALT-MLT comprimidos de desintegração oral contém aspartame, uma fonte de fenilalanina.
Fenilcetonúricos:
MAXALT-MLT comprimidos de desintegração oral de 5 mg contém 1,1 mg de fenilalanina. MAXALT-MLT comprimidos de desintegração oral de 10 mg contém 2,1 mg de fenilalanina.
Esta informação do paciente foi aprovada pela Food and Drug Administration dos EUA.
