Naprelan 250mg, 500mg Naproxen Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
que é Naprelan e como é usado?
Naprelan é um medicamento de prescrição usado para tratar os sintomas da artrite reumatóide, osteoartrite, espondilite anquilosina, dismenorreia, gota aguda e dor. Naprelan pode ser usado sozinho ou com outros medicamentos.
Naprelan pertence a uma classe de medicamentos chamados AINEs.
Não se sabe se Naprelan 250mg é seguro e eficaz em crianças menores de 2 anos de idade.
Quais são os possíveis efeitos colaterais do Naprelan 500mg?
Naprelan pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- fácil de hematomas ou sangramento,
- deglutição difícil ou dolorosa,
- zumbido nos ouvidos,
- mudanca de humor,
- alterações na quantidade de urina,
- torcicolo inexplicável,
- alterações na visão,
- inchaço dos tornozelos e pés,
- cansaço incomum,
- ganho de peso incomum e repentino,
- urina escura,
- náuseas ou vômitos persistentes,
- perda de apetite,
- dor abdominal,
- amarelecimento dos olhos ou da pele (icterícia), e
- tontura severa
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Naprelan incluem:
- dor de estômago,
- náusea,
- azia,
- dor de cabeça,
- pressão arterial elevada
- sonolência e
- tontura
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Naprelan. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
RISCO DE EVENTOS CARDIOVASCULARES E GASTROINTESTINAIS GRAVES
Eventos Trombóticos Cardiovasculares
- Os anti-inflamatórios não esteroides (AINEs) aumentam o risco de eventos trombóticos cardiovasculares graves, incluindo infarto do miocárdio e acidente vascular cerebral, que podem ser fatais. Este risco pode ocorrer no início do tratamento e pode aumentar com a duração do uso [ver ADVERTÊNCIAS E PRECAUÇÕES].
- NAPRELAN é contraindicado no contexto de cirurgia de revascularização do miocárdio (CRM) [consulte CONTRA-INDICAÇÕES e ADVERTÊNCIAS E PRECAUÇÕES].
Hemorragia, Ulceração e Perfuração Gastrointestinal
- Os AINEs causam um risco aumentado de eventos adversos gastrointestinais (GI) graves, incluindo sangramento, ulceração e perfuração do estômago ou intestinos, que podem ser fatais. Esses eventos podem ocorrer a qualquer momento durante o uso e sem sintomas de aviso. Pacientes idosos e pacientes com história prévia de úlcera péptica e/ou sangramento GI apresentam maior risco de eventos GI graves [ver ADVERTÊNCIAS E PRECAUÇÕES].
DESCRIÇÃO
NAPRELAN (naproxeno sódico) comprimidos de liberação controlada é um medicamento anti-inflamatório não esteróide, disponível como comprimidos de liberação controlada em doses de 375 mg, 500 mg e 750 mg para administração oral. O nome químico é ácido 2-naftalenoacético, sal 6-metoxi-α-metil-sódico, (S)-. O peso molecular é 252,24. Sua fórmula molecular é C14H13NaO3, e tem a seguinte estrutura química.
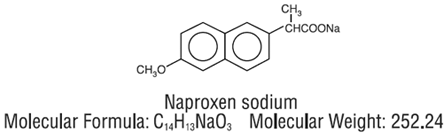
naproxeno sódico é um pó cristalino inodoro, de cor branca a cremosa. É solúvel em metanol e água. Os comprimidos de NAPRELAN 250 mg contêm 412,5 mg, 550 mg ou 825 mg de naproxeno sódico, equivalente a 375 mg, 500 mg e 750 mg de naproxeno e 37,5 mg, 50 mg e 75 mg de sódio, respectivamente. Cada comprimido de NAPRELAN 250mg também contém os seguintes ingredientes inativos: copolímero de amôniometacrilato Tipo A, copolímero de amôniometacrilato Tipo B, ácido cítrico, crospovidona, estearato de magnésio, copolímero de ácido metacrílico Tipo A, celulose microcristalina, povidona e talco. O revestimento do comprimido contém hidroxipropilmetilcelulose, polietilenoglicol e dióxido de titânio.
INDICAÇÕES
Os comprimidos de NAPRELAN 250mg são indicados para o tratamento de:
- artrite reumatóide (AR)
- osteoartrite (OA)
- espondilite anquilosante (EA)
- tendinite, bursite
- gota aguda
- dismenorreia primária (DP)
- o alívio da dor leve a moderada
 [ver AVISOS E PRECAUÇÕES ].
DOSAGEM E ADMINISTRAÇÃO
Instruções Gerais de Dosagem
Considere cuidadosamente os potenciais benefícios e riscos de NAPRELAN e outras opções de tratamento antes de decidir usar NAPRELAN. Use a dosagem eficaz mais baixa pelo menor período de tempo consistente com as metas de tratamento do paciente individual [consulte AVISOS E PRECAUÇÕES ].
Após observar a resposta à terapia inicial com NAPRELAN, a dose e a frequência devem ser ajustadas para atender às necessidades individuais de cada paciente.
Artrite reumatóide, osteoartrite e espondilite anquilosante
A dose inicial recomendada de NAPRELAN comprimidos em adultos é de dois comprimidos de NAPRELAN 375 mg (750 mg) uma vez ao dia, um comprimido de NAPRELAN 750 mg (750 mg) uma vez ao dia ou dois comprimidos de NAPRELAN 500 mg (1.000 mg) uma vez ao dia. Pacientes que já estejam tomando naproxeno 250 mg, 375 mg ou 500 mg duas vezes ao dia (manhã e noite) podem ter sua dose diária total substituída por NAPRELAN 500 mg comprimidos em dose única diária.
Durante a administração a longo prazo, a dose de NAPRELAN 250mg comprimidos pode ser aumentada ou diminuída dependendo da resposta clínica do paciente. Em pacientes que toleram bem doses mais baixas de NAPRELAN comprimidos, a dose pode ser aumentada para dois comprimidos de NAPRELAN 750 mg (1.500 mg) ou três comprimidos de NAPRELAN 500 mg (1.500 mg) uma vez ao dia por períodos limitados quando um nível mais alto de anti-inflamatório /atividade analgésica é necessária. Ao tratar pacientes, especialmente com níveis de dose mais altos, o médico deve observar um aumento do benefício clínico suficiente para compensar o risco potencial aumentado [ver FARMACOLOGIA CLÍNICA ]. A menor dose eficaz deve ser procurada e utilizada em cada paciente. A melhora sintomática na artrite geralmente começa dentro de uma semana; no entanto, o tratamento por duas semanas pode ser necessário para obter um benefício terapêutico.
Tratamento da dor, dismenorreia primária e tendinite e bursite agudas
dose inicial recomendada é de dois comprimidos de NAPRELAN 500 mg (1.000 mg) uma vez ao dia. Para pacientes que necessitam de maior benefício analgésico, dois comprimidos de NAPRELAN 750 mg (1.500 mg) ou três comprimidos de NAPRELAN 500 mg (1.500 mg) podem ser usados por um período limitado. Depois disso, a dose diária total não deve exceder dois comprimidos de NAPRELAN 500 mg (1.000 mg).
Gota Aguda
A dose recomendada no primeiro dia é de dois a três comprimidos de NAPRELAN 500 mg (1.000 a 1.500 mg) uma vez ao dia, seguidos por dois comprimidos de NAPRELAN 500 mg (1.000 mg) uma vez ao dia, até que o ataque desapareça.
Ajustes de dosagem em pacientes com insuficiência hepática
Uma dose mais baixa deve ser considerada em pacientes com insuficiência renal ou hepática ou em pacientes idosos [ver AVISOS E PRECAUÇÕES ]. Estudos indicam que, embora a concentração plasmática total de naproxeno permaneça inalterada, a fração plasmática não ligada de naproxeno está aumentada em idosos. Recomenda-se cautela quando altas doses são necessárias e alguns ajustes de dosagem podem ser necessários em pacientes idosos. Tal como acontece com outros medicamentos usados em idosos, é prudente usar a menor dose eficaz.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Os comprimidos de liberação controlada NAPRELAN (naproxeno sódico) estão disponíveis da seguinte forma:
- NAPRELAN 375: comprimido branco em forma de cápsula com “N” de um lado e “375” no verso. Cada comprimido contém 412,5 mg de naproxeno sódico equivalente a 375 mg de naproxeno.
- NAPRELAN 500: comprimido branco em forma de cápsula com “N” de um lado e “500” no verso. Cada comprimido contém 550 mg de naproxeno sódico equivalente a 500 mg de naproxeno.
- NAPRELAN 750: comprimido branco em forma de cápsula com “N” de um lado e “750” no verso. Cada comprimido contém 825 mg de naproxeno sódico equivalente a 750 mg de naproxeno.
Armazenamento e manuseio
NAPRELAN (naproxeno sódico) 375 mg, 500 mg e 750 mg são comprimidos de liberação controlada fornecidos como:
NAPRELAN 375 : comprimido branco em forma de cápsula com “N” de um lado e “375” no verso; em garrafas de 100; NDC 52427-272-01. Cada comprimido contém 412,5 mg de naproxeno sódico equivalente a 375 mg de naproxeno.
NAPRELAN 500 : comprimido branco em forma de cápsula com “N” de um lado e “500” no verso; em garrafas de 75; NDC 52427-273-75. Cada comprimido contém 550 mg de naproxeno sódico equivalente a 500 mg de naproxeno.
NAPRELAN 750 : comprimido branco em forma de cápsula com “N” de um lado e “750” no verso; em garrafas de 30; NDC 52427-274-30. Cada comprimido contém 825 mg de naproxeno sódico equivalente a 750 mg de naproxeno.
Armazenar
Armazene em temperatura ambiente, 20° a 25°C (68° a 77°F), excursões permitidas de 15° a 30°C (59° a 86°F) [consulte USP Controlled Room Temperature]. FARMACÊUTICO: Dispensar em recipiente bem fechado.
Distribuído por: Almatica Pharma, Inc. Morristown, NJ 07960 EUA. Revisado: abril de 2021
EFEITOS COLATERAIS
As seguintes reações adversas são discutidas em mais detalhes em outras seções da bula:
- Eventos Trombóticos Cardiovasculares [ver AVISOS E PRECAUÇÕES ]
- Sangramento, Ulceração e Perfuração GI [ver AVISOS E PRECAUÇÕES ]
- Hepatotoxicidade [ver AVISOS E PRECAUÇÕES ]
- Hipertensão [ver AVISOS E PRECAUÇÕES ]
- Insuficiência Cardíaca e Edema [ver AVISOS E PRECAUÇÕES ]
- Toxicidade renal e hipercalemia [ver AVISOS E PRECAUÇÕES ]
- Reações anafiláticas [ver AVISOS E PRECAUÇÕES ]
- Reações cutâneas graves [ver AVISOS E PRECAUÇÕES ]
- Toxicidade hematológica [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Como acontece com todos os medicamentos desta classe, a frequência e a gravidade dos eventos adversos dependem de vários fatores: a dose do medicamento e a duração do tratamento; a idade, o sexo, a condição física do paciente; quaisquer diagnósticos médicos concomitantes ou fatores de risco individuais. As seguintes reações adversas são divididas em três partes com base na frequência e se existe ou não a possibilidade de uma relação causal entre o uso do medicamento e esses eventos adversos. Nas reações listadas como “Provável Relação Causal” há pelo menos um caso para cada reação adversa em que há evidências que sugerem que existe uma relação causal entre o uso do medicamento e o evento relatado. As reações adversas notificadas foram baseadas nos resultados de dois ensaios clínicos controlados em dupla ocultação de três meses de duração com uma extensão adicional de nove meses em regime aberto. Um total de 542 pacientes receberam comprimidos de NAPRELAN no período duplo-cego ou na extensão aberta de nove meses. Destes 542 pacientes, 232 receberam comprimidos de NAPRELAN, 167 foram inicialmente tratados com Naprosyn® e 143 foram tratados inicialmente com placebo. As reações adversas relatadas por pacientes que receberam comprimidos de NAPRELAN 500mg são mostradas por sistema corporal. As reações adversas observadas com naproxeno, mas não relatadas em estudos controlados com NAPRELAN comprimidos, estão em itálico.
Os eventos adversos mais frequentes dos ensaios clínicos duplo-cegos e abertos foram cefaleia (15%), seguido de dispepsia (14%) e síndrome gripal (10%). A incidência de outros eventos adversos que ocorrem em 3% a 9% dos pacientes está marcada com um asterisco.
As reações que ocorrem em menos de 3% dos pacientes não são marcadas.
Incidência maior que 1% (relação causal provável)
Corpo como um todo - Dor (costas)*, dor*, infecção*, febre, lesão (acidente), astenia, dor no peito, dor de cabeça (15%), síndrome gripal (10%).
Gastrintestinais - Náuseas*, diarreia*, obstipação*, dor abdominal*, flatulência, gastrite, vómitos, disfagia, dispepsia (14%), azia*, estomatite.
Hematologico - Anemia, equimose.
Respiratório - Faringite*, rinite*, sinusite*, bronquite, tosse aumentada.
Renal - Infecção do trato urinário*, cistite.
Dermatológico - Erupção cutânea*, erupções cutâneas*, equimoses*, púrpura.
Metabólico e Nutrição - Edema periférico, hiperglicemia.
Sistema nervoso central - Tonturas, parestesia, insónia, sonolência*, vertigens.
Cardiovascular - Hipertensão, edema*, dispneia*, palpitações.
Musculoesquelético - Cãibras (perna), mialgia, artralgia, distúrbio articular, distúrbio do tendão.
Sentidos Especiais - Zumbido*, distúrbios auditivos, distúrbios visuais.
Em geral - Sede.
Incidência inferior a 1% (relação causal provável)
Corpo como um todo - Abscesso, monilia, pescoço rígido, dor no pescoço, abdome aumentado, carcinoma, celulite, edema geral, síndrome LE, mal-estar, distúrbio da membrana mucosa, reação alérgica, dor pélvica.
Gastrintestinais - Anorexia, colecistite, colelitíase, eructação, hemorragia GI, hemorragia retal, estomatite aftosa, úlcera estomatite, úlcera na boca, úlcera estomacal, abscesso periodontal, cardioespasmo, colite, esofagite, gastroenterite, distúrbio GI, distúrbio retal, distúrbio dentário, hepatoesplenomegalia, função hepática anormalidade, melena, úlcera de esôfago, hematêmese, icterícia, pancreatite, necrose.
Renal - Dismenorreia, disúria, anormalidade da função renal, noctúria, distúrbio da próstata, pielonefrite, carcinoma de mama, incontinência urinária, cálculo renal, insuficiência renal, menorragia, metrorragia, neoplasia de mama, nefrosclerose, hematúria, dor renal, piúria, urina anormal, frequência urinária, retenção, espasmo uterino, vaginite, nefrite glomerular, hipercalemia, nefrite intersticial, síndrome nefrótica, doença renal, insuficiência renal, necrose papilar renal.
Hematologico - Leucopenia, aumento do tempo de sangramento, eosinofilia, eritrócitos anormais, leucócitos anormais, trombocitopenia, agranulocitose, granulocitopenia.
Sistema nervoso central - Depressão, ansiedade, hipertonia, nervosismo, neuralgia, neurite, vertigem, amnésia, confusão, coordenação, diplopia anormal, labilidade emocional, hematoma subdural, paralisia, anormalidades em sonhos, incapacidade de concentração, fraqueza muscular.
Dermatológico: Angiodermatite, herpes simples, pele seca, sudorese, úlcera cutânea, acne, alopecia, dermatite de contato, eczema, herpes zoster, afecção ungueal, necrose da pele, nódulo subcutâneo, prurido, urticária, neoplasia de pele, dermatite fotossensível, reações de fotossensibilidade semelhantes a porfiria tarda cutânea , epidermólise bolhosa.
Sentidos Especiais - Ambliopia, esclerite, catarata, conjuntivite, surdez, distúrbio do ouvido, ceratoconjuntivite, distúrbio do lacrimejamento, otite média, dor ocular.
Cardiovascular - Angina pectoris, doença arterial coronariana, infarto do miocárdio, tromboflebite profunda, vasodilatação, anomalia vascular, arritmia, bloqueio de ramo, ECG anormal, insuficiência cardíaca direita, hemorragia, enxaqueca, estenose aórtica, síncope, taquicardia, insuficiência cardíaca congestiva.
Respiratório - Asma, dispnéia, edema pulmonar, laringite, distúrbio pulmonar, epistaxe, pneumonia, desconforto respiratório, distúrbio respiratório, pneumonite eosinofílica.
Musculoesquelético - Miastenia, distúrbio ósseo, fratura óssea espontânea, fibrotendinite, dor óssea, ptose, espasmo geral, bursite.
Metabólico e Nutrição - Aumento da creatinina, glicosúria, hipercolesteremia, albuminúria, alcalose, aumento da ureia, desidratação, edema, diminuição da tolerância à glicose, hiperuricemia, hipocalemia, aumento do SGOT, aumento do SGPT, diminuição do peso.
Em geral - Reações anafilactóides, edema angioneurótico, distúrbios menstruais, hipoglicemia, pirexia (calafrios e febre).
Incidência inferior a 1% (relação causal desconhecida)
Outras reações adversas listadas no rótulo da embalagem do naproxeno, mas não relatadas por aqueles que receberam os comprimidos de NAPRELAN são mostradas em itálico. Essas observações estão sendo listadas como informações de alerta para o médico.
Hematologico - Anemia aplástica, anemia hemolítica.
Sistema nervoso central - Meningite asséptica, disfunção cognitiva.
Dermatológico - Necrólise epidérmica, eritema multiforme, síndrome de Stevens-Johnson.
Gastrintestinais - Ulceração GI não péptica, estomatite ulcerativa.
Cardiovascular - Vasculite.
INTERAÇÕES MEDICAMENTOSAS
Consulte a Tabela 1 para interações medicamentosas clinicamente significativas com naproxeno.
Interações Medicamentos/Testes Laboratoriais
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Eventos Trombóticos Cardiovasculares
Ensaios clínicos de vários AINEs seletivos e não seletivos de COX-2 com duração de até três anos mostraram um risco aumentado de eventos trombóticos cardiovasculares (CV) graves, incluindo infarto do miocárdio (IM) e acidente vascular cerebral, que podem ser fatais. Com base nos dados disponíveis, não está claro que o risco de eventos trombóticos CV seja semelhante para todos os AINEs. O aumento relativo de eventos trombóticos CV graves em relação à linha de base conferida pelo uso de AINEs parece ser semelhante naqueles com e sem doença CV conhecida ou fatores de risco para doença CV. No entanto, pacientes com doença CV conhecida ou fatores de risco tiveram uma incidência absoluta mais alta de excesso de eventos trombóticos CV graves, devido ao aumento da taxa basal. Alguns estudos observacionais descobriram que esse risco aumentado de eventos trombóticos CV graves começou logo nas primeiras semanas de tratamento. O aumento do risco trombótico CV foi observado de forma mais consistente em doses mais elevadas.
Para minimizar o risco potencial de um evento CV adverso em pacientes tratados com AINEs, use a menor dose eficaz pelo menor tempo possível. Médicos e pacientes devem permanecer alertas para o desenvolvimento de tais eventos, durante todo o curso do tratamento, mesmo na ausência de sintomas CV prévios. Os pacientes devem ser informados sobre os sintomas de eventos CV graves e as medidas a serem tomadas se ocorrerem.
Não há evidências consistentes de que o uso concomitante de aspirina reduza o risco aumentado de eventos trombóticos CV graves associados ao uso de AINEs. O uso concomitante de aspirina e um AINE, como o naproxeno, aumenta o risco de eventos gastrointestinais (GI) graves [ver AVISOS E PRECAUÇÕES ].
Status Pós Cirurgia de Revascularização do Miocárdio (CRM)
Dois grandes ensaios clínicos controlados de um AINE seletivo para COX-2 para o tratamento da dor nos primeiros 10 a 14 dias após a cirurgia de revascularização do miocárdio encontraram um aumento na incidência de infarto do miocárdio e acidente vascular cerebral. Os AINEs são contraindicados no contexto de CRM [ver CONTRA-INDICAÇÕES ].
Pacientes pós-IM
Estudos observacionais conduzidos no Registro Nacional Dinamarquês demonstraram que pacientes tratados com AINEs no período pós-IM apresentaram risco aumentado de reinfarto, morte relacionada a CV e mortalidade por todas as causas a partir da primeira semana de tratamento. Nesta mesma coorte, a incidência de morte no primeiro ano pós-IAM foi de 20 por 100 pessoas-ano em pacientes tratados com AINEs em comparação com 12 por 100 pessoas-anos em pacientes não expostos a AINEs. Embora a taxa absoluta de morte tenha diminuído um pouco após o primeiro ano pós-IM, o aumento do risco relativo de morte em usuários de AINEs persistiu durante pelo menos os próximos quatro anos de acompanhamento.
Evite o uso de NAPRELAN 250mg em pacientes com infarto do miocárdio recente, a menos que se espere que os benefícios superem o risco de eventos trombóticos CV recorrentes. Se NAPRELAN for usado em pacientes com infarto do miocárdio recente, monitore os pacientes quanto a sinais de isquemia cardíaca.
Hemorragia, ulceração e perfuração gastrointestinais
Os AINEs, incluindo o naproxeno, causam eventos adversos gastrointestinais (GI) graves, incluindo inflamação, sangramento, ulceração e perfuração do esôfago, estômago, intestino delgado ou intestino grosso, que podem ser fatais. Esses eventos adversos graves podem ocorrer a qualquer momento, com ou sem sintomas de alerta, em pacientes tratados com AINEs. Apenas um em cada cinco pacientes que desenvolvem um evento adverso grave no trato GI superior na terapia com AINEs é sintomático. Úlceras do trato GI superior, sangramento grave ou perfuração causada por AINEs ocorreram em aproximadamente 1% dos pacientes tratados por 3 a 6 meses e em cerca de 2% a 4% dos pacientes tratados por um ano. No entanto, mesmo a terapia com AINEs de curto prazo não é isenta de riscos.
Fatores de risco para sangramento GI, ulceração e perfuração
Pacientes com história prévia de úlcera péptica e/ou sangramento GI que usaram AINEs tiveram um risco 10 vezes maior de desenvolver sangramento GI em comparação com pacientes sem esses fatores de risco. Outros fatores que aumentam o risco de sangramento GI em pacientes tratados com AINEs incluem maior duração da terapia com AINEs; uso concomitante de corticosteroides orais, aspirina, anticoagulantes ou inibidores seletivos da recaptação da serotonina (ISRS); fumar; uso de álcool; idoso; e mau estado geral de saúde. A maioria dos relatos pós-comercialização de eventos gastrointestinais fatais ocorreu em pacientes idosos ou debilitados. Além disso, pacientes com doença hepática avançada e/ou coagulopatia apresentam risco aumentado de sangramento GI.
Estratégias para minimizar os riscos gastrointestinais em pacientes tratados com AINEs
- Use a dosagem eficaz mais baixa para a duração mais curta possível.
- Evite a administração de mais de um AINE de cada vez.
- Evite o uso em pacientes de alto risco, a menos que se espere que os benefícios superem o risco aumentado de sangramento. Para esses pacientes, bem como aqueles com sangramento GI ativo, considere terapias alternativas além dos AINEs.
- Permaneça alerta para sinais e sintomas de ulceração GI e sangramento durante a terapia com AINEs.
- Se houver suspeita de um evento adverso GI grave, inicie imediatamente a avaliação e o tratamento e descontinue NAPRELAN 250mg até que um evento adverso GI grave seja descartado.
- No caso de uso concomitante de aspirina em baixas doses para profilaxia cardíaca, monitore os pacientes mais de perto quanto a evidências de sangramento GI [ver INTERAÇÕES MEDICAMENTOSAS ].
Hepatotoxicidade
Elevações de ALT ou AST (três ou mais vezes o limite superior do normal [LSN]) foram relatadas em aproximadamente 1% dos pacientes tratados com AINEs em ensaios clínicos. Além disso, casos raros, às vezes fatais, de lesão hepática grave, incluindo hepatite fulminante, necrose hepática e insuficiência hepática foram relatados.
Elevações de ALT ou AST (menos de três vezes o LSN) podem ocorrer em até 15% dos pacientes tratados com AINEs, incluindo naproxeno.
Informe os pacientes sobre os sinais e sintomas de alerta de hepatotoxicidade (p. Se surgirem sinais e sintomas clínicos consistentes com doença hepática, ou se ocorrerem manifestações sistêmicas (por exemplo, eosinofilia, erupção cutânea, etc.), descontinue NAPRELAN 500mg imediatamente e realize uma avaliação clínica do paciente.
Hipertensão
Os AINEs, incluindo NAPRELAN, podem levar a um novo aparecimento ou agravamento de hipertensão pré-existente, qualquer um dos quais pode contribuir para o aumento da incidência de eventos CV. Pacientes em uso de inibidores da enzima conversora de angiotensina (ECA), diuréticos tiazídicos ou diuréticos de alça podem apresentar resposta prejudicada a essas terapias ao tomar AINEs [ver INTERAÇÕES MEDICAMENTOSAS ].
Monitorar a pressão arterial (PA) durante o início do tratamento com AINEs e durante o curso da terapia.
Insuficiência Cardíaca e Edema
A meta-análise do Coxib e a tradicional NSAID Trialists' Collaboration de ensaios clínicos randomizados demonstraram um aumento de aproximadamente duas vezes nas hospitalizações por insuficiência cardíaca em pacientes tratados com COX-2 seletivo e pacientes tratados com NSAID não seletivos em comparação com pacientes tratados com placebo. Em um estudo do Registro Nacional Dinamarquês de pacientes com insuficiência cardíaca, o uso de AINEs aumentou o risco de infarto do miocárdio, hospitalização por insuficiência cardíaca e morte.
Além disso, retenção de líquidos e edema foram observados em alguns pacientes tratados com AINEs. O uso de naproxeno pode atenuar os efeitos CV de vários agentes terapêuticos usados para tratar essas condições médicas (por exemplo, diuréticos, inibidores da ECA ou bloqueadores dos receptores da angiotensina [BRA]) [ver INTERAÇÕES MEDICAMENTOSAS ].
Evite o uso de NAPRELAN 250mg em pacientes com insuficiência cardíaca grave, a menos que se espere que os benefícios superem o risco de agravamento da insuficiência cardíaca. Se NAPRELAN for usado em pacientes com insuficiência cardíaca grave, monitore os pacientes quanto a sinais de piora da insuficiência cardíaca.
Toxicidade renal e hipercalemia
Toxicidade renal
A administração a longo prazo de AINEs resultou em necrose papilar renal e outras lesões renais.
toxicidade renal também foi observada em pacientes nos quais as prostaglandinas renais têm um papel compensatório na manutenção da perfusão renal. Nesses pacientes, a administração de um AINE pode causar uma redução dose-dependente na formação de prostaglandinas e, secundariamente, no fluxo sanguíneo renal, o que pode precipitar uma descompensação renal evidente. Os pacientes com maior risco dessa reação são aqueles com função renal comprometida, desidratação, hipovolemia, insuficiência cardíaca, disfunção hepática, aqueles que tomam diuréticos e inibidores da ECA ou BRAs e os idosos. A descontinuação da terapia com AINEs geralmente é seguida pela recuperação ao estado pré-tratamento.
Não há informações disponíveis de estudos clínicos controlados sobre o uso de NAPRELAN em pacientes com doença renal avançada. Os efeitos renais de NAPRELAN 250mg podem acelerar a progressão da disfunção renal em pacientes com doença renal preexistente.
Corrija o status do volume em pacientes desidratados ou hipovolêmicos antes de iniciar NAPRELAN. Monitorar a função renal em pacientes com insuficiência renal ou hepática, insuficiência cardíaca, desidratação ou hipovolemia durante o uso de NAPRELAN [ver INTERAÇÕES MEDICAMENTOSAS ]. Evite o uso de NAPRELAN 500mg em pacientes com doença renal avançada, a menos que se espere que os benefícios superem o risco de piora da função renal. Se NAPRELAN for usado em pacientes com doença renal avançada, monitore os pacientes quanto a sinais de piora da função renal.
Hipercalemia
Aumentos na concentração sérica de potássio, incluindo hipercalemia, foram relatados com o uso de AINEs, mesmo em alguns pacientes sem insuficiência renal. Em pacientes com função renal normal, esses efeitos foram atribuídos a um estado hiporreninêmico-hipoaldosteronismo.
Reações anafiláticas
O naproxeno tem sido associado a reações anafiláticas em pacientes com e sem hipersensibilidade conhecida ao naproxeno e em pacientes com asma sensível à aspirina. CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Procure ajuda de emergência se ocorrer uma reação anafilática.
Exacerbação da asma relacionada à sensibilidade à aspirina
Uma subpopulação de pacientes com asma pode ter asma sensível à aspirina, que pode incluir rinossinusite crônica complicada por pólipos nasais; broncoespasmo grave e potencialmente fatal; e/ou intolerância à aspirina e outros AINEs. Como a reação cruzada entre aspirina e outros AINEs foi relatada nesses pacientes sensíveis à aspirina, NAPRELAN 250mg é contraindicado em pacientes com essa forma de sensibilidade à aspirina [ver CONTRA-INDICAÇÕES ]. Quando NAPRELAN é usado em pacientes com asma preexistente (sem sensibilidade conhecida à aspirina), monitore os pacientes quanto a alterações nos sinais e sintomas da asma.
Reações cutâneas graves
Os AINEs, incluindo o naproxeno, podem causar reações adversas graves na pele, como dermatite esfoliativa, síndrome de Stevens-Johnson (SSJ) e necrólise epidérmica tóxica (NET), que podem ser fatais. Esses eventos graves podem ocorrer sem aviso prévio. Informar os pacientes sobre os sinais e sintomas de reações cutâneas graves e descontinuar o uso de NAPRELAN 500mg ao primeiro aparecimento de erupção cutânea ou qualquer outro sinal de hipersensibilidade.
NAPRELAN é contraindicado em pacientes com reações cutâneas graves prévias a AINEs [ver CONTRA-INDICAÇÕES ].
Reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS)
Reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS) foi relatada em pacientes tomando AINEs, como NAPRELAN. Alguns desses eventos foram fatais ou com risco de vida. DRESS tipicamente, embora não exclusivamente, apresenta febre, erupção cutânea, linfadenopatia e/ou edema facial. Outras manifestações clínicas podem incluir hepatite, nefrite, anormalidades hematológicas, miocardite ou miosite. Às vezes, os sintomas do DRESS podem se assemelhar a uma infecção viral aguda. A eosinofilia está frequentemente presente. Como esse distúrbio é variável em sua apresentação, outros sistemas orgânicos não mencionados aqui podem estar envolvidos. É importante notar que manifestações precoces de hipersensibilidade, como febre ou linfadenopatia, podem estar presentes, mesmo que a erupção não seja evidente. Se tais sinais ou sintomas estiverem presentes, descontinue NAPRELAN e avalie o paciente imediatamente.
Toxicidade Fetal
Fechamento prematuro do canal arterial fetal
Evite o uso de AINEs, incluindo NAPRELAN, em mulheres grávidas com cerca de 30 semanas de gestação e mais tarde. AINEs, incluindo NAPRELAN, aumentam o risco de fechamento prematuro do canal arterial fetal aproximadamente nesta idade gestacional.
Oligoidrâmnio/Insuficiência Renal Neonatal
O uso de AINEs, incluindo NAPRELAN 500mg, com cerca de 20 semanas de gestação ou mais tarde na gravidez, pode causar disfunção renal fetal levando a oligoidrâmnio e, em alguns casos, insuficiência renal neonatal. Esses resultados adversos são observados, em média, após dias a semanas de tratamento, embora oligoidrâmnios tenham sido relatados com pouca frequência tão logo 48 horas após o início dos AINEs. O oligoidrâmnio é frequentemente, mas nem sempre, reversível com a descontinuação do tratamento. As complicações do oligoidrâmnio prolongado podem, por exemplo, incluir contraturas dos membros e maturação pulmonar retardada. Em alguns casos pós-comercialização de insuficiência renal neonatal, foram necessários procedimentos invasivos, como exsanguineotransfusão ou diálise.
Se o tratamento com AINEs for necessário entre cerca de 20 semanas e 30 semanas de gestação, limite o uso de NAPRELAN 500mg à menor dose eficaz e à menor duração possível. Considere o monitoramento por ultrassom do líquido amniótico se o tratamento com NAPRELAN se estender além de 48 horas. Interrompa o NAPRELAN se ocorrer oligoidrâmnio e faça o acompanhamento de acordo com a prática clínica [ver Uso em populações específicas ].
Toxicidade hematológica
Anemia ocorreu em pacientes tratados com AINEs. Isso pode ser devido à perda de sangue oculta ou grosseira, retenção de líquidos ou um efeito descrito de forma incompleta na eritropoiese. Se um paciente tratado com NAPRELAN 500mg apresentar quaisquer sinais ou sintomas de anemia, monitore a hemoglobina ou o hematócrito.
AINEs, incluindo NAPRELAN, podem aumentar o risco de eventos hemorrágicos. Condições comórbidas como distúrbios de coagulação, uso concomitante de varfarina, outros anticoagulantes, agentes antiplaquetários (p. Monitore esses pacientes quanto a sinais de sangramento [ver INTERAÇÕES MEDICAMENTOSAS ].
Mascaramento de inflamação e febre
A atividade farmacológica de NAPRELAN 250mg na redução da inflamação, e possivelmente da febre, pode diminuir a utilidade dos sinais diagnósticos na detecção de infecções.
Monitoramento de Laboratório
Como sangramento GI grave, hepatotoxicidade e lesão renal podem ocorrer sem sinais ou sintomas de alerta, considere monitorar os pacientes em tratamento prolongado com AINEs com hemograma e perfil químico periodicamente [ver AVISOS E PRECAUÇÕES ].
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação ) que acompanha cada receita dispensada. Informe os pacientes, familiares ou seus cuidadores sobre as seguintes informações antes de iniciar a terapia com NAPRELAN 500mg e periodicamente durante o curso da terapia em andamento.
Eventos Trombóticos Cardiovasculares
Aconselhe os pacientes a ficarem alertas para os sintomas de eventos trombóticos cardiovasculares, incluindo dor no peito, falta de ar, fraqueza ou fala arrastada, e relatar qualquer um desses sintomas ao seu médico imediatamente [ver AVISOS E PRECAUÇÕES ].
Hemorragia, ulceração e perfuração gastrointestinais
NAPRELAN 500mg, como outros AINEs, pode causar desconforto GI e, raramente, efeitos colaterais gastrointestinais graves, como úlceras e sangramento, que podem resultar em hospitalização e até morte. Aconselhe os pacientes a relatar sintomas de ulcerações e sangramento, incluindo dor epigástrica, dispepsia, melena e hematêmese ao seu médico. No caso de uso concomitante de aspirina em baixas doses para profilaxia cardíaca, informe os pacientes sobre o risco aumentado e os sinais e sintomas de sangramento GI [ver AVISOS E PRECAUÇÕES ].
Hepatotoxicidade
Informe os pacientes sobre os sinais e sintomas de alerta de hepatotoxicidade (p. Se isso ocorrer, instrua os pacientes a interromper NAPRELAN e procurar terapia médica imediata [ver AVISOS E PRECAUÇÕES ].
Insuficiência Cardíaca e Edema
Aconselhe os pacientes a ficarem atentos aos sintomas de insuficiência cardíaca congestiva, incluindo falta de ar, ganho de peso inexplicável ou edema, e a entrar em contato com seu médico se tais sintomas ocorrerem [ver AVISOS E PRECAUÇÕES ].
Reações anafiláticas
Informe os pacientes sobre os sinais de uma reação anafilática (por exemplo, dificuldade em respirar, inchaço da face ou garganta). Instrua os pacientes a procurar ajuda de emergência imediata se isso ocorrer [ver CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Reações cutâneas graves, incluindo DRESS
NAPRELAN 500mg, como outros AINEs, pode causar sérios efeitos colaterais na pele, como dermatite esfoliativa, SSJ e NET, que podem resultar em hospitalização e até morte. Aconselhe os pacientes a parar de tomar NAPRELAN imediatamente se desenvolverem qualquer tipo de erupção cutânea ou febre e a entrar em contato com seu médico o mais rápido possível [ver AVISOS E PRECAUÇÕES ].
Fertilidade Feminina
Aconselhe as mulheres com potencial reprodutivo que desejam engravidar que os AINEs, incluindo NAPRELAN 250mg, podem estar associados a um atraso reversível na ovulação [ver Uso em populações específicas ].
Toxicidade Fetal
Informar as gestantes para evitar o uso de NAPRELAN 500mg e outros AINEs a partir de 30 semanas de gestação devido ao risco de fechamento prematuro do canal arterial fetal. Se o tratamento com NAPRELAN 500mg for necessário para uma gestante entre cerca de 20 a 30 semanas de gestação, informe que ela pode precisar ser monitorada para oligoidrâmnio, se o tratamento continuar por mais de 48 horas [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Evite o uso concomitante de AINEs
Informe os pacientes que o uso concomitante de NAPRELAN com outros AINEs ou salicilatos (por exemplo, diflunisal, salsalato) não é recomendado devido ao risco aumentado de toxicidade gastrointestinal e pouco ou nenhum aumento na eficácia [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ]. Alertar os pacientes de que os AINEs podem estar presentes em medicamentos de venda livre para o tratamento de resfriados, febre ou insônia.
Uso de AINEs e aspirina em baixas doses
Informe os pacientes para não usar aspirina em baixas doses concomitantemente com NAPRELAN 250mg até que conversem com seu médico [ver INTERAÇÕES MEDICAMENTOSAS ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Um estudo de dois anos foi realizado em ratos para avaliar o potencial carcinogênico do naproxeno nas doses de 8 mg/kg/dia, 16 mg/kg/dia e 24 mg/kg/dia (0,05, 0,1 e 0,16 vezes o máximo recomendado humana diária de 1.500 mg/dia com base na comparação da área de superfície corporal). Nenhuma evidência de tumorigenicidade foi encontrada.
Mutagênese
Os estudos para avaliar o potencial mutagênico de Naprosyn Suspension não foram concluídos.
Prejuízo da Fertilidade
Os estudos para avaliar o impacto do naproxeno na fertilidade masculina ou feminina não foram concluídos.
Uso em populações específicas
Gravidez
Resumo do risco
uso de AINEs, incluindo NAPRELAN 500mg, pode causar fechamento prematuro do canal arterial fetal e disfunção renal fetal levando a oligoidrâmnio e, em alguns casos, insuficiência renal neonatal. Devido a esses riscos, limite a dose e a duração do uso de NAPRELAN 500mg entre cerca de 20 e 30 semanas de gestação e evite o uso de NAPRELAN 500mg em cerca de 30 semanas de gestação e mais tarde na gravidez (consulte Considerações Clínicas , Dados ).
Fechamento prematuro do canal arterial fetal
O uso de AINEs, incluindo NAPRELAN 500mg, por volta de 30 semanas de gestação ou mais tarde na gravidez aumenta o risco de fechamento prematuro do canal arterial fetal.
Oligoidrâmnio/Insuficiência Renal Neonatal
O uso de AINEs com cerca de 20 semanas de gestação ou mais tarde na gravidez tem sido associado a casos de disfunção renal fetal levando a oligoidrâmnio e, em alguns casos, insuficiência renal neonatal.
Os dados de estudos observacionais sobre outros riscos embriofetais potenciais do uso de AINEs em mulheres no primeiro ou segundo trimestre de gravidez são inconclusivos. Em estudos de reprodução animal em ratos, coelhos e camundongos, não houve evidência de teratogenicidade ou dano fetal quando o naproxeno foi administrado durante o período de organogênese em doses de 0,13, 0,26 e 0,6 vezes a dose diária máxima recomendada para humanos de 1.500 mg/dia, respectivamente. Com base em dados de animais, as prostaglandinas demonstraram ter um papel importante na permeabilidade vascular endometrial, implantação de blastocistos e decidualização. Em estudos com animais, a administração de inibidores da síntese de prostaglandinas, como o naproxeno, resultou em aumento da perda pré e pós-implantação. As prostaglandinas também demonstraram ter um papel importante no desenvolvimento do rim fetal. Em estudos publicados em animais, foi relatado que os inibidores da síntese de prostaglandinas prejudicam o desenvolvimento renal quando administrados em doses clinicamente relevantes.
O risco de fundo estimado de defeitos congênitos graves e aborto para a(s) população(ões) indicada(s) é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Considerações Clínicas
Reações Adversas Fetais/Neonatais
Fechamento prematuro do canal arterial fetal: Evite o uso de AINEs em mulheres com cerca de 30 semanas de gestação e mais tarde na gravidez, porque os AINEs, incluindo NAPRELAN, podem causar fechamento prematuro do canal arterial fetal (ver Dados ).
Oligoidrâmnio/Insuficiência Renal Neonatal: Se for necessário um AINE por volta da 20ª semana de gestação ou mais tarde na gravidez, limite o uso à menor dose eficaz e à menor duração possível. Se o tratamento com NAPRELAN 500mg se estender por mais de 48 horas, considere o monitoramento com ultra-som para oligoidrâmnio. Se ocorrer oligoidrâmnio, descontinuar NAPRELAN 500mg e acompanhar de acordo com a prática clínica (ver Dados ).
Mão de obra ou entrega
Não há estudos sobre os efeitos de NAPRELAN 500mg durante o trabalho de parto ou parto. Em estudos com animais, AINEs, incluindo naproxeno sódico, inibem a síntese de prostaglandinas, causam atraso no parto, aumentam a incidência de distocia e aumentam a incidência de natimortos.
Dados
Dados humanos
Há algumas evidências que sugerem que, quando inibidores da síntese de prostaglandinas são usados para retardar o trabalho de parto prematuro, há um risco aumentado de complicações neonatais, como enterocolite necrosante, persistência do canal arterial e hemorragia intracraniana. O tratamento com naproxeno administrado no final da gravidez para retardar o parto tem sido associado a hipertensão pulmonar persistente, disfunção renal e níveis anormais de prostaglandina E em bebês prematuros. Devido ao conhecido efeito de drogas desta classe no sistema cardiovascular fetal humano (fechamento do canal arterial), o uso durante o terceiro trimestre deve ser evitado.
Fechamento prematuro do canal arterial fetal
A literatura publicada relata que o uso de AINEs em cerca de 30 semanas de gestação e mais tarde na gravidez pode causar fechamento prematuro do canal arterial fetal.
Oligoidrâmnio/Insuficiência Renal Neonatal
Estudos publicados e relatórios pós-comercialização descrevem o uso materno de AINEs em cerca de 20 semanas de gestação ou mais tarde na gravidez associado a disfunção renal fetal levando a oligoidrâmnio e, em alguns casos, insuficiência renal neonatal. Esses resultados adversos são observados, em média, após dias a semanas de tratamento, embora oligoidrâmnios tenham sido relatados com pouca frequência tão logo 48 horas após o início dos AINEs. Em muitos casos, mas não em todos, a diminuição do líquido amniótico foi transitória e reversível com a suspensão da droga. Houve um número limitado de relatos de casos de uso materno de AINEs e disfunção renal neonatal sem oligoidrâmnio, alguns dos quais irreversíveis. Alguns casos de disfunção renal neonatal necessitaram de tratamento com procedimentos invasivos, como exsanguineotransfusão ou diálise.
As limitações metodológicas desses estudos e relatórios pós-comercialização incluem a falta de um grupo de controle; informações limitadas sobre dose, duração e tempo de exposição ao medicamento; e uso concomitante de outros medicamentos. Essas limitações impedem o estabelecimento de uma estimativa confiável do risco de desfechos fetais e neonatais adversos com o uso materno de AINEs. Como os dados de segurança publicados sobre os resultados neonatais envolveram principalmente bebês prematuros, a generalização de certos riscos relatados para o bebê a termo exposto a AINEs pelo uso materno é incerto.
Dados de animais
Estudos de reprodução foram realizados em ratos a 20 mg/kg/dia (0,13 vezes a dose diária máxima recomendada em humanos de 1.500 mg/dia com base na comparação da área de superfície corporal) coelhos a 20 mg/kg/dia (0,26 vezes a dose máxima recomendada em humanos dose diária, com base na comparação da área de superfície corporal), e camundongos a 170 mg/kg/dia (0,6 vezes a dose máxima diária humana recomendada com base na comparação da área de superfície corporal) sem evidência de fertilidade prejudicada ou dano ao feto devido à medicamento. Com base em dados de animais, as prostaglandinas demonstraram ter um papel importante na permeabilidade vascular endometrial, implantação de blastocistos e decidualização. Em estudos com animais, a administração de inibidores da síntese de prostaglandinas, como o naproxeno sódico, resultou em aumento da perda pré e pós-implantação.
Lactação
Resumo do risco
ânion naproxeno foi encontrado no leite de mulheres lactantes em uma concentração de aproximadamente 1% daquela encontrada no plasma. Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de NAPRELAN e quaisquer efeitos adversos potenciais no lactente amamentado pelo NAPRELAN ou pela condição materna subjacente.
Fêmeas e Machos com Potencial Reprodutivo
Infertilidade
Mulheres
Com base no mecanismo de ação, o uso de AINEs mediados por prostaglandinas, incluindo NAPRELAN, pode retardar ou prevenir a ruptura dos folículos ovarianos, que tem sido associada à infertilidade reversível em algumas mulheres. Estudos em animais publicados mostraram que a administração de inibidores da síntese de prostaglandinas tem o potencial de interromper a ruptura folicular mediada por prostaglandinas necessária para a ovulação. Pequenos estudos em mulheres tratadas com AINEs também mostraram um atraso reversível na ovulação. Considerar a retirada de AINEs, incluindo NAPRELAN 250mg, em mulheres com dificuldades de conceber ou em investigação de infertilidade.
Uso Pediátrico
A segurança e eficácia de NAPRELAN 500mg em populações pediátricas não foram estabelecidas.
Uso Geriátrico
Pacientes idosos, em comparação com pacientes mais jovens, estão em maior risco de reações adversas cardiovasculares, gastrointestinais e/ou renais graves associadas aos AINEs. Se o benefício previsto para o paciente idoso superar esses riscos potenciais, inicie a dosagem no limite inferior da faixa de dosagem e monitore os pacientes quanto a efeitos adversos [ver AVISOS E PRECAUÇÕES ].
Sabe-se que o naproxeno e seus metabólitos são substancialmente excretados pelos rins, e o risco de reações adversas a este medicamento pode ser maior em pacientes com função renal comprometida. Como os pacientes idosos são mais propensos a ter função renal diminuída, tenha cuidado nessa população de pacientes e pode ser útil monitorar a função renal [ver FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Os sintomas após superdosagem aguda de AINEs têm sido tipicamente limitados a letargia, sonolência, náusea, vômito e dor epigástrica, que geralmente são reversíveis com cuidados de suporte. Ocorreu sangramento gastrointestinal. Hipertensão, insuficiência renal aguda, depressão respiratória e coma ocorreram, mas foram raros [ver AVISOS E PRECAUÇÕES ].
Alguns pacientes tiveram convulsões, mas não está claro se elas estavam ou não relacionadas à droga. Não se sabe qual dose da droga seria fatal.
Gerencie os pacientes com cuidados sintomáticos e de suporte após uma superdosagem de AINEs. Não existem antídotos específicos. A hemodiálise não diminui a concentração plasmática de naproxeno devido ao alto grau de sua ligação às proteínas. Considerar êmese e/ou carvão ativado (60 a 100 gramas em adultos, 1 a 2 gramas por kg de peso corporal em pacientes pediátricos) e/ou catártico osmótico em pacientes sintomáticos atendidos dentro de quatro horas após a ingestão ou em pacientes com grande superdosagem. 5 a 10 vezes a dosagem recomendada). Diurese forçada, alcalinização da urina, hemodiálise ou hemoperfusão podem não ser úteis devido à alta ligação proteica.
Para obter informações adicionais sobre o tratamento de superdosagem, entre em contato com um centro de controle de intoxicações (1-800-222-1222).
CONTRA-INDICAÇÕES
NAPRELAN 500mg é contraindicado nos seguintes pacientes:
Hipersensibilidade conhecida (por exemplo, reações anafiláticas e reações cutâneas graves) ao naproxeno ou a qualquer componente do medicamento [ver AVISOS E PRECAUÇÕES ]
História de asma, urticária ou outras reações alérgicas após tomar aspirina ou outros AINEs. Reações anafiláticas graves, às vezes fatais, aos AINEs foram relatadas nesses pacientes [ver AVISOS E PRECAUÇÕES ]
No cenário de cirurgia de revascularização do miocárdio (CRM) [ver AVISOS E PRECAUÇÕES ]
FARMACOLOGIA CLÍNICA
Mecanismo de ação
O naproxeno tem propriedades analgésicas, anti-inflamatórias e antipiréticas.
O mecanismo de ação do NAPRELAN, como o de outros AINEs, não é completamente compreendido, mas envolve a inibição da ciclooxigenase (COX-1 e COX-2).
O naproxeno sódico é um potente inibidor da síntese de prostaglandinas in vitro. As concentrações de naproxeno sódico alcançadas durante a terapia produziram efeitos in vivo. As prostaglandinas sensibilizam os nervos aferentes e potencializam a ação da bradicinina na indução da dor em modelos animais.
As prostaglandinas são mediadores da inflamação. Como o naproxeno sódico é um inibidor da síntese de prostaglandinas, seu modo de ação pode ser devido à diminuição das prostaglandinas nos tecidos periféricos.
Farmacodinâmica
Em um estudo com voluntários saudáveis, 10 dias de administração concomitante de naproxeno 220 mg uma vez ao dia com dose baixa de aspirina de liberação imediata (81 mg) mostrou uma interação com a atividade antiplaquetária da aspirina medida pela % de inibição do tromboxano B2 sérico em 24 horas após a dose do dia 10 [98,7% (somente aspirina) vs 93,1% (naproxeno e aspirina)]. A interação foi observada mesmo após a descontinuação do naproxeno no dia 11 (enquanto a dose de aspirina foi continuada), mas normalizada no dia 13. No mesmo estudo, a interação foi maior quando o naproxeno foi administrado 30 minutos antes da aspirina [98,7% vs 87,7%] e mínimo quando a aspirina foi administrada 30 minutos antes do naproxeno [98,7% vs 95,4%].
Após a administração de naproxeno 220 mg duas vezes ao dia com baixa dose de aspirina de liberação imediata (primeira dose de naproxeno administrada 30 minutos antes da aspirina), a interação foi mínima 24 h após a dose do dia 10 [98,7% vs 95,7%]. No entanto, a interação foi mais proeminente após a descontinuação do naproxeno (washout) no dia 11 [98,7% vs 84,3%] e não normalizou completamente no dia 13 [98,5% vs 90,7%]. [Vejo INTERAÇÕES MEDICAMENTOSAS ].
Farmacocinética
Embora o naproxeno em si seja bem absorvido, a forma de sal de sódio é absorvida mais rapidamente, resultando em níveis plasmáticos de pico mais altos para uma determinada dose. Aproximadamente 30% da dose total de naproxeno sódico em comprimidos de NAPRELAN 500mg está presente na forma farmacêutica como componente de liberação imediata. O restante naproxeno sódico é revestido como micropartículas para fornecer propriedades de liberação sustentada. Após a administração oral, os níveis plasmáticos de naproxeno são detectados dentro de 30 minutos após a administração, com picos dos níveis plasmáticos ocorrendo aproximadamente 5 horas após a administração. A meia-vida de eliminação terminal observada do naproxeno tanto do naproxeno sódico de liberação imediata quanto dos comprimidos de NAPRELAN é de aproximadamente 15 horas. Níveis de estado estacionário de naproxeno são alcançados em 3 dias e o grau de acúmulo de naproxeno no sangue é consistente com isso.
Concentrações Plasmáticas de Naproxeno Média de 24 Indivíduos (+/-2SD) (Estado Estacionário, Dia 5)
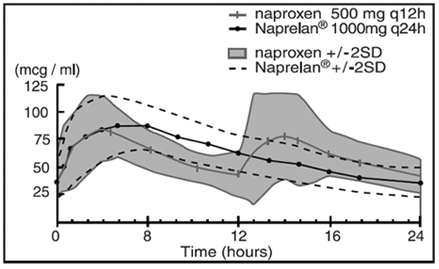
Parâmetros farmacocinéticos no dia 5 do estado estacionário (média de 24 indivíduos)
Absorção
próprio naproxeno é rápida e completamente absorvido pelo trato GI com uma biodisponibilidade in vivo de 95%. Com base no perfil farmacocinético, a fase de absorção de NAPRELAN 250mg comprimidos ocorre nas primeiras 4 a 6 horas após a administração. Isso coincide com a desintegração do comprimido no estômago, o trânsito das micropartículas de liberação sustentada através do intestino delgado e para o intestino grosso proximal. Um estudo de imagem in vivo foi realizado em voluntários saudáveis que confirma a rápida desintegração da matriz do comprimido e a dispersão das micropartículas.
A taxa de absorção do componente particulado de liberação sustentada dos comprimidos de NAPRELAN é mais lenta do que a dos comprimidos convencionais de naproxeno sódico. É este prolongamento dos processos de absorção do fármaco que mantém os níveis plasmáticos e permite uma dosagem única diária.
Efeitos dos alimentos
Não foram observados efeitos alimentares significativos quando vinte e quatro indivíduos receberam uma dose única de NAPRELAN 500 mg Comprimidos 500 mg após um jejum noturno ou 30 minutos após uma refeição. Em comum com as formulações convencionais de naproxeno e naproxeno sódico, os alimentos causam uma ligeira diminuição na taxa de absorção de naproxeno após a administração de NAPRELAN 250mg comprimidos.
Distribuição
O naproxeno tem um volume de distribuição de 0,16 L/kg. Em níveis terapêuticos, o naproxeno é mais de 99% ligado à albumina. Em doses de naproxeno superiores a 500 mg/dia, há um aumento menos que proporcional nos níveis plasmáticos devido a um aumento na depuração causado pela saturação da ligação às proteínas plasmáticas em doses mais altas. No entanto, a concentração de naproxeno não ligado continua a aumentar proporcionalmente à dose. Os comprimidos de NAPRELAN apresentam características de proporcionalidade de dose semelhantes.
Eliminação
Metabolismo
O naproxeno é extensivamente metabolizado em 6-0-desmetil naproxeno e tanto o progenitor quanto os metabólitos não induzem enzimas metabolizadoras.
Excreção
meia-vida de eliminação de NAPRELAN 500mg comprimidos e naproxeno convencional é de aproximadamente 15 horas. As condições de estado estacionário são alcançadas após 2 a 3 doses de NAPRELAN Tablets. A maior parte da droga é excretada na urina, principalmente como naproxeno inalterado (menos de 1%), 6-0-desmetil naproxeno (menos de 1%) e seus glicuronídeos ou outros conjugados (66 a 92%). Uma pequena quantidade (
Populações Específicas
Pediátrico
Não foram realizados estudos pediátricos com NAPRELAN 500mg comprimidos, portanto a segurança de NAPRELAN 500mg comprimidos em populações pediátricas não foi estabelecida.
Insuficiência hepática
doença hepática alcoólica crônica e provavelmente outras doenças com proteínas plasmáticas diminuídas ou anormais (albumina) reduzem a concentração plasmática total de naproxeno, mas a concentração plasmática de naproxeno não ligado é aumentada. Recomenda-se precaução quando são necessárias doses elevadas e pode ser necessário algum ajuste da dose nestes doentes. É prudente usar a menor dose eficaz.
Insuficiência renal
A farmacocinética do naproxeno não foi determinada em indivíduos com insuficiência renal. Dado que o naproxeno é metabolizado e os conjugados são excretados principalmente pelos rins, existe o potencial de acúmulo de metabólitos do naproxeno na presença de insuficiência renal. A eliminação do naproxeno é diminuída em pacientes com insuficiência renal grave. Produtos contendo naproxeno não são recomendados para uso em pacientes com insuficiência renal moderada a grave e grave (clearance de creatinina AVISOS E PRECAUÇÕES ].
Estudos de interação medicamentosa
Aspirina
Quando os AINEs foram administrados com aspirina, a ligação proteica dos AINEs foi reduzida, embora a depuração do AINE livre não tenha sido alterada. O significado clínico desta interação não é conhecido. Consulte a Tabela 1 para interações medicamentosas clinicamente significativas de AINEs com aspirina [consulte INTERAÇÕES MEDICAMENTOSAS ].
Estudos clínicos
Artrite reumatoide
O uso de NAPRELAN 500mg comprimidos para o manejo dos sinais e sintomas da artrite reumatoide foi avaliado em um estudo duplo-cego, randomizado, controlado por placebo e ativo de 12 semanas em 348 pacientes. Dois comprimidos de NAPRELAN 500 mg (1.000 mg) uma vez ao dia e naproxeno 500 mg comprimidos duas vezes ao dia (1.000 mg) foram mais eficazes do que o placebo. A eficácia clínica foi demonstrada em uma semana e continuou durante o estudo.
Osteoartrite
uso de NAPRELAN Tablets para o tratamento dos sinais e sintomas da osteoartrite do joelho foi avaliado em um estudo duplo-cego, placebo e ativo controlado de 12 semanas em 347 pacientes. Dois comprimidos de NAPRELAN 500 mg (1.000 mg) uma vez ao dia e naproxeno 500 mg comprimidos duas vezes ao dia (1.000 mg) foram mais eficazes do que o placebo. A eficácia clínica foi demonstrada em uma semana e continuou durante o estudo.
Analgesia
início do efeito analgésico dos comprimidos de NAPRELAN foi observado em 30 minutos em um estudo farmacocinético/farmacodinâmico de pacientes com dor após cirurgia oral. Em ensaios clínicos controlados, o naproxeno foi usado em combinação com ouro, D-penicilamina, metotrexato e corticosteróides. Seu uso em combinação com salicilato não é recomendado porque há evidências de que a aspirina aumenta a taxa de excreção de naproxeno e os dados são inadequados para demonstrar que naproxeno e aspirina produzem maior melhora em relação à alcançada com aspirina sozinha. Além disso, como com outros AINEs, a combinação pode resultar em maior frequência de eventos adversos do que a demonstrada para qualquer um dos produtos isoladamente.
Estudos Especiais
Em um estudo duplo-cego randomizado, de grupos paralelos, 19 indivíduos receberam dois comprimidos de NAPRELAN 500 mg (1.000 mg) uma vez ao dia ou comprimidos de naproxeno 500 mg (1.000 mg) duas vezes ao dia por 7 dias. As pontuações da biópsia da mucosa e as pontuações endoscópicas foram menores nos indivíduos que receberam os comprimidos de NAPRELAN. Em outro estudo duplo-cego, randomizado e cruzado, 23 indivíduos receberam dois comprimidos de NAPRELAN 500 mg (1.000 mg) uma vez ao dia, naproxeno 500 mg comprimidos (1.000 mg) duas vezes ao dia e aspirina 650 mg quatro vezes ao dia (2.600 mg) por 7 dias cada. Houve significativamente menos erosões duodenais observadas com os comprimidos de NAPRELAN do que com naproxeno ou aspirina. Houve significativamente menos erosões gástricas com ambos os comprimidos de NAPRELAN e naproxeno do que com aspirina. O significado clínico destes resultados é desconhecido.
INFORMAÇÃO DO PACIENTE
Guia de Medicação para Anti-inflamatórios Não Esteroides (AINEs)
Qual é a informação mais importante que devo saber sobre medicamentos chamados anti-inflamatórios não esteroides (AINEs)?
Os AINEs podem causar efeitos colaterais graves, incluindo:
- Aumento do risco de ataque cardíaco ou acidente vascular cerebral que pode levar à morte. Este risco pode ocorrer no início do tratamento e pode aumentar:
- com doses crescentes de AINEs
- com uso mais prolongado de AINEs
Não tome AINEs imediatamente antes ou após uma cirurgia cardíaca chamada “enxerto de revascularização miocárdica (CRM).“ Evite tomar AINEs após um ataque cardíaco recente, a menos que seu médico lhe diga para fazê-lo. Você pode ter um risco aumentado de outro ataque cardíaco se tomar AINEs após um ataque cardíaco recente.
- Aumento do risco de sangramento, úlceras e lágrimas (perfuração) do esôfago (tubo que vai da boca ao estômago), estômago e intestinos:
- a qualquer momento durante o uso
- sem sintomas de alerta
- que pode causar a morte
O risco de ter uma úlcera ou sangramento aumenta com:
- história pregressa de úlceras estomacais ou sangramento estomacal ou intestinal com uso de AINEs
- tomar medicamentos chamados “corticosteróides”, “anticoagulantes”, “SSRIs” ou “SNRIs”
- doses crescentes de AINEs
- idoso
- uso mais prolongado de AINEs
- saúde debilitada
- fumar
- doença hepática avançada
- beber álcool
- problemas de sangramento
Os AINEs só devem ser usados:
- exatamente como prescrito
- na dose mais baixa possível para o seu tratamento
- pelo menor tempo necessário
O que são AINEs?
Os AINEs são usados para tratar dor e vermelhidão, inchaço e calor (inflamação) de condições médicas, como diferentes tipos de artrite, cólicas menstruais e outros tipos de dor de curto prazo.
Quem não deve tomar AINEs?
Não tome AINEs:
- se você teve um ataque de asma, urticária ou outra reação alérgica com aspirina ou qualquer outro AINE.
- imediatamente antes ou após a cirurgia de bypass cardíaco.
Antes de tomar AINEs, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem problemas de fígado ou rins
- tem pressão alta
- tem asma
- estão grávidas ou planejam engravidar. Tomar AINEs com cerca de 20 semanas de gravidez ou mais tarde pode prejudicar o feto. Se você precisar tomar AINEs por mais de 2 dias quando estiver entre 20 e 30 semanas de gravidez, seu médico pode precisar monitorar a quantidade de líquido no útero ao redor do bebê. Você não deve tomar AINEs após cerca de 30 semanas de gravidez.
- está amamentando ou planeja amamentar.
Informe o seu médico sobre todos os medicamentos que você toma, incluindo medicamentos prescritos ou de venda livre, vitaminas ou suplementos de ervas. Os AINEs e alguns outros medicamentos podem interagir entre si e causar efeitos colaterais graves. Não comece a tomar nenhum medicamento novo sem falar primeiro com o seu médico.
Quais são os possíveis efeitos colaterais dos AINEs?
Os AINEs podem causar efeitos colaterais graves, incluindo:
Consulte “Quais são as informações mais importantes que devo saber sobre medicamentos chamados anti-inflamatórios não esteroides (AINEs)?
- pressão alta nova ou pior
- insuficiência cardíaca
- problemas hepáticos, incluindo insuficiência hepática
- problemas renais, incluindo insuficiência renal
- glóbulos vermelhos baixos (anemia)
- reações cutâneas com risco de vida
- reações alérgicas com risco de vida
Outros efeitos colaterais dos AINEs incluem: dor de estômago, constipação, diarréia, gases, azia, náusea, vômito e tontura.
Obtenha ajuda de emergência imediatamente se tiver algum dos seguintes sintomas:
- falta de ar ou dificuldade para respirar
- fala arrastada
- dor no peito
- inchaço do rosto ou garganta
- fraqueza em uma parte ou lado do seu corpo
Pare de tomar seu AINE e ligue para seu médico imediatamente se tiver algum dos seguintes sintomas:
- náusea
- vômito de sangue
- mais cansado ou mais fraco do que o habitual
- há sangue em seu movimento intestinal ou é preto e pegajoso como alcatrão
- diarréia
- coceira
- ganho de peso incomum
- sua pele ou olhos parecem amarelos
- erupção cutânea ou bolhas com febre
- indigestão ou dor de estômago
- inchaço dos braços, pernas, mãos e pés
- sintomas como os da gripe
Se você tomar muito do seu AINE, ligue para o seu médico ou procure ajuda médica imediatamente.
Estes não são todos os possíveis efeitos colaterais dos AINEs. Para obter mais informações, pergunte ao seu médico ou farmacêutico sobre AINEs.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Outras informações sobre AINEs
- A aspirina é um AINE, mas não aumenta a chance de ataque cardíaco. A aspirina pode causar sangramento no cérebro, estômago e intestinos. A aspirina também pode causar úlceras no estômago e nos intestinos.
- Alguns AINEs são vendidos em doses mais baixas sem receita médica (sem receita). Converse com seu médico antes de usar AINEs de venda livre por mais de 10 dias.
Informações gerais sobre o uso seguro e eficaz de AINEs
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use AINEs para uma condição para a qual não foi prescrito. Não dê AINEs a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Se você quiser mais informações sobre AINEs, fale com seu médico. Você pode pedir ao seu farmacêutico ou profissional de saúde informações sobre AINEs escritas para profissionais de saúde.
Este Guia de Medicação foi aprovado pela Food and Drug Administration dos EUA.
