Neurontin 100mg, 300mg, 400mg, 600mg Gabapentin Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Neurontin e como é usado?
Neurontin 400mg é um medicamento de prescrição usado para tratar os sintomas de dores nos nervos e convulsões. Neurontin pode ser usado sozinho ou com outros medicamentos.
Neurontin é um análogo de GABA, droga antiepiléptica.
Não se sabe se Neurontin é seguro e eficaz em crianças menores de 3 anos.
Quais são os possíveis efeitos colaterais do Neurontin 400mg?
Neurontin pode causar efeitos colaterais graves, incluindo:
- aumento das convulsões
- fraqueza ou cansaço grave
- problemas com equilíbrio ou movimento muscular
- dor de estômago superior
- dor no peito
- tosse nova ou agravada com febre
- Problemas respiratórios
- formigamento ou dormência grave
- Movimento rápido dos olhos
- pouca ou nenhuma micção
- dor ou dificuldade para urinar
- inchaço nos pés ou tornozelos
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Neurontin incluem:
- dor de cabeça
- tontura
- sonolência
- cansaço
- inchaço nas mãos ou pés
- problemas com seus olhos
- problemas de coordenação
- Os efeitos colaterais mais comuns de Neurontin 600mg em crianças incluem:
- febre
- náusea
- vômito
- mudanças de comportamento
- problemas de memória
- dificuldade de concentração
- agindo inquieto, hostil ou agressivo
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Neurontin. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
O ingrediente ativo nas cápsulas, comprimidos e solução oral de NEURONTIN é a gabapentina, que tem o nome químico ácido 1-(aminometil)ciclohexanoacético.
A fórmula molecular da gabapentina é C9H17NO2 e o peso molecular é 171,24. A fórmula estrutural da gabapentina é:
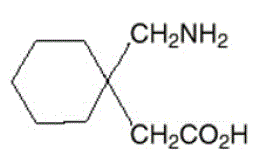
gabapentina é um sólido cristalino branco a esbranquiçado com um pKa1 de 3,7 e um pKa2 de 10,7. É livremente solúvel em água e em soluções aquosas básicas e ácidas. O logaritmo do coeficiente de partição (noctanol/tampão fosfato 0,05M) em pH 7,4 é –1,25.
Cada cápsula de Neurontin 100 mg contém 100 mg, 300 mg ou 400 mg de gabapentina e os seguintes ingredientes inativos: lactose, amido de milho, talco, gelatina, dióxido de titânio, FD&C Blue No. 2, óxido de ferro amarelo (somente 300 mg e 400 mg) e óxido de ferro vermelho (apenas 400 mg).
Cada comprimido de Neurontin contém 600 mg ou 800 mg de gabapentina e os seguintes ingredientes inativos: poloxâmero 407, copovidona, amido de milho, estearato de magnésio, hidroxipropilcelulose, talco e cera de candelila.
Neurontin solução oral contém 250 mg de gabapentina por 5 mL (50 mg por mL) e os seguintes ingredientes inativos: glicerina, xilitol, água purificada e aroma artificial de anis de morango.
INDICAÇÕES
NEURONTIN® é indicado para:
- Manejo da neuralgia pós-herpética em adultos
- Terapia adjuvante no tratamento de crises parciais, com e sem generalização secundária, em adultos e pacientes pediátricos com 3 anos ou mais com epilepsia
DOSAGEM E ADMINISTRAÇÃO
Dosagem para neuralgia pós-herpética
Em adultos com neuralgia pós-herpética, NEURONTIN pode ser iniciado no Dia 1 como uma dose única de 300 mg, no Dia 2 como 600 mg/dia (300 mg duas vezes ao dia) e no Dia 3 como 900 mg/dia (300 mg três vezes ao dia). vezes por dia). A dose pode ser posteriormente titulada conforme necessário para alívio da dor para uma dose de 1800 mg/dia (600 mg três vezes ao dia). Em estudos clínicos, a eficácia foi demonstrada em uma faixa de doses de 1800 mg/dia a 3600 mg/dia com efeitos comparáveis em toda a faixa de dose; entretanto, nesses estudos clínicos, o benefício adicional do uso de doses superiores a 1.800 mg/dia não foi demonstrado.
Dosagem para epilepsia com convulsões de início parcial
Pacientes com 12 anos de idade e acima
dose inicial é de 300 mg três vezes ao dia. A dose de manutenção recomendada de NEURONTIN é de 300 mg a 600 mg três vezes ao dia. Dosagens de até 2.400 mg/dia foram bem toleradas em estudos clínicos de longo prazo. Doses de 3600 mg/dia também foram administradas a um pequeno número de pacientes por um período relativamente curto e foram bem toleradas. Administrar NEURONTIN três vezes ao dia usando cápsulas de 300 mg ou 400 mg ou comprimidos de 600 mg ou 800 mg. O tempo máximo entre as doses não deve exceder 12 horas.
Pacientes pediátricos de 3 a 11 anos
intervalo de dose inicial é de 10 mg/kg/dia a 15 mg/kg/dia, administrado em três doses divididas, e a dose de manutenção recomendada é alcançada por titulação ascendente durante um período de aproximadamente 3 dias. A dose de manutenção recomendada de NEURONTIN em pacientes de 3 a 4 anos de idade é de 40 mg/kg/dia, dividida em três doses. A dose de manutenção recomendada de NEURONTIN 100 mg em pacientes de 5 a 11 anos de idade é de 25 mg/kg/dia a 35 mg/kg/dia, dividida em três doses. NEURONTIN 300mg pode ser administrado como solução oral, cápsula ou comprimido, ou usando combinações dessas formulações. Dosagens de até 50 mg/kg/dia foram bem toleradas em um estudo clínico de longo prazo. O intervalo de tempo máximo entre as doses não deve exceder 12 horas.
Ajuste de Dosagem em Pacientes com Insuficiência Renal
Recomenda-se o ajuste da dose em pacientes com 12 anos de idade ou mais com insuficiência renal ou em hemodiálise, como segue (consulte as recomendações de dosagem acima para doses eficazes em cada indicação):
TABELA 1: Dosagem de NEURONTIN com base na função renal
A depuração de creatinina (CLCr) é difícil de medir em pacientes ambulatoriais. Em pacientes com função renal estável, a depuração de creatinina pode ser razoavelmente bem estimada usando a equação de Cockcroft e Gault:
O uso de NEURONTIN em pacientes com menos de 12 anos de idade com função renal comprometida não foi estudado.
Dosagem em Idosos
Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se ter cuidado na seleção da dose e a dose deve ser ajustada com base nos valores de depuração de creatinina nesses pacientes.
Informações de administração
Administrar NEURONTIN por via oral com ou sem alimentos.
As cápsulas de NEURONTIN 100mg devem ser engolidas inteiras com água.
Informe os pacientes que, caso eles dividam o comprimido de 600 mg ou 800 mg de NEURONTIN para administrar um meio comprimido, eles devem tomar o meio comprimido não utilizado como a próxima dose. Meios comprimidos não utilizados dentro de 28 dias após a divisão do comprimido marcado devem ser descartados.
Se a dose de NEURONTIN for reduzida, descontinuada ou substituída por um medicamento alternativo, isso deve ser feito gradualmente ao longo de no mínimo 1 semana (um período maior pode ser necessário a critério do prescritor).
COMO FORNECIDO
Formas de dosagem e pontos fortes
Cápsulas
- 100 mg: cápsulas de gelatina dura branca impressas com “PD” no corpo e “Neurontin/100 mg” na tampa
- 300 mg: cápsulas de gelatina dura amarela impressas com “PD” no corpo e “Neurontin/300 mg” na tampa
- 400 mg: cápsulas de gelatina dura laranja impressas com “PD” no corpo e “Neurontin/400 mg” na tampa
Comprimidos
- 600 mg: comprimidos revestidos por película brancos elípticos gravados com “NT” e “16” numa das faces
- 800 mg: comprimidos revestidos por película brancos elípticos gravados com “NT” e “26” numa das faces
Solução oral
- 250 mg por 5 mL (50 mg por mL), solução límpida incolor a ligeiramente amarela
Armazenamento e manuseio
NEURONTIN (gabapentina) cápsulas, comprimidos e solução oral são fornecidos da seguinte forma:
Cápsulas de 100 mg
Cápsulas de gelatina dura branca impressas com “PD” no corpo e “Neurontin/100 mg” na tampa; disponível em:
Garrafas de 100: NDC 0071-0803-24
Cápsulas de 300 mg
Cápsulas de gelatina dura amarelas impressas com “PD” no corpo e “Neurontin/300 mg” na tampa; disponível em:
Garrafas de 100: NDC 0071-0805-24 Dose unitária 50's: NDC 0071-0805-40
Cápsulas de 400 mg
Cápsulas de gelatina dura laranja impressas com “PD” no corpo e “Neurontin/400 mg” na tampa; disponível em:
Garrafas de 100: NDC 0071-0806-24 Dose unitária 50's: NDC 0071-0806-40
Comprimidos de 600 mg
Comprimidos revestidos por película elípticos brancos com ranhuras gravadas com “NT” e “16” numa das faces; disponível em:
Garrafas de 100: NDC 0071-0513-24
Comprimidos de 800 mg
Comprimidos revestidos por película elípticos brancos com a gravação “NT” e “26” numa das faces; disponível em:
Garrafas de 100: NDC 0071-0401-24
250 mg por 5 mL de solução oral
Solução límpida incolor a levemente amarelada; cada 5 mL de solução oral contém 250 mg de gabapentina; disponível em:
Frascos de vidro contendo 470 mL: NDC 0071-2012-23 Frascos contendo 470 mL: NDC 0071-2012-44
Armazene os comprimidos e cápsulas de NEURONTIN 400mg a 25°C (77°F); excursões permitidas entre 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada USP ].
Armazene a Solução Oral NEURONTIN refrigerada, de 2°C a 8°C (36°F a 46°F).
Distribuído por: Parke-Davis, Division of Pfizer Inc., NY, NY 10017. Revisado: dezembro de 2020
EFEITOS COLATERAIS
As seguintes reações adversas graves são discutidas em mais detalhes em outras seções:
- Reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS)/hipersensibilidade multiorgânica [ver AVISOS E PRECAUÇÕES ]
- Anafilaxia e angioedema [ver AVISOS E PRECAUÇÕES ]
- Sonolência/Sedação e Tonturas [ver AVISOS E PRECAUÇÕES ]
- Convulsão Precipitada de Retirada, Status Epilepticus [ver AVISOS E PRECAUÇÕES ]
- Comportamento Suicida e Ideação [ver AVISOS E PRECAUÇÕES ]
- Depressão Respiratória [ver AVISOS E PRECAUÇÕES ]
- Reações Adversas Neuropsiquiátricas (Pacientes Pediátricos de 3 a 12 Anos de Idade) [ver AVISOS E PRECAUÇÕES ]
- Morte súbita e inexplicada em pacientes com epilepsia [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Neuralgia pós-herpética
As reações adversas mais comuns associadas ao uso de NEURONTIN em adultos, não observadas em uma frequência equivalente entre os pacientes tratados com placebo, foram tontura, sonolência e edema periférico.
Nos 2 ensaios controlados em neuralgia pós-herpética, 16% dos 336 pacientes que receberam NEURONTIN e 9% dos 227 pacientes que receberam placebo interromperam o tratamento devido a uma reação adversa. As reações adversas que mais frequentemente levaram à retirada em pacientes tratados com NEURONTIN foram tontura, sonolência e náusea.
A Tabela 3 lista as reações adversas que ocorreram em pelo menos 1% dos pacientes tratados com NEURONTIN com neuralgia pós-herpética que participaram de estudos controlados por placebo e que foram numericamente mais frequentes no grupo NEURONTIN do que no grupo placebo.
TABELA 3: Reações Adversas em Ensaios Agrupados Controlados por Placebo em Neuralgia Pós-herpética
Outras reações em mais de 1% dos pacientes, mas igualmente ou mais frequentes no grupo placebo, incluíram dor, tremor, neuralgia, dor nas costas, dispepsia, dispneia e síndrome gripal.
Não houve diferenças clinicamente importantes entre homens e mulheres nos tipos e incidência de reações adversas. Como houve poucos pacientes cuja raça foi relatada como diferente da branca, não há dados suficientes para apoiar uma afirmação sobre a distribuição de reações adversas por raça.
Epilepsia com Convulsões de Início Parcial (Terapia Adjunta)
As reações adversas mais comuns com NEURONTIN 300mg em combinação com outras drogas antiepilépticas em pacientes >12 anos de idade, não observadas em uma frequência equivalente entre os pacientes tratados com placebo, foram sonolência, tontura, ataxia, fadiga e nistagmo.
As reações adversas mais comuns com NEURONTIN em combinação com outras drogas antiepilépticas em pacientes pediátricos de 3 a 12 anos de idade, não observadas em igual frequência entre os pacientes tratados com placebo, foram infecção viral, febre, náusea e/ou vômito, sonolência e hostilidade [ver AVISOS E PRECAUÇÕES ].
Aproximadamente 7% dos 2.074 pacientes >12 anos de idade e aproximadamente 7% dos 449 pacientes pediátricos de 3 a 12 anos de idade que receberam NEURONTIN em estudos clínicos pré-comercialização descontinuaram o tratamento devido a uma reação adversa. As reações adversas mais comumente associadas à retirada em pacientes >12 anos de idade foram sonolência (1,2%), ataxia (0,8%), fadiga (0,6%), náusea e/ou vômito (0,6%) e tontura (0,6%) . As reações adversas mais comumente associadas à retirada em pacientes pediátricos foram labilidade emocional (1,6%), hostilidade (1,3%) e hipercinesia (1,1%).
A Tabela 4 lista as reações adversas que ocorreram em pelo menos 1% dos pacientes tratados com NEURONTIN >12 anos de idade com epilepsia participando de estudos controlados por placebo e foram numericamente mais comuns no grupo NEURONTIN. Nesses estudos, NEURONTIN 300mg ou placebo foi adicionado à terapia antiepiléptica atual do paciente.
TABELA 4: Reações Adversas em Ensaios Complementares Agrupados Controlados por Placebo em Pacientes com Epilepsia >12 anos de Idade
Entre as reações adversas que ocorrem com uma incidência de pelo menos 10% em pacientes tratados com NEURONTIN, sonolência e ataxia parecem apresentar uma relação dose-resposta positiva.
A incidência geral de reações adversas e os tipos de reações adversas observadas foram semelhantes entre homens e mulheres tratados com NEURONTIN. A incidência de reações adversas aumentou ligeiramente com o aumento da idade em pacientes tratados com NEURONTIN ou placebo. Como apenas 3% dos pacientes (28/921) em estudos controlados com placebo foram identificados como não brancos (negros ou outros), não há dados suficientes para apoiar uma afirmação sobre a distribuição de reações adversas por raça.
Tabela 5 lista as reações adversas que ocorreram em pelo menos 2% dos pacientes tratados com NEURONTIN, de 3 a 12 anos de idade com epilepsia participando de estudos controlados por placebo, e que foram numericamente mais comuns no grupo NEURONTIN.
TABELA 5: Reações adversas em um estudo complementar controlado por placebo em pacientes com epilepsia pediátrica de 3 a 12 anos
Outras reações em mais de 2% dos pacientes pediátricos de 3 a 12 anos de idade, mas igualmente ou mais frequentes no grupo placebo, incluíram: faringite, infecção respiratória superior, cefaleia, rinite, convulsões, diarreia, anorexia, tosse e otite média.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-comercialização de NEURONTIN. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Distúrbios hepatobiliares: icterícia
Investigações: creatina quinase elevada, testes de função hepática elevados
Distúrbios do metabolismo e da nutrição: hiponatremia
Distúrbios musculoesqueléticos e do tecido conjuntivo: rabdomiólise
Distúrbios do sistema nervoso: distúrbio do movimento
Distúrbios psiquiátricos: agitação
Distúrbios do sistema reprodutor e da mama: aumento da mama, alterações na libido, distúrbios da ejaculação e anorgasmia
Distúrbios da pele e tecidos subcutâneos: angioedema [ver AVISOS E PRECAUÇÕES ], penfigóide bolhoso, eritema multiforme, síndrome de Stevens-Johnson.
Existem relatos pós-comercialização de depressão respiratória fatal ou com risco de vida em pacientes tomando NEURONTIN com opióides ou outros depressores do SNC, ou no contexto de insuficiência respiratória subjacente [ver AVISOS E PRECAUÇÕES ].
Reações adversas após a descontinuação abrupta da gabapentina também foram relatadas. As reações mais frequentemente relatadas foram ansiedade, insônia, náusea, dor e sudorese.
INTERAÇÕES MEDICAMENTOSAS
Opióides
Depressão respiratória e sedação, às vezes resultando em morte, foram relatadas após a coadministração de gabapentina com opioides (por exemplo, morfina, hidrocodona, oxicodona, buprenorfina) [ver AVISOS E PRECAUÇÕES ].
Hidrocodona
A coadministração de NEURONTIN 300mg com hidrocodona diminui a exposição à hidrocodona [ver FARMACOLOGIA CLÍNICA ]. O potencial de alteração na exposição e efeito da hidrocodona deve ser considerado quando NEURONTIN 100 mg é iniciado ou descontinuado em um paciente tomando hidrocodona.
Morfina
Quando a gabapentina é administrada com morfina, os pacientes devem ser observados quanto a sinais de depressão do SNC, como sonolência, sedação e depressão respiratória. FARMACOLOGIA CLÍNICA ].
Outras drogas antiepilépticas
A gabapentina não é metabolizada de forma apreciável nem interfere com o metabolismo de drogas antiepilépticas comumente coadministradas. FARMACOLOGIA CLÍNICA ].
Maalox® (hidróxido de alumínio, hidróxido de magnésio)
biodisponibilidade média da gabapentina foi reduzida em cerca de 20% com o uso concomitante de um antiácido (Maalox) contendo hidróxidos de magnésio e alumínio. Recomenda-se que a gabapentina seja tomada pelo menos 2 horas após a administração de Maalox [ver FARMACOLOGIA CLÍNICA ].
Interações Medicamentos/Testes Laboratoriais
Como leituras falso-positivas foram relatadas com o teste de fita reagente Ames N-Multistix SG para proteína urinária quando a gabapentina foi adicionada a outras drogas antiepilépticas, o procedimento de precipitação com ácido sulfossalicílico mais específico é recomendado para determinar a presença de proteína na urina.
Abuso e Dependência de Drogas
Substância controlada
A gabapentina não é um medicamento programado.
Abuso
Abuso é o uso intencional e não terapêutico de uma droga, mesmo que uma vez, por seus efeitos psicológicos ou fisiológicos desejáveis. O uso indevido é o uso intencional, para fins terapêuticos, de um medicamento por um indivíduo de forma diferente da prescrita por um profissional de saúde ou para quem não foi prescrito.
gabapentina não apresenta afinidade para receptores de benzodiazepínicos, opióides (mu, delta ou kappa) ou canabinóides 1. O uso indevido e abuso de gabapentina foram relatados no cenário pós-comercialização e na literatura publicada. A maioria dos indivíduos descritos nesses relatos tinha histórico de abuso de polisubstâncias. Alguns desses indivíduos estavam tomando doses de gabapentina mais altas do que as recomendadas para usos não aprovados. Ao prescrever NEURONTIN, avalie cuidadosamente os pacientes quanto a um histórico de abuso de drogas e observe-os quanto a sinais e sintomas de uso indevido ou abuso de gabapentina (por exemplo, aumento da autodose e comportamento de busca de drogas). O potencial de abuso da gabapentina não foi avaliado em estudos em humanos.
Dependência
dependência física é um estado que se desenvolve como resultado da adaptação fisiológica em resposta ao uso repetido da droga, manifestada por sinais e sintomas de abstinência após interrupção abrupta ou redução significativa da dose de uma droga. Existem raros relatos pós-comercialização de indivíduos que apresentam sintomas de abstinência logo após a descontinuação de doses superiores às recomendadas de gabapentina usadas para tratar doenças para as quais o medicamento não foi aprovado. Tais sintomas incluíram agitação, desorientação e confusão após a interrupção repentina da gabapentina que se resolveu após o reinício da gabapentina. O potencial de dependência da gabapentina não foi avaliado em estudos em humanos.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS)/hipersensibilidade multiorgânica
Reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS), também conhecida como hipersensibilidade de múltiplos órgãos, ocorreu com NEURONTIN. Algumas dessas reações foram fatais ou com risco de vida. O DRESS tipicamente, embora não exclusivamente, apresenta-se com febre, erupção cutânea e/ou linfadenopatia, em associação com o envolvimento de outros órgãos, como hepatite, nefrite, anormalidades hematológicas, miocardite ou miosite, às vezes lembrando uma infecção viral aguda. A eosinofilia está frequentemente presente. Esse distúrbio é variável em sua expressão, e outros sistemas orgânicos não mencionados aqui podem estar envolvidos.
É importante notar que manifestações precoces de hipersensibilidade, como febre ou linfadenopatia, podem estar presentes, mesmo que a erupção não seja evidente. Se tais sinais ou sintomas estiverem presentes, o paciente deve ser avaliado imediatamente. NEURONTIN deve ser descontinuado se uma etiologia alternativa para os sinais ou sintomas não puder ser estabelecida.
Anafilaxia e angioedema
NEURONTIN pode causar anafilaxia e angioedema após a primeira dose ou a qualquer momento durante o tratamento. Sinais e sintomas em casos relatados incluem dificuldade em respirar, inchaço dos lábios, garganta e língua e hipotensão que requer tratamento de emergência. Os pacientes devem ser instruídos a descontinuar NEURONTIN 300mg e procurar atendimento médico imediato caso apresentem sinais ou sintomas de anafilaxia ou angioedema.
Efeitos na condução e operação de máquinas pesadas
Os doentes a tomar NEURONTIN não devem conduzir até adquirirem experiência suficiente para avaliar se NEURONTIN 100 mg prejudica a sua capacidade de conduzir. Estudos de desempenho de direção conduzidos com um pró-fármaco de gabapentina (gabapentina enacarbil comprimido, liberação prolongada) indicam que a gabapentina pode causar comprometimento significativo da direção. Os prescritores e os pacientes devem estar cientes de que os pacientes' capacidade de avaliar sua própria competência de condução, bem como sua capacidade de avaliar o grau de sonolência causada por NEURONTIN, pode ser imperfeita. A duração do comprometimento da direção após o início da terapia com NEURONTIN 300mg é desconhecida. Se a deficiência está relacionada à sonolência [ver AVISOS E PRECAUÇÕES ] ou outros efeitos de NEURONTIN é desconhecido.
Além disso, como NEURONTIN 300mg causa sonolência e tontura [ver AVISOS E PRECAUÇÕES ], os pacientes devem ser aconselhados a não operar máquinas complexas até que tenham adquirido experiência suficiente com NEURONTIN para avaliar se NEURONTIN 300mg prejudica sua capacidade de realizar tais tarefas.
Sonolência/Sedação e tontura
Durante os ensaios controlados de epilepsia em pacientes com mais de 12 anos de idade recebendo doses de NEURONTIN 100 mg até 1800 mg por dia, sonolência, tontura e ataxia foram relatados em uma taxa maior em pacientes que receberam NEURONTIN em comparação com placebo: ou seja, 19% no medicamento versus 9% no placebo para sonolência, 17% no medicamento versus 7% no placebo para tontura e 13% no medicamento versus 6% no placebo para ataxia. Nesses estudos, sonolência, ataxia e fadiga foram reações adversas comuns que levaram à descontinuação de NEURONTIN em pacientes com mais de 12 anos de idade, com 1,2%, 0,8% e 0,6% descontinuando por esses eventos, respectivamente.
Durante os estudos controlados em pacientes com neuralgia pós-herpética, sonolência e tontura foram relatados em uma taxa maior em comparação com placebo em pacientes recebendo NEURONTIN, em doses de até 3600 mg por dia: ou seja, 21% em pacientes tratados com NEURONTIN versus 5 % em pacientes tratados com placebo para sonolência e 28% em pacientes tratados com NEURONTIN versus 8% em pacientes tratados com placebo para tontura. Tonturas e sonolência estavam entre as reações adversas mais comuns que levaram à descontinuação de NEURONTIN.
Os pacientes devem ser cuidadosamente observados quanto a sinais de depressão do sistema nervoso central (SNC), como sonolência e sedação, quando NEURONTIN 400mg é usado com outros medicamentos com propriedades sedativas devido à potencial sinergia. Além disso, os pacientes que necessitam de tratamento concomitante com morfina podem apresentar aumentos nas concentrações de gabapentina e podem necessitar de ajuste de dose. INTERAÇÕES MEDICAMENTOSAS ].
Convulsão Precipitada de Retirada, Status Epilepticus
As drogas antiepilépticas não devem ser descontinuadas abruptamente devido à possibilidade de aumentar a frequência das crises.
Nos estudos de epilepsia controlados por placebo em pacientes >12 anos de idade, a incidência de estado de mal epiléptico em pacientes que receberam NEURONTIN foi de 0,6% (3 de 543) versus 0,5% em pacientes que receberam placebo (2 de 378). Entre os 2.074 pacientes >12 anos de idade tratados com NEURONTIN 300mg em todos os estudos de epilepsia (controlados e não controlados), 31 (1,5%) apresentavam estado de mal epiléptico. Destes, 14 pacientes não tinham história prévia de estado de mal epiléptico antes do tratamento ou durante o uso de outros medicamentos. Como os dados históricos adequados não estão disponíveis, é impossível dizer se o tratamento com NEURONTIN está ou não associado a uma taxa de status epilepticus mais alta ou mais baixa do que seria esperado que ocorresse em uma população semelhante não tratada com NEURONTIN.
Comportamento Suicida e Ideação
Medicamentos antiepilépticos (DAEs), incluindo NEURONTIN 100mg, aumentam o risco de pensamentos ou comportamentos suicidas em pacientes que tomam esses medicamentos para qualquer indicação. Pacientes tratados com qualquer DEA para qualquer indicação devem ser monitorados quanto ao surgimento ou agravamento de depressão, pensamentos ou comportamento suicida e/ou quaisquer alterações incomuns no humor ou comportamento.
Análises combinadas de 199 ensaios clínicos controlados por placebo (terapia mono e adjuvante) de 11 DEAs diferentes mostraram que os pacientes randomizados para um dos DEAs tinham aproximadamente o dobro do risco (Risco Relativo ajustado 1,8, IC 95%:1,2, 2,7) de suicídio pensamento ou comportamento em comparação com pacientes randomizados para placebo. Nestes ensaios, que tiveram uma duração média de tratamento de 12 semanas, a taxa de incidência estimada de comportamento suicida ou ideação entre 27.863 pacientes tratados com AED foi de 0,43%, em comparação com 0,24% entre 16.029 pacientes tratados com placebo, representando um aumento de aproximadamente um caso de pensamento ou comportamento suicida para cada 530 pacientes tratados. Houve quatro suicídios em pacientes tratados com drogas nos ensaios e nenhum em pacientes tratados com placebo, mas o número é muito pequeno para permitir qualquer conclusão sobre o efeito da droga no suicídio.
risco aumentado de pensamentos ou comportamentos suicidas com AEDs foi observado uma semana após o início do tratamento medicamentoso com AEDs e persistiu durante o tratamento avaliado. Como a maioria dos estudos incluídos na análise não se estendeu além de 24 semanas, o risco de pensamentos ou comportamentos suicidas além de 24 semanas não pôde ser avaliado.
O risco de pensamentos ou comportamentos suicidas foi geralmente consistente entre as drogas nos dados analisados. A descoberta de risco aumentado com DAEs de mecanismos de ação variados e em uma variedade de indicações sugere que o risco se aplica a todos os AEDs usados para qualquer indicação. O risco não variou substancialmente por idade (5-100 anos) nos ensaios clínicos analisados. A Tabela 2 mostra o risco absoluto e relativo por indicação para todos os DEAs avaliados.
TABELA 2: Risco por indicação de drogas antiepilépticas na análise combinada
risco relativo de pensamentos ou comportamentos suicidas foi maior em ensaios clínicos para epilepsia do que em ensaios clínicos para doenças psiquiátricas ou outras, mas as diferenças de risco absoluto foram semelhantes para epilepsia e indicações psiquiátricas.
Qualquer pessoa que considere prescrever NEURONTIN 100mg ou qualquer outro DEA deve equilibrar o risco de pensamentos ou comportamentos suicidas com o risco de doença não tratada. A epilepsia e muitas outras doenças para as quais os DEAs são prescritos estão associadas à morbidade e mortalidade e a um risco aumentado de pensamentos e comportamentos suicidas. Caso pensamentos e comportamentos suicidas surjam durante o tratamento, o prescritor precisa considerar se o surgimento desses sintomas em um determinado paciente pode estar relacionado à doença que está sendo tratada.
Pacientes, seus cuidadores e familiares devem ser informados de que os DEAs aumentam o risco de pensamentos e comportamentos suicidas e devem ser alertados sobre a necessidade de estar alerta para o surgimento ou agravamento dos sinais e sintomas de depressão, quaisquer alterações incomuns de humor ou comportamento , ou o surgimento de pensamentos suicidas, comportamento ou pensamentos sobre automutilação. Comportamentos preocupantes devem ser relatados imediatamente aos profissionais de saúde.
Depressão respiratória
Há evidências de relatos de casos, estudos em humanos e estudos em animais que associam a gabapentina a depressão respiratória grave, com risco de vida ou fatal quando coadministrada com depressores do SNC, incluindo opioides, ou no contexto de insuficiência respiratória subjacente. Quando for tomada a decisão de co-prescrever NEURONTIN 100mg com outro depressor do SNC, particularmente um opióide, ou prescrever NEURONTIN 100mg a pacientes com insuficiência respiratória subjacente, monitore os pacientes quanto a sintomas de depressão respiratória e sedação e considere iniciar NEURONTIN em dose baixa . O manejo da depressão respiratória pode incluir observação cuidadosa, medidas de suporte e redução ou retirada de depressores do SNC (incluindo NEURONTIN).
Reações Adversas Neuropsiquiátricas (Pacientes Pediátricos de 3 a 12 Anos de Idade)
uso de gabapentina em pacientes pediátricos com epilepsia de 3 a 12 anos de idade está associado à ocorrência de reações adversas relacionadas ao SNC. Os mais significativos podem ser classificados nas seguintes categorias: 1) labilidade emocional (principalmente problemas comportamentais), 2) hostilidade, incluindo comportamentos agressivos, 3) transtorno de pensamento, incluindo problemas de concentração e mudança no desempenho escolar e 4) hipercinesia ( principalmente inquietação e hiperatividade). Entre os pacientes tratados com gabapentina, a maioria das reações foi de intensidade leve a moderada.
Em ensaios clínicos controlados de epilepsia em pacientes pediátricos de 3 a 12 anos de idade, a incidência dessas reações adversas foi: labilidade emocional 6% (pacientes tratados com gabapentina) versus 1,3% (pacientes tratados com placebo); hostilidade 5,2% versus 1,3%; hipercinesia 4,7% versus 2,9%; e transtorno do pensamento 1,7% versus 0%. Uma dessas reações, um relato de hostilidade, foi considerada grave. A descontinuação do tratamento com gabapentina ocorreu em 1,3% dos pacientes que relataram labilidade emocional e hipercinesia e 0,9% dos pacientes tratados com gabapentina relataram hostilidade e transtorno do pensamento. Um paciente tratado com placebo (0,4%) desistiu devido à labilidade emocional.
Potencial tumorigênico
Em um estudo de carcinogenicidade oral, a gabapentina aumentou a incidência de tumores de células acinares pancreáticas em ratos. Toxicologia não clínica ]. O significado clínico deste achado é desconhecido. A experiência clínica durante o desenvolvimento pré-comercialização da gabapentina não fornece meios diretos para avaliar seu potencial para induzir tumores em humanos.
Em estudos clínicos em terapia adjuvante na epilepsia compreendendo 2.085 pacientes-ano de exposição em pacientes >12 anos de idade, novos tumores foram relatados em 10 pacientes (2 de mama, 3 de cérebro, 2 de pulmão, 1 adrenal, 1 não Hodgkin' s, 1 carcinoma endometrial in situ) e tumores preexistentes pioraram em 11 pacientes (9 cérebro, 1 mama, 1 próstata) durante ou até 2 anos após a descontinuação de NEURONTIN. Sem o conhecimento da incidência e recorrência em uma população semelhante não tratada com NEURONTIN 100mg, é impossível saber se a incidência observada nesta coorte é ou não afetada pelo tratamento.
Morte súbita e inexplicável em pacientes com epilepsia
Durante o desenvolvimento pré-comercialização de NEURONTIN 400mg, 8 mortes súbitas e inexplicáveis foram registradas em uma coorte de 2.203 pacientes com epilepsia tratados (2.103 pacientes-ano de exposição) com NEURONTIN.
Algumas delas podem representar mortes relacionadas a convulsões nas quais a convulsão não foi observada, por exemplo, à noite. Isso representa uma incidência de 0,0038 óbitos por paciente-ano. Embora essa taxa exceda o esperado em uma população saudável pareada por idade e sexo, está dentro da faixa de estimativas para a incidência de mortes súbitas inexplicadas em pacientes com epilepsia que não recebem NEURONTIN (variando de 0,0005 para a população geral de epilépticos a 0,003 para uma população de ensaio clínico semelhante à do programa NEURONTIN, para 0,005 para pacientes com epilepsia refratária). Consequentemente, se esses números são tranquilizadores ou aumentam a preocupação depende da comparabilidade das populações relatadas à coorte NEURONTIN e da precisão das estimativas fornecidas.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação ).
Informações de administração
Informe os pacientes que NEURONTIN é tomado por via oral com ou sem alimentos. Informar os pacientes que, caso eles dividam o comprimido de 600 mg ou 800 mg marcado para administrar um meio comprimido, eles devem tomar o meio comprimido não utilizado como a próxima dose. Aconselhe os pacientes a descartar metades dos comprimidos não utilizados dentro de 28 dias após a divisão do comprimido marcado.
Reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS)/hipersensibilidade multiorgânica
Antes de iniciar o tratamento com NEURONTIN, instrua os pacientes que uma erupção cutânea ou outros sinais ou sintomas de hipersensibilidade (como febre ou linfadenopatia) podem indicar um evento médico grave e que o paciente deve relatar qualquer ocorrência a um médico imediatamente [ver AVISOS E PRECAUÇÕES ].
Anafilaxia e angioedema
Aconselhe os pacientes a descontinuar NEURONTIN 300mg e procurar atendimento médico se desenvolverem sinais ou sintomas de anafilaxia ou angioedema [ver AVISOS E PRECAUÇÕES ].
Tonturas e sonolência e efeitos na condução e operação de máquinas pesadas
Avise os pacientes que NEURONTIN 100mg pode causar tontura, sonolência e outros sintomas e sinais de depressão do SNC. Outros medicamentos com propriedades sedativas podem aumentar esses sintomas. Assim, embora os pacientes' capacidade de determinar seu nível de deficiência pode não ser confiável, aconselhe-os a não dirigir um carro nem operar outras máquinas complexas até que tenham adquirido experiência suficiente com NEURONTIN para avaliar se isso afeta negativamente seu desempenho mental e/ou motor. Informe os pacientes que não se sabe quanto tempo esse efeito dura [ver AVISOS E PRECAUÇÕES e AVISOS E PRECAUÇÕES ].
Pensamento e comportamento suicida
Aconselhe o paciente, seus cuidadores e familiares que os DEAs, incluindo NEURONTIN, podem aumentar o risco de pensamentos e comportamentos suicidas. Aconselhar os pacientes sobre a necessidade de estar alerta para o surgimento ou agravamento dos sintomas de depressão, quaisquer alterações incomuns no humor ou comportamento, ou o surgimento de pensamentos suicidas, comportamento ou pensamentos sobre automutilação. Instrua os pacientes a relatar comportamentos preocupantes imediatamente aos profissionais de saúde [ver AVISOS E PRECAUÇÕES ].
Depressão respiratória
Informar os pacientes sobre o risco de depressão respiratória. Inclua informações de que o risco é maior para aqueles que usam concomitantemente depressores do SNC (como analgésicos opióides) ou aqueles com insuficiência respiratória subjacente. Ensine os pacientes a reconhecer a depressão respiratória e aconselhe-os a procurar atendimento médico imediatamente se ocorrer [ver AVISOS E PRECAUÇÕES ].
Uso na gravidez
Instrua as pacientes a notificarem seu médico se engravidarem ou pretendem engravidar durante a terapia e notificarem seu médico se estiverem amamentando ou pretendem amamentar durante a terapia [ver Uso em populações específicas ].
Incentive as pacientes a se inscreverem no NAAED Pregnancy Registry se ficarem grávidas. Este registro está coletando informações sobre a segurança dos medicamentos antiepilépticos durante a gravidez. Para se inscrever, os pacientes podem ligar para o número gratuito 1-888-233-2334 [consulte Uso em populações específicas ].
A rotulagem deste produto pode ter sido atualizada. Para obter as informações de prescrição mais recentes, visite www.pfizer.com.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
gabapentina foi administrada oralmente a camundongos e ratos em estudos de carcinogenicidade de 2 anos. Nenhuma evidência de carcinogenicidade relacionada à droga foi observada em camundongos tratados com doses de até 2.000 mg/kg/dia. A 2.000 mg/kg, a exposição à gabapentina plasmática (AUC) em camundongos foi aproximadamente 2 vezes maior do que em humanos na MRHD de 3.600 mg/dia. Em ratos, foram encontrados aumentos na incidência de adenoma e carcinoma de células acinares pancreáticas em ratos machos que receberam a dose mais alta (2.000 mg/kg), mas não em doses de 250 ou 1.000 mg/kg/dia. A 1.000 mg/kg, a exposição à gabapentina plasmática (AUC) em ratos foi aproximadamente 5 vezes maior do que em humanos na MRHD.
Estudos desenhados para investigar o mecanismo de carcinogênese pancreática induzida por gabapentina em ratos indicam que a gabapentina estimula a síntese de DNA em células acinares pancreáticas de ratos in vitro e, assim, pode estar atuando como promotor tumoral, aumentando a atividade mitogênica. Não se sabe se a gabapentina tem a capacidade de aumentar a proliferação celular em outros tipos de células ou em outras espécies, incluindo humanos.
Mutagênese
A gabapentina não demonstrou potencial mutagênico ou genotóxico in vitro (teste de Ames, ensaio de mutação direta HGPRT em células pulmonares de hamster chinês) e in vivo (aberração cromossômica e teste de micronúcleo em medula óssea de hamster chinês, micronúcleo de camundongo, síntese de DNA não programada em hepatócitos de rato) ensaios.
Prejuízo da Fertilidade
Não foram observados efeitos adversos na fertilidade ou na reprodução em ratos com doses de até 2.000 mg/kg. A 2.000 mg/kg, a exposição à gabapentina plasmática (AUC) em ratos é aproximadamente 8 vezes maior do que em humanos na MRHD.
Uso em populações específicas
Gravidez
Registro de Exposição à Gravidez
Existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas a drogas antiepilépticas (DAEs), como NEURONTIN 300mg, durante a gravidez. Incentive as mulheres que estão tomando NEURONTIN durante a gravidez a se inscreverem no Registro de Gravidez de Drogas Antiepilépticas da América do Norte (NAAED) ligando para o número gratuito 1-888-233-2334 ou visitando http://www.aedpregnancyregistry.org/.
Resumo do risco
Não existem dados adequados sobre os riscos de desenvolvimento associados ao uso de NEURONTIN em mulheres grávidas. Em estudos não clínicos em camundongos, ratos e coelhos, a gabapentina foi tóxica para o desenvolvimento (aumento de anormalidades esqueléticas e viscerais fetais e aumento da mortalidade embriofetal) quando administrada a animais prenhes em doses semelhantes ou inferiores às usadas clinicamente [ver Dados ].
Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2 a 4% e 15 a 20%, respectivamente. O risco de fundo de defeitos congênitos graves e aborto para a população indicada é desconhecido.
Dados
Dados de animais
Quando camundongos prenhes receberam doses orais de gabapentina (500, 1.000 ou 3.000 mg/kg/dia) durante o período de organogênese, a toxicidade embriofetal (aumento da incidência de variações esqueléticas) foi observada nas duas doses mais altas. A dose sem efeito para toxicidade no desenvolvimento embriofetal em camundongos (500 mg/kg/dia) é menor que a dose humana máxima recomendada (MRHD) de 3600 mg com base na área de superfície corporal (mg/m²).
Em estudos em que ratos receberam doses orais de gabapentina (500 a 2.000 mg/kg/dia) durante a gravidez, foram observados efeitos adversos no desenvolvimento da prole (aumento da incidência de hidroureter e/ou hidronefrose) em todas as doses. A dose mais baixa testada é semelhante à MRHD na base de mg/m².
Quando coelhas grávidas foram tratadas com gabapentina durante o período de organogênese, foi observado um aumento na mortalidade embriofetal em todas as doses testadas (60, 300 ou 1500 mg/kg). A dose mais baixa testada é menor que a MRHD na base de mg/m².
Em um estudo publicado, a gabapentina (400 mg/kg/dia) foi administrada por injeção intraperitoneal em camundongos neonatos durante a primeira semana pós-natal, um período de sinaptogênese em roedores (correspondente ao último trimestre de gravidez em humanos). A gabapentina causou uma diminuição acentuada na formação de sinapses neuronais em cérebros de camundongos intactos e formação anormal de sinapses neuronais em um modelo de reparo sináptico em camundongos. A gabapentina demonstrou in vitro interferir na atividade da subunidade α2δ dos canais de cálcio ativados por voltagem, um receptor envolvido na sinaptogênese neuronal. O significado clínico destes resultados é desconhecido.
Lactação
Resumo do risco
gabapentina é secretada no leite humano após administração oral. Os efeitos no lactente e na produção de leite são desconhecidos. Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de NEURONTIN e quaisquer potenciais efeitos adversos no lactente de NEURONTIN ou da condição materna subjacente.
Uso Pediátrico
A segurança e eficácia de NEURONTIN 600mg no manejo da neuralgia pós-herpética em pacientes pediátricos não foram estabelecidas.
A segurança e a eficácia como terapia adjuvante no tratamento de convulsões parciais em pacientes pediátricos com idade inferior a 3 anos não foram estabelecidas [ver Estudos clínicos ].
Uso Geriátrico
número total de pacientes tratados com NEURONTIN em ensaios clínicos controlados em pacientes com neuralgia pós-herpética foi de 336, dos quais 102 (30%) tinham 65 a 74 anos de idade e 168 (50%) tinham 75 anos de idade ou mais. Houve um efeito maior do tratamento em pacientes com 75 anos de idade ou mais em comparação com pacientes mais jovens que receberam a mesma dosagem. Uma vez que a gabapentina é quase exclusivamente eliminada por excreção renal, o maior efeito do tratamento observado em pacientes ≥ 75 anos pode ser consequência do aumento da exposição à gabapentina para uma determinada dose que resulta de uma diminuição da função renal relacionada à idade. No entanto, outros fatores não podem ser excluídos. Os tipos e incidência de reações adversas foram semelhantes em todas as faixas etárias, exceto para edema periférico e ataxia, que tendem a aumentar em incidência com a idade.
Os estudos clínicos de NEURONTIN na epilepsia não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles responderam de forma diferente dos indivíduos mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os mais jovens. Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, geralmente começando no limite inferior da faixa de dosagem, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa.
Este fármaco é conhecido por ser substancialmente excretado pelos rins, e o risco de reações tóxicas a este fármaco pode ser maior em pacientes com função renal comprometida. Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se ter cuidado na seleção da dose, e a dose deve ser ajustada com base nos valores de depuração de creatinina nesses pacientes. DOSAGEM E ADMINISTRAÇÃO , REAÇÕES ADVERSAS , e FARMACOLOGIA CLÍNICA ].
Insuficiência renal
O ajuste da dose em pacientes adultos com função renal comprometida é necessário [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ]. Pacientes pediátricos com insuficiência renal não foram estudados.
O ajuste da dose em pacientes submetidos à hemodiálise é necessário [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Os sinais de toxicidade aguda em animais incluíram ataxia, respiração difícil, ptose, sedação, hipoatividade ou excitação.
Superdosagens orais agudas de NEURONTIN 300mg foram relatadas. Os sintomas incluem visão dupla, tremor, fala arrastada, sonolência, estado mental alterado, tontura, letargia e diarréia. Depressão respiratória fatal foi relatada com superdosagem de NEURONTIN 400mg, isoladamente e em combinação com outros depressores do SNC.
A gabapentina pode ser removida por hemodiálise.
Se ocorrer superexposição, ligue para o centro de controle de envenenamento em 1-800-222-1222.
CONTRA-INDICAÇÕES
NEURONTIN é contraindicado em pacientes que demonstraram hipersensibilidade ao medicamento ou a seus componentes.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
Os mecanismos precisos pelos quais a gabapentina produz suas ações analgésicas e antiepilépticas são desconhecidos. A gabapentina está estruturalmente relacionada ao neurotransmissor ácido gama-aminobutírico (GABA), mas não tem efeito na ligação, absorção ou degradação do GABA. Estudos in vitro mostraram que a gabapentina se liga com alta afinidade à subunidade α2δ dos canais de cálcio ativados por voltagem; no entanto, a relação desta ligação com os efeitos terapêuticos da gabapentina é desconhecida.
Farmacocinética
Todas as ações farmacológicas após a administração de gabapentina são devidas à atividade do composto original; a gabapentina não é significativamente metabolizada em humanos.
Biodisponibilidade oral
biodisponibilidade da gabapentina não é proporcional à dose; isto é, à medida que a dose é aumentada, a biodisponibilidade diminui. A biodisponibilidade da gabapentina é de aproximadamente 60%, 47%, 34%, 33% e 27% após 900, 1200, 2400, 3600 e 4800 mg/dia administrados em 3 doses divididas, respectivamente. Os alimentos têm apenas um leve efeito na taxa e extensão da absorção da gabapentina (aumento de 14% na AUC e Cmax).
Distribuição
Menos de 3% da gabapentina circula ligada à proteína plasmática. O volume aparente de distribuição da gabapentina após administração intravenosa de 150 mg é de 58±6 L (média ±DP). Em pacientes com epilepsia, as concentrações de pré-dose (Cmin) no estado de equilíbrio de gabapentina no líquido cefalorraquidiano foram de aproximadamente 20% das concentrações plasmáticas correspondentes.
Eliminação
A gabapentina é eliminada da circulação sistêmica por excreção renal como droga inalterada. A gabapentina não é significativamente metabolizada em humanos.
meia-vida de eliminação da gabapentina é de 5 a 7 horas e não é alterada pela dose ou após doses múltiplas. A constante da taxa de eliminação da gabapentina, a depuração plasmática e a depuração renal são diretamente proporcionais à depuração da creatinina. Em pacientes idosos e em pacientes com função renal comprometida, a depuração plasmática da gabapentina é reduzida. A gabapentina pode ser removida do plasma por hemodiálise.
Populações Específicas
Era
O efeito da idade foi estudado em indivíduos de 20 a 80 anos de idade. A depuração oral aparente (CL/F) da gabapentina diminuiu com o aumento da idade, de cerca de 225 mL/min em menores de 30 anos para cerca de 125 mL/min em maiores de 70 anos. O clearance renal (CLr) e o CLr ajustado para a área de superfície corporal também diminuíram com a idade; entretanto, o declínio na depuração renal da gabapentina com a idade pode ser amplamente explicado pelo declínio da função renal. [Vejo DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Gênero
Embora nenhum estudo formal tenha sido realizado para comparar a farmacocinética da gabapentina em homens e mulheres, parece que os parâmetros farmacocinéticos para homens e mulheres são semelhantes e não há diferenças significativas entre os sexos.
Corrida
As diferenças farmacocinéticas devido à raça não foram estudadas. Como a gabapentina é excretada principalmente por via renal e não há diferenças raciais importantes na depuração da creatinina, não são esperadas diferenças farmacocinéticas devido à raça.
Pediátrico
farmacocinética da gabapentina foi determinada em 48 pacientes pediátricos com idades entre 1 mês e 12 anos após uma dose de aproximadamente 10 mg/kg. As concentrações plasmáticas máximas foram semelhantes em todo o grupo etário e ocorreram 2 a 3 horas após a dose. Em geral, os indivíduos pediátricos entre 1 mês e
Uma análise farmacocinética populacional foi realizada em 253 pacientes pediátricos entre 1 mês e 13 anos de idade. Os pacientes receberam 10 a 65 mg/kg/dia três vezes ao dia. A depuração oral aparente (CL/F) foi diretamente proporcional à depuração da creatinina e esta relação foi semelhante após uma dose única e no estado de equilíbrio. Foram observados valores de depuração oral mais elevados em crianças
Esses dados farmacocinéticos indicam que a dose diária eficaz em pacientes pediátricos com epilepsia de 3 e 4 anos deve ser de 40 mg/kg/dia para atingir concentrações plasmáticas médias semelhantes às alcançadas em pacientes com 5 anos de idade ou mais recebendo gabapentina na dose de 30 mg/dia. kg/dia [ver DOSAGEM E ADMINISTRAÇÃO ].
Pacientes adultos com insuficiência renal
Indivíduos (N = 60) com insuficiência renal (clearance médio de creatinina variando de 13 a 114 mL/min) receberam doses orais únicas de 400 mg de gabapentina. A meia-vida média da gabapentina variou de cerca de 6,5 horas (pacientes com clearance de creatinina >60 mL/min) a 52 horas (clearance de creatinina 60 mL/min). grupo) a cerca de 10 mL/min ( DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ]. Pacientes pediátricos com insuficiência renal não foram estudados.
Hemodiálise
Em um estudo em indivíduos adultos anúricos (N=11), a meia-vida de eliminação aparente da gabapentina em dias sem diálise foi de cerca de 132 horas; durante a diálise, a meia-vida aparente da gabapentina foi reduzida para 3,8 horas. A hemodiálise tem, portanto, um efeito significativo na eliminação de gabapentina em indivíduos anúricos [ver DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Doença hepática
Como a gabapentina não é metabolizada, nenhum estudo foi realizado em pacientes com insuficiência hepática.
Interações medicamentosas
Estudos in vitro
Estudos in vitro foram conduzidos para investigar o potencial da gabapentina para inibir as principais enzimas do citocromo P450 (CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 e CYP3A4) que medeiam o metabolismo de drogas e xenobióticos usando substratos de marcadores seletivos de isoformas e preparações microssomais de fígado humano . Apenas na concentração mais alta testada (171 mcg/mL; 1 mM) foi observado um leve grau de inibição (14% a 30%) da isoforma CYP2A6. Nenhuma inibição de qualquer uma das outras isoformas testadas foi observada em concentrações de gabapentina de até 171 mcg/mL (aproximadamente 15 vezes a C em 3600 mg/dia) da isoforma CYP2A6 observada. Nenhuma inibição de qualquer uma das outras isoformas testadas foi observada em concentrações de gabapentina de até 171 mcg/mL (aproximadamente 15 vezes a Cmax em 3600 mg/dia).
Estudos In Vivo
Os dados de interação medicamentosa descritos nesta seção foram obtidos de estudos envolvendo adultos saudáveis e pacientes adultos com epilepsia.
Fenitoína
Em um estudo de dose única (400 mg) e dose múltipla (400 mg três vezes ao dia) de NEURONTIN 400 mg em pacientes epilépticos (N = 8) mantidos em monoterapia com fenitoína por pelo menos 2 meses, a gabapentina não teve efeito no vale do estado de equilíbrio as concentrações plasmáticas de fenitoína e fenitoína não tiveram efeito sobre a farmacocinética da gabapentina.
Carbamazepina
As concentrações plasmáticas de carbamazepina e carbamazepina 10, 11 no estado estacionário não foram afetadas pela administração concomitante de gabapentina (400 mg três vezes ao dia; N = 12). Da mesma forma, a farmacocinética da gabapentina não foi alterada pela administração de carbamazepina.
Ácido valpróico
As concentrações séricas médias de ácido valpróico no estado de equilíbrio antes e durante a administração concomitante de gabapentina (400 mg três vezes ao dia; N = 17) não foram diferentes e os parâmetros farmacocinéticos da gabapentina também não foram afetados pelo ácido valpróico.
Fenobarbital
As estimativas dos parâmetros farmacocinéticos no estado de equilíbrio para fenobarbital ou gabapentina (300 mg três vezes ao dia; N = 12) são idênticas, quer os medicamentos sejam administrados isoladamente ou em conjunto.
Naproxeno
A coadministração (N=18) de cápsulas de naproxeno sódico (250 mg) com NEURONTIN (125 mg) parece aumentar a quantidade de gabapentina absorvida em 12% a 15%. A gabapentina não teve efeito nos parâmetros farmacocinéticos do naproxeno. Essas doses são menores do que as doses terapêuticas para ambas as drogas. A magnitude da interação dentro das faixas de dose recomendadas de qualquer um dos medicamentos não é conhecida.
Hidrocodona
coadministração de NEURONTIN (125 a 500 mg; N=48) diminui os valores de Cmax e AUC de hidrocodona (10 mg; N=50) de uma forma dependente da dose em relação à administração de hidrocodona isolada; Os valores de Cmax e AUC são 3% a 4% menores, respectivamente, após a administração de 125 mg de NEURONTIN e 21% a 22% menores, respectivamente, após a administração de 500 mg de NEURONTIN. O mecanismo para esta interação é desconhecido. A hidrocodona aumenta os valores de AUC da gabapentina em 14%. A magnitude da interação em outras doses não é conhecida.
Morfina
Um artigo da literatura relatou que, quando uma cápsula de morfina de liberação controlada de 60 mg foi administrada 2 horas antes de uma cápsula de 600 mg de NEURONTIN (N = 12), a AUC média da gabapentina aumentou 44% em comparação com a gabapentina administrada sem morfina. Os valores dos parâmetros farmacocinéticos da morfina não foram afetados pela administração de NEURONTIN 2 horas após a morfina. A magnitude da interação em outras doses não é conhecida.
Cimetidina
Na presença de cimetidina na dose de 300 mg quatro vezes ao dia (N=12), a depuração oral aparente média da gabapentina caiu 14% e a depuração da creatinina caiu 10%. Assim, a cimetidina pareceu alterar a excreção renal de gabapentina e creatinina, um marcador endógeno da função renal. Não se espera que esta pequena diminuição na excreção de gabapentina pela cimetidina tenha importância clínica. O efeito da gabapentina na cimetidina não foi avaliado.
Anticoncepcional Oral
Com base na AUC e na meia-vida, os perfis farmacocinéticos de doses múltiplas de noretindrona e etinilestradiol após a administração de comprimidos contendo 2,5 mg de acetato de noretindrona e 50 mcg de etinilestradiol foram semelhantes com e sem coadministração de gabapentina (400 mg três vezes ao dia; N=13). A Cmax da noretindrona foi 13% maior quando coadministrada com gabapentina; não se espera que esta interação tenha importância clínica.
Antiácido (Maalox®) (hidróxido de alumínio, hidróxido de magnésio)
antiácido (Maalox®) contendo hidróxidos de magnésio e alumínio reduziu a biodisponibilidade média da gabapentina (N=16) em cerca de 20%. Esta diminuição na biodisponibilidade foi de cerca de 10% quando a gabapentina foi administrada 2 horas após Maalox.
probenecida
A probenecida é um bloqueador da secreção tubular renal. Os parâmetros farmacocinéticos da gabapentina sem e com probenecida foram comparáveis. Isso indica que a gabapentina não sofre secreção tubular renal pela via bloqueada pela probenecida.
Estudos clínicos
Neuralgia pós-herpética
NEURONTIN foi avaliado para o tratamento da neuralgia pós-herpética (NPH) em dois estudos multicêntricos randomizados, duplo-cegos, controlados por placebo. A população com intenção de tratar (ITT) consistiu em um total de 563 pacientes com dor por mais de 3 meses após a cicatrização da erupção cutânea do herpes zoster (Tabela 6).
TABELA 6. Estudos de PHN controlados: duração, dosagens e número de pacientes
Cada estudo incluiu uma fase duplo-cega de 7 ou 8 semanas (3 ou 4 semanas de titulação e 4 semanas de dose fixa). Os pacientes iniciaram o tratamento com titulação até um máximo de 900 mg/dia de gabapentina durante 3 dias. As dosagens foram então tituladas em incrementos de 600 a 1200 mg/dia em intervalos de 3 a 7 dias até a dose alvo ao longo de 3 a 4 semanas. Os pacientes registraram sua dor em um diário usando uma escala numérica de dor de 11 pontos variando de 0 (sem dor) a 10 (pior dor possível). Uma pontuação média de dor durante a linha de base de pelo menos 4 foi necessária para a randomização. As análises foram conduzidas usando a população ITT (todos os pacientes randomizados que receberam pelo menos uma dose da medicação do estudo).
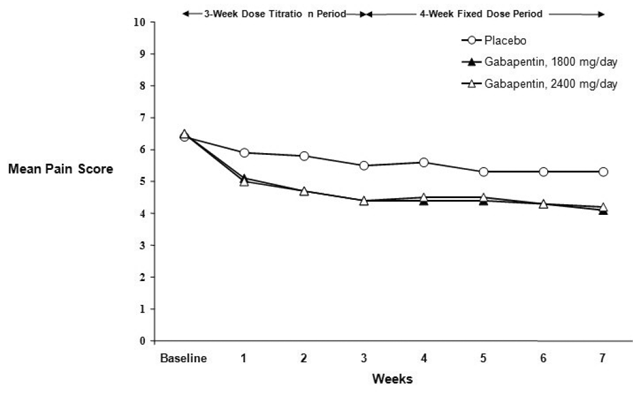
Ambos os estudos demonstraram eficácia em comparação com placebo em todas as doses testadas.
redução nos escores médios semanais de dor foi observada na Semana 1 em ambos os estudos e foi mantida até o final do tratamento. Efeitos de tratamento comparáveis foram observados em todos os braços de tratamento ativo. A modelagem farmacocinética/farmacodinâmica forneceu evidências confirmatórias de eficácia em todas as doses. As Figuras 1 e 2 mostram os escores de intensidade da dor ao longo do tempo para os Estudos 1 e 2.
Figura 1. Pontuações médias semanais de dor (casos observados na população ITT): Estudo 1
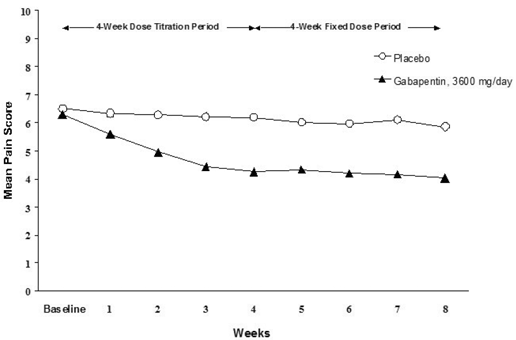
Figura 2. Pontuações médias semanais de dor (casos observados na população ITT): Estudo 2
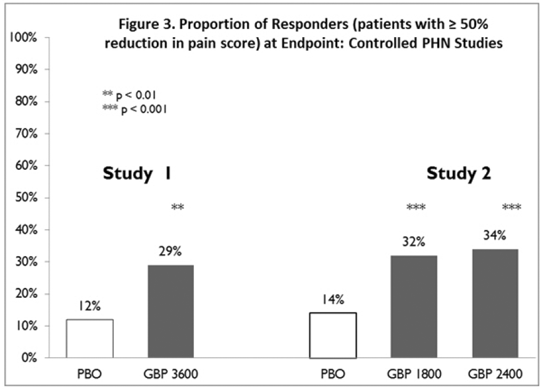
A proporção de respondedores (aqueles pacientes que relataram pelo menos 50% de melhora na pontuação de dor de ponto final em comparação com a linha de base) foi calculada para cada estudo (Figura 3).
Figura 3. Proporção de Respondentes (pacientes com ≥50% de redução no escore de dor) no Ponto Final: Estudos de NPH controlados
Epilepsia para Convulsões de Início Parcial (Terapia Adjunta)
eficácia de NEURONTIN 400mg como terapia adjuvante (adicionada a outras drogas antiepilépticas) foi estabelecida em ensaios clínicos multicêntricos controlados por placebo, duplo-cegos e de grupos paralelos em pacientes adultos e pediátricos (3 anos ou mais) com convulsões parciais refratárias.
evidência de eficácia foi obtida em três estudos realizados em 705 pacientes (12 anos ou mais) e um estudo realizado em 247 pacientes pediátricos (3 a 12 anos de idade). Os pacientes inscritos tinham um histórico de pelo menos 4 crises parciais por mês, apesar de receberem um ou mais medicamentos antiepilépticos em níveis terapêuticos e foram observados em seu regime de medicamentos antiepilépticos estabelecido durante um período basal de 12 semanas (6 semanas no estudo de pacientes pediátricos). pacientes). Em pacientes que continuaram a ter pelo menos 2 (ou 4 em alguns estudos) convulsões por mês, NEURONTIN 300mg ou placebo foi então adicionado à terapia existente durante um período de tratamento de 12 semanas. A eficácia foi avaliada principalmente com base na porcentagem de pacientes com uma redução de 50% ou mais na frequência de convulsões desde a linha de base até o tratamento (a "taxa de resposta") e uma medida derivada chamada razão de resposta, uma medida de mudança definida como (T - B)/(T + B), em que B é a frequência de convulsões da linha de base do paciente e T é a frequência de convulsões do paciente durante o tratamento. A taxa de resposta é distribuída dentro do intervalo -1 a +1. Um valor zero indica nenhuma mudança enquanto a eliminação completa de convulsões daria um valor de -1; o aumento das taxas de convulsões daria valores positivos. Uma taxa de resposta de -0,33 corresponde a uma redução de 50% na frequência de convulsões. Os resultados fornecidos abaixo são para todas as convulsões parciais na população com intenção de tratar (todos os pacientes que receberam qualquer dose de tratamento) em cada estudo, a menos que indicado de outra forma.
Um estudo comparou NEURONTIN 1200 mg/dia, em três doses divididas com placebo. A taxa de resposta foi de 23% (14/61) no grupo NEURONTIN 600mg e 9% (6/66) no grupo placebo; a diferença entre os grupos foi estatisticamente significativa. A taxa de resposta também foi melhor no grupo NEURONTIN (-0,199) do que no grupo placebo (-0,044), uma diferença que também alcançou significância estatística.
Um segundo estudo comparou principalmente NEURONTIN 1200 mg/dia, em três doses divididas (N=101), com placebo (N=98). Grupos de dosagem adicionais menores de NEURONTIN 300mg (600 mg/dia, N=53; 1800 mg/dia, N=54) também foram estudados para obter informações sobre a resposta à dose. A taxa de resposta foi maior no grupo NEURONTIN 1200 mg/dia (16%) do que no grupo placebo (8%), mas a diferença não foi estatisticamente significativa. A taxa de resposta em 600 mg (17%) também não foi significativamente maior do que no placebo, mas a taxa de resposta no grupo de 1800 mg (26%) foi estatisticamente significativamente superior à taxa de placebo. A taxa de resposta foi melhor no grupo NEURONTIN 1200 mg/dia (-0,103) do que no grupo placebo (-0,022); mas essa diferença também não foi estatisticamente significativa (p = 0,224). Uma melhor resposta foi observada no grupo NEURONTIN 600 mg/dia (-0,105) e no grupo 1800 mg/dia (-0,222) do que no grupo 1200 mg/dia, com o grupo 1800 mg/dia alcançando significância estatística em comparação com o placebo grupo.
Um terceiro estudo comparou NEURONTIN 900 mg/dia, em três doses divididas (N=111), e placebo (N=109). Um grupo de dosagem adicional de NEURONTIN 1200 mg/dia (N=52) forneceu dados de dose-resposta. Uma diferença estatisticamente significativa na taxa de resposta foi observada no grupo NEURONTIN 900 mg/dia (22%) em comparação com o grupo placebo (10%). A taxa de resposta também foi estatisticamente significativamente superior no grupo NEURONTIN 900 mg/dia (-0,119) em comparação com o grupo placebo (-0,027), assim como a taxa de resposta em 1200 mg/dia NEURONTIN (-0,184) em comparação com placebo.
Também foram realizadas análises em cada estudo para examinar o efeito de NEURONTIN 300mg na prevenção de convulsões tônico-clônicas secundariamente generalizadas. Os pacientes que sofreram uma convulsão tônico-clônica generalizada secundariamente na linha de base ou no período de tratamento em todos os três estudos controlados por placebo foram incluídos nessas análises. Houve várias comparações de razão de resposta que mostraram uma vantagem estatisticamente significativa para NEURONTIN em comparação com placebo e tendências favoráveis para quase todas as comparações.
A análise da taxa de resposta usando dados combinados de todos os três estudos e todas as doses (N=162, NEURONTIN; N=89, placebo) também mostrou uma vantagem significativa para NEURONTIN em relação ao placebo na redução da frequência de convulsões tônico-clônicas secundariamente generalizadas.
Em dois dos três estudos controlados, foi utilizada mais de uma dose de NEURONTIN. Dentro de cada estudo, os resultados não mostraram uma resposta consistentemente aumentada à dose. No entanto, analisando os estudos, é evidente uma tendência de aumento da eficácia com o aumento da dose (ver Figura 4).
Figura 4. Taxa de resposta em pacientes que receberam NEURONTIN 600mg expresso como uma diferença do placebo por dose e estudo: estudos de terapia adjuvante em pacientes ≥12 anos de idade com convulsões parciais
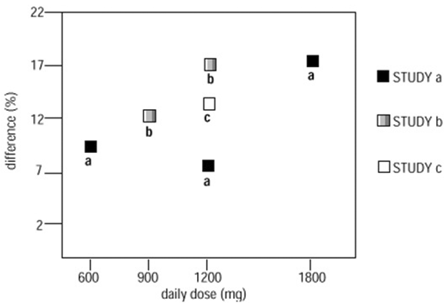
Na figura, a magnitude do efeito do tratamento, medida no eixo Y em termos da diferença na proporção de gabapentina e pacientes atribuídos a placebo, atingindo uma redução de 50% ou mais na frequência de convulsões da linha de base, é plotada em relação à dose diária de gabapentina administrada (eixo X).
Embora nenhuma análise formal por sexo tenha sido realizada, as estimativas de resposta (Response Ratio) derivadas de ensaios clínicos (398 homens, 307 mulheres) indicam que não existem diferenças importantes entre os sexos. Não houve padrão consistente indicando que a idade teve algum efeito na resposta ao NEURONTIN. Houve um número insuficiente de pacientes de outras raças que não a caucasiana para permitir uma comparação de eficácia entre grupos raciais.
Um quarto estudo em pacientes pediátricos de 3 a 12 anos comparou 25 –35 mg/kg/dia de NEURONTIN (N=118) com placebo (N=127). Para todas as convulsões parciais na população com intenção de tratar, a razão de resposta foi estatisticamente significativamente melhor para o grupo NEURONTIN (-0,146) do que para o grupo placebo (-0,079). Para a mesma população, a taxa de resposta para NEURONTIN (21%) não foi significativamente diferente do placebo (18%).
Um estudo em pacientes pediátricos de 1 mês a 3 anos comparou 40 mg/kg/dia de NEURONTIN (N=38) com placebo (N=38) em pacientes que estavam recebendo pelo menos um medicamento antiepiléptico comercializado e tiveram pelo menos uma convulsão parcial durante o período de triagem (dentro de 2 semanas antes da linha de base). Os pacientes tiveram até 48 horas de linha de base e até 72 horas de monitoramento de vídeo EEG duplo-cego para registrar e contar a ocorrência de convulsões. Não houve diferenças estatisticamente significativas entre os tratamentos na razão de resposta ou na taxa de resposta.
INFORMAÇÃO DO PACIENTE
NEURONTIN (Neu ron' estanho) (Gabapentina) Cápsulas, Comprimidos e Solução Oral
Qual é a informação mais importante que devo saber sobre o NEURONTIN?
Não pare de tomar NEURONTIN 300mg sem primeiro falar com seu médico.
Parar o NEURONTIN repentinamente pode causar sérios problemas.
NEURONTIN 400mg pode causar efeitos colaterais graves, incluindo:
1. Pensamentos suicidas. Como outros medicamentos antiepilépticos, NEURONTIN 100mg pode causar pensamentos ou ações suicidas em um número muito pequeno de pessoas, cerca de 1 em 500.
Ligue para um profissional de saúde imediatamente se tiver algum destes sintomas, especialmente se eles forem novos, piores ou se preocuparem:
- pensamentos sobre suicídio ou morte
- tentativas de suicídio
- depressão nova ou pior
- ansiedade nova ou pior
- sentindo-se agitado ou inquieto
- ataques de pânico
- problemas para dormir (insônia)
- irritabilidade nova ou pior
- agindo de forma agressiva, com raiva ou violento
- agindo em impulsos perigosos
- um aumento extremo na atividade e na fala (mania)
- outras mudanças incomuns no comportamento ou humor
Como posso observar os primeiros sintomas de pensamentos e ações suicidas?
- Preste atenção a quaisquer mudanças, especialmente mudanças repentinas, de humor, comportamentos, pensamentos ou sentimentos.
- Mantenha todas as visitas de acompanhamento com seu médico conforme programado.
Ligue para o seu médico entre as visitas, conforme necessário, especialmente se estiver preocupado com os sintomas.
Não pare de tomar NEURONTIN sem primeiro falar com um profissional de saúde.
- Parar de repente NEURONTIN 100mg pode causar sérios problemas. A interrupção repentina de um medicamento para convulsões em um paciente com epilepsia pode causar convulsões que não param (status epilepticus).
- Pensamentos ou ações suicidas podem ser causados por outras coisas além de medicamentos. Se você tiver pensamentos ou ações suicidas, seu médico pode verificar outras causas.
2. Mudanças de comportamento e pensamento - O uso de NEURONTIN 100mg em crianças de 3 a 12 anos pode causar alterações emocionais, comportamento agressivo, problemas de concentração, inquietação, alterações no desempenho escolar e hiperatividade.
3. NEURONTIN pode causar reações alérgicas graves ou com risco de vida que podem afetar a sua pele ou outras partes do seu corpo, como o fígado ou as células do sangue. Isso pode fazer com que você seja hospitalizado ou interrompa NEURONTIN. Você pode ou não ter uma erupção cutânea com uma reação alérgica causada por NEURONTIN. Ligue para um profissional de saúde imediatamente se tiver algum dos seguintes sintomas:
- erupção cutânea
- urticária
- dificuldade para respirar
- febre
- glândulas inchadas que não desaparecem
- inchaço do rosto, lábios, garganta ou língua
- amarelecimento da pele ou do branco dos olhos
- hematomas ou sangramentos incomuns
- fadiga severa ou fraqueza
- dor muscular inesperada
- infecções frequentes
Estes sintomas podem ser os primeiros sinais de uma reação grave. Um profissional de saúde deve examiná-lo para decidir se você deve continuar tomando NEURONTIN.
4. Problemas respiratórios graves. Problemas respiratórios graves podem ocorrer quando NEURONTIN é tomado com outros medicamentos que podem causar sonolência grave ou diminuição da consciência, ou quando é tomado por alguém que já tem problemas respiratórios. Fique atento ao aumento da sonolência ou diminuição da respiração ao iniciar NEURONTIN 300mg ou quando a dose for aumentada. Obtenha ajuda imediatamente se ocorrerem problemas respiratórios.
O que é NEURONTIN 400mg?
NEURONTIN 400mg é um medicamento de prescrição usado para tratar:
- Dor de nervos danificados (dor pós-herpética) que segue a cicatrização de herpes zoster (uma erupção dolorosa que ocorre após uma infecção por herpes zoster) em adultos.
- Convulsões parciais quando tomado em conjunto com outros medicamentos em adultos e crianças com 3 anos de idade ou mais com convulsões.
Quem não deve tomar NEURONTIN?
Não tome NEURONTIN se for alérgico à gabapentina ou a qualquer outro componente de NEURONTIN. Consulte o final deste Guia de Medicação para obter uma lista completa dos ingredientes do NEURONTIN.
que devo dizer ao meu médico antes de tomar NEURONTIN 300mg?
Antes de tomar NEURONTIN 400mg, informe o seu médico se você:
- tem ou teve problemas renais ou está em hemodiálise
- tem ou teve depressão, problemas de humor ou pensamentos ou comportamento suicida
- tem diabetes
- tem problemas respiratórios
- estão grávidas ou planejam engravidar. Não se sabe se NEURONTIN pode prejudicar o feto. Informe o seu médico imediatamente se engravidar enquanto estiver a tomar NEURONTIN. Você e seu médico decidirão se você deve tomar NEURONTIN 100mg enquanto estiver grávida. Registro de gravidez: Se você engravidar enquanto estiver tomando NEURONTIN, converse com seu médico sobre o registro no Registro de Gravidez de Drogas Antiepilépticas da América do Norte (NAAED). O objetivo deste registro é coletar informações sobre a segurança dos medicamentos antiepilépticos durante a gravidez. Você pode se inscrever neste registro ligando para 1-888-233-2334.
- está amamentando ou planeja amamentar. NEURONTIN pode passar para o leite materno. Você e seu médico devem decidir como você irá alimentar seu bebê enquanto estiver tomando NEURONTIN.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas. Informe especialmente o seu médico se estiver a tomar algum medicamento opióide para a dor (como oxicodona), qualquer medicamento para ansiedade (como lorazepam) ou insónia (como zolpidem) ou qualquer medicamento que o deixe sonolento.
Você pode ter uma chance maior de tontura, sonolência ou problemas respiratórios se esses medicamentos forem tomados com NEURONTIN.
Tomar NEURONTIN 100mg com alguns outros medicamentos pode causar efeitos colaterais ou afetar o seu funcionamento. Não inicie ou interrompa outros medicamentos sem falar com seu médico.
Conheça os medicamentos que você toma. Mantenha uma lista deles e mostre-a ao seu médico e farmacêutico quando receber um novo medicamento.
Como devo tomar NEURONTIN 400mg?
- Tome NEURONTIN exatamente como prescrito. Seu médico lhe dirá quanto NEURONTIN 600mg você deve tomar.
- Não altere sua dose de NEURONTIN sem falar com seu médico.
- Se você tomar NEURONTIN comprimidos e quebrar um comprimido ao meio, a metade não utilizada do comprimido deve ser tomada na próxima dose programada. Metade dos comprimidos não utilizados dentro de 28 dias após o rompimento devem ser jogados fora.
- Tome as cápsulas de NEURONTIN com água.
- Os comprimidos de NEURONTIN podem ser tomados com ou sem alimentos. Se você tomar um antiácido contendo alumínio e magnésio, como Maalox®, Mylanta®, Gelusil®, Gaviscon® ou Di-Gel®, você deve esperar pelo menos 2 horas antes de tomar sua próxima dose de NEURONTIN. Se você tomar muito NEURONTIN 600mg, ligue para seu médico ou para o Centro de Controle de Intoxicações local imediatamente em 1-800-222-1222.
O que devo evitar ao tomar NEURONTIN?
- Não beba álcool ou tome outros medicamentos que o deixem sonolento ou tonto enquanto estiver tomando NEURONTIN sem primeiro falar com seu médico. Tomar NEURONTIN 600mg com álcool ou drogas que causam sonolência ou tontura pode piorar sua sonolência ou tontura.
- Não dirija, opere máquinas pesadas ou faça outras atividades perigosas até saber como NEURONTIN 100mg o afeta. NEURONTIN 600mg pode retardar seu pensamento e habilidades motoras.
Quais são os possíveis efeitos colaterais do NEURONTIN 300mg?
NEURONTIN 100mg pode causar efeitos colaterais graves, incluindo:
Ver “Qual é a informação mais importante que devo saber sobre o NEURONTIN?”
- problemas de condução ao usar NEURONTIN. Consulte “O que devo evitar ao tomar Neurontin 600mg?”
- sonolência e tontura, o que pode aumentar a ocorrência de lesões acidentais, incluindo quedas
- Os efeitos colaterais mais comuns de NEURONTIN 100mg incluem:
- falta de coordenação
- infecção viral
- sentindo sonolento
- nausea e vomito
- dificuldade em falar
- tremor
- inchaço, geralmente das pernas e pés
- sentindo cansado
- febre
- movimentos bruscos
- dificuldade de coordenação
- visão dupla
- movimento ocular incomum
Informe o seu médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do NEURONTIN. Para mais informações, pergunte ao seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o NEURONTIN?
- Armazene as cápsulas e comprimidos NEURONTIN 400mg entre 68°F a 77°F (20°C a 25°C).
- Armazene NEURONTIN 400mg Solução Oral na geladeira entre 36°F a 46°F (2°C a 8°C).
Mantenha NEURONTIN 600mg e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de NEURONTIN
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use NEURONTIN 300mg para uma condição para a qual não foi prescrito. Não dê NEURONTIN a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este Guia de Medicação resume as informações mais importantes sobre NEURONTIN. Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu médico ou farmacêutico informações sobre NEURONTIN 100mg que foram escritas para profissionais de saúde.
Para obter mais informações, visite http://www.pfizer.com ou ligue para 1-800-438-1985.
Quais são os ingredientes de NEURONTIN 400mg?
Ingrediente ativo: gabapentina
Ingredientes inativos nas cápsulas: lactose, amido de milho, talco, gelatina, dióxido de titânio e FD&C Blue No. 2.
O invólucro da cápsula de 300 mg também contém: óxido de ferro amarelo.
invólucro da cápsula de 400 mg também contém: óxido de ferro vermelho e óxido de ferro amarelo.
Ingredientes inativos nos comprimidos: poloxâmero 407, copovidona, amido de milho, estearato de magnésio, hidroxipropilcelulose, talco e cera de candelila
Ingredientes inativos na solução oral: glicerina, xilitol, água purificada e aroma artificial.
Este Guia de Medicação foi aprovado pela Food and Drug Administration dos EUA.
