Nimotop 30mg Nimodipine Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Nimotop 30mg e como é usado?
Nimotop é um medicamento de prescrição usado para tratar os sintomas de Aneurisma (Hemorragia Subaracnoidea). Nimotop pode ser usado sozinho ou com outros medicamentos.
Nimotop pertence a uma classe de medicamentos chamados bloqueadores dos canais de cálcio; Neurológicos Outros; Bloqueadores dos canais de cálcio, diidrofiridina.
Não se sabe se Nimotop 30mg é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Nimotop?
Nimotop pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- tontura,
- frequência cardíaca rápida ou lenta, e
- inchaço ou seus tornozelos ou pés
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Nimotop incluem:
- pressão arterial baixa (sensação de tontura),
- náusea,
- dor de estômago,
- batimentos cardíacos lentos e
- dor muscular
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Nimotop. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
NÃO ADMINISTRAR NIMOTOP (nimodipina) INTRAVENOSA OU POR OUTRAS VIA PARENTERAL. MORTES E EVENTOS ADVERSOS GRAVES E AMEAÇA À VIDA OCORRERÃO QUANDO O CONTEÚDO DAS CÁPSULAS DE NIMOTOP (nimodipina) FOR INJETADO POR PARENTERALMENTE (Ver ADVERTÊNCIAS, DOSAGEM E ADMINISTRAÇÃO).
DESCRIÇÃO
Nimotop® (nimodipina) pertence à classe de agentes farmacológicos conhecidos como bloqueadores dos canais de cálcio. Nimodipina é isopropil 2 - metoxietil 1, 4 - dihidro - 2, 6 - dimetil - 4 - (m-nitrofenil) - 3, 5 - piridinadicarboxilato. Tem um peso molecular de 418,5 e uma fórmula molecular de C21H26N2O7. A fórmula estrutural é:
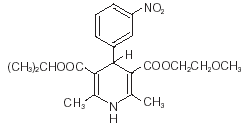
A nimodipina é uma substância cristalina amarela, praticamente insolúvel em água.
As cápsulas de NIMOTOP® (nimodipina) são formuladas como cápsulas de gelatina mole para administração oral. Cada cápsula cheia de líquido contém 30 mg de nimodipina num veículo de glicerina, óleo de hortelã-pimenta, água purificada e polietilenoglicol 400. O invólucro da cápsula de gelatina mole contém gelatina, glicerina, água purificada e dióxido de titânio.
INDICAÇÕES
Nimotop® (nimodipina) é indicado para a melhora do resultado neurológico, reduzindo a incidência e gravidade de déficits isquêmicos em pacientes com hemorragia subaracnóidea de aneurismas de bagas intracranianas rompidos, independentemente de sua condição neurológica pós-icto (ou seja, Hunt e Hess Graus IV).
DOSAGEM E ADMINISTRAÇÃO
NÃO ADMINISTRAR NIMOTOP (nimodipina) CÁPSULAS INTRAVENOSA OU POR OUTRAS VIA PARENTERAL (ver ADVERTÊNCIAS). Se Nimotop (nimodipina) for administrado inadvertidamente por via intravenosa, hipotensão clinicamente significativa pode exigir suporte cardiovascular com agentes pressores. Tratamentos específicos para superdosagem de bloqueadores dos canais de cálcio também devem ser administrados imediatamente.
Nimotop (nimodipina) é administrado por via oral na forma de cápsulas de gelatina mole cor de marfim de 30 mg para hemorragia subaracnóidea.
A dose oral é de 60 mg (duas cápsulas de 30 mg) a cada 4 horas durante 21 dias consecutivos, preferencialmente não menos de uma hora antes ou duas horas após as refeições. A terapia oral com Nimotop® (nimodipina) deve começar dentro de 96 horas após a hemorragia subaracnóidea.
Se a cápsula não puder ser engolida, por exemplo, no momento da cirurgia, ou se o paciente estiver inconsciente, um orifício deve ser feito em ambas as extremidades da cápsula com uma agulha de calibre 18 e o conteúdo da cápsula extraído para uma seringa. Uma seringa parenteral pode ser usada para extrair o líquido dentro da cápsula, mas o líquido deve sempre ser transferido para uma seringa que não pode aceitar uma agulha e que é projetada para administração por via oral ou via sonda nasogástrica ou PEG. Para ajudar a minimizar os erros de administração, recomenda-se que a seringa usada para administração seja rotulada como “Não para uso IV”. O conteúdo deve então ser esvaziado na sonda in situnaso-gástrica do paciente e lavado com 30 mL de solução salina normal (0,9%). A eficácia e segurança deste método de administração não foi demonstrada em ensaios clínicos.
Os doentes com cirrose hepática apresentam uma depuração substancialmente reduzida e aproximadamente o dobro da Cmax. A dosagem deve ser reduzida para 30 mg a cada 4 horas, com monitoramento cuidadoso da pressão arterial e da frequência cardíaca.
COMO FORNECIDO
Cada cápsula de gelatina mole de cor marfim NIMOTOP® (nimodipina) é impressa com a palavra Nimotop 30mg e contém 30 mg de nimodipina. As cápsulas de 30 mg são embaladas em bolsas de folha de dose unitária e fornecidas em embalagens contendo 100 cápsulas. O produto também está disponível em embalagens de segurança de dose unitária resistentes a crianças contendo 30 cápsulas por embalagem. As cápsulas devem ser armazenadas na embalagem original do fabricante a 25°C (77°F), excursões permitidas a 15-30°C (59-86°F) [Consulte a temperatura ambiente controlada pela USP.]
As cápsulas devem ser protegidas da luz e do congelamento.
Distribuído por: Bayer Pharmaceuticals Corporation, 400 Morgan Lane, West Haven, CT 06516. Fabricado por: Catalent Pharma Solutions St. Petersburg, FL 33716. Data de revisão da FDA: 20/01/2006
EFEITOS COLATERAIS
Experiências adversas foram relatadas por 92 de 823 pacientes com hemorragia subaracnóidea (11,2%) que receberam nimodipina. A experiência adversa relatada com mais frequência foi a diminuição da pressão arterial em 4,4% desses pacientes. Vinte e nove dos 479 (6,1%) pacientes tratados com placebo também relataram experiências adversas. Os eventos relatados com uma frequência superior a 1% são exibidos abaixo por dose.
DOSE q4h Número de Pacientes (%) Nimodipina
Não houve outras experiências adversas relatadas pelos pacientes que receberam 0,35 mg/kg a cada 4 horas, 30 mg a cada 4 horas ou 120 mg a cada 4 horas. Experiências adversas com uma taxa de incidência inferior a 1% no grupo de dose de 60 mg a cada 4 horas foram: hepatite; coceira; hemorragia gastrointestinal; trombocitopenia; anemia; palpitações; vômito; rubor; diaforese; chiado; toxicidade da fenitoína; tontura; tontura; vasoespasmo de rebote; icterícia; hipertensão; hematoma.
Experiências adversas com uma taxa de incidência inferior a 1% no grupo de dose de 90 mg a cada 4 horas foram: coceira, hemorragia gastrointestinal; trombocitopenia; deterioração neurológica; vômito; diaforese; insuficiência cardíaca congestiva; hiponatremia; diminuição da contagem de plaquetas; Coagulação intravascular disseminada; trombose venosa profunda.
Como pode ser visto na tabela, os efeitos colaterais que aparecem relacionados ao uso de nimodipina com base no aumento da incidência com dose mais alta ou taxa mais alta em comparação ao controle com placebo, incluíram diminuição da pressão arterial, edema e dores de cabeça que são ações farmacológicas conhecidas dos bloqueadores dos canais de cálcio. Deve-se notar, no entanto, que a HAS é frequentemente acompanhada por alterações de consciência que levam a uma subnotificação de experiências adversas. Os pacientes que receberam nimodipina em ensaios clínicos para outras indicações relataram rubor (2,1%), dor de cabeça (4,1%) e retenção de líquidos (0,3%), respostas típicas aos bloqueadores dos canais de cálcio. Como bloqueador dos canais de cálcio, a nimodipina pode ter o potencial de exacerbar a insuficiência cardíaca em pacientes suscetíveis ou interferir na condução AV, mas esses eventos não foram observados.
Nenhum efeito clinicamente significativo sobre fatores hematológicos, função renal ou hepática ou metabolismo de carboidratos foi causalmente associado com nimodipina oral. Foram relatados casos isolados de níveis elevados de glicose sérica sem jejum (0,8%), níveis elevados de LDH (0,4%), diminuição da contagem de plaquetas (0,3%), níveis elevados de fosfatase alcalina (0,2%) e níveis elevados de SGPT (0,2%) raramente.

Abuso e Dependência de Drogas
Não houve casos relatados de abuso ou dependência de drogas com Nimotop® (nimodipina).
INTERAÇÕES MEDICAMENTOSAS
É possível que a ação cardiovascular de outros bloqueadores dos canais de cálcio possa ser potencializada pela adição de Nimotop® (nimodipina) .
Na Europa, observou-se que Nimotop® (nimodipina) ocasionalmente intensifica o efeito de compostos anti-hipertensivos tomados concomitantemente por pacientes que sofrem de hipertensão; esse fenômeno não foi observado em ensaios clínicos norte-americanos.
Um estudo em oito voluntários saudáveis mostrou um aumento de 50% no pico médio das concentrações plasmáticas de nimodipina e um aumento de 90% na área média sob a curva, após um curso de uma semana de cimetidina a 1.000 mg/dia e nimodipina a 90 mg/dia . Este efeito pode ser mediado pela conhecida inibição do citocromo P-450 hepático pela cimetidina, que pode diminuir o metabolismo de primeira passagem da nimodipina.
AVISOS
MORTE DEVIDO A ADMINISTRAÇÃO INTRAVENOSA INADVERTENTE: NÃO administre NIMOTOP (nimodipina) INTRAVENOSA OU POR OUTRAS VIA PARENTERAL. MORTES E EVENTOS ADVERSOS GRAVES, AMEAÇA À VIDA, INCLUINDO PARADA CARDÍACA, COLAPSO CARDIOVASCULAR, HIPOTENSÃO E BRADICARDIA, OCORRERAM QUANDO O CONTEÚDO DAS CÁPSULAS DE NIMOTOP (nimodipina) FOR INJETADO PARENTERALMENTE (VER DOSAGEM E ADMINISTRAÇÃO).
PRECAUÇÕES
Em geral: Pressão Arterial: A nimodipina tem os efeitos hemodinâmicos esperados de um bloqueador dos canais de cálcio, embora geralmente não sejam acentuados. No entanto, a administração intravenosa do conteúdo de Nimotop (nimodipina) Cápsulas resultou em graves consequências adversas, incluindo morte, parada cardíaca, colapso cardiovascular, hipotensão e bradicardia. Em pacientes com hemorragia subaracnóidea que receberam Nimotop® (nimodipina) em estudos clínicos, cerca de 5% relataram redução da pressão arterial e cerca de 1% abandonou o estudo por causa disso (nem todos podem ser atribuídos à nimodipina). No entanto, a pressão arterial deve ser cuidadosamente monitorada durante o tratamento com Nimotop® (nimodipina) com base em sua farmacologia conhecida e nos efeitos conhecidos dos bloqueadores dos canais de cálcio. (Vejo AVISOS e DOSAGEM E ADMINISTRAÇÃO )
Doença Hepática: O metabolismo de Nimotop® (nimodipina) está diminuído em pacientes com função hepática prejudicada. Esses pacientes devem ter sua pressão arterial e frequência cardíaca monitoradas de perto e devem receber uma dose mais baixa (ver DOSAGEM E ADMINISTRAÇÃO ).
Pseudo-obstrução intestinal e íleo foram relatados raramente em pacientes tratados com nimodipina. Uma relação causal não foi estabelecida. A condição respondeu à gestão conservadora.
Interações de Testes de Laboratório: Nenhum conhecido.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade: Em um estudo de dois anos, foram observadas incidências mais altas de adenocarcinoma do útero e adenoma de células de Leydig dos testículos em ratos que receberam uma dieta contendo 1800 ppm de nimodipina (equivalente a 91 a 121 mg/kg/dia de nimodipina) do que em controles placebo . As diferenças não foram estatisticamente significativas, no entanto, e as taxas mais altas estavam bem dentro do intervalo de controle histórico para esses tumores na cepa Wistar.
nimodipina não foi considerada cancerígena em um estudo de 91 semanas em camundongos, mas a alta dose de 1800 ppm de nimodipina na ração (546 a 774 mg/kg/dia) reduziu a expectativa de vida dos animais. Os estudos de mutagenicidade, incluindo os testes de Ames, micronúcleo e letal dominante foram negativos. A nimodipina não prejudicou a fertilidade e o desempenho reprodutivo geral de ratos Wistar machos e fêmeas após doses orais de até 30 mg/kg/dia quando administradas diariamente por mais de 10 semanas nos machos e 3 semanas nas fêmeas antes do acasalamento e continuado até o 7º dia de gravidez. Esta dose em um rato é cerca de 4 vezes a dose clínica equivalente de 60 mg a cada 4 horas em um paciente de 50 kg.
Gravidez: Gravidez Categoria C. Nimodipina demonstrou ter um efeito teratogênico em coelhos do Himalaia. As incidências de malformações e fetos atrofiados aumentaram com doses orais de 1 e 10 mg/kg/dia administradas (por gavagem) do dia 6 ao dia 18 de gravidez, mas não com 3,0 mg/kg/dia em um dos dois estudos idênticos em coelhos. No segundo estudo, observou-se um aumento da incidência de fetos atrofiados com 1,0 mg/kg/dia, mas não com doses mais altas. A nimodipina foi embriotóxica, causando reabsorção e crescimento atrofiado de fetos, em ratos Long Evans na dose de 100 mg/kg/dia administrada por gavagem do 6º ao 15º dia de prenhez. Em dois outros estudos em ratos, doses de 30 mg/kg/dia de nimodipina administradas por gavagem a partir do 16º dia de gestação e continuadas até o sacrifício (20º dia de gestação ou 21º dia pós-parto) foram associadas a maiores incidências de variação esquelética, fetos atrofiados e natimortos, mas sem malformações. Não existem estudos adequados e bem controlados em mulheres grávidas para avaliar diretamente o efeito em fetos humanos. A nimodipina deve ser usada durante a gravidez apenas se o benefício potencial justificar o risco potencial para o feto.
Mães que amamentam: A nimodipina e/ou seus metabólitos aparecem no leite de rato em concentrações muito mais altas do que no plasma materno. Não se sabe se a droga é excretada no leite humano. Como muitos medicamentos são excretados no leite humano, as mães que amamentam são aconselhadas a não amamentar seus bebês ao tomar o medicamento.
Uso Pediátrico: A segurança e eficácia em crianças não foram estabelecidas.
Uso Geriátrico: Os estudos clínicos de nimodipina não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente dos indivíduos mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os mais jovens. Em geral, a dosagem em pacientes idosos deve ser cautelosa, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa.
SOBREDOSAGEM
Não houve relatos de superdosagem com a administração oral de Nimotop® (nimodipina). Espera-se que os sintomas de superdosagem estejam relacionados a efeitos cardiovasculares, como vasodilatação periférica excessiva com hipotensão sistêmica acentuada. Hipotensão clinicamente significativa devido à superdosagem de Nimotop® (nimodipina) pode exigir suporte cardiovascular ativo com agentes pressores. Tratamentos específicos para superdosagem de bloqueadores dos canais de cálcio também devem ser administrados imediatamente. Uma vez que Nimotop® (nimodipina) é altamente ligado às proteínas, a diálise provavelmente não será benéfica.
CONTRA-INDICAÇÕES
Nenhum conhecido.
FARMACOLOGIA CLÍNICA
Mecanismo de ação: Nimodipina é um bloqueador dos canais de cálcio. Os processos contráteis das células musculares lisas são dependentes de íons cálcio, que entram nessas células durante a despolarização como correntes iônicas transmembrana lentas. A nimodipina inibe a transferência de íons cálcio para essas células e, assim, inibe as contrações do músculo liso vascular. Em experimentos com animais, a nimodipina teve um efeito maior nas artérias cerebrais do que nas artérias de outras partes do corpo, talvez porque seja altamente lipofílica, permitindo que ela atravesse a barreira hematoencefálica; concentrações de nimodipina tão altas quanto 12,5 ng/mL foram detectadas no líquido cefalorraquidiano de pacientes com hemorragia subaracnóidea (HSA) tratados com nimodipina. O mecanismo preciso de ação da nimodipina em humanos é desconhecido. Embora os estudos clínicos descritos abaixo demonstrem um efeito favorável da nimodipina na gravidade dos déficits neurológicos causados pelo vasoespasmo cerebral após a HAS, não há evidência arteriográfica de que a droga previna ou alivie o espasmo dessas artérias. No entanto, não se sabe se a metodologia arteriográfica utilizada foi adequada para detectar um efeito clinicamente significativo, se houver, no vasoespasmo.
Farmacocinética e Metabolismo: No homem, a nimodipina é rapidamente absorvida após administração oral e as concentrações máximas são geralmente atingidas dentro de uma hora. A meia-vida de eliminação terminal é de aproximadamente 8 a 9 horas, mas as taxas de eliminação precoce são muito mais rápidas, equivalente a uma meia-vida de 1-2 horas; uma consequência é a necessidade de administração frequente (a cada 4 horas). Não houve sinais de acúmulo quando a nimodipina foi administrada três vezes ao dia durante sete dias. A nimodipina liga-se mais de 95% às proteínas plasmáticas. A ligação foi independente da concentração na faixa de 10 ng/mL a 10 µg/mL. A nimodipina é eliminada quase exclusivamente na forma de metabólitos e menos de 1% é recuperado na urina como droga inalterada. Numerosos metabólitos, todos eles inativos ou consideravelmente menos ativos do que o composto original, foram identificados. Devido ao alto metabolismo de primeira passagem, a biodisponibilidade da nimodipina é em média 13% após administração oral. A biodisponibilidade é significativamente aumentada em pacientes com cirrose hepática, com Cmax aproximadamente o dobro dos normais, o que requer a redução da dose neste grupo de pacientes (ver DOSAGEM E ADMINISTRAÇÃO ). Em um estudo com 24 voluntários saudáveis do sexo masculino, a administração de cápsulas de nimodipina após um café da manhã padrão resultou em um pico de concentração plasmática 68% menor e biodisponibilidade 38% menor em relação à dosagem em condições de jejum.
Em um único estudo de grupo paralelo envolvendo 24 indivíduos idosos (59-79 anos) e 24 indivíduos mais jovens (22-40 anos), a AUC e Cmax observadas da nimodipina foram aproximadamente 2 vezes maiores na população idosa em comparação com o estudo mais jovem. indivíduos após administração oral (administrada como uma dose única de 30 mg e administrada até o estado de equilíbrio com 30 mg três vezes por dia por 6 dias). A resposta clínica a essas diferenças farmacocinéticas relacionadas à idade, no entanto, não foi considerada significativa. (Ver PRECAUÇÕES : Uso Geriátrico.)
Testes clínicos: nimodipina demonstrou, em 4 estudos randomizados, duplo-cegos, controlados por placebo, reduzir a gravidade dos déficits neurológicos resultantes do vasoespasmo em pacientes que tiveram hemorragia subaracnóidea (HSA) recente. Os ensaios usaram doses variando de 20 a 30 mg a 90 mg a cada 4 horas, com o medicamento administrado por 21 dias em 3 estudos e por pelo menos 18 dias no outro. Três dos quatro estudos acompanharam os pacientes por 3-6 meses. Três dos estudos estudaram pacientes relativamente bem, com todos ou a maioria dos pacientes em Hunt e Hess Graus I - III (essencialmente livres de déficits focais após o sangramento inicial) o quarto estudou pacientes muito mais doentes, Hunt e Hess Graus III - V. Dois estudos , um americano, um francês, foram semelhantes em desenho, com pacientes com HAS relativamente intactos randomizados para nimodipina ou placebo. Em cada um, foi feito um julgamento se algum déficit de desenvolvimento tardio foi devido a espasmo ou outras causas, e os déficits foram classificados. Ambos os estudos mostraram déficits graves significativamente menores devido ao espasmo no grupo da nimodipina; o segundo estudo (francês) mostrou menos déficits relacionados ao espasmo de todas as gravidades. Nenhum efeito foi observado em déficits não relacionados ao espasmo.
Um terceiro grande estudo foi realizado no Reino Unido em pacientes com HAS com todos os graus de gravidade (mas 89% estavam nos graus I-III). Nimodipina foi administrada 60mg a cada 4 horas. Os resultados não foram definidos como relacionados ao espasmo ou não, mas houve uma redução significativa na taxa geral de infarto e resultado neurológico gravemente incapacitante em 3 meses:
Um estudo canadense incluiu pacientes muito mais doentes (Hunt e Hess Graus III-V), que tiveram uma alta taxa de morte e incapacidade e usaram uma dose de 90 mg a cada 4 horas, mas foi semelhante aos dois primeiros estudos. A análise dos déficits isquêmicos tardios, muitos dos quais decorrentes de espasmo, mostrou uma redução significativa nos déficits relacionados ao espasmo. Entre os pacientes analisados (72 nimodipina, 82 placebo), houve os seguintes resultados.
Quando os dados foram combinados para os estudos do Canadá e do Reino Unido, a diferença de tratamento na taxa de sucesso (ou seja, boa recuperação) na Escala de Resultados de Glasgow foi de 25,3% (nimodipina) versus 10,9% (placebo) para Hunt e Hess Graus IV ou V. A tabela abaixo demonstra que a nimodipina tende a melhorar a boa recuperação de pacientes com HAS com mau estado neurológico pós-ictus, enquanto diminui os números com incapacidade grave e sobrevida vegetativa.
Um estudo de variação de dose comparando doses de 30, 60 e 90 mg encontrou uma taxa geralmente baixa de déficits neurológicos relacionados ao espasmo, mas nenhuma relação dose-resposta.
INFORMAÇÃO DO PACIENTE
Nenhuma informação fornecida. Por favor, consulte o AVISOS e PRECAUÇÕES Seções.
