Sustiva 200mg, 600mg Efavirenz Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Sustiva 600mg e como é usado?
Sustiva é um medicamento de prescrição usado para tratar os sintomas da infecção pelo HIV. Sustiva pode ser usado sozinho ou com outros medicamentos.
Sustiva pertence a uma classe de medicamentos chamados HIV, NNRTIs.
Não se sabe se Sustiva é seguro e eficaz em crianças com menos de 3 meses de idade.
Quais são os possíveis efeitos colaterais do Sustiva?
Sustiva pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- febre,
- dor de garganta,
- Olhos queimando,
- dor de pele,
- erupção cutânea vermelha ou roxa com bolhas e descamação,
- apreensão,
- alucinações,
- dificuldade de concentração,
- dificuldade para falar ou se mover (pode ocorrer meses ou anos após o início do medicamento),
- tontura,
- sonolência,
- confusão,
- dificuldade de concentração,
- sonhos estranhos,
- insônia,
- problemas com a fala,
- dificuldades com o seu equilíbrio ou movimento muscular,
- ansiedade,
- paranóia,
- comportamento incomum,
- sentindo-se triste ou sem esperança,
- pensamentos suicidas,
- náusea,
- dor de estômago,
- perda de apetite,
- urina escura,
- fezes cor de barro,
- amarelecimento da pele ou dos olhos (icterícia),
- suor noturno,
- glândulas inchadas,
- feridas frias,
- tosse,
- chiado,
- diarréia,
- perda de peso,
- dificuldade em engolir,
- problemas de equilíbrio ou movimento dos olhos,
- fraqueza,
- sensação espinhosa,
- inchaço no pescoço ou na garganta (tireoide aumentada),
- alterações menstruais e
- impotência
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Sustiva incluem:
- náusea,
- vômito,
- tontura,
- sonolência,
- dificuldade de concentração,
- irritação na pele,
- dor de cabeça,
- cansaço,
- problemas de sono (insônia),
- sonhos estranhos e
- alterações na forma ou localização da gordura corporal (especialmente nos braços, pernas, rosto, pescoço, seios e cintura)
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Sustiva. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
SUSTIVA® (efavirenz) é um inibidor da transcriptase reversa (NNRTI) específico do HIV-1, não nucleosídeo. O efavirenz é quimicamente descrito como (S)-6-cloro-4-(ciclopropiletinil)-1,4-di-hidro4-(trifluorometil)-2H-3,1-benzoxazin-2-ona. Sua fórmula empírica é C14H9ClF3NO2 e sua fórmula estrutural é:
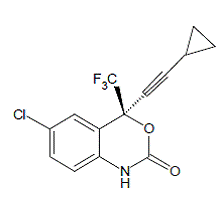
O efavirenz é um pó cristalino branco a levemente rosado com massa molecular de 315,68. É praticamente insolúvel em água (
Cápsulas
SUSTIVA está disponível em cápsulas para administração oral contendo 50 mg ou 200 mg de efavirenz e os seguintes ingredientes inativos: lactose mono-hidratada, estearato de magnésio, lauril sulfato de sódio e amidoglicolato de sódio. O invólucro da cápsula contém os seguintes ingredientes inativos e corantes: gelatina, lauril sulfato de sódio, dióxido de titânio e/ou óxido de ferro amarelo. Os invólucros das cápsulas também podem conter dióxido de silício. As cápsulas são impressas com tinta contendo azul carmim 40, azul FD&C nº 2 e dióxido de titânio.
Comprimidos
SUSTIVA 600 mg está disponível na forma de comprimidos revestidos por película para administração oral contendo 600 mg de efavirenz e os seguintes ingredientes inativos: croscarmelose sódica, hidroxipropilcelulose, lactose mono-hidratada, estearato de magnésio, celulose microcristalina e lauril sulfato de sódio. O revestimento de filme contém Opadry Yellow e Opadry Clear. As pastilhas são polidas com cera de carnaúba e impressas com tinta roxa, Opacode WB.
INDICAÇÕES
SUSTIVA® (efavirenz) em combinação com outros agentes antirretrovirais é indicado para o tratamento da infecção pelo vírus da imunodeficiência humana tipo 1 (HIV-1) em adultos e em pacientes pediátricos com pelo menos 3 meses de idade e peso mínimo de 3,5 kg.
DOSAGEM E ADMINISTRAÇÃO
Função hepática
Monitorar a função hepática antes e durante o tratamento com SUSTIVA [ver AVISOS E PRECAUÇÕES ]. SUSTIVA 600mg não é recomendado em pacientes com insuficiência hepática moderada ou grave (Child Pugh B ou C) [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Adultos
dosagem recomendada de SUSTIVA (efavirenz) é de 600 mg por via oral, uma vez ao dia, em combinação com um inibidor de protease e/ou inibidores da transcriptase reversa análogos de nucleosídeos (NRTIs). Recomenda-se que SUSTIVA seja tomado com o estômago vazio, de preferência ao deitar. As concentrações aumentadas de efavirenz observadas após a administração de SUSTIVA 600 mg com alimentos podem levar a um aumento na frequência de reações adversas [ver FARMACOLOGIA CLÍNICA ]. A dosagem na hora de dormir pode melhorar a tolerabilidade dos sintomas do sistema nervoso [ver AVISOS E PRECAUÇÕES , REAÇÕES ADVERSAS , e INFORMAÇÃO DO PACIENTE ]. As cápsulas ou comprimidos de SUSTIVA devem ser engolidos intactos com líquido. Para pacientes que não conseguem engolir cápsulas ou comprimidos, o método de administração por aspersão de cápsulas é recomendado [ver Método de administração de cápsulas aspergidas ].
Terapia Antirretroviral Concomitante
SUSTIVA deve ser administrado em combinação com outros medicamentos antirretrovirais [ver INDICAÇÕES , AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS , e FARMACOLOGIA CLÍNICA ].
Ajuste de dosagem
Se SUSTIVA 200 mg for coadministrado com voriconazol, a dose de manutenção de voriconazol deve ser aumentada para 400 mg a cada 12 horas e a dose de SUSTIVA 200 mg deve ser diminuída para 300 mg uma vez ao dia usando a formulação em cápsula (uma cápsula de 200 mg e duas cápsulas de 50 mg ou seis cápsulas de 50 mg mg cápsulas). Os comprimidos de SUSTIVA 600mg não devem ser partidos. [Vejo INTERAÇÕES MEDICAMENTOSAS e FARMACOLOGIA CLÍNICA .]
Se SUSTIVA for coadministrado com rifampicina em pacientes com peso igual ou superior a 50 kg, recomenda-se um aumento na dose de SUSTIVA 200 mg para 800 mg uma vez ao dia [ver INTERAÇÕES MEDICAMENTOSAS e FARMACOLOGIA CLÍNICA ].
Pacientes pediátricos
Recomenda-se que SUSTIVA 600mg seja tomado com o estômago vazio, de preferência ao deitar. A Tabela 1 descreve a dose recomendada de SUSTIVA para pacientes pediátricos com 3 meses de idade ou mais e pesando entre 3,5 kg e 40 kg [ver FARMACOLOGIA CLÍNICA ]. A dosagem recomendada de SUSTIVA para pacientes pediátricos com peso igual ou superior a 40 kg é de 600 mg uma vez ao dia. Para pacientes pediátricos que não conseguem engolir as cápsulas, o conteúdo das cápsulas pode ser administrado com uma pequena quantidade de alimento ou fórmula infantil usando o método de administração por aspersão de cápsulas [ver Método de administração de cápsulas aspergidas ].
Método de administração de cápsulas aspergidas
Para pacientes pediátricos com pelo menos 3 meses de idade e pesando pelo menos 3,5 kg e adultos que não conseguem engolir cápsulas ou comprimidos, o conteúdo da cápsula pode ser administrado com uma pequena quantidade (1 a 2 colheres de chá) de alimento. O uso de fórmula infantil para mistura deve ser considerado apenas para os bebês que não podem consumir alimentos sólidos de forma confiável. Pacientes e cuidadores devem ser instruídos a abrir a cápsula com cuidado para evitar derramamento ou dispersão do conteúdo da cápsula no ar. A cápsula deve ser mantida horizontalmente sobre um pequeno recipiente e cuidadosamente torcida para abrir. Para pacientes capazes de tolerar alimentos sólidos, todo o conteúdo da cápsula deve ser misturado suavemente com um alimento macio apropriado para a idade, como compota de maçã, geleia de uva ou iogurte, no pequeno recipiente. Para lactentes pequenos que recebem a mistura de fórmula infantil de aspersão em cápsulas, todo o conteúdo da cápsula deve ser misturado suavemente em 2 colheres de chá de fórmula infantil reconstituída em temperatura ambiente em um pequeno recipiente, mexendo cuidadosamente com uma colher pequena e, em seguida, colocando a mistura em um recipiente de 10 mL seringa de dosagem oral para administração. Após a administração da mistura SUSTIVA-alimento ou fórmula, uma pequena quantidade adicional (aproximadamente 2 colheres de chá) de alimento ou fórmula deve ser adicionada ao recipiente de mistura vazio, agitado para dispersar qualquer resíduo de SUSTIVA remanescente e administrado ao paciente. A mistura SUSTIVA-alimento ou fórmula deve ser administrada dentro de 30 minutos após a mistura. Nenhum alimento adicional deve ser consumido por 2 horas após a administração de SUSTIVA.
Mais instruções ao paciente sobre o método de administração por aspersão de cápsulas são fornecidas na bula do paciente aprovada pela FDA (consulte INFORMAÇÃO DO PACIENTE e INSTRUÇÕES DE USO ).
COMO FORNECIDO
Formas de dosagem e pontos fortes
Cápsulas
As cápsulas de 200 mg são douradas, impressas no verso com “SUSTIVA” no corpo e “200 mg” impresso na tampa.
As cápsulas de 50 mg são douradas e brancas, impressas com “SUSTIVA” na tampa dourada e “50 mg” impresso no verso no corpo branco.
Comprimidos
Os comprimidos de 600 mg são amarelos, em forma de cápsula, revestidos por película, com “SUSTIVA” impresso em ambos os lados.
Armazenamento e manuseio
Cápsulas
As cápsulas de SUSTIVA® (efavirenz) estão disponíveis da seguinte forma:
As cápsulas de 200 mg são douradas, impressas no verso com “SUSTIVA” no corpo e “200 mg” impresso na tampa.
Garrafas de 90 - NDC 0056-0474-92
As cápsulas de 50 mg são douradas e brancas, impressas com “SUSTIVA” na tampa dourada e “50 mg” impresso no verso no corpo branco.
Garrafas de 30 - NDC 0056-0470-30
Comprimidos
Os comprimidos de SUSTIVA® (efavirenz) estão disponíveis da seguinte forma:
Os comprimidos de 600 mg são comprimidos revestidos por película amarelos, em forma de cápsula, com “SUSTIVA” impresso em ambos os lados.
Garrafas de 30 - NDC 0056-0510-30
Armazenar
As cápsulas de SUSTIVA 600mg e os comprimidos de SUSTIVA devem ser armazenados a 25°C (77°F); excursões permitidas para 15°C-30°C (59°F-86°F) [veja USP Controlled Room Temperature].
Distribuído por: Bristol-Myers Squibb Company Princeton, NJ 08543 EUA. Revisado: outubro de 2020
EFEITOS COLATERAIS
As reações adversas mais significativas observadas em pacientes tratados com SUSTIVA são:
- sintomas psiquiátricos [ver AVISOS E PRECAUÇÕES ],
- sintomas do sistema nervoso [ver AVISOS E PRECAUÇÕES ],
- erupção cutânea [ver AVISOS E PRECAUÇÕES ].
- hepatotoxicidade [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os estudos clínicos são conduzidos em condições muito variadas, as taxas de reações adversas relatadas não podem ser diretamente comparadas às taxas de outros estudos clínicos e podem não refletir as taxas observadas na prática clínica.
Reações Adversas em Adultos
As reações adversas mais comuns (>5% em qualquer grupo de tratamento com efavirenz) de gravidade pelo menos moderada entre os pacientes no Estudo 006 tratados com SUSTIVA 200mg em combinação com zidovudina/lamivudina ou indinavir foram erupção cutânea, tontura, náusea, dor de cabeça, fadiga, insônia, e vômitos.
As reações adversas clínicas selecionadas de intensidade moderada ou grave observadas em ≥2% dos pacientes tratados com SUSTIVA em dois ensaios clínicos controlados são apresentadas na Tabela 2.
Pancreatite foi relatada, embora uma relação causal com efavirenz não tenha sido estabelecida. Aumentos assintomáticos nos níveis séricos de amilase foram observados em um número significativamente maior de pacientes tratados com efavirenz 600 mg do que em pacientes controle (ver Anormalidades laboratoriais ).
Sintomas do sistema nervoso
Para 1.008 pacientes tratados com regimes contendo SUSTIVA e 635 pacientes tratados com regime controle em estudos controlados, a Tabela 3 lista a frequência dos sintomas de diferentes graus de gravidade e fornece as taxas de descontinuação de um ou mais dos seguintes sintomas do sistema nervoso: tontura, insônia, concentração prejudicada, sonolência, sonhos anormais, euforia, confusão, agitação, amnésia, alucinações, estupor, pensamento anormal e despersonalização [ver AVISOS E PRECAUÇÕES ]. As frequências de sintomas específicos do sistema nervoso central e periférico são fornecidas na Tabela 2.
Sintomas psiquiátricos
Foram notificadas experiências adversas psiquiátricas graves em doentes tratados com SUSTIVA. Em estudos controlados, os sintomas psiquiátricos observados com frequência superior a 2% entre os pacientes tratados com SUSTIVA 600mg ou regimes de controle, respectivamente, foram depressão (19%, 16%), ansiedade (13%, 9%) e nervosismo (7% , 2%).
Irritação na pele
Em ensaios clínicos controlados, a frequência de erupções cutâneas (todos os graus, independentemente da causalidade) foi de 26% para 1.008 adultos tratados com regimes contendo SUSTIVA 200mg e 17% para 635 adultos tratados com um regime de controle. A maioria dos relatos de erupção cutânea foi de gravidade leve ou moderada. A frequência de erupções cutâneas de Grau 3 foi de 0,8% para pacientes tratados com SUSTIVA e 0,3% para grupos de controle, e a frequência de erupções cutâneas de Grau 4 foi de 0,1% para SUSTIVA e 0 para grupos de controle. As taxas de descontinuação como resultado de erupção cutânea foram de 1,7% para pacientes tratados com SUSTIVA e 0,3% para grupos de controle [ver AVISOS E PRECAUÇÕES ].
A experiência com SUSTIVA em pacientes que descontinuaram outros agentes antirretrovirais da classe NNRTI é limitada. Dezenove pacientes que descontinuaram a nevirapina devido a erupção cutânea foram tratados com SUSTIVA. Nove desses pacientes desenvolveram erupção cutânea leve a moderada durante o tratamento com SUSTIVA, e dois desses pacientes descontinuaram devido a erupção cutânea.
Anormalidades laboratoriais
Anormalidades laboratoriais selecionadas de Grau 3-4 relatadas em ≥2% dos pacientes tratados com SUSTIVA em dois ensaios clínicos são apresentadas na Tabela 4.
Pacientes coinfectados com hepatite B ou C
Os testes de função hepática devem ser monitorados em pacientes com histórico de hepatite B e/ou C. No conjunto de dados de longo prazo do Estudo 006, 137 pacientes tratados com regimes contendo SUSTIVA (duração média da terapia, 68 semanas) e 84 tratados com um regime de controle (duração mediana, 56 semanas) foram soropositivos na triagem para hepatite B (positivo de antígeno de superfície) e/ou C (positivo de anticorpo de hepatite C). Entre esses pacientes coinfectados, elevações na AST para mais de cinco vezes o LSN desenvolveram-se em 13% dos pacientes nos braços SUSTIVA e 7% daqueles no braço controle, e elevações na ALT para mais de cinco vezes o LSN desenvolveram-se em 20% dos pacientes nos braços SUSTIVA e 7% dos pacientes no braço controle. Entre os pacientes coinfectados, 3% daqueles tratados com regimes contendo SUSTIVA e 2% no braço controle descontinuaram o estudo devido a distúrbios hepáticos ou do sistema biliar [ver AVISOS E PRECAUÇÕES ].
Lipídios
Em alguns voluntários não infectados que receberam SUSTIVA, foram observados aumentos de 10-20% no colesterol total em relação à linha de base. Em pacientes tratados com SUSTIVA + zidovudina + lamivudina, foram observados aumentos desde o início do colesterol total não em jejum e HDL de aproximadamente 20% e 25%, respectivamente. Em pacientes tratados com SUSTIVA + indinavir, foram observados aumentos em relação aos valores basais de colesterol não-jejum e HDL de aproximadamente 40% e 35%, respectivamente. Níveis de colesterol total sem jejum ≥240 mg/dL e ≥300 mg/dL foram relatados em 34% e 9%, respectivamente, dos pacientes tratados com SUSTIVA + zidovudina + lamivudina; 54% e 20%, respectivamente, dos pacientes tratados com SUSTIVA + indinavir; e 28% e 4%, respectivamente, dos pacientes tratados com indinavir + zidovudina + lamivudina. Os efeitos de SUSTIVA 600mg sobre triglicerídeos e LDL neste estudo não foram bem caracterizados, uma vez que amostras foram coletadas de pacientes que não estavam em jejum. O significado clínico desses achados é desconhecido [ver AVISOS E PRECAUÇÕES ].
Reações Adversas em Pacientes Pediátricos
Como os estudos clínicos são conduzidos em condições muito variadas, as taxas de reações adversas relatadas não podem ser diretamente comparadas às taxas de outros estudos clínicos e podem não refletir as taxas observadas na prática clínica.
avaliação das reações adversas é baseada em três ensaios clínicos em 182 pacientes pediátricos infectados pelo HIV-1 (3 meses a 21 anos de idade) que receberam SUSTIVA 200 mg em combinação com outros agentes antirretrovirais por uma média de 123 semanas. As reações adversas observadas nos três ensaios foram semelhantes às observadas em ensaios clínicos em adultos, exceto que a erupção cutânea foi mais comum em pacientes pediátricos (32% para todos os graus, independentemente da causalidade) e mais frequentemente de grau superior (ou seja, mais grave). Dois (1,1%) pacientes pediátricos apresentaram erupção cutânea de grau 3 (erupção cutânea confluente com febre, erupção cutânea generalizada) e quatro (2,2%) pacientes pediátricos apresentaram erupção cutânea de grau 4 (todos eritema multiforme). Cinco pacientes pediátricos (2,7%) descontinuaram o estudo devido a erupção cutânea [ver AVISOS E PRECAUÇÕES ].
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de SUSTIVA. Como essas reações são relatadas voluntariamente por uma população de tamanho desconhecido, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Corpo como um todo: reações alérgicas, astenia, redistribuição/acúmulo de gordura corporal [ver AVISOS E PRECAUÇÕES ]
Sistema Nervoso Central e Periférico: coordenação anormal, ataxia, encefalopatia, coordenação cerebelar e distúrbios do equilíbrio, convulsões, hipoestesia, parestesia, neuropatia, tremor, vertigem
Endócrino: ginecomastia
Gastrointestinal: constipação, má absorção
Cardiovascular: rubor, palpitações
Fígado e Sistema Biliar: aumento das enzimas hepáticas, insuficiência hepática, hepatite.
Metabólico e Nutricional: hipercolesterolemia, hipertrigliceridemia
Musculoesquelético: artralgia, mialgia, miopatia
Psiquiátrico: reações agressivas, agitação, delírios, labilidade emocional, mania, neurose, paranóia, psicose, suicídio, catatonia
Respiratório: dispnéia
Pele e anexos: eritema multiforme, dermatite fotoalérgica, síndrome de Stevens-Johnson
Sentidos Especiais: visão anormal, zumbido
INTERAÇÕES MEDICAMENTOSAS
Potencial para SUSTIVA afetar outras drogas
O efavirenz demonstrou in vivo induzir CYP3A e CYP2B6. Outros compostos que são substratos de CYP3A ou CYP2B6 podem ter concentrações plasmáticas diminuídas quando coadministrados com SUSTIVA.
Potencial para outras drogas afetarem a SUSTIVA
Espera-se que os medicamentos que induzem a atividade do CYP3A (por exemplo, fenobarbital, rifampicina, rifabutina) aumentem a depuração do efavirenz resultando em concentrações plasmáticas mais baixas DOSAGEM E ADMINISTRAÇÃO ].
Drogas Prolongadoras do QT
Há informações limitadas disponíveis sobre o potencial de interação farmacodinâmica entre SUSTIVA 600mg e medicamentos que prolongam o intervalo QTc. Foi observado prolongamento do intervalo QTc com o uso de efavirenz [ver FARMACOLOGIA CLÍNICA ]. Considerar alternativas ao SUSTIVA 600mg quando coadministrado com um medicamento com risco conhecido de Torsade de Pointes.
Estabelecidas e outras interações medicamentosas potencialmente significativas
As interações medicamentosas com SUSTIVA estão resumidas na Tabela 5. Para dados farmacocinéticos, [ver FARMACOLOGIA CLÍNICA ] Tabelas 7 e 8. Esta tabela inclui interações potencialmente significativas, mas não inclui tudo.
Medicamentos sem interações clinicamente significativas com SUSTIVA
Não é recomendado ajuste de dose quando SUSTIVA 600 mg é administrado com os seguintes: antiácidos de hidróxido de alumínio/magnésio, azitromicina, cetirizina, famotidina, fluconazol, lorazepam, nelfinavir, inibidores nucleosídeos da transcriptase reversa (abacavir, emtricitabina, lamivudina, estavudina, tenofovir disoproxil fumarato, zidovudina ), paroxetina e raltegravir.
Interação do teste de canabinóides
O efavirenz não se liga aos receptores canabinóides. Resultados falso-positivos de testes de canabinóides na urina foram relatados com alguns ensaios de triagem em indivíduos não infectados e infectados pelo HIV recebendo efavirenz. Recomenda-se a confirmação de testes de triagem positivos para canabinóides por um método mais específico.
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Interações medicamentosas
As concentrações plasmáticas de efavirenz podem ser alteradas por substratos, inibidores ou indutores de CYP3A. Da mesma forma, o efavirenz pode alterar as concentrações plasmáticas de drogas metabolizadas por CYP3A ou CYP2B6. O efeito mais proeminente do efavirenz no estado de equilíbrio é a indução de CYP3A e CYP2B6 [ver DOSAGEM E ADMINISTRAÇÃO e INTERAÇÕES MEDICAMENTOSAS ].
Prolongamento do QTc
Foi observado prolongamento do intervalo QTc com o uso de efavirenz [ver INTERAÇÕES MEDICAMENTOSAS e FARMACOLOGIA CLÍNICA ]. Considerar alternativas ao SUSTIVA 600mg quando coadministrado com um medicamento com risco conhecido de Torsade de Pointes ou quando administrado a pacientes com maior risco de Torsade de Pointes.
Resistência
SUSTIVA 200mg não deve ser usado como agente único para tratar a infecção por HIV-1 ou adicionado como agente único a um regime que falhou. O vírus resistente emerge rapidamente quando o efavirenz é administrado em monoterapia. A escolha de novos agentes antirretrovirais a serem usados em combinação com efavirenz deve levar em consideração o potencial de resistência cruzada viral.
Coadministração com produtos relacionados
coadministração de SUSTIVA com ATRIPLA (efavirenz 600 mg/emtricitabina 200 mg/tenofovir disoproxil fumarato 300 mg) não é recomendada, a menos que seja necessário para ajuste de dose (por exemplo, com rifampicina), uma vez que o efavirenz é um dos seus ingredientes ativos.
Sintomas psiquiátricos
Foram notificadas experiências adversas psiquiátricas graves em doentes tratados com SUSTIVA. Em estudos controlados de 1.008 pacientes tratados com regimes contendo SUSTIVA 600mg por uma média de 2,1 anos e 635 pacientes tratados com regimes de controle por uma média de 1,5 anos, a frequência (independentemente da causalidade) de eventos psiquiátricos graves específicos entre pacientes que receberam SUSTIVA ou regimes de controle, respectivamente, foram depressão grave (2,4%, 0,9%), ideação suicida (0,7%, 0,3%), tentativas de suicídio não fatais (0,5%, 0), comportamento agressivo (0,4%, 0,5%), reações paranóides (0,4 %, 0,3%) e reações maníacas (0,2%, 0,3%). Quando sintomas psiquiátricos semelhantes aos observados acima foram combinados e avaliados como um grupo em uma análise multifatorial dos dados do Estudo 006, o tratamento com efavirenz foi associado a um aumento na ocorrência desses sintomas psiquiátricos selecionados. Outros fatores associados a um aumento na ocorrência desses sintomas psiquiátricos foram história de uso de drogas injetáveis, história psiquiátrica e uso de medicação psiquiátrica no início do estudo; associações semelhantes foram observadas em ambos os grupos de tratamento SUSTIVA e controle. No Estudo 006, o aparecimento de novos sintomas psiquiátricos graves ocorreu ao longo do estudo para pacientes tratados com SUSTIVA e tratados com SUSTIVA. Um por cento dos pacientes tratados com SUSTIVA descontinuaram ou interromperam o tratamento devido a um ou mais desses sintomas psiquiátricos selecionados. Também houve relatos ocasionais pós-comercialização de morte por suicídio, delírios e comportamento semelhante a psicose, embora uma relação causal com o uso de SUSTIVA não possa ser determinada a partir desses relatos. Casos pós-comercialização de catatonia também foram relatados e podem estar associados ao aumento da exposição ao efavirenz. Pacientes com experiências adversas psiquiátricas graves devem procurar avaliação médica imediata para avaliar a possibilidade de que os sintomas possam estar relacionados ao uso de SUSTIVA e, em caso afirmativo, determinar se os riscos da terapia continuada superam os benefícios. [Vejo REAÇÕES ADVERSAS .]
Sintomas do sistema nervoso
Cinquenta e três por cento (531/1008) dos pacientes que receberam SUSTIVA 600mg em estudos controlados relataram sintomas do sistema nervoso central (qualquer grau, independentemente da causalidade) em comparação com 25% (156/635) dos pacientes que receberam regimes de controle [ver REAÇÕES ADVERSAS ]. Esses sintomas incluíam, mas não se limitavam a, tontura (28,1% dos 1.008 pacientes), insônia (16,3%), concentração prejudicada (8,3%), sonolência (7,0%), sonhos anormais (6,2%) e alucinações (1,2 %). Esses sintomas foram graves em 2,0% dos pacientes; e 2,1% dos pacientes descontinuaram a terapia como resultado. Esses sintomas geralmente começam durante o primeiro ou segundo dia de terapia e geralmente desaparecem após as primeiras 2-4 semanas de terapia. Após 4 semanas de terapia, a prevalência de sintomas do sistema nervoso de gravidade pelo menos moderada variou de 5% a 9% em pacientes tratados com esquemas contendo SUSTIVA e de 3% a 5% em pacientes tratados com esquema controle. Os pacientes devem ser informados de que esses sintomas comuns tendem a melhorar com a continuação da terapia e não são preditivos do início subsequente dos sintomas psiquiátricos menos frequentes [ver Sintomas psiquiátricos ]. A dosagem na hora de dormir pode melhorar a tolerabilidade desses sintomas do sistema nervoso [ver DOSAGEM E ADMINISTRAÇÃO ].
análise dos dados de longo prazo do Estudo 006 (seguimento médio de 180 semanas, 102 semanas e 76 semanas para pacientes tratados com SUSTIVA + zidovudina + lamivudina, SUSTIVA + indinavir e indinavir + zidovudina + lamivudina, respectivamente) mostrou que, além Após 24 semanas de terapia, as incidências de novos sintomas do sistema nervoso entre os pacientes tratados com SUSTIVA foram geralmente semelhantes às do braço de controle contendo indinavir.
neurotoxicidade de início tardio, incluindo ataxia e encefalopatia (alteração da consciência, confusão, lentificação psicomotora, psicose, delírio), pode ocorrer meses a anos após o início da terapia com efavirenz. Alguns eventos de neurotoxicidade de início tardio ocorreram em pacientes com polimorfismos genéticos CYP2B6 que estão associados a níveis aumentados de efavirenz apesar da dosagem padrão de SUSTIVA. Pacientes que apresentem sinais e sintomas de reações adversas neurológicas graves devem ser avaliados imediatamente para avaliar a possibilidade de que esses eventos possam estar relacionados ao uso de efavirenz e se a descontinuação de SUSTIVA 600mg é justificada.
Pacientes recebendo SUSTIVA 600 mg devem ser alertados para o potencial de efeitos aditivos no sistema nervoso central quando SUSTIVA 200 mg é usado concomitantemente com álcool ou drogas psicoativas.
Pacientes que apresentam sintomas do sistema nervoso central, como tontura, concentração prejudicada e/ou sonolência, devem evitar tarefas potencialmente perigosas, como dirigir ou operar máquinas.
Toxicidade Embrio-Fetal
O efavirenz pode causar danos ao feto quando administrado durante o primeiro trimestre a uma mulher grávida. Aconselhar as mulheres com potencial reprodutivo que estejam recebendo SUSTIVA 600mg para evitar a gravidez. [Vejo Uso em populações específicas .]
Irritação na pele
Em ensaios clínicos controlados, 26% (266/1008) dos pacientes adultos tratados com 600 mg de SUSTIVA apresentaram erupção cutânea de início recente em comparação com 17% (111/635) dos tratados em grupos de controle [ver REAÇÕES ADVERSAS ]. Erupção cutânea associada a bolhas, descamação úmida ou ulceração ocorreu em 0,9% (9/1008) dos pacientes tratados com SUSTIVA. A incidência de erupção cutânea de Grau 4 (por exemplo, eritema multiforme, síndrome de Stevens-Johnson) em pacientes adultos tratados com SUSTIVA em todos os estudos e acesso expandido foi de 0,1%. As erupções cutâneas são geralmente erupções cutâneas maculopapulares leves a moderadas que ocorrem nas primeiras 2 semanas após o início da terapia com efavirenz (o tempo médio para o início da erupção em adultos foi de 11 dias) e, na maioria dos pacientes que continuam a terapia com efavirenz, a erupção desaparece em 1 mês (duração mediana, 16 dias). A taxa de descontinuação de erupção cutânea em ensaios clínicos em adultos foi de 1,7% (17/1008).
Erupção cutânea foi relatada em 59 de 182 pacientes pediátricos (32%) tratados com SUSTIVA [ver REAÇÕES ADVERSAS ]. Dois pacientes pediátricos apresentaram erupção cutânea de grau 3 (erupção cutânea confluente com febre, erupção cutânea generalizada) e quatro pacientes apresentaram erupção cutânea de grau 4 (eritema multiforme). O tempo médio para o aparecimento de erupção cutânea em pacientes pediátricos foi de 28 dias (intervalo de 3-1642 dias). Deve ser considerada a profilaxia com anti-histamínicos apropriados antes de iniciar a terapêutica com SUSTIVA em doentes pediátricos.
SUSTIVA 600mg geralmente pode ser reiniciado em pacientes que interrompem a terapia devido a erupção cutânea. SUSTIVA 200mg deve ser descontinuado em pacientes que desenvolvam erupção cutânea grave associada a bolhas, descamação, envolvimento de mucosas ou febre. Anti-histamínicos e/ou corticosteroides apropriados podem melhorar a tolerabilidade e acelerar a resolução do exantema. Para pacientes que tiveram uma reação cutânea com risco de vida (por exemplo, síndrome de Stevens-Johnson), terapia alternativa deve ser considerada [ver CONTRA-INDICAÇÕES ].
Hepatotoxicidade
Casos de hepatite pós-comercialização, incluindo hepatite fulminante que progrediu para insuficiência hepática requerendo transplante ou resultando em morte, foram relatados em pacientes tratados com SUSTIVA. Os relatórios incluíram pacientes com doença hepática subjacente, incluindo coinfecção com hepatite B ou C, e pacientes sem doença hepática pré-existente ou outros fatores de risco identificáveis.
SUSTIVA 600mg não é recomendado para pacientes com insuficiência hepática moderada ou grave. Recomenda-se monitoramento cuidadoso para pacientes com insuficiência hepática leve recebendo SUSTIVA. [Vejo REAÇÕES ADVERSAS e Uso em populações específicas ].
O monitoramento das enzimas hepáticas antes e durante o tratamento é recomendado para todos os pacientes [ver DOSAGEM E ADMINISTRAÇÃO ].
Considerar a descontinuação de SUSTIVA 600mg em pacientes com elevações persistentes das transaminases séricas acima de cinco vezes o limite superior da faixa normal.Descontinuar SUSTIVA 200mg se a elevação das transaminases séricas for acompanhada por sinais ou sintomas clínicos de hepatite ou descompensação hepática.
Convulsões
Convulsões foram observadas em pacientes adultos e pediátricos recebendo efavirenz, geralmente na presença de histórico médico conhecido de convulsões [ver Toxicologia não clínica ]. Deve-se ter cautela em qualquer paciente com histórico de convulsões. Pacientes que estão recebendo concomitantemente medicamentos anticonvulsivantes metabolizados principalmente pelo fígado, como fenitoína e fenobarbital, podem necessitar de monitoramento periódico dos níveis plasmáticos [ver INTERAÇÕES MEDICAMENTOSAS ].
Elevações de Lipídios
O tratamento com SUSTIVA resultou em aumentos na concentração de colesterol total e triglicerídeos [ver REAÇÕES ADVERSAS ]. Testes de colesterol e triglicerídeos devem ser realizados antes de iniciar a terapia com SUSTIVA 200mg e em intervalos periódicos durante a terapia.
Síndrome de Reconstituição Imune
síndrome de reconstituição imune foi relatada em pacientes tratados com terapia antirretroviral combinada, incluindo SUSTIVA. Durante a fase inicial do tratamento antirretroviral combinado, os pacientes cujo sistema imunológico responde pode desenvolver uma resposta inflamatória a infecções oportunistas indolentes ou residuais (como infecção por Mycobacterium avium, citomegalovírus, pneumonia por Pneumocystis jiroveci [PCP] ou tuberculose), que podem necessitar de avaliação adicional e tratamento.
Distúrbios autoimunes (como doença de Graves, polimiosite, síndrome de Guillain-Barré e hepatite autoimune) também foram relatados no contexto de reconstituição imune; no entanto, o tempo de início é mais variável e pode ocorrer muitos meses após o início do tratamento.
Redistribuição de gordura
Redistribuição/acúmulo de gordura corporal, incluindo obesidade central, aumento da gordura dorsocervical (corcova de búfalo), perda periférica, perda facial, aumento das mamas e “aparência cushingoide” foram observados em pacientes recebendo terapia antirretroviral. O mecanismo e as consequências a longo prazo desses eventos são atualmente desconhecidos. Uma relação causal não foi estabelecida.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( INFORMAÇÃO DO PACIENTE e Instruções de uso ).
Interações medicamentosas
Uma declaração aos pacientes e profissionais de saúde está incluída nos rótulos dos frascos do produto: ALERTA: Informe-se sobre os medicamentos que NÃO devem ser tomados com SUSTIVA.
SUSTIVA pode interagir com alguns medicamentos; portanto, aconselhe os pacientes a relatar ao seu médico o uso de qualquer outro medicamento prescrito ou não prescrito.
Informações gerais para pacientes
Informe os pacientes que SUSTIVA 200mg não é uma cura para a infecção pelo HIV-1 e que os pacientes podem continuar a apresentar doenças associadas à infecção pelo HIV-1, incluindo infecções oportunistas. Os doentes devem permanecer sob os cuidados de um médico enquanto estiverem a tomar SUSTIVA.
Aconselhe os pacientes a evitar fazer coisas que possam espalhar a infecção pelo HIV-1 para outras pessoas.
- Não compartilhe ou reutilize agulhas ou outros equipamentos de injeção.
- Não compartilhe itens pessoais que possam conter sangue ou fluidos corporais, como escovas de dentes e lâminas de barbear.
- Não faça nenhum tipo de sexo sem proteção. Sempre pratique sexo seguro usando um preservativo de látex ou poliuretano para diminuir a chance de contato sexual com sêmen, secreções vaginais ou sangue.
- Não amamente. Mães com HIV-1 não devem amamentar porque o HIV-1 pode ser passado para o bebê no leite materno.
Instruções de dosagem
Aconselhe os pacientes a tomar SUSTIVA todos os dias conforme prescrito. Se um paciente se esquecer de tomar SUSTIVA, diga ao paciente para tomar a dose esquecida imediatamente, a menos que esteja quase na hora da próxima dose. Aconselhe o paciente a não tomar 2 doses de uma só vez e a tomar a próxima dose no horário regular. Aconselhe o paciente a perguntar a um profissional de saúde se ele precisa de ajuda para planejar os melhores horários para tomar seu medicamento.
SUSTIVA 200mg deve sempre ser usado em combinação com outros medicamentos antirretrovirais. Aconselhe os pacientes a tomar SUSTIVA 600mg com o estômago vazio, de preferência ao deitar. Tomar SUSTIVA com alimentos aumenta as concentrações de efavirenz e pode aumentar a frequência de reações adversas. A dosagem na hora de dormir pode melhorar a tolerabilidade dos sintomas do sistema nervoso [ver DOSAGEM E ADMINISTRAÇÃO e REAÇÕES ADVERSAS ]. Os profissionais de saúde devem ajudar os pais ou cuidadores a determinar o melhor esquema de dosagem de SUSTIVA para bebês e crianças pequenas.
Para pacientes adultos e pediátricos que não conseguem engolir cápsulas ou comprimidos, os pacientes ou seus cuidadores devem ser aconselhados a ler e seguir cuidadosamente as instruções para administrar o conteúdo da cápsula em uma pequena quantidade de alimento ou fórmula infantil [ver DOSAGEM E ADMINISTRAÇÃO e rotulagem do paciente aprovada pela FDA ( INFORMAÇÃO DO PACIENTE e INSTRUÇÕES DE USO )]. Os pacientes devem ligar para seu médico ou farmacêutico se tiverem alguma dúvida.
Sintomas do sistema nervoso
Informe os pacientes que sintomas do sistema nervoso central (NSS), incluindo tontura, insônia, concentração prejudicada, sonolência e sonhos anormais são comumente relatados durante as primeiras semanas de terapia com SUSTIVA [ver AVISOS E PRECAUÇÕES ]. A dosagem na hora de dormir pode melhorar a tolerabilidade desses sintomas, que provavelmente melhorarão com a continuação da terapia. Alertar os pacientes para o potencial de efeitos aditivos quando SUSTIVA é usado concomitantemente com álcool ou drogas psicoativas. Instruir os pacientes que, se apresentarem NSS, devem evitar tarefas potencialmente perigosas, como dirigir ou operar máquinas.
Informar os pacientes que existe o risco de desenvolver neurotoxicidade de início tardio, incluindo ataxia e encefalopatia, que podem ocorrer meses a anos após o início da terapia com SUSTIVA [ver AVISOS E PRECAUÇÕES ].
Sintomas psiquiátricos
Informar os pacientes que sintomas psiquiátricos graves, incluindo depressão grave, tentativas de suicídio, comportamento agressivo, delírios, paranóia, sintomas semelhantes a psicose e catatonia foram relatados em pacientes recebendo SUSTIVA [ver AVISOS E PRECAUÇÕES ]. Se experimentarem experiências adversas psiquiátricas graves, devem procurar avaliação médica imediata. Aconselhe os pacientes a informar seu médico sobre qualquer histórico de doença mental ou abuso de substâncias.
Irritação na pele
Informe os pacientes que um efeito colateral comum é erupção cutânea [ver AVISOS E PRECAUÇÕES ]. As erupções geralmente desaparecem sem qualquer alteração no tratamento. No entanto, como a erupção cutânea pode ser grave, aconselhe os pacientes a contatar seu médico imediatamente se ocorrer erupção cutânea.
Hepatotoxicidade
Informe os pacientes para observar os primeiros sinais de alerta de inflamação ou insuficiência hepática, como fadiga, fraqueza, falta de apetite, náuseas e vômitos, bem como sinais posteriores, como icterícia, confusão, inchaço abdominal e fezes descoloridas, e consultar seu médico. profissional de saúde sem demora se tais sintomas ocorrerem [ver AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS ].
Fêmeas com potencial reprodutivo
Aconselhe as mulheres com potencial reprodutivo a utilizarem métodos contracetivos eficazes, bem como um método de barreira durante o tratamento com SUSTIVA 600 mg e durante 12 semanas após a descontinuação de SUSTIVA. Aconselhe as pacientes a entrar em contato com seu médico se planejarem engravidar, engravidar ou se houver suspeita de gravidez durante o tratamento com SUSTIVA [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
Registro de Exposição à Gravidez
Avisar as pacientes que existe um registro de exposição na gravidez que monitora os resultados da gravidez em mulheres expostas a SUSTIVA durante a gravidez [ver Uso em populações específicas ].
Redistribuição de gordura
Informar os pacientes que pode ocorrer redistribuição ou acúmulo de gordura corporal em pacientes recebendo terapia antirretroviral e que a causa e os efeitos a longo prazo dessas condições na saúde não são conhecidos [ver AVISOS E PRECAUÇÕES ].
SUSTIVA é uma marca registrada da Bristol-Myers Squibb Pharma Company. ATRIPLA é uma marca comercial da Bristol-Myers Squibb & Gilead Sciences, LLC.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Estudos de carcinogenicidade de longo prazo em camundongos e ratos foram realizados com efavirenz. Os camundongos receberam doses de 0, 25, 75, 150 ou 300 mg/kg/dia por 2 anos. Incidências de adenomas e carcinomas hepatocelulares e adenomas pulmonares alveolares/bronquiolares aumentaram acima do histórico em mulheres. Não foram observados aumentos na incidência de tumor acima do nível de fundo em homens. Não houve NOAEL em mulheres estabelecido para este estudo porque os achados tumorais ocorreram em todas as doses. A AUC no NOAEL (150 mg/kg) nos machos foi aproximadamente 0,9 vezes a dos humanos na dose clínica recomendada. No estudo em ratos, não foram observados aumentos na incidência de tumores com doses de até 100 mg/kg/dia, para as quais as AUCs foram 0,1 (machos) ou 0,2 (fêmeas) vezes aquelas em humanos na dose clínica recomendada.
Mutagênese
efavirenz foi negativo em uma bateria de ensaios de genotoxicidade in vitro e in vivo. Estes incluíram ensaios de mutação bacteriana em S.typhimurium e E. coli, ensaios de mutação de mamífero em células de ovário de hamster chinês, ensaios de aberração cromossômica em linfócitos de sangue periférico humano ou células de ovário de hamster chinês e um ensaio de micronúcleo de medula óssea de camundongo in vivo.
Prejuízo da Fertilidade
O efavirenz não prejudicou o acasalamento ou a fertilidade de ratos machos ou fêmeas e não afetou o esperma de ratos machos tratados. O desempenho reprodutivo da prole nascida de ratas que receberam efavirenz não foi afetado. As AUCs nos valores NOAEL em ratos machos (200 mg/kg) e fêmeas (100 mg/kg) foram aproximadamente ≤ 0,15 vezes maiores que em humanos na dose clínica recomendada.
Uso em populações específicas
Gravidez
Registro de Exposição à Gravidez
Existe um registo de exposição à gravidez que monitoriza os resultados da gravidez em mulheres expostas a SUSTIVA 600 mg durante a gravidez. Os médicos são incentivados a registrar pacientes ligando para o Registro de Gravidez Antirretroviral no número 1-800-258-4263.
Resumo do risco
Existem relatos de casos retrospectivos de defeitos do tubo neural em bebês cujas mães foram expostas a regimes contendo efavirenz no primeiro trimestre de gravidez. Os dados prospectivos de gravidez do Registro de Gravidez Antirretroviral não são suficientes para avaliar adequadamente esse risco. Os dados disponíveis do Antiretroviral Pregnancy Registry não mostram diferença no risco geral de defeitos congênitos maiores em comparação com a taxa básica de defeitos congênitos maiores de 2,7% na população de referência dos EUA do Programa Metropolitano de Defeitos Congênitos de Atlanta (MACDP). Embora não tenha sido estabelecida uma relação causal entre a exposição ao efavirenz no primeiro trimestre e defeitos do tubo neural, foram observadas malformações semelhantes em estudos realizados em macacos com doses semelhantes à dose humana. Além disso, toxicidades fetais e embrionárias ocorreram em ratos, em uma dose dez vezes menor do que a exposição humana na dose clínica recomendada. Devido ao risco potencial de defeitos do tubo neural, o efavirenz não deve ser usado no primeiro trimestre da gravidez. Aconselhar as mulheres grávidas sobre o risco potencial para o feto.
Dados
Dados humanos
Há relatos pós-comercialização retrospectivos de achados consistentes com defeitos do tubo neural, incluindo meningomielocele, todos em bebês de mães expostas a regimes contendo efavirenz no primeiro trimestre.
Com base em relatórios prospectivos do Registro de Gravidez Antirretroviral (APR) de aproximadamente 1.000 nascidos vivos após exposição a regimes contendo efavirenz (incluindo mais de 800 nascidos vivos expostos no primeiro trimestre), não houve diferença entre efavirenz e defeitos congênitos gerais em comparação com o taxa de defeitos congênitos de 2,7% na população de referência dos EUA do Programa Metropolitano de Defeitos Congênitos de Atlanta. A partir do relatório APR provisório emitido em dezembro de 2014, a prevalência de defeitos congênitos após a exposição no primeiro trimestre foi de 2,3% (IC 95%: 1,4%-3,6%). Um desses defeitos relatados prospectivamente com exposição no primeiro trimestre foi um defeito do tubo neural. Um único caso de anoftalmia com exposição ao efavirenz no primeiro trimestre também foi relatado prospectivamente. Este caso também incluiu graves fissuras faciais oblíquas e banda amniótica, que têm uma associação conhecida com anoftalmia.
Dados de animais
Os efeitos do efavirenz no desenvolvimento embriofetal foram estudados em três espécies não clínicas (macacos cynomolgus, ratos e coelhos). Em macacos, 60 mg/kg/dia de efavirenz foi administrado a fêmeas grávidas durante toda a gravidez (dias de gestação 20 a 150). As exposições maternas sistêmicas à droga (AUC) foram 1,3 vezes a exposição em humanos na dose clínica recomendada (600 mg/dia), com concentrações fetais da droga venosa umbilical de aproximadamente 0,7 vezes os valores maternos. Três dos 20 fetos/lactentes apresentaram uma ou mais malformações; não houve fetos malformados ou bebês de mães tratadas com placebo. As malformações que ocorreram nesses três fetos de macaco incluíram anencefalia e anoftalmia unilateral em um feto, microftalmia em um segundo e fenda palatina no terceiro. Não houve NOAEL (nenhum nível de efeito adverso observável) estabelecido para este estudo porque apenas uma dosagem foi avaliada. Em ratos, o efavirenz foi administrado durante a organogênese (dias de gestação 7 a 18) ou desde o dia 7 de gestação até o dia 21 de lactação a 50, 100 ou 200 mg/kg/dia. A administração de 200 mg/kg/dia em ratos foi associada ao aumento da incidência de reabsorções precoces; e doses de 100 mg/kg/dia e maiores foram associadas à mortalidade neonatal precoce. A AUC no NOAEL (50 mg/kg/dia) neste estudo em ratos foi 0,1 vezes maior do que em humanos na dose clínica recomendada. As concentrações do fármaco no leite no dia 10 da lactação foram aproximadamente 8 vezes maiores do que as do plasma materno. Em coelhas grávidas, o efavirenz não foi letal embrionário nem teratogênico quando administrado em doses de 25, 50 e 75 mg/kg/dia durante o período de organogênese (dias de gestação 6 a 18). A AUC no NOAEL (75 mg/kg/dia) em coelhos foi 0,4 vezes maior que em humanos na dose clínica recomendada.
Lactação
Resumo do risco
Os Centros de Controle e Prevenção de Doenças recomendam que as mães infectadas pelo HIV não amamentem seus filhos para evitar o risco de transmissão pós-natal do HIV. Devido ao potencial de transmissão do HIV em bebês amamentados, aconselhe as mulheres a não amamentar.
Fêmeas e Machos com Potencial Reprodutivo
Devido aos potenciais efeitos teratogênicos, a gravidez deve ser evitada em mulheres recebendo SUSTIVA. [Vejo Gravidez .]
Teste de gravidez
Mulheres com potencial reprodutivo devem ser submetidas a testes de gravidez antes do início de SUSTIVA.
Contracepção
Mulheres com potencial reprodutivo devem usar métodos contraceptivos eficazes durante o tratamento com SUSTIVA 200 mg e por 12 semanas após a descontinuação de SUSTIVA 200 mg devido à meia-vida longa do efavirenz. A contracepção de barreira deve ser sempre usada em combinação com outros métodos de contracepção. Os métodos hormonais que contêm progesterona podem ter eficácia diminuída [ver INTERAÇÕES MEDICAMENTOSAS ].
Uso Pediátrico
segurança, o perfil farmacocinético e as respostas virológicas e imunológicas de SUSTIVA 600mg foram avaliados em pacientes pediátricos infectados pelo HIV-1 virgens de tratamento antirretroviral e com experiência de 3 meses a 21 anos de idade em três ensaios clínicos abertos [ver REAÇÕES ADVERSAS , FARMACOLOGIA CLÍNICA , e Estudos clínicos ]. O tipo e a frequência das reações adversas nesses estudos foram geralmente semelhantes aos de pacientes adultos, com exceção de uma frequência mais alta de erupções cutâneas, incluindo uma frequência mais alta de erupções cutâneas de grau 3 ou 4, em pacientes pediátricos em comparação com adultos [ver AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS ].
O uso de SUSTIVA em pacientes com menos de 3 meses de idade OU com peso corporal inferior a 3,5 kg não é recomendado porque a segurança, farmacocinética e atividade antiviral de SUSTIVA 600mg não foram avaliadas nessa faixa etária e existe o risco de desenvolver resistência ao HIV se SUSTIVA for subdosado. Vejo DOSAGEM E ADMINISTRAÇÃO para recomendações de dosagem para pacientes pediátricos.
Uso Geriátrico
Os estudos clínicos de SUSTIVA 200 mg não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente dos indivíduos mais jovens. Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia.
Insuficiência hepática
SUSTIVA não é recomendado para pacientes com insuficiência hepática moderada ou grave porque não há dados suficientes para determinar se o ajuste de dose é necessário. Pacientes com insuficiência hepática leve podem ser tratados com efavirenz sem qualquer ajuste de dose. Devido ao extenso metabolismo do efavirenz mediado pelo citocromo P450 e à experiência clínica limitada em pacientes com insuficiência hepática, deve-se ter cautela ao administrar SUSTIVA a esses pacientes [ver AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Alguns pacientes que tomaram acidentalmente 600 mg duas vezes ao dia relataram aumento dos sintomas do sistema nervoso. Um paciente apresentou contrações musculares involuntárias.
O tratamento da sobredosagem com SUSTIVA 200 mg deve consistir em medidas gerais de suporte, incluindo monitorização dos sinais vitais e observação do estado clínico do doente. A administração de carvão ativado pode ser usada para auxiliar na remoção do fármaco não absorvido. Não há antídoto específico para superdosagem com SUSTIVA. Uma vez que o efavirenz é altamente ligado às proteínas, é improvável que a diálise remova significativamente a droga do sangue.
CONTRA-INDICAÇÕES
- SUSTIVA é contra-indicado em pacientes com hipersensibilidade clinicamente significativa previamente demonstrada (por exemplo, síndrome de Stevens-Johnson, eritema multiforme ou erupções cutâneas tóxicas) a qualquer um dos componentes deste produto.
- A coadministração de efavirenz com elbasvir e grazoprevir é contraindicada [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
O efavirenz é um medicamento antiviral [ver Microbiologia ].
Farmacodinâmica
Eletrofisiologia Cardíaca
efeito de SUSTIVA 600mg no intervalo QTc foi avaliado em um estudo QT cruzado de 3 períodos e 3 tratamentos, de sequência única fixa, controlado por placebo, aberto, em 58 indivíduos saudáveis enriquecidos por polimorfismos CYP2B6. A Cmáx média de efavirenz em indivíduos com genótipo CYP2B6 *6/*6 após a administração de uma dose diária de 600 mg durante 14 dias foi 2,25 vezes a Cmáx média observada em indivíduos com genótipo CYP2B6 *1/*1. Foi observada uma relação positiva entre a concentração de efavirenz e o prolongamento do intervalo QTc. Com base na relação concentração-QTc, o prolongamento médio do QTc e seu intervalo de confiança de 90% do limite superior são 8,7 ms e 11,3 ms em indivíduos com genótipo CYP2B6*6/*6 após a administração de uma dose diária de 600 mg por 14 dias [ver AVISOS E PRECAUÇÕES ].
Farmacocinética
Absorção
As concentrações plasmáticas máximas de efavirenz de 1,6-9,1 μM foram atingidas em 5 horas após doses orais únicas de 100 mg a 1600 mg administradas a voluntários não infectados. Foram observados aumentos relacionados com a dose na Cmax e AUC para doses até 1600 mg; os aumentos foram menos do que proporcionais, sugerindo absorção diminuída em doses mais elevadas.
Em pacientes infectados pelo HIV-1 em estado de equilíbrio, a Cmax média, a Cmin média e a AUC média foram proporcionais à dose após doses diárias de 200 mg, 400 mg e 600 mg. O tempo até o pico das concentrações plasmáticas foi de aproximadamente 3-5 horas e as concentrações plasmáticas no estado de equilíbrio foram atingidas em 6-10 dias. Em 35 pacientes que receberam SUSTIVA 600 mg uma vez ao dia, a Cmax no estado de equilíbrio foi de 12,9 ± 3,7 μM (média ± DP), a Cmin no estado de equilíbrio foi de 5,6 ± 3,2 μM e a AUC foi de 184 ± 73 μM•h.
Efeito dos Alimentos na Absorção Oral:
Cápsulas
Administração de uma dose única de 600 mg de cápsulas de efavirenz com uma refeição com alto teor de gordura/alto teor calórico (894 kcal, 54 g de gordura, 54% calorias de gordura) ou uma refeição com baixo teor de gordura/normal calórico (440 kcal, 2 g gordura, 4% calorias de gordura) foi associado a um aumento médio de 22% e 17% na AUC∞ do efavirenz e um aumento médio de 39% e 51% na Cmax do efavirenz, respectivamente, em relação às exposições alcançadas quando administrado em condições de jejum . [Vejo DOSAGEM E ADMINISTRAÇÃO e INFORMAÇÃO DO PACIENTE .]
Comprimidos
A administração de um único comprimido de efavirenz de 600 mg com uma refeição rica em gordura/alto teor calórico (aproximadamente 1000 kcal, 500-600 kcal de gordura) foi associada a um aumento de 28% na AUC∞ média de efavirenz e um aumento de 79% na média Cmax de efavirenz em relação às exposições obtidas em condições de jejum. [Vejo DOSAGEM E ADMINISTRAÇÃO e INFORMAÇÃO DO PACIENTE .]
Biodisponibilidade do conteúdo da cápsula misturado com veículos alimentares
Em indivíduos adultos saudáveis, a AUC do efavirenz, quando administrado como o conteúdo de três cápsulas de 200 mg misturadas com 2 colheres de chá de certos veículos alimentares (molho de maçã, geleia de uva ou iogurte ou fórmula infantil) atendeu aos critérios de bioequivalência para a AUC da formulação de cápsula intacta administrada em condições de jejum.
Distribuição
O efavirenz liga-se fortemente (aproximadamente 99,5-99,75%) às proteínas plasmáticas humanas, predominantemente albumina. Em pacientes infectados pelo HIV-1 (n=9) que receberam SUSTIVA 200 a 600 mg uma vez ao dia por pelo menos um mês, as concentrações no líquido cefalorraquidiano variaram de 0,26 a 1,19% (média de 0,69%) da concentração plasmática correspondente. Esta proporção é aproximadamente 3 vezes maior do que a fração não ligada às proteínas (livre) do efavirenz no plasma.
Metabolismo
Estudos em humanos e estudos in vitro utilizando microssomas hepáticos humanos demonstraram que o efavirenz é metabolizado principalmente pelo sistema do citocromo P450 em metabolitos hidroxilados com subsequente glucuronidação destes metabolitos hidroxilados. Esses metabólitos são essencialmente inativos contra o HIV-1. Os estudos in vitro sugerem que CYP3A e CYP2B6 são as principais isoenzimas responsáveis pelo metabolismo do efavirenz.
O efavirenz demonstrou induzir as enzimas CYP, resultando na indução do seu próprio metabolismo. Doses múltiplas de 200-400 mg por dia durante 10 dias resultaram em uma extensão de acúmulo menor do que o previsto (22-42% menor) e uma meia-vida terminal mais curta de 40-55 horas (meia-vida de dose única 52-76 horas ).
Eliminação
efavirenz tem meia-vida terminal de 52-76 horas após doses únicas e 40-55 horas após doses múltiplas. Um estudo de balanço de massa/excreção de um mês foi realizado usando 400 mg por dia com uma dose marcada com C administrada no Dia 8. Aproximadamente 14-34% do marcador radioativo foi recuperado na urina e 16-61% foi recuperado nas fezes . Quase toda a excreção urinária do fármaco radiomarcado estava na forma de metabólitos. O efavirenz foi responsável pela maior parte da radioatividade total medida nas fezes.
Populações Especiais
Pediátrico
Os parâmetros farmacocinéticos do efavirenz no estado de equilíbrio em pacientes pediátricos foram previstos por um modelo farmacocinético populacional e estão resumidos na Tabela 6 por faixas de peso que correspondem às doses recomendadas.
Gênero e raça
A farmacocinética do efavirenz nos doentes parece ser semelhante entre homens e mulheres e entre os grupos raciais estudados.
Insuficiência renal
farmacocinética do efavirenz não foi estudada em pacientes com insuficiência renal; no entanto, menos de 1% do efavirenz é excretado inalterado na urina, portanto o impacto da insuficiência renal na eliminação do efavirenz deve ser mínimo.
Insuficiência hepática
Um estudo de dose múltipla não mostrou efeito significativo na farmacocinética do efavirenz em pacientes com insuficiência hepática leve (Child-Pugh Classe A) em comparação com os controles. Não havia dados suficientes para determinar se a insuficiência hepática moderada ou grave (Child-Pugh Classe B ou C) afeta a farmacocinética do efavirenz.
Estudos de interação medicamentosa
efavirenz demonstrou in vivo causar indução de enzimas hepáticas, aumentando assim a biotransformação de alguns medicamentos metabolizados por CYP3A e CYP2B6. Estudos in vitro demonstraram que o efavirenz inibiu as isozimas CYP 2C9 e 2C19 com valores de Ki (8,5-17 μM) no intervalo das concentrações plasmáticas de efavirenz observadas. Em estudos in vitro, o efavirenz não inibiu CYP2E1 e inibiu CYP2D6 e CYP1A2 (valores de Ki 82-160 μM) apenas em concentrações bem acima das alcançadas clinicamente. A coadministração de efavirenz com medicamentos metabolizados principalmente pelas isoenzimas CYP2C9, CYP2C19, CYP3A ou CYP2B6 pode resultar em concentrações plasmáticas alteradas do medicamento coadministrado. Espera-se que os medicamentos que induzem a atividade do CYP3A e CYP2B6 aumentem a depuração do efavirenz, resultando em concentrações plasmáticas mais baixas.
Os estudos de interação medicamentosa foram realizados com efavirenz e outros medicamentos provavelmente coadministrados ou medicamentos comumente usados como sondas para interação farmacocinética. Os efeitos da coadministração de efavirenz na Cmax, AUC e Cmin estão resumidos na Tabela 7 (efeito do efavirenz em outros medicamentos) e na Tabela 8 (efeito de outros medicamentos no efavirenz). Para informações sobre recomendações clínicas, consulte INTERAÇÕES MEDICAMENTOSAS .
Microbiologia
Mecanismo de ação
O efavirenz é um NNRTI do HIV-1. A atividade do efavirenz é mediada predominantemente pela inibição não competitiva da transcriptase reversa do HIV-1. A transcriptase reversa do HIV-2 e as polimerases de DNA celular humana α, β, γ e δ não são inibidas pelo efavirenz.
Atividade antiviral em cultura de células
concentração de efavirenz inibindo a replicação de cepas adaptadas de laboratório de tipo selvagem e isolados clínicos em cultura de células em 90-95% (EC90-95) variou de 1,7 a 25 nM em linhagens de células linfoblastóides, células mononucleares de sangue periférico (PBMCs) e macrófagos /culturas de monócitos. O efavirenz demonstrou atividade antiviral contra o clade B e a maioria dos isolados não-clade B (subtipos A, AE, AG, C, D, F, G, J, N), mas teve atividade antiviral reduzida contra os vírus do grupo O. O efavirenz demonstrou atividade antiviral aditiva sem citotoxicidade contra o HIV-1 em cultura de células quando combinado com os NNRTIs delavirdina e nevirapina, NRTIs (abacavir, didanosina, emtricitabina, lamivudina, estavudina, tenofovir, zalcitabina, zidovudina), IPs (amprenavir, indinavir, lopinavir, nelfinavir, ritonavir, saquinavir) e o inibidor de fusão enfuvirtida. O efavirenz demonstrou atividade antiviral aditiva à antagonista em cultura de células com atazanavir. O efavirenz não foi antagonista do adefovir, usado para o tratamento da infecção pelo vírus da hepatite B, ou da ribavirina, usado em combinação com o interferon para o tratamento da infecção pelo vírus da hepatite C.
Resistência
Em cultura de células
Em cultura de células, isolados de HIV-1 com suscetibilidade reduzida ao efavirenz (aumento >380 vezes no valor de EC90) surgiram rapidamente na presença do fármaco. A caracterização genotípica desses vírus identificou substituições de aminoácidos simples L100I ou V179D, substituições duplas L100I/V108I e substituições triplas L100I/V179D/Y181C na transcriptase reversa.
Estudos clínicos
Foram obtidos isolados clínicos com sensibilidade reduzida em cultura de células ao efavirenz. Uma ou mais substituições nas posições de aminoácidos 98, 100, 101, 103, 106, 108, 188, 190, 225 e 227 na transcriptase reversa foram observadas em pacientes que falharam no tratamento com efavirenz em combinação com indinavir ou com zidovudina mais lamivudina. A substituição K103N foi a mais observada. A vigilância de resistência a longo prazo (média de 52 semanas, intervalo de 4 a 106 semanas) analisou 28 isolados de linha de base e falha virológica correspondentes. Sessenta e um por cento (17/28) destes isolados com falha apresentaram diminuição da suscetibilidade ao efavirenz em cultura de células com uma alteração média de 88 vezes na suscetibilidade ao efavirenz (valor EC50) da referência. A substituição de NNRTI mais frequente a desenvolver nestes isolados de doentes foi K103N (54%). Outras substituições de NNRTI que se desenvolveram incluíram L100I (7%), K101E/Q/R (14%), V108I (11%), G190S/T/A (7%), P225H (18%) e M230I/L (11 %).
Resistência cruzada
Foi observada resistência cruzada entre os NNRTIs. Os isolados clínicos previamente caracterizados como resistentes ao efavirenz também foram fenotipicamente resistentes em cultura de células a delavirdina e nevirapina em comparação com a linha de base. Isolados virais clínicos resistentes a delavirdina e/ou nevirapina com substituições associadas à resistência a NNRTI (A98G, L100I, K101E/P, K103N/S, V106A, Y181X, Y188X, G190X, P225H, F227L ou M230L) mostraram suscetibilidade reduzida ao efavirenz em cultura de células. Mais de 90% dos isolados clínicos resistentes aos NRTI testados em cultura de células mantiveram a suscetibilidade ao efavirenz.
Toxicologia Animal
Convulsões não sustentadas foram observadas em 6 de 20 macacos que receberam efavirenz em doses que produziram valores de AUC plasmática 4 a 13 vezes maiores do que aqueles em humanos que receberam a dose recomendada [ver AVISOS E PRECAUÇÕES ].
Estudos clínicos
Adultos
Estudo 006 um estudo randomizado, aberto, comparou SUSTIVA (600 mg uma vez ao dia) + zidovudina (ZDV, 300 mg a cada 12h) + lamivudina (LAM, 150 mg a cada 12 horas) ou SUSTIVA (600 mg uma vez ao dia) + indinavir (IDV, 1000 mg q8h) com indinavir (800 mg q8h) + zidovudina (300 mg q12h) + lamivudina (150 mg q12h). Mil e sessenta e seis pacientes (idade média de 36,5 anos [intervalo 18-81], 60% caucasianos, 83% do sexo masculino) foram inscritos. Todos os pacientes eram virgens de efavirenz, lamivudina, NNRTI e PI na entrada do estudo. A contagem mediana de células CD4+ na linha de base foi de 320 células/mm3 e o nível médio de RNA do HIV-1 na linha de base foi de 4,8 log cópias/mL. Os resultados do tratamento com ensaio padrão (limite de ensaio de 400 cópias/mL) até 48 e 168 semanas são mostrados na Tabela 9. Os níveis plasmáticos de RNA do HIV foram quantificados com padrão (limite de ensaio de 400 cópias/mL) e ultrassensível (limite de ensaio de 50 cópias/mL) versões do ensaio AMPLICOR HIV-1 MONITOR. Durante o estudo, a versão 1.5 do ensaio foi introduzida na Europa para melhorar a detecção de vírus não-clade B.
Para pacientes tratados com SUSTIVA + zidovudina + lamivudina, SUSTIVA + indinavir ou indinavir + zidovudina + lamivudina, a porcentagem de respondedores com RNA do HIV-1
ACTG 364 é um estudo randomizado, duplo-cego, controlado por placebo, de 48 semanas em pacientes com experiência em NRTI que completaram dois estudos ACTG anteriores. Cento e noventa e seis pacientes (idade média de 41 anos [intervalo 18-76], 74% caucasianos, 88% homens) receberam NRTIs em combinação com SUSTIVA (600 mg uma vez ao dia) ou nelfinavir (NFV, 750 mg três vezes ao dia) ), ou SUSTIVA (600 mg uma vez ao dia) + nelfinavir de forma randomizada e duplo-cega. A contagem média de células CD4+ na linha de base foi de 389 células/mm3 e o nível médio de RNA do HIV-1 na linha de base foi de 8.130 cópias/mL. Após a entrada no estudo, todos os pacientes receberam um novo regime de NRTI aberto, que dependia de sua experiência anterior de tratamento com NRTI. Não houve diferença significativa na contagem média de células CD4+ entre os grupos de tratamento; o aumento médio global foi de aproximadamente 100 células em 48 semanas entre os pacientes que continuaram nos regimes de estudo. Os resultados do tratamento são mostrados na Tabela 10. Os níveis plasmáticos de RNA do HIV foram quantificados com o ensaio AMPLICOR HIV-1 MONITOR usando um limite inferior de quantificação de 500 cópias/mL.
Uma análise de Kaplan-Meier do tempo até a falha do tratamento até 72 semanas demonstra uma duração mais longa da supressão virológica (RNA do HIV
Pacientes pediátricos
estudo AI266922 é um estudo aberto para avaliar a farmacocinética, segurança, tolerabilidade e atividade antiviral de SUSTIVA 200mg em combinação com didanosina e emtricitabina em pacientes pediátricos virgens de tratamento antirretroviral e com experiência. Trinta e sete pacientes de 3 meses a 6 anos de idade (mediana de 0,7 anos) foram tratados com SUSTIVA. Na linha de base, a mediana do RNA do HIV-1 no plasma foi de 5,88 log cópias/mL, a mediana da contagem de células CD4+ foi de 1.144 células/mm3 e a mediana da porcentagem de CD4+ foi de 25%. O tempo médio na terapia do estudo foi de 60 semanas; 27% dos pacientes descontinuaram antes da Semana 48. Usando uma análise ITT, as proporções gerais de pacientes com RNA do HIV
estudo PACTG 1021 foi um estudo aberto para avaliar a farmacocinética, segurança, tolerabilidade e atividade antiviral de SUSTIVA 200mg em combinação com didanosina e emtricitabina em pacientes pediátricos virgens de terapia antirretroviral. Quarenta e três pacientes de 3 meses a 21 anos de idade (média de 9,6 anos) receberam SUSTIVA. Na linha de base, a mediana de RNA do HIV-1 no plasma foi de 4,8 log cópias/mL, a mediana da contagem de células CD4+ foi de 367 células/mm3 e a mediana da porcentagem de CD4+ foi de 18%. O tempo médio na terapia do estudo foi de 181 semanas; 16% dos pacientes descontinuaram antes da Semana 48. Usando uma análise ITT, as proporções gerais de pacientes com RNA do HIV
estudo PACTG 382 foi um estudo aberto para avaliar a farmacocinética, segurança, tolerabilidade e atividade antiviral de SUSTIVA em combinação com nelfinavir e um NRTI em pacientes pediátricos virgens de tratamento antirretroviral e com experiência em NRTI. Cento e dois pacientes de 3 meses a 16 anos de idade (mediana de 5,7 anos) foram tratados com SUSTIVA. Oitenta e sete por cento dos pacientes haviam recebido terapia antirretroviral prévia. Na linha de base, a mediana de RNA do HIV-1 no plasma foi de 4,57 log cópias/mL, a mediana da contagem de células CD4+ foi de 755 células/mm3 e a mediana da porcentagem de CD4+ foi de 30%. O tempo médio na terapia do estudo foi de 118 semanas; 25% dos pacientes descontinuaram antes da Semana 48. Usando uma análise ITT, a proporção geral de pacientes com RNA do HIV
INFORMAÇÃO DO PACIENTE
SUSTIVA® (sus-TEE-vah) (efavirenz) cápsulas
SUSTIVA® (sus-TEE-vah) (efavirenz) comprimidos
Importante: Pergunte ao seu médico ou farmacêutico sobre medicamentos que não devem ser tomados com SUSTIVA. Para mais informações, consulte a seção "O que devo dizer ao meu médico antes de tomar SUSTIVA?"
Leia esta Informação do Paciente antes de começar a tomar SUSTIVA e cada vez que receber um reabastecimento. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou tratamento.
O que é SUSTIVA?
SUSTIVA 600mg é um medicamento de prescrição para HIV-1 (vírus da imunodeficiência humana tipo 1) usado com outros medicamentos antirretrovirais para tratar a infecção por HIV-1 em adultos e crianças com pelo menos 3 meses de idade e que pesem pelo menos 7 libras 12 onças (3,5 kg). O HIV é o vírus que causa a AIDS (Síndrome da Imunodeficiência Adquirida).
Não se sabe se SUSTIVA é seguro e eficaz em crianças com menos de 3 meses de idade ou que pesem menos de 3,5 kg (7 libras e 12 onças).
Quando usado com outros medicamentos antirretrovirais para tratar a infecção pelo HIV-1, SUSTIVA 600mg pode ajudar:
- reduzir a quantidade de HIV-1 no sangue. Isso é chamado de carga viral.
- aumentar o número de células CD4+ (T) no sangue que ajudam a combater outras infecções.
Reduzir a quantidade de HIV-1 e aumentar as células CD4+ (T) no sangue pode ajudar a melhorar o sistema imunológico. Isso pode reduzir o risco de morte ou contrair infecções que podem ocorrer quando seu sistema imunológico está fraco (infecções oportunistas).
SUSTIVA 600mg não cura a infecção pelo HIV-1 ou AIDS. Você deve continuar tomando medicamentos para o HIV-1 para controlar a infecção pelo HIV-1 e diminuir as doenças relacionadas ao HIV.
Evite fazer coisas que possam espalhar a infecção pelo HIV-1 para outras pessoas:
- Não compartilhe ou reutilize agulhas ou outros equipamentos de injeção.
- Não compartilhe itens pessoais que possam conter sangue ou fluidos corporais, como escovas de dentes e lâminas de barbear.
- Não faça nenhum tipo de sexo sem proteção. Sempre pratique sexo seguro usando um preservativo de látex ou poliuretano para diminuir a chance de contato sexual com qualquer fluido corporal, como sêmen, secreções vaginais ou sangue.
Pergunte ao seu médico se tiver alguma dúvida sobre como prevenir a transmissão do HIV para outras pessoas.
Quem não deve tomar SUSTIVA 600mg?
Não tome SUSTIVA se for alérgico ao efavirenz ou a qualquer um dos ingredientes de SUSTIVA. Consulte o final deste folheto para obter uma lista completa dos ingredientes de SUSTIVA.
Não tome SUSTIVA se estiver tomando elbasvir e grazoprevir (ZEPATIER®).
O que devo dizer ao meu médico antes de tomar SUSTIVA 200mg?
Antes de tomar SUSTIVA, informe o seu médico se tiver alguma condição médica e, em particular, se:
- tem um problema cardíaco
- já teve um problema de saúde mental
- já usou drogas de rua ou grandes quantidades de álcool
- tem problemas no fígado, incluindo infecção pelo vírus da hepatite B ou C
- tem histórico de convulsões
- estão grávidas ou planejam engravidar. SUSTIVA 600mg pode prejudicar o feto. Se você puder engravidar, seu médico deve fazer um teste de gravidez antes de iniciar SUSTIVA. Não deve engravidar enquanto estiver a tomar SUSTIVA e durante 12 semanas após a interrupção do tratamento com SUSTIVA. As mulheres que podem engravidar devem usar 2 formas eficazes de controle de natalidade durante o tratamento e por 12 semanas após a interrupção do tratamento com SUSTIVA. Uma forma de barreira de controle de natalidade deve sempre ser usada junto com outro tipo de controle de natalidade.
- Formas de barreira de controle de natalidade podem incluir preservativo de látex ou poliuretano, esponja contraceptiva, diafragma com espermicida e capuz cervical.
- Formas hormonais de controle de natalidade, como pílulas anticoncepcionais, injeções, anéis vaginais ou implantes podem não funcionar durante o tratamento com SUSTIVA.
- Converse com seu médico sobre formas de controle de natalidade que podem ser usadas durante o tratamento com SUSTIVA.
- Registro de gravidez. Existe um registro de gravidez para mulheres que tomam medicamentos antirretrovirais durante a gravidez. O objetivo deste registro é coletar informações sobre sua saúde e de seu bebê. Converse com seu médico sobre como você pode participar desse registro.
- Não amamente se estiver a tomar SUSTIVA.
- Você não deve amamentar se tiver HIV devido ao risco de transmitir o HIV ao seu bebê.
Informe o seu médico e farmacêutico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas.
SUSTIVA 600mg pode afetar o funcionamento de outros medicamentos, e outros medicamentos podem afetar o funcionamento de SUSTIVA 600mg, e pode causar efeitos colaterais graves. Se tomar certos medicamentos com SUSTIVA, a quantidade de SUSTIVA 600 mg no seu corpo pode ser muito baixa e pode não funcionar para ajudar a controlar a sua infecção por VIH. O vírus HIV no seu corpo pode tornar-se resistente ao SUSTIVA ou a outros medicamentos para o HIV semelhantes.
Você não deve tomar SUSTIVA 600mg se tomar ATRIPLA (efavirenz, emtricitabina, tenofovir disoproxil fumarato), a menos que o seu médico lhe diga para o fazer.
Informe o seu médico e farmacêutico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas. Alguns medicamentos interagem com SUSTIVA.
Mantenha uma lista dos seus medicamentos para mostrar ao seu médico e farmacêutico.
- Pode pedir ao seu médico ou farmacêutico uma lista de medicamentos que interagem com SUSTIVA.
- Não comece a tomar um novo medicamento sem informar o seu médico. O seu médico pode dizer-lhe se é seguro tomar SUSTIVA com outros medicamentos.
Como devo tomar SUSTIVA?
- Tome SUSTIVA 600mg exatamente como seu médico lhe disser.
- Não altere a sua dose nem pare de tomar SUSTIVA a menos que o seu médico lhe diga para o fazer.
- Fique sob os cuidados do seu médico durante o tratamento com SUSTIVA.
- SUSTIVA deve ser utilizado com outros medicamentos antirretrovirais.
- Tome SUSTIVA 1 vez por dia.
- SUSTIVA vem em comprimidos ou cápsulas.
- Os comprimidos de SUSTIVA não devem ser partidos.
- Engula os comprimidos ou cápsulas de SUSTIVA inteiros com líquido.
Como e quando tomar SUSTIVA.
- Deve tomar SUSTIVA 600mg com o estômago vazio ao deitar. Tomar SUSTIVA 200mg com alimentos aumenta a quantidade de medicamento no seu corpo. Alguns efeitos secundários podem incomodá-lo menos se tomar SUSTIVA 600 mg com o estômago vazio e ao deitar.
- O médico do seu filho irá prescrever a dose certa de SUSTIVA 200mg com base no peso do seu filho.
- Se tiver dificuldade em engolir comprimidos ou cápsulas, informe o seu médico. O seu médico pode recomendar abrir a cápsula de SUSTIVA e misturar o conteúdo com alimentos ou fórmula infantil. Consulte as "Instruções de Uso" detalhadas no final desta Informação ao Paciente para aprender a maneira correta de tomar SUSTIVA 600mg usando o método de aspersão em cápsula.
- Adultos e crianças que tomam SUSTIVA 600mg usando o método de pulverização de cápsulas não devem comer por 2 horas após tomar uma dose de SUSTIVA.
- Os bebês não devem receber fórmula infantil por 2 horas após tomar uma dose de SUSTIVA usando o método de pulverização de cápsulas.
- Não perca uma dose de SUSTIVA. Se se esquecer de tomar SUSTIVA, tome a dose esquecida imediatamente, a menos que esteja quase na hora da próxima dose. Não tome 2 doses de uma só vez. Apenas tome sua próxima dose no horário agendado regularmente. Se precisar de ajuda para planejar os melhores horários para tomar seu medicamento, pergunte ao seu médico ou farmacêutico.
- Se tomar demasiado SUSTIVA, contacte o seu médico ou dirija-se imediatamente ao serviço de urgência do hospital mais próximo.
- Quando o seu suprimento de SUSTIVA 600mg começar a acabar, peça mais ao seu médico ou farmácia. É importante não ficar sem SUSTIVA. A quantidade de HIV-1 no seu sangue pode aumentar se o medicamento for interrompido por um curto período de tempo. O vírus pode tornar-se resistente a SUSTIVA 600mg e mais difícil de tratar.
Quais são os possíveis efeitos colaterais do SUSTIVA?
SUSTIVA 600mg pode causar efeitos colaterais graves, incluindo:
Se você tiver tontura, dificuldade de concentração ou sonolência, não dirija, use máquinas ou faça qualquer coisa que precise que você esteja alerta.
Alguns sintomas do sistema nervoso (por exemplo, confusão, pensamentos e movimentos físicos lentos e delírios [falsas crenças] ou alucinações [ver ou ouvir coisas que outros não veem ou ouvem]) podem ocorrer meses a anos após o início da terapia com SUSTIVA 600mg. Contacte imediatamente o seu prestador de cuidados de saúde se ocorrer algum destes sintomas.
Informe o seu médico imediatamente se tiver algum dos seguintes sintomas:
- Problemas graves de saúde mental pode acontecer em pessoas que tomam SUSTIVA. Informe o seu médico imediatamente se tiver algum dos seguintes sintomas:
- sentir-se triste ou sem esperança não confiar em outras pessoas
- sentir-se ansioso ou inquieto ouvir ou ver coisas que não são reais
- tem pensamentos de se machucar (suicídio) ou tentou se machucar ou outros
- não são capazes de se mover ou falar normalmente
- não são capazes de dizer a diferença entre o que é verdadeiro ou real e o que é falso ou irreal
- Sintomas do sistema nervoso são comuns em pessoas que tomam SUSTIVA 200mg e podem ser graves. Esses sintomas geralmente começam durante o primeiro ou segundo dia de tratamento com SUSTIVA 200mg e geralmente desaparecem após 2 a 4 semanas de tratamento. Alguns sintomas podem ocorrer meses a anos após o início da terapia com SUSTIVA. Estes sintomas podem piorar se beber álcool, tomar medicamentos para problemas de saúde mental ou usar certas drogas de rua durante o tratamento com SUSTIVA. Os sintomas podem incluir:
- tontura
- dificuldade de concentração
- problemas para dormir
- sonolência
- sonhos incomuns
- falta de coordenação ou dificuldade de equilíbrio
- Erupção cutânea é comum com SUSTIVA 600mg, mas às vezes pode ser grave. A erupção cutânea geralmente desaparece sem qualquer alteração no tratamento. Se você desenvolver uma erupção cutânea com qualquer um dos seguintes sintomas, informe o seu médico imediatamente:
- erupção cutânea, com ou sem coceira
- descamação da pele
- febre
- aftas
- inchaço do seu rosto
- olhos vermelhos ou inflamados, como "olho rosa" (conjuntivite)
- bolhas ou lesões na pele
- Problemas hepáticos, incluindo insuficiência hepática e morte pode acontecer em pessoas que tomam SUSTIVA. Problemas hepáticos podem ocorrer em pessoas sem histórico de problemas hepáticos. O seu médico fará análises ao sangue para verificar o seu fígado antes de iniciar SUSTIVA 200 mg e durante o tratamento.
- a sua pele ou a parte branca dos seus olhos fica amarela (icterícia)
- você não sente vontade de comer por vários dias ou mais
- sua urina fica escura
- você se sente mal do estômago (náuseas)
- seus movimentos intestinais (fezes) ficam de cor clara
- você tem dor na área inferior do estômago (abdominal)
- Convulsões pode acontecer em pessoas que tomam SUSTIVA. As convulsões são mais prováveis de acontecer se você já teve convulsões no passado. Informe o seu médico se tiver tido uma convulsão ou se estiver a tomar um medicamento para ajudar a prevenir convulsões.
- Alterações no seu sistema imunológico (Síndrome de Reconstituição Imune) pode acontecer quando você começa a tomar medicamentos para o HIV-1. Seu sistema imunológico pode ficar mais forte e começar a combater infecções que estão escondidas em seu corpo há muito tempo. Informe o seu médico se começar a ter novos sintomas após iniciar o seu medicamento para o VIH-1.
- Alterações na gordura corporal pode acontecer em pessoas que tomam medicamentos para o HIV-1. Essas alterações podem incluir aumento da quantidade de gordura na parte superior das costas e pescoço ("corcova de búfalo"), mama e ao redor da parte principal do corpo (tronco). A perda de gordura das pernas, braços e rosto também pode acontecer. A causa e os efeitos a longo prazo dessas condições na saúde não são conhecidos.
Os efeitos colaterais mais comuns de SUSTIVA 600mg incluem:
- irritação na pele
- sonhos anormais
- tontura
- cansaço
- náusea
- problemas para dormir
- dor de cabeça
- vômito
- Dificuldade de concentração
Alguns doentes a tomar SUSTIVA apresentaram níveis elevados de lípidos (colesterol e triglicéridos) no sangue. Informe o seu médico se tiver algum efeito secundário que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais de SUSTIVA. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o SUSTIVA?
- Armazene as cápsulas e comprimidos de SUSTIVA à temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
Mantenha SUSTIVA e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre SUSTIVA
Os medicamentos às vezes são prescritos para outros fins que não os listados em um folheto de informações ao paciente. Não use SUSTIVA 600mg para uma condição para a qual não foi prescrito. Não dê SUSTIVA 600mg a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu farmacêutico ou médico informações sobre SUSTIVA escritas para profissionais de saúde. Para mais informações, acesse www.sustiva.com ou ligue para 1-800-321-1335.
Quais são os ingredientes de SUSTIVA?
Ingrediente ativo: efavirenz
Ingredientes inativos:
Cápsulas de SUSTIVA 600mg: lactose monohidratada, estearato de magnésio, lauril sulfato de sódio e amidoglicolato de sódio. O invólucro da cápsula contém gelatina, lauril sulfato de sódio, dióxido de titânio e/ou óxido de ferro amarelo. O invólucro da cápsula também pode conter dióxido de silício. As cápsulas são impressas com tinta contendo azul carmim 40, azul FD&C nº 2 e dióxido de titânio.
SUSTIVA comprimidos: croscarmelose sódica, hidroxipropilcelulose, lactose monohidratada, estearato de magnésio, celulose microcristalina e lauril sulfato de sódio. O revestimento do comprimido contém Opadry Yellow e Opadry Clear. As pastilhas são polidas com cera de carnaúba e impressas com tinta roxa, Opacode WB.
Esta informação do paciente foi aprovada pela Food and Drug Administration dos EUA.
Instruções de uso
SUSTIVA® (sus-TEE-vah) (efavirenz) cápsulas
Preparação de uma dose de SUSTIVA 600mg usando o método de aspersão em cápsula
Leia estas Instruções de Uso antes de preparar sua primeira dose de SUSTIVA misturada com alimentos ou fórmula infantil usando o método de pulverização de cápsulas, cada vez que receber uma recarga e conforme necessário. Pode haver novas informações. Esta informação não substitui a conversa com o seu médico sobre a sua condição médica ou tratamento. Pergunte ao seu médico ou farmacêutico se tiver alguma dúvida sobre como misturar ou administrar uma dose de SUSTIVA 200 mg usando o método de pulverização em cápsula.
Informação importante:
- Para mais informações sobre as cápsulas de SUSTIVA 600mg, consulte o folheto informativo do paciente.
- O método de aspersão de cápsulas para misturar o conteúdo das cápsulas de SUSTIVA com alimentos moles ou fórmula infantil pode ser usado para adultos ou crianças que não conseguem engolir cápsulas ou comprimidos.
- Deve tomar SUSTIVA 600mg com o estômago vazio ao deitar.
- Não deve comer durante 2 horas após tomar SUSTIVA misturado com alimentos.
- Os bebês com idade suficiente para engolir alimentos devem receber SUSTIVA usando o método de pulverização de cápsulas misturado com alimentos em vez de fórmula infantil.
- Converse com seu médico para ajudar a decidir o melhor horário para dar ao seu bebê SUSTIVA misturado com fórmula infantil usando o método de pulverização de cápsulas.
Preparar uma dose de SUSTIVA 600mg misturado com alimentos usando o método de aspersão em cápsulas.
Antes de preparar uma dose de SUSTIVA 200mg misturada com alimentos usando o método de pulverização de cápsulas, reúna os seguintes suprimentos:
- toalhas de papel
- colher de chá para medir
- colher pequena para mexer e alimentar
- pequena recipiente limpo (como um pequena copo ou tigela)
- alimentos macios, como compota de maçã, geleia de uva ou iogurte
Passo 1. Escolha uma superfície de trabalho limpa e plana. Coloque uma toalha de papel limpa na superfície de trabalho. Em seguida, coloque os outros suprimentos na toalha de papel.
Passo 2. Lave e seque bem as mãos.
Etapa 3. Coloque 1 a 2 colheres de chá de alimentos macios, como compota de maçã, geleia de uva ou iogurte no recipiente pequeno (consulte Figura A ). A cor e a espessura dos alimentos podem mudar quando misturados com o medicamento.
Figura A
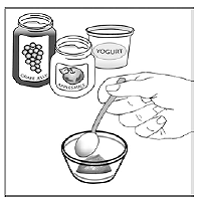
Passo 4. Existem 2 partes da cápsula SUSTIVA 200mg. Olhe para a cápsula SUSTIVA para ver qual parte da cápsula se sobrepõe à outra parte (consulte Figura B ).
Figura B
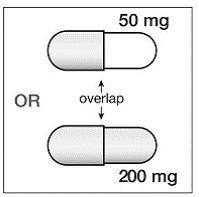
Etapa 5. Segure a cápsula SUSTIVA na posição lateral (horizontal) diretamente sobre o recipiente de alimentos. Segure cada extremidade da cápsula SUSTIVA entre os polegares e os dedos indicadores (indicadores) (consulte Figura C ).
Figura C
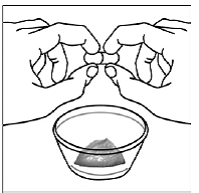
Etapa 6. Use o polegar e o dedo indicador para apertar perto da extremidade da parte sobreposta da cápsula de SUSTIVA 600mg (consulte Figura D ).
Figura D
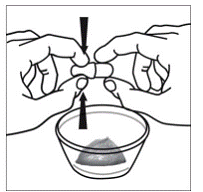
Em seguida, torça cuidadosamente ambas as extremidades da cápsula de SUSTIVA 600mg em direções opostas para abri-la (consulte Figura E ). Tenha cuidado para não derramar o conteúdo da cápsula ou espalhá-lo no ar.
Figura E

Etapa 7. Polvilhe o conteúdo da cápsula de SUSTIVA nos alimentos (consulte Figura F ).
- Verifique os invólucros das cápsulas para se certificar de que estão vazios.
- Jogue fora as cápsulas vazias.
Figura F

Se a dose total prescrita for superior a 1 cápsula, siga os Passos 4 a 7 para cada cápsula. Não adicione mais alimentos.
As etapas 8 a 11 devem ser concluídas em 30 minutos de misturar o medicamento (ver Figura G ).
Figura G

Etapa 8. Use a colher pequena para misturar suavemente o conteúdo da cápsula e os alimentos (consulte Figura H ). Sprinkles não se dissolvem. A mistura parecerá granulada, mas não deve ser grumosa.
Figura H
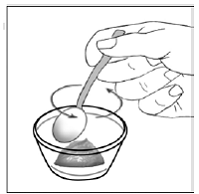
Etapa 9. Use a colher pequena para dar ou tirar a mistura de alimentos e cápsulas. Certifique-se de que toda a mistura é engolida.
Passo 10. Adicione cerca de 2 colheres de chá a mais do alimento ao recipiente vazio e mexa delicadamente com a colher pequena para misturar com qualquer conteúdo da cápsula que ainda possa estar no recipiente.
Passo 11. Use a colher pequena para dar ou tirar a mistura de alimentos e cápsulas. Certifique-se de que toda a mistura seja engolida.
Passo 12. Lave o recipiente e as colheres. Jogue fora a toalha de papel e limpe a superfície de trabalho. Lave suas mãos.
Preparação de uma dose de SUSTIVA 600mg misturado com fórmula infantil usando o método de aspersão em cápsula
Para se certificar de que o seu bebé recebe todo o medicamento, não dê o conteúdo das cápsulas de SUSTIVA ao seu bebé num biberão.
Antes de preparar uma dose de SUSTIVA misturada com fórmula infantil usando o método de pulverização de cápsulas, reúna os seguintes suprimentos:
- toalhas de papel
- colher de chá para mexer e medir
- pequena recipiente limpo (como um pequena xícara ou tigela) (ver Figura I ).
- Seringa de dosagem oral de 10 mL (consulte o seu farmacêutico) (consulte Figura I ).
- fórmula infantil à temperatura ambiente.
Figura I
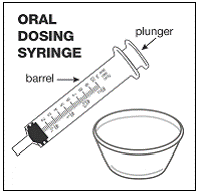
Passo 1. Prepare a fórmula infantil de acordo com as instruções da embalagem da fórmula infantil. Você usará cerca de 1 onça da fórmula para administrar o medicamento. Qualquer fórmula restante não deve ser dada à criança por 2 horas.
Passo 2. Escolha uma superfície de trabalho limpa e plana. Coloque uma toalha de papel limpa na superfície de trabalho. Coloque os suprimentos que você vai precisar na toalha de papel.
Etapa 3. Lave e seque bem as mãos.
Passo 4. Despeje 2 colheres de chá de fórmula infantil em temperatura ambiente no recipiente (consulte Figura J ).
Figura J
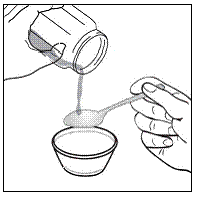
Etapa 5. Existem 2 partes da cápsula SUSTIVA. Olhe para a cápsula SUSTIVA para ver qual parte da cápsula se sobrepõe à outra parte (consulte Figura K ).
Figura K
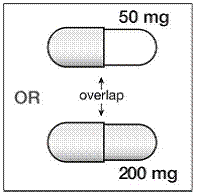
Etapa 6. Segure a cápsula SUSTIVA na posição lateral (horizontal) diretamente sobre o recipiente com a fórmula infantil. Segure cada extremidade da cápsula de SUSTIVA 600mg entre os polegares e os dedos indicadores (indicadores) (consulte Figura L ).
Figura L
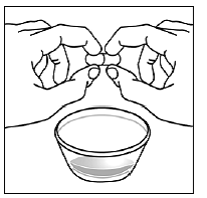
Etapa 7. Use o polegar e o dedo indicador para beliscar perto da extremidade da parte sobreposta da cápsula SUSTIVA (consulte Figura M ).
Figura M
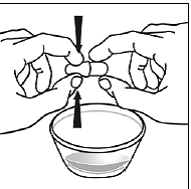
Em seguida, gire cuidadosamente ambas as extremidades da cápsula SUSTIVA em direções opostas para abri-la (consulte Figura N ). Tenha cuidado para não derramar o conteúdo da cápsula ou espalhá-lo no ar.
Figura N
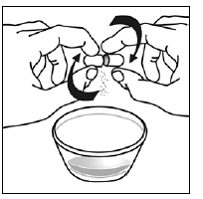
Etapa 8. Polvilhe o conteúdo da cápsula de SUSTIVA 600mg na fórmula infantil (consulte Figura O ).
- Verifique os invólucros das cápsulas para se certificar de que estão vazios.
- Jogue fora as cápsulas vazias.
Figura O
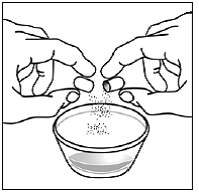
Se a dose total prescrita for superior a 1 cápsula, siga os Passos 5 a 8 para cada cápsula. Não adicione mais fórmula infantil.
As etapas 9 a 12 devem ser concluídas em 30 minutos de misturar o medicamento (ver Figura P ).
Figura P

Etapa 9. Segure o recipiente com uma mão. Com a outra mão, use a colher de chá para misturar suavemente o conteúdo da cápsula e a fórmula infantil (consulte Figura Q ). Sprinkles não se dissolvem. A mistura parecerá granulada, mas não deve ser grumosa.
Figura Q
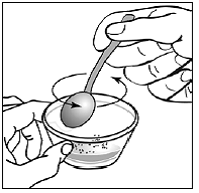
Passo 10. Para retirar toda a mistura para a seringa doseadora oral:
Figura R
Figura S
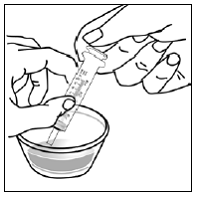
Figura T
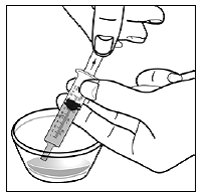
- Verifique se o êmbolo está completamente inserido no cilindro da seringa (consulte Figura R ).
- Coloque a ponta da seringa na mistura no recipiente (consulte Figura S ).
- Puxe lentamente o êmbolo e retire toda a mistura (consulte Figura T ).
Passo 11. Coloque a ponta da seringa na boca do bebê ao longo da bochecha interna (consulte Figura U ). Empurre lentamente o êmbolo para dar ao bebê toda a mistura.
Figura U
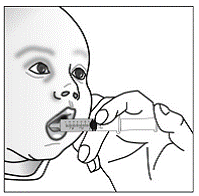
Etapa 12. Para garantir que todo o medicamento seja administrado ao seu bebê:
- Repita a Etapa 4 acima.
- Mexa com uma colher de chá.
- Em seguida, repita Etapas 10 e 11 acima (Vejo Figura V ).
Figura V
Passo 13. Remova o êmbolo da seringa de dosagem oral. Lave o recipiente, a colher de chá e a seringa de dosagem oral. Deixe o êmbolo e o cilindro da seringa secarem antes de juntá-los novamente.
Passo 14. Jogue fora a toalha de papel e limpe a superfície de trabalho. Lave suas mãos.
Como devo armazenar as cápsulas de SUSTIVA 600mg?
- Armazene as cápsulas de SUSTIVA em temperatura ambiente entre 20°C e 25°C (68°F a 77°F).
Mantenha as cápsulas de SUSTIVA 600mg e todos os medicamentos fora do alcance das crianças.
Estas Instruções de Uso foram aprovadas pela Food and Drug Administration dos EUA.
