Paxil 10mg, 20mg, 30mg, 40mg Paroxetine Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Paxil e como é usado?
Paxil 20mg é um medicamento de prescrição usado para tratar os sintomas de depressão, transtorno obsessivo-compulsivo (TOC), transtorno do pânico, fobia social, transtorno de ansiedade generalizada, transtorno de estresse pós-traumático (TEPT) e transtornos disoóricos pré-menstruais (TDPM). Paxil pode ser usado sozinho ou com outros medicamentos.
- Paxil 40mg pertence a uma classe de medicamentos chamados antidepressivos, ISRSs.
- Não se sabe se Paxil é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Paxil 30mg?
Paxil 10mg pode causar efeitos colaterais graves, incluindo:
- pensamentos descontrolados,
- diminuição da necessidade de sono,
- comportamento de risco incomum,
- sentimentos de extrema felicidade ou tristeza,
- sendo mais falante do que o habitual,
- visão embaçada,
- visão de túnel,
- dor ou inchaço nos olhos,
- vendo halos ao redor das luzes,
- dor ou sensibilidade óssea incomum, inchaço ou hematomas,
- alterações de peso,
- alterações no apetite,
- contusões fáceis,
- sangramento incomum do nariz, boca, vagina ou reto,
- tossindo sangue,
- músculos muito rígidos ou rígidos,
- febre alta,
- sudorese,
- confusão,
- batimentos cardíacos rápidos ou irregulares,
- tremores,
- desmaio,
- dor de cabeça,
- confusão,
- fala arrastada,
- fraqueza severa,
- perda de coordenação e
- sentindo-se instável
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Paxil 30mg incluem:
- alterações na visão,
- fraqueza,
- sonolência,
- tontura,
- cansaço,
- sudorese,
- ansiedade,
- tremendo,
- problemas de sono (insônia),
- perda de apetite,
- náusea,
- vômito,
- diarréia,
- constipação,
- boca seca,
- infecção,
- dor de cabeça,
- diminuição do desejo sexual,
- impotência,
- ejaculação anormal e
- dificuldade em ter um orgasmo
Suicídio e drogas antidepressivas
Os antidepressivos aumentaram o risco em comparação ao placebo de pensamento e comportamento suicida (suicidalidade) em crianças, adolescentes e adultos jovens em estudos de curto prazo de transtorno depressivo maior (TDM) e outros transtornos psiquiátricos. Qualquer pessoa considerando o uso de PAXIL 40mg ou qualquer outro antidepressivo em uma criança, adolescente ou adulto jovem deve equilibrar esse risco com a necessidade clínica. Estudos de curto prazo não mostraram um aumento no risco de suicídio com antidepressivos em comparação com placebo em adultos com mais de 24 anos; houve uma redução no risco com antidepressivos em comparação com placebo em adultos com 65 anos ou mais. A depressão e alguns outros transtornos psiquiátricos estão associados ao aumento do risco de suicídio. Pacientes de todas as idades que iniciam terapia antidepressiva devem ser monitorados adequadamente e observados de perto quanto a piora clínica, suicídio ou mudanças incomuns no comportamento. As famílias e os cuidadores devem ser avisados da necessidade de observação atenta e comunicação com o prescritor. PAXIL 30mg não está aprovado para uso em pacientes pediátricos. (Consulte ADVERTÊNCIAS: Agravamento clínico e risco de suicídio, INFORMAÇÕES AO PACIENTE e PRECAUÇÕES: Uso pediátrico.)
DESCRIÇÃO
PAXIL (cloridrato de paroxetina) é um medicamento psicotrópico administrado por via oral. É o sal cloridrato de um composto de fenilpiperidina identificado quimicamente como (-)-trans-4R-(4'fluorofenil)-3S-[(3',4'-metilenodioxifenoxi)metil]piperidina cloridrato hemi-hidratado e tem a fórmula empírica de C19H20FNO3•HCl•½H2O. O peso molecular é 374,8 (329,4 como base livre). A fórmula estrutural do cloridrato de paroxetina é:
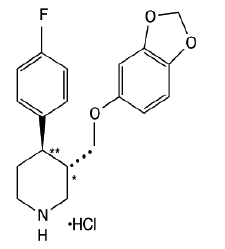
O cloridrato de paroxetina é um pó esbranquiçado inodoro, com uma faixa de ponto de fusão de 120° a 138°C e solubilidade de 5,4 mg/mL em água.
Cada comprimido revestido por película contém cloridrato de paroxetina equivalente à paroxetina da seguinte forma: 10 mg-amarelo (com ranhuras); 20 mg-rosa (pontuado); 30 mg-azul, 40 mg-verde. Os ingredientes inativos consistem em fosfato de cálcio dibásico dihidratado, hipromelose, estearato de magnésio, polietilenoglicóis, polissorbato 80, amidoglicolato de sódio, dióxido de titânio e 1 ou mais dos seguintes: Laca de alumínio D&C Red Nº 30, Laca de alumínio D&C Yellow Nº 10 , Laca de alumínio FD&C Blue No. 2, Laca de alumínio FD&C Yellow No. 6.
Suspensão para administração oral
Cada 5 mL de líquido laranja com sabor a laranja contém cloridrato de paroxetina equivalente a paroxetina, 10 mg. Os ingredientes inativos consistem em polacrilina potássica, celulose microcristalina, propilenoglicol, glicerina, sorbitol, metilparabeno, propilparabeno, citrato de sódio dihidratado, ácido cítrico anidro, sacarina sódica, aromatizantes, laca de alumínio FD&C Yellow No. 6 e emulsão de simeticona, USP.
INDICAÇÕES
PAXIL 20mg é indicado em adultos para o tratamento de:
- Transtorno Depressivo Maior (TDM)
- Transtorno obsessivo compulsivo (TOC)
- Transtorno do Pânico (DP)
- Transtorno de ansiedade social (TAS)
- Transtorno de ansiedade generalizada (TAG)
- Transtorno de estresse pós-traumático (TEPT)
DOSAGEM E ADMINISTRAÇÃO
Informações de administração
Administrar PAXIL em dose única diária pela manhã, com ou sem alimentos.
Agite bem a suspensão oral antes da administração.
Dosagem recomendada para MDD, OCD, PD e PTSD
As dosagens iniciais recomendadas e as dosagens máximas de PAXIL 20mg em pacientes com TDM, TOC, DP e TEPT são apresentadas na Tabela 1.
Em pacientes com resposta inadequada, aumentar a dose em incrementos de 10 mg por dia em intervalos de pelo menos 1 semana, dependendo da tolerabilidade.
Dosagem recomendada para SAD e GAD
TRISTE
dosagem inicial e recomendada em pacientes com TAS é de 20 mg por dia. Em ensaios clínicos, a eficácia de PAXIL 30 mg foi demonstrada em pacientes com doses de 20 mg a 60 mg por dia. Embora a segurança de PAXIL tenha sido avaliada em pacientes com TAS em doses de até 60 mg por dia, as informações disponíveis não sugerem nenhum benefício adicional para doses acima de 20 mg por dia [ver Estudos clínicos ].
GAD
A dosagem inicial e recomendada em pacientes com TAG é de 20 mg por dia. Em ensaios clínicos, a eficácia de PAXIL 10 mg no GAD foi demonstrada em pacientes com doses de 20 mg a 50 mg por dia. Não há evidências suficientes para sugerir um benefício maior para doses superiores a 20 mg por dia [ver Estudos clínicos ].
Em pacientes com resposta inadequada, aumentar a dose em incrementos de 10 mg por dia em intervalos de pelo menos 1 semana, dependendo da tolerabilidade.
Triagem para transtorno bipolar antes de iniciar PAXIL
Antes de iniciar o tratamento com PAXIL 10mg ou outro antidepressivo, rastreie os pacientes quanto a história pessoal ou familiar de transtorno bipolar, mania ou hipomania [ver AVISOS E PRECAUÇÕES ].
Dosagem recomendada para pacientes idosos, pacientes com insuficiência renal grave e pacientes com insuficiência hepática grave
A dose inicial recomendada é de 10 mg por dia para pacientes idosos, pacientes com insuficiência renal grave e pacientes com insuficiência hepática grave. A dosagem não deve exceder 40 mg/dia.
Troca de pacientes de ou para um inibidor da monoamina oxidase (IMAO)
Pelo menos 14 dias devem decorrer entre a descontinuação de um inibidor da monoaminoxidase (IMAO e início de PAXIL. Além disso, pelo menos 14 dias devem decorrer após a interrupção do PAXIL antes de iniciar um antidepressivo IMAO [ver CONTRA-INDICAÇÕES , AVISOS E PRECAUÇÕES ].
Descontinuação do tratamento com PAXIL
Reações adversas podem ocorrer com a descontinuação de PAXIL [ver AVISOS E PRECAUÇÕES ]. Reduza gradualmente a dosagem em vez de interromper o PAXIL abruptamente sempre que possível.
COMO FORNECIDO
Formas de dosagem e pontos fortes
PAXIL comprimidos estão disponíveis como:
- Comprimido amarelo de 10 mg com ranhura gravada na frente com “PAXIL” e no verso com “10”.
- Comprimido cor-de-rosa de 20 mg com ranhura gravada na frente com “PAXIL” e no verso com “20”.
- Comprimido azul de 30 mg gravado na frente com “PAXIL” e no verso com “30”.
- Comprimido verde de 40 mg gravado na frente com “PAXIL” e no verso com “40”.
PAXIL 20mg suspensão oral está disponível como:
- 10 mg/5 mL de suspensão cor de laranja com sabor a laranja em frascos contendo 250 mL.
Armazenamento e manuseio
PAXIL (paroxetina) comprimidos são comprimidos ovais fornecidos como:
Armazene os comprimidos entre 15° e 30°C (59° e 86°F).
PAXIL (paroxetina) suspensão oral é fornecido como:
Armazenar a suspensão a ou abaixo de 25°C (77°F)
Fabricado por: Apotex Inc., Toronto, Ontário, Canadá M9L 1T9. Revisado: fevereiro de 2021
EFEITOS COLATERAIS
As seguintes reações adversas estão incluídas com mais detalhes em outras seções das informações de prescrição:
- Reações de hipersensibilidade à paroxetina [ver CONTRA-INDICAÇÕES ]
- Pensamentos e Comportamentos Suicidas [ver AVISOS E PRECAUÇÕES ]
- Síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES ]
- Toxicidade embriofetal e neonatal [ver AVISOS E PRECAUÇÕES ]
- Aumento do risco de sangramento [ver AVISOS E PRECAUÇÕES ]
- Ativação de Mania/Hipomania [ver AVISOS E PRECAUÇÕES ]
- Síndrome de descontinuação [ver AVISOS E PRECAUÇÕES ]
- Convulsões [ver AVISOS E PRECAUÇÕES ]
- Glaucoma de ângulo fechado [ver AVISOS E PRECAUÇÕES ]
- Hiponatremia [ver AVISOS E PRECAUÇÕES ]
- Fratura Óssea [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Os dados de segurança para PAXIL são de:
- Ensaios clínicos de 6 semanas em pacientes com MDD que receberam PAXIL 20 mg a 50 mg uma vez ao dia
- Ensaios clínicos de 12 semanas em pacientes com TOC que receberam PAXIL 20 mg a 60 mg uma vez ao dia
- Ensaios clínicos de 10 a 12 semanas em pacientes com DP que receberam PAXIL 10 mg a 60 mg uma vez ao dia
- Ensaios clínicos de 12 semanas em pacientes com SAD que receberam PAXIL 20 mg a 50 mg uma vez ao dia
- Ensaios clínicos de 8 semanas em pacientes com TAG que receberam PAXIL 10 mg a 50 mg uma vez ao dia
- Ensaios clínicos de 12 semanas em pacientes com TEPT que receberam PAXIL 20 mg a 50 mg uma vez ao dia
Reações Adversas que Levam à Descontinuação
Vinte por cento (1.199/6.145) dos pacientes tratados com PAXIL em ensaios clínicos em MDD e 16,1% (84/522), 11,8% (64/542), 9,4% (44/469), 10,7% (79/735), e 11,7% (79/676) dos pacientes tratados com PAXIL em ensaios clínicos em TAS, TOC, DP, TAG e TEPT, respectivamente, descontinuaram o tratamento devido a uma reação adversa. As reações adversas mais comuns (≥1%) associadas à descontinuação (ou seja, as reações adversas associadas à desistência a uma taxa de aproximadamente duas vezes ou mais para PAXIL 10mg em comparação com placebo) são apresentadas na Tabela 3:
Reações Adversas Mais Comuns
As reações adversas mais comumente observadas associadas ao uso de PAXIL (incidência de 5% ou mais e pelo menos o dobro do placebo) foram:
MDD
Astenia, sudorese, náusea, diminuição do apetite, sonolência, tontura, insônia, tremor, nervosismo, distúrbios ejaculatórios e outros distúrbios genitais masculinos.
TOC
Náuseas, boca seca, diminuição do apetite, constipação, tontura, sonolência, tremores, sudorese, impotência e ejaculação anormal.
PD
Astenia, sudorese, diminuição do apetite, diminuição da libido, tremores, ejaculação anormal, distúrbios genitais femininos e impotência.
TRISTE
Sudorese, náusea, boca seca, constipação, diminuição do apetite, sonolência, tremor, diminuição da libido, bocejo, ejaculação anormal, distúrbios genitais femininos e impotência.
GAD
Astenia, infecção, constipação, diminuição do apetite, boca seca, náusea, diminuição da libido, sonolência, tremor, sudorese e ejaculação anormal.
PTSD
Astenia, sudorese, náusea, boca seca, diarréia, diminuição do apetite, sonolência, diminuição da libido, ejaculação anormal, distúrbios genitais femininos e impotência.
Reações Adversas em Pacientes com MDD
A Tabela 4 apresenta as reações adversas que ocorreram com incidência de 1% ou mais e maior do que placebo em ensaios clínicos de pacientes tratados com PAXIL com MDD.
Reações Adversas em Pacientes com TOC, DP e TAS
A Tabela 5 apresenta as reações adversas que ocorreram com frequência de 2% ou mais em ensaios clínicos em pacientes com TOC, DP e TAS.
Reações Adversas em Pacientes com TAG e TEPT
A Tabela 6 apresenta as reações adversas que ocorreram com uma frequência de 2% ou mais em ensaios clínicos em pacientes com TAG e TEPT.
Reações Adversas Dependentes da Dose
MDD
Uma comparação das taxas de reações adversas em um estudo de dose fixa comparando PAXIL10 mg, 20 mg, 30 mg e 40 mg uma vez ao dia com placebo no tratamento de MDD revelou reações adversas dependentes da dose, conforme mostrado na Tabela 7:
TOC
Em um estudo de dose fixa comparando placebo e PAXIL 20 mg, 40 mg e 60 mg no tratamento do TOC, não houve relação clara entre reações adversas e a dose de PAXIL 30 mg à qual os pacientes foram atribuídos.
PD
Em um estudo de dose fixa comparando placebo e PAXIL 10 mg, 20 mg e 40 mg no tratamento da DP, as seguintes reações adversas mostraram-se dose-dependentes: astenia, boca seca, ansiedade, diminuição da libido, tremor e ejaculação anormal.
TRISTE
Em um estudo de dose fixa comparando placebo e PAXIL 20 mg, 40 mg e 60 mg no tratamento de TAS, para a maioria das reações adversas, não houve relação clara entre as reações adversas e a dose de PAXIL 10 mg à qual os pacientes foram atribuídos .
GAD
Em um estudo de dose fixa comparando placebo e PAXIL 20 mg e 40 mg no tratamento de TAG, as seguintes reações adversas mostraram-se dependentes da dose: astenia, constipação e ejaculação anormal.
PTSD
Em um estudo de dose fixa comparando placebo e PAXIL 20 mg e 40 mg no tratamento de TEPT, as seguintes reações adversas mostraram-se dependentes da dose: impotência e ejaculação anormal.
Disfunção Sexual Masculina e Feminina
Embora as alterações no desejo sexual, desempenho sexual e satisfação sexual ocorram frequentemente como manifestações de um transtorno psiquiátrico, elas também podem ser consequência do tratamento com ISRS. No entanto, estimativas confiáveis da incidência e gravidade de experiências indesejáveis envolvendo desejo sexual, desempenho e satisfação são difíceis de obter, no entanto, em parte porque pacientes e profissionais de saúde podem relutar em discuti-las. Assim, as estimativas da incidência de experiência sexual e desempenho indesejáveis citados na rotulagem podem subestimar sua incidência real.
A porcentagem de pacientes que relatam sintomas de disfunção sexual em homens e mulheres com MDD, TOC, PD, SAD, GAD e PTSD é apresentada na Tabela 8.
O tratamento com PAXIL 20mg foi associado a vários casos de priapismo. Nos casos com desfecho conhecido, os pacientes se recuperaram sem sequelas.
Alucinações
Em ensaios clínicos agrupados de PAXIL, foram observadas alucinações em 0,2% dos pacientes tratados com PAXIL em comparação com 0,1% dos pacientes que receberam placebo.
Reações Adversas Menos Comuns
As seguintes reações adversas ocorreram durante os estudos clínicos de PAXIL e não estão incluídas em nenhuma outra parte da bula.
As reações adversas são categorizadas por sistema corporal e listadas em ordem decrescente de frequência de acordo com as seguintes definições: Reações adversas frequentes são aquelas que ocorrem em 1 ou mais ocasiões em pelo menos 1/100 pacientes; reações adversas infrequentes são aquelas que ocorrem em 1/100 a 1/1.000 pacientes; reações adversas raras são aquelas que ocorrem em menos de 1/1.000 pacientes.
Corpo como um todo
Infrequentes: reação alérgica, calafrios, edema facial, mal-estar, dor no pescoço; raros: síndrome adrenérgica, celulite, monilíase, rigidez do pescoço, dor pélvica, peritonite, sepse, úlcera.
Sistema cardiovascular
Frequentes: Hipertensão, taquicardia; infrequentes: bradicardia, hematoma, hipotensão, enxaqueca, hipotensão postural, síncope; raros: Angina pectoris, arritmia nodal, fibrilação atrial, bloqueio de ramo, isquemia cerebral, acidente vascular cerebral, insuficiência cardíaca congestiva, bloqueio cardíaco, baixo débito cardíaco, infarto do miocárdio, isquemia do miocárdio, palidez, flebite, embolia pulmonar, extrassístoles supraventriculares, tromboflebite, trombose, varizes, cefaleia vascular, extrassístoles ventriculares.
Sistema digestivo
Infrequentes: bruxismo, colite, disfagia, eructação, gastrite, gastroenterite, gengivite, glossite, salivação aumentada, testes de função hepática anormais, hemorragia retal, estomatite ulcerativa; raros: estomatite aftosa, diarreia sanguinolenta, bulimia, cardioespasmo, colelitíase, duodenite, enterite, esofagite, impactações fecais, incontinência fecal, hemorragia gengival, hematêmese, hepatite, ileíte, íleo, obstrução intestinal, icterícia, melena, ulceração da boca, úlcera péptica, aumento das glândulas salivares, sialoadenite, úlcera estomacal, estomatite, descoloração da língua, edema da língua, cárie dentária.
Sistema endócrino
Raros: Diabetes mellitus, bócio, hipertireoidismo, hipotireoidismo, tireoidite.
Sistemas Hemico e Linfático
Infrequentes: Anemia, leucopenia, linfadenopatia, púrpura; raros: eritrócitos anormais, basofilia, tempo de sangramento aumentado, eosinofilia, anemia hipocrômica, anemia ferropriva, leucocitose, linfedema, linfócitos anormais, linfocitose, anemia microcítica, monocitose, anemia normocítica, trombocitemia, trombocitopenia.
Metabólico e Nutricional
Frequentes: Ganho de peso; pouco frequentes: Edema, edema periférico, SGOT aumentada, SGPT aumentada, sede, perda de peso; raros: aumento da fosfatase alcalina, bilirrubinemia, aumento da ureia, aumento da creatinina fosfoquinase, desidratação, aumento das gamaglobulinas, gota, hipercalcemia, hipercolesteremia, hiperglicemia, hipercalemia, hiperfosfatemia, hipocalcemia, hipoglicemia, hipocalemia, hiponatremia, cetose, desidrogenase lática aumentada, não-proteína nitrogênio (NPN) aumentou.
Sistema musculo-esquelético
Frequentes: Artralgia; infrequentes: Artrite, artrose; raros: bursite, miosite, osteoporose, espasmo generalizado, tenossinovite, tetania.
Sistema nervoso
Frequentes: labilidade emocional, vertigem; infrequentes: pensamento anormal, abuso de álcool, ataxia, distonia, discinesia, euforia, hostilidade, hipertonia, hipestesia, hipocinesia, incoordenação, falta de emoção, aumento da libido, reação maníaca, neurose, paralisia, reação paranóide; raros: marcha anormal, acinesia, reação antissocial, afasia, coreoatetose, parestesias circumorais, convulsão, delírio, delírios, diplopia, dependência de drogas, disartria, síndrome extrapiramidal, fasciculações, convulsão grande mal, hiperalgesia, histeria, reação maníaco-depressiva, meningite, mielite, neuralgia, neuropatia, nistagmo, neurite periférica, depressão psicótica, psicose, reflexos diminuídos, reflexos aumentados, estupor, torcicolo, trismo, síndrome de abstinência.
Sistema respiratório
Infrequentes: Asma, bronquite, dispnéia, epistaxe, hiperventilação, pneumonia, gripe respiratória; raros: enfisema, hemoptise, soluços, fibrose pulmonar, edema pulmonar, escarro aumentado, estridor, alteração da voz.
Pele e Anexos
Frequentes: Prurido; infrequentes: Acne, alopecia, dermatite de contato, pele seca, equimose, eczema, herpes simples, fotossensibilidade, urticária; raros: angioedema, eritema nodoso, eritema multiforme, dermatite esfoliativa, dermatite fúngica, furunculose; herpes zoster, hirsutismo, erupção cutânea maculopapular, seborreia, descoloração da pele, hipertrofia da pele, úlcera da pele, diminuição da sudorese, erupção cutânea vesiculobolhosa.
Sentidos Especiais
Frequentes: Zumbido; pouco frequentes: Anormalidade de acomodação, conjuntivite, dor de ouvido, dor nos olhos, ceratoconjuntivite, midríase, otite média; raros: ambliopia, anisocoria, blefarite, catarata, edema conjuntival, úlcera de córnea, surdez, exoftalmia, hemorragia ocular, glaucoma, hiperacusia, cegueira noturna, otite externa, parosmia, fotofobia, ptose, hemorragia retiniana, perda do paladar, defeito do campo visual.
Sistema Urogenital
Infrequentes: Amenorreia, dor mamária, cistite, disúria, hematúria, menorragia, noctúria, poliúria, piúria, incontinência urinária, retenção urinária, urgência urinária, vaginite; raros: aborto, atrofia mamária, aumento mamário, distúrbio endometrial, epididimite, lactação feminina, mama fibrocística, cálculo renal, dor renal, leucorréia, mastite, metrorragia, nefrite, oligúria, salpingite, uretrite, cilindros urinários, espasmo uterino, urólito, vaginal hemorragia, monilíase vaginal.
Experiência pós-marketing
As seguintes reações foram identificadas durante o uso pós-aprovação de PAXIL. Como essas reações são relatadas voluntariamente por uma população de tamanho desconhecido, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Pancreatite aguda, testes de função hepática elevados (os casos mais graves foram mortes por necrose hepática e transaminases grosseiramente elevadas associadas a disfunção hepática grave), síndrome de Guillain-Barré, síndrome de Stevens-Johnson, necrólise epidérmica tóxica, síndrome de secreção inapropriada de ADH, prolactinemia e galactorreia; sintomas extrapiramidais que incluem acatisia, bradicinesia, rigidez de roda dentada, crise oculogírica que tem sido associada ao uso concomitante de pimozida; estado de mal epiléptico, insuficiência renal aguda, hipertensão pulmonar, alveolite alérgica, anafilaxia, eclâmpsia, laringismo, neurite óptica, porfiria, síndrome das pernas inquietas (SPI), fibrilação ventricular, taquicardia ventricular (incluindo torsade de pointes), anemia hemolítica, eventos relacionados ao comprometimento hematopoiese (incluindo anemia aplástica, pancitopenia, aplasia da medula óssea e agranulocitose), síndromes vasculíticas (como púrpura de Henoch-Schönlein) e partos prematuros em mulheres grávidas. Houve um relato de caso de hipotensão grave quando PAXIL 20mg foi adicionado ao tratamento crônico com metoprolol.
INTERAÇÕES MEDICAMENTOSAS
Tabela 9 apresenta interações medicamentosas clinicamente significativas com PAXIL.
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Pensamentos e Comportamentos Suicidas em Adolescentes e Jovens Adultos
Em análises agrupadas de estudos controlados por placebo de medicamentos antidepressivos (ISRSs e outras classes de antidepressivos) que incluíram aproximadamente 77.000 pacientes adultos e 4.500 pacientes pediátricos, a incidência de pensamentos e comportamentos suicidas em pacientes tratados com antidepressivos com 24 anos ou menos foi maior do que em pacientes tratados com placebo. Houve variação considerável no risco de pensamentos e comportamentos suicidas entre os medicamentos, mas houve um risco aumentado identificado em pacientes jovens para a maioria dos medicamentos estudados. Houve diferenças no risco absoluto de pensamentos e comportamentos suicidas entre as diferentes indicações, com maior incidência em pacientes com TDM. As diferenças droga-placebo no número de casos de pensamentos e comportamentos suicidas por 1.000 pacientes tratados são fornecidas na Tabela 2.
PAXIL 30mg não está aprovado para uso em pacientes pediátricos.
Não se sabe se o risco de pensamentos e comportamentos suicidas em crianças, adolescentes e adultos jovens se estende ao uso a longo prazo, ou seja, além de quatro meses. No entanto, há evidências substanciais de ensaios de manutenção controlados por placebo em adultos com TDM de que os antidepressivos retardam a recorrência da depressão e que a própria depressão é um fator de risco para pensamentos e comportamentos suicidas.
Monitorar todos os pacientes tratados com antidepressivos para qualquer indicação de piora clínica e surgimento de pensamentos e comportamentos suicidas, especialmente durante os primeiros meses de terapia medicamentosa e em momentos de mudanças de dosagem. Aconselhar os familiares ou cuidadores de pacientes a monitorar mudanças de comportamento e alertar o profissional de saúde. Considere mudar o regime terapêutico, incluindo possivelmente a descontinuação do PAXIL, em pacientes cuja depressão é persistentemente pior, ou que estão experimentando pensamentos ou comportamentos suicidas emergentes.
Síndrome da serotonina
ISRSs, incluindo PAXIL, podem precipitar a síndrome serotoninérgica, uma condição potencialmente fatal. O risco aumenta com o uso concomitante de outros medicamentos serotoninérgicos (incluindo triptanos, antidepressivos tricíclicos, fentanil, lítio, tramadol, triptofano, buspirona, anfetaminas e erva de São João) e com medicamentos que prejudicam o metabolismo da serotonina, ou seja, IMAOs [ver CONTRA-INDICAÇÕES , INTERAÇÕES MEDICAMENTOSAS ]. A síndrome serotoninérgica também pode ocorrer quando esses medicamentos são usados isoladamente.
Os sintomas da síndrome serotoninérgica podem incluir alterações do estado mental (p. ex., agitação, alucinações, delírio e coma), instabilidade autonômica (p. mioclonia, hiperreflexia, incoordenação), convulsões e/ou sintomas gastrointestinais (p.
uso concomitante de PAXIL com IMAOs é contraindicado. Além disso, não inicie PAXIL 30mg em um paciente em tratamento com IMAOs, como linezolida ou azul de metileno intravenoso. Nenhum relato envolveu a administração de azul de metileno por outras vias (como comprimidos orais ou injeção local no tecido) ou em doses mais baixas. Se for necessário iniciar o tratamento com um IMAO, como linezolida ou azul de metileno intravenoso em um paciente tomando PAXIL 10mg, descontinue PAXIL 40mg antes de iniciar o tratamento com o IMAO [ver CONTRA-INDICAÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
Monitorar todos os pacientes em uso de PAXIL 20mg quanto ao surgimento da síndrome serotoninérgica. Interrompa o tratamento com PAXIL 20mg e quaisquer agentes serotoninérgicos concomitantes imediatamente se ocorrerem os sintomas acima e inicie tratamento sintomático de suporte. Se o uso concomitante de PAXIL com outros medicamentos serotoninérgicos for clinicamente justificado, informe os pacientes sobre o risco aumentado de síndrome serotoninérgica e monitore os sintomas.
Interações medicamentosas que levam ao prolongamento do intervalo QT
As propriedades inibitórias do CYP2D6 da paroxetina podem elevar os níveis plasmáticos de tioridazina e pimozida. Como a tioridazina e a pimozida administradas isoladamente produzem prolongamento do intervalo QTc e aumentam o risco de arritmias ventriculares graves, o uso de PAXIL 40mg é contraindicado em combinação com tioridazina e pimozida [ver CONTRA-INDICAÇÕES , INTERAÇÕES MEDICAMENTOSAS , FARMACOLOGIA CLÍNICA ].
Toxicidade embriofetal e neonatal
PAXIL pode causar danos ao feto quando administrado a mulheres grávidas. Estudos epidemiológicos mostraram que bebês expostos à paroxetina no primeiro trimestre de gravidez têm um risco aumentado de malformações cardiovasculares. A exposição à paroxetina no final da gravidez pode levar a um risco aumentado de hipertensão pulmonar persistente do recém-nascido (HPPRN) e/ou complicações neonatais que requerem hospitalização prolongada, suporte respiratório e alimentação por sonda.
Se PAXIL 20mg for usado durante a gravidez, ou se a paciente engravidar enquanto estiver tomando PAXIL 30mg, a paciente deve ser informada do risco potencial para o feto [ver Uso em populações específicas ].
Aumento do risco de sangramento
Medicamentos que interferem na inibição da recaptação de serotonina, incluindo PAXIL 40mg, aumentam o risco de eventos hemorrágicos. O uso concomitante de aspirina, anti-inflamatórios não esteroides (AINEs), outros antiplaquetários, varfarina e outros anticoagulantes pode aumentar esse risco. Relatos de casos e estudos epidemiológicos (caso-controle e desenho de coorte) têm demonstrado associação entre o uso de drogas que interferem na recaptação de serotonina e a ocorrência de sangramento gastrointestinal. Eventos de sangramento relacionados a drogas que interferem na recaptação de serotonina variam de equimoses, hematomas, epistaxe e petéquias a hemorragias com risco de vida.
Informar os pacientes sobre o risco aumentado de sangramento associado ao uso concomitante de PAXIL 20mg e agentes antiplaquetários ou anticoagulantes. Para pacientes em uso de varfarina, monitore cuidadosamente a proporção normalizada internacional.
Ativação de mania ou hipomania
Em pacientes com transtorno bipolar, o tratamento de um episódio depressivo com PAXIL 30mg ou outro antidepressivo pode precipitar um episódio misto/maníaco. Durante os ensaios clínicos controlados de PAXIL, ocorreu hipomania ou mania em aproximadamente 1% dos pacientes unipolares tratados com PAXIL em comparação com 1,1% dos pacientes com controle ativo e 0,3% dos pacientes unipolares tratados com placebo. Antes de iniciar o tratamento com PAXIL 20mg, rastreie os pacientes quanto a qualquer histórico pessoal ou familiar de transtorno bipolar, mania ou hipomania.
Síndrome de descontinuação
As reações adversas após a descontinuação de antidepressivos serotoninérgicos, particularmente após a descontinuação abrupta, incluem: náusea, sudorese, humor disfórico, irritabilidade, agitação, tontura, distúrbios sensoriais (por exemplo, parestesia, como sensações de choque elétrico), tremor, ansiedade, confusão, dor de cabeça, letargia, labilidade emocional, insônia, hipomania, zumbido e convulsões. Recomenda-se uma redução gradual da dosagem em vez de uma interrupção abrupta sempre que possível [ver DOSAGEM E ADMINISTRAÇÃO ].
Durante os ensaios clínicos de TAG e TEPT, foram utilizadas diminuições graduais na dose diária de 10 mg/dia em intervalos semanais seguidos por 1 semana de 20 mg/dia antes da descontinuação do tratamento. As seguintes reações adversas foram relatadas com uma incidência de 2% ou mais para PAXIL 20mg e foram pelo menos o dobro da relatada para placebo: Sonhos anormais, parestesia e tontura Reações adversas foram relatadas após a descontinuação do tratamento com PAXIL em pacientes pediátricos. A segurança e eficácia de PAXIL em pacientes pediátricos não foram estabelecidas [ver AVISO EM CAIXA , Pensamentos e Comportamentos Suicidas em Adolescentes e Jovens Adultos , Uso em populações específicas ].
Convulsões
PAXIL 10mg comprimidos e suspensão oral não foram sistematicamente avaliados em pacientes com distúrbios convulsivos. Pacientes com histórico de convulsões foram excluídos dos estudos clínicos. Durante os estudos clínicos, ocorreram convulsões em 0,1% dos pacientes tratados com PAXIL. PAXIL deve ser prescrito com cautela em pacientes com distúrbios convulsivos. Descontinuar PAXIL 30mg em qualquer paciente que desenvolva convulsões.
Glaucoma de ângulo fechado
dilatação pupilar que ocorre após o uso de muitos medicamentos antidepressivos, incluindo PAXIL, pode desencadear um ataque de fechamento angular em um paciente com ângulos anatomicamente estreitos que não tenha uma iridectomia patente. Casos de glaucoma de ângulo fechado associados ao uso de PAXIL 40mg foram relatados. Evite o uso de antidepressivos, incluindo PAXIL em pacientes com ângulos anatomicamente estreitos não tratados.
Hiponatremia
A hiponatremia pode ocorrer como resultado do tratamento com ISRSs, incluindo PAXIL. Casos com sódio sérico inferior a 110 mmol/L foram relatados. Sinais e sintomas de hiponatremia incluem dor de cabeça, dificuldade de concentração, comprometimento da memória, confusão, fraqueza e instabilidade, o que pode levar a quedas. Sinais e sintomas associados a casos mais graves e/ou agudos incluem alucinação, síncope, convulsão, coma, parada respiratória e morte. Em muitos casos, essa hiponatremia parece ser o resultado da síndrome da secreção inapropriada do hormônio antidiurético (SIADH).
Em pacientes com hiponatremia sintomática, descontinuar PAXIL e instituir intervenção médica apropriada. Pacientes idosos, pacientes em uso de diuréticos e aqueles com depleção de volume podem ter maior risco de desenvolver hiponatremia com ISRSs [ver Uso em populações específicas ].
Redução da eficácia do tamoxifeno
Alguns estudos demonstraram que a eficácia do tamoxifeno, medida pelo risco de recidiva/mortalidade do câncer de mama, pode ser reduzida com o uso concomitante de PAXIL como resultado da inibição irreversível do CYP2D6 pela paroxetina e níveis sanguíneos mais baixos de tamoxifeno [ver INTERAÇÕES MEDICAMENTOSAS ]. Um estudo sugere que o risco pode aumentar com maior duração da coadministração. No entanto, outros estudos não conseguiram demonstrar tal risco. Quando o tamoxifeno é usado para o tratamento ou prevenção do câncer de mama, os prescritores devem considerar o uso de um antidepressivo alternativo com pouca ou nenhuma inibição do CYP2D6.
Fratura óssea
Estudos epidemiológicos sobre o risco de fratura óssea durante a exposição a alguns antidepressivos, incluindo ISRSs, relataram uma associação entre o tratamento antidepressivo e fraturas. Existem múltiplas causas possíveis para esta observação e não se sabe até que ponto o risco de fratura é diretamente atribuível ao tratamento com ISRS.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( Guia de Medicação ).
Pensamentos e Comportamentos Suicidas
Aconselhe os pacientes e cuidadores a procurarem o surgimento de tendências suicidas, especialmente no início do tratamento e quando a dosagem for ajustada para cima ou para baixo, e instrua-os a relatar esses sintomas ao profissional de saúde [ver AVISO EM CAIXA e AVISOS E PRECAUÇÕES ].
Síndrome da serotonina
Alertar os pacientes sobre o risco de síndrome serotoninérgica, particularmente com o uso concomitante de PAXIL com outros medicamentos serotoninérgicos, incluindo triptanos, antidepressivos tricíclicos, fentanil, lítio, tramadol, triptofano, buspirona, anfetaminas, Erva de São João e com medicamentos que prejudicam o metabolismo de serotonina (em particular, IMAOs, tanto os destinados ao tratamento de distúrbios psiquiátricos como também outros, como a linezolida). Instrua os pacientes a entrar em contato com seu médico ou se reportar ao pronto-socorro se apresentarem sinais ou sintomas de síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
Medicamentos Concomitantes
Aconselhe os pacientes a informar seu médico se estiverem tomando, ou planejam tomar, qualquer medicamento prescrito ou de venda livre, uma vez que existe potencial para interações medicamentosas [ver ADVERTÊNCIAS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
Aumento do risco de sangramento
Informe os pacientes sobre o uso concomitante de PAXIL com aspirina, AINEs, outros medicamentos antiplaquetários, varfarina ou outros anticoagulantes, pois o uso combinado foi associado a um risco aumentado de sangramento. Aconselhe os pacientes a informar seus profissionais de saúde se estiverem tomando ou planejando tomar algum medicamento prescrito ou de venda livre que aumente o risco de sangramento [ver AVISOS E PRECAUÇÕES ].
Ativação de mania/hipomania
Aconselhe os pacientes e seus cuidadores a observar sinais de ativação de mania/hipomania e instrua-os a relatar tais sintomas ao profissional de saúde [ver AVISOS E PRECAUÇÕES ].
Síndrome de descontinuação
Aconselhe os pacientes a não descontinuar abruptamente PAXIL 40mg e a discutir qualquer regime de redução gradual com seu médico. Informe os pacientes que reações adversas podem ocorrer quando PAXIL é descontinuado [ver AVISOS E PRECAUÇÕES ].
Informações de administração para suspensão oral
Instrua os pacientes a agitar a suspensão oral bem antes da administração [ver DOSAGEM E ADMINISTRAÇÃO ].
Reações alérgicas
Aconselhe os pacientes a notificar seu médico se desenvolverem uma reação alérgica, como erupção cutânea, urticária, inchaço ou dificuldade para respirar [ver REAÇÕES ADVERSAS ].
Toxicidade Embrio-Fetal
Aconselhar as mulheres sobre o risco potencial para o feto [ver AVISOS E PRECAUÇÕES , Uso em populações específicas ]. Aconselhe as pacientes a notificarem seu médico se engravidarem ou pretendem engravidar durante a terapia devido ao risco para o feto.
Enfermagem
Aconselhe as mulheres a notificarem seu médico se estiverem amamentando um bebê [ver Uso em populações específicas ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Estudos de carcinogenicidade de dois anos foram conduzidos em roedores que receberam paroxetina na dieta em 1, 5 e 25 mg/kg/dia (camundongos) e 1, 5 e 20 mg/kg/dia (ratos). Essas doses são de até 2,0 (camundongo) e 3,2 (rato) vezes a MRHD de 75 mg em uma base de mg/m2. Houve um número significativamente maior de ratos machos no grupo de alta dose com sarcomas de células do retículo (1/100, 0/50, 0/50 e 4/50 para controle, grupos de dose baixa, média e alta , respectivamente) e uma tendência linear significativamente aumentada entre os grupos de dose para a ocorrência de tumores linforreticulares em ratos machos. Ratas fêmeas não foram afetadas. Embora tenha havido um aumento relacionado à dose no número de tumores em camundongos, não houve aumento relacionado à droga no número de camundongos com tumores. A relevância desses achados para humanos é desconhecida.

Mutagênese
paroxetina não produziu efeitos genotóxicos em uma bateria de 5 ensaios in vitro e 2 in vivo que incluíram o seguinte: ensaio de mutação bacteriana, ensaio de mutação de linfoma de camundongo, ensaio de síntese de DNA não programado e testes para aberrações citogenéticas in vivo na medula óssea de camundongo e in vitro em linfócitos humanos e em um teste letal dominante em ratos.
Prejuízo da Fertilidade
Alguns estudos clínicos demonstraram que os ISRSs (incluindo a paroxetina) podem afetar a qualidade do esperma durante o tratamento com ISRS, o que pode afetar a fertilidade em alguns homens.
Uma taxa de gravidez reduzida foi encontrada em estudos de reprodução em ratos com uma dose de paroxetina de 15 mg/kg/dia, que é 2,4 vezes a MRHD de 75 mg em uma base de mg/m2. Lesões irreversíveis ocorreram no trato reprodutivo de ratos machos após administração em estudos de toxicidade por 2 a 52 semanas. Essas lesões consistiam em vacuolização do epitélio tubular epididimal na dose de 50 mg/kg/dia e alterações atróficas nos túbulos seminíferos dos testículos com espermatogênese interrompida na dose de 25 mg/kg/dia (8,2 e 4,1 vezes a MRHD de 75 mg na dose mg/ base m2).
Uso em populações específicas
Gravidez
Gravidez Categoria D [Ver AVISOS E PRECAUÇÕES ]
Estudos epidemiológicos mostraram que bebês expostos à paroxetina no primeiro trimestre de gravidez têm um risco aumentado de malformações congênitas, particularmente malformações cardiovasculares. Se a paroxetina for usada durante a gravidez, ou se a paciente engravidar enquanto estiver tomando paroxetina, informe a paciente sobre o risco potencial para o feto.
Considerações Clínicas
menos que os benefícios da paroxetina para a mãe justifiquem a continuação do tratamento, deve-se considerar a descontinuação da terapia com paroxetina ou a mudança para outro antidepressivo [ver AVISOS E PRECAUÇÕES ]. Por
- Um estudo baseado em dados do registro nacional sueco demonstrou que bebês expostos à paroxetina durante a gravidez (n = 815) tiveram um risco aumentado de malformações cardiovasculares (risco de 2% em bebês expostos à paroxetina) em comparação com toda a população do registro (risco de 1%). para uma razão de chances (OR) de 1,8 (intervalo de confiança de 95% 1,1 a 2,8). Nenhum aumento no risco de malformações congênitas gerais foi observado nos bebês expostos à paroxetina. As malformações cardíacas nas crianças expostas à paroxetina foram principalmente defeitos do septo ventricular (CIV) e defeitos do septo atrial (CIA). Os defeitos septais variam em gravidade, desde aqueles que se resolvem espontaneamente até aqueles que requerem cirurgia.
- Um estudo de coorte retrospectivo separado dos Estados Unidos (dados da United Healthcare) avaliou 5.956 bebês de mães que dispensaram antidepressivos durante o primeiro trimestre (n = 815 para paroxetina). Este estudo mostrou uma tendência de aumento do risco de malformações cardiovasculares para paroxetina (risco de 1,5%) em comparação com outros antidepressivos (risco de 1%), para um OR de 1,5 (intervalo de confiança de 95% 0,8 a 2,9). Dos 12 recém-nascidos expostos à paroxetina com malformações cardiovasculares, 9 apresentavam CIV. Este estudo também sugeriu um risco aumentado de malformações congênitas maiores em geral, incluindo defeitos cardiovasculares para paroxetina (4% de risco) em comparação com outros antidepressivos (2% de risco) (OR 1,8; intervalo de confiança de 95% 1,2 a 2,8).
- Dois grandes estudos de caso-controle usando bancos de dados separados, cada um com > 9.000 casos de defeitos congênitos e > 4.000 controles, descobriram que o uso materno de paroxetina durante o primeiro trimestre de gravidez foi associado a um aumento de 2 a 3 vezes no risco de saída do ventrículo direito obstruções do trato. Em um estudo o OR foi de 2,5 (intervalo de confiança de 95%, 1,0 a 6,0, 7 bebês expostos) e no outro estudo o OR foi de 3,3 (intervalo de confiança de 95%, 1,3 a 8,8, 6 bebês expostos).
Outros estudos encontraram resultados variados quanto ao aumento do risco de malformações congênitas gerais, cardiovasculares ou específicas. Uma meta-análise de dados epidemiológicos durante um período de 16 anos (1992 a 2008) sobre o uso de paroxetina no primeiro trimestre na gravidez e malformações congênitas incluiu os estudos mencionados acima, além de outros (n = 17 estudos que incluíram malformações gerais e n = 14 estudos que incluíram malformações cardiovasculares; n = 20 estudos distintos). Embora sujeita a limitações, esta meta-análise sugeriu uma maior ocorrência de malformações cardiovasculares (razão de chances de prevalência [POR] 1,5; intervalo de confiança de 95% 1,2 a 1,9) e malformações gerais (POR 1,2; intervalo de confiança de 95% 1,1 a 1,4) com paroxetina uso durante o primeiro trimestre. Não foi possível nesta meta-análise determinar até que ponto a prevalência observada de malformações cardiovasculares pode ter contribuído para a prevalência de malformações gerais, nem foi possível determinar se algum tipo específico de malformações cardiovasculares pode ter contribuído para a prevalência observada de todas as malformações cardiovasculares.
menos que os benefícios da paroxetina para a mãe justifiquem a continuação do tratamento, deve-se considerar a descontinuação da terapia com paroxetina ou a mudança para outro antidepressivo [ver AVISOS E PRECAUÇÕES ]. Para mulheres que pretendem engravidar ou estão no primeiro trimestre de gravidez, a paroxetina só deve ser iniciada após consideração das outras opções de tratamento disponíveis [ver AVISOS E PRECAUÇÕES ].
Tratamento de mulheres grávidas durante o terceiro trimestre
Recém-nascidos expostos a ISRSs ou inibidores da recaptação de serotonina e norepinefrina (SNRIs), incluindo PAXIL 40mg, no final do terceiro trimestre desenvolveram complicações que requerem hospitalização prolongada, suporte respiratório e alimentação por sonda. Tais complicações podem surgir imediatamente após o parto. Os achados clínicos relatados incluíram desconforto respiratório, cianose, apnéia, convulsões, instabilidade de temperatura, dificuldade de alimentação, vômitos, hipoglicemia, hipotonia, hipertonia, hiperreflexia, tremor, nervosismo, irritabilidade e choro constante. Essas características são consistentes com um efeito tóxico direto de SSRIs e SNRIs ou, possivelmente, uma síndrome de descontinuação da droga. Deve-se notar que, em alguns casos, o quadro clínico é compatível com síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES ].
exposição a ISRSs no final da gravidez pode aumentar o risco de hipertensão pulmonar persistente do recém-nascido (HPPRN). A HPPN ocorre em 1 a 2 por 1.000 nascidos vivos na população geral e está associada a morbidade e mortalidade neonatal substanciais. Em um estudo caso-controle retrospectivo de 377 mulheres cujos bebês nasceram com HPPN e 836 mulheres cujos bebês nasceram saudáveis, o risco de desenvolver HPPN foi aproximadamente seis vezes maior para bebês expostos a ISRSs após a 20ª semana de gestação em comparação com bebês que não foram expostas a antidepressivos durante a gravidez.
Também houve relatos pós-comercialização de partos prematuros em mulheres grávidas expostas à paroxetina ou outros ISRSs.
Ao tratar uma mulher grávida com paroxetina durante o terceiro trimestre, o médico deve considerar cuidadosamente os potenciais riscos e benefícios do tratamento. Estudo longitudinal prospectivo de 201 mulheres com histórico de depressão maior que estavam eutímicas no início da gravidez. As mulheres que descontinuaram a medicação antidepressiva durante a gravidez eram mais propensas a ter uma recaída de depressão maior do que as mulheres que continuaram a medicação antidepressiva.
Achados de animais
Os estudos de reprodução foram realizados com doses de até 50 mg/kg/dia em ratos e 6 mg/kg/dia em coelhos administrados durante a organogênese. Estas doses são aproximadamente 6 (rato) e menos de 2 (coelho) vezes a dose humana máxima recomendada (MRHD – 75 mg) numa base de mg/m2. Esses estudos não revelaram evidências de efeitos no desenvolvimento. No entanto, em ratos, houve um aumento nas mortes de filhotes durante os primeiros 4 dias de lactação quando a dosagem ocorreu durante o último trimestre de gestação e continuou durante toda a lactação. Este efeito ocorreu com uma dose de 1 mg/kg/dia que é superior à MRHD numa base de mg/m2. A dose sem efeito para a mortalidade de filhotes de rato não foi determinada. A causa dessas mortes não é conhecida.
Mães que amamentam
Como muitos outros medicamentos, a paroxetina é secretada no leite humano. Devido ao potencial de reações adversas graves em lactentes com PAXIL 20mg, deve-se decidir entre descontinuar lactentes ou descontinuar o medicamento, levando em consideração a importância do medicamento para a mãe.
Uso Pediátrico
A segurança e eficácia de PAXIL em pacientes pediátricos não foram estabelecidas [ver AVISO DE CAIXA ]. A eficácia não foi demonstrada em três estudos controlados com placebo em 752 pacientes pediátricos tratados com PAXIL com MDD.
Os antidepressivos aumentam o risco de pensamentos e comportamentos suicidas em pacientes pediátricos [ver AVISO EM CAIXA , AVISOS E PRECAUÇÕES ]. A diminuição do apetite e a perda de peso foram observadas em associação com o uso de ISRSs.
Em estudos clínicos controlados por placebo realizados com pacientes pediátricos, as seguintes reações adversas foram relatadas em pelo menos 2% dos pacientes pediátricos tratados com PAXIL e ocorreram em uma taxa pelo menos duas vezes maior que a dos pacientes pediátricos que receberam placebo: labilidade emocional (incluindo automutilação , pensamentos suicidas, tentativa de suicídio, choro e flutuações de humor), hostilidade, diminuição do apetite, tremor, sudorese, hipercinesia e agitação.
As reações adversas após a descontinuação do tratamento com PAXIL nos ensaios clínicos pediátricos que incluíram um regime de redução gradual, que ocorreram em pelo menos 2% dos pacientes e com uma taxa de pelo menos o dobro do placebo, foram: labilidade emocional (incluindo ideação suicida, suicídio tentativa, alterações de humor e choro), nervosismo, tontura, náusea e dor abdominal.
Uso Geriátrico
Em ensaios clínicos pré-comercialização com PAXIL 10mg, 17% dos pacientes tratados com PAXIL (aproximadamente 700) tinham 65 anos de idade ou mais. Os estudos farmacocinéticos revelaram uma diminuição da depuração em idosos, e uma dose inicial mais baixa é recomendada; no entanto, não foram observadas diferenças gerais na segurança ou eficácia entre pacientes idosos e mais jovens [ver DOSAGEM E ADMINISTRAÇÃO , FARMACOLOGIA CLÍNICA ].
ISRSs, incluindo PAXIL, foram associados a casos de hiponatremia clinicamente significativa em pacientes idosos, que podem estar em maior risco para esta reação adversa [ver AVISOS E PRECAUÇÕES ].
Insuficiência Renal e Hepática
Concentrações plasmáticas aumentadas de paroxetina ocorrem em pacientes com insuficiência renal e hepática. A dose inicial de PAXIL deve ser reduzida em pacientes com insuficiência renal grave e em pacientes com insuficiência hepática grave [ver DOSAGEM E ADMINISTRAÇÃO , FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Experiência Humana
Desde a introdução de PAXIL 30mg nos Estados Unidos, casos espontâneos de superdosagem deliberada ou acidental durante o tratamento com paroxetina foram relatados em todo o mundo. Estes incluem overdoses com paroxetina isoladamente e em combinação com outras substâncias. Há relatos de fatalidades que parecem envolver apenas paroxetina.
As reações adversas comumente relatadas associadas à superdosagem de paroxetina incluem sonolência, coma, náusea, tremor, taquicardia, confusão, vômito e tontura. Outros sinais e sintomas notáveis observados com superdosagem envolvendo paroxetina (isolada ou com outras substâncias) incluem midríase, convulsões (incluindo estado de mal epiléptico), arritmias ventriculares (incluindo torsade de pointes), hipertensão, reações agressivas, síncope, hipotensão, estupor, bradicardia, distonia , rabdomiólise, sintomas de disfunção hepática (incluindo insuficiência hepática, necrose hepática, icterícia, hepatite e esteatose hepática), síndrome serotoninérgica, reações maníacas, mioclonia, insuficiência renal aguda e retenção urinária.
Gerenciamento de superdosagem
Não são conhecidos antídotos específicos para PAXIL. Se ocorrer superdosagem, ligue para o centro de controle de envenenamento em 1-800-222-1222 para obter as recomendações mais recentes.
CONTRA-INDICAÇÕES
PAXIL é contraindicado em pacientes:
- Tomar, ou dentro de 14 dias após a interrupção, IMAOs (incluindo os IMAOs linezolida e azul de metileno intravenoso) devido a um risco aumentado de síndrome serotoninérgica [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
- Tomar tioridazina devido ao risco de prolongamento do intervalo QT [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ]
- Tomar pimozida devido ao risco de prolongamento do intervalo QT [ver AVISOS E PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ].
- Com hipersensibilidade conhecida (por exemplo, anafilaxia, angioedema, síndrome de Stevens-Johnson) à paroxetina ou a qualquer um dos ingredientes inativos de PAXIL [ver REAÇÕES ADVERSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
O mecanismo de ação do PAXIL no tratamento de MDD, SAD, TOC\, PD, GAD e PTSD é desconhecido, mas presume-se que esteja ligado à potencialização da atividade serotoninérgica no sistema nervoso central resultante da inibição da recaptação neuronal de serotonina (5-hidroxi-triptamina, 5-HT).
Farmacodinâmica
Estudos em doses clinicamente relevantes em humanos demonstraram que a paroxetina bloqueia a captação de serotonina nas plaquetas humanas. Estudos in vitro em animais também sugerem que a paroxetina é um inibidor potente e altamente seletivo da recaptação neuronal de serotonina (ISRS) e tem apenas efeitos muito fracos na recaptação neuronal de norepinefrina e dopamina.
Farmacocinética
Não linearidade na farmacocinética é observada com doses crescentes de PAXIL.
Em uma meta-análise de paroxetina de 4 estudos realizados em voluntários saudáveis após doses múltiplas de 20 mg/dia a 40 mg/dia, os homens não exibiram Cmax ou AUC significativamente mais baixos do que as mulheres.
Absorção
cloridrato de paroxetina é completamente absorvido após administração oral de uma solução do sal cloridrato. Em um estudo em que indivíduos normais do sexo masculino (n = 15) receberam comprimidos de 30 mg diariamente por 30 dias, as concentrações de paroxetina no estado de equilíbrio foram alcançadas em aproximadamente 10 dias para a maioria dos indivíduos, embora possa demorar substancialmente mais em um paciente ocasional. No estado estacionário, os valores médios de Cmax, Tmax, Cmin e T½ foram 61,7 ng/mL (CV 45%), 5,2 h. (CV 10%), 30,7 ng/mL (CV 67%) e 21,0 horas (CV 32%), respectivamente. Os valores de Cmax e Cmin no estado de equilíbrio foram cerca de 6 e 14 vezes o que seria previsto em estudos de dose única. A exposição ao fármaco em estado estacionário com base na AUC0-24 foi cerca de 8 vezes maior do que o previsto a partir de dados de dose única nestes indivíduos. O acúmulo excessivo é consequência do fato de que uma das enzimas que metaboliza a paroxetina é prontamente saturável.
A paroxetina é igualmente biodisponível na suspensão oral e no comprimido.
Efeito dos Alimentos
Os efeitos dos alimentos na biodisponibilidade da paroxetina foram estudados em indivíduos que receberam uma dose única com e sem alimentos. A AUC aumentou apenas ligeiramente (6%) quando o fármaco foi administrado com alimentos, mas a Cmax foi 29% maior, enquanto o tempo para atingir a concentração plasmática máxima diminuiu de 6,4 horas após a administração para 4,9 horas.
Distribuição
A paroxetina distribui-se por todo o corpo, incluindo o SNC, restando apenas 1% no plasma.
Aproximadamente 95% e 93% da paroxetina liga-se à proteína plasmática em 100 ng/mL e 400 ng/mL, respectivamente. Sob condições clínicas, as concentrações de paroxetina normalmente seriam inferiores a 400 ng/mL. A paroxetina não altera a ligação proteica in vitro da fenitoína ou da varfarina.
Eliminação
Metabolismo
A meia-vida média de eliminação é de aproximadamente 21 horas (CV 32%) após a administração oral de comprimidos de 30 mg diariamente por 30 dias de PAXIL.
Em estudos de proporcionalidade de dose em estado de equilíbrio envolvendo pacientes idosos e não idosos, em doses de 20 mg a 40 mg por dia para idosos e 20 mg a 50 mg por dia para não idosos, alguma não linearidade foi observada em ambas as populações, refletindo novamente uma via metabólica saturável . Em comparação com os valores de Cmin após 20 mg diários, os valores após 40 mg diários foram apenas cerca de 2 a 3 vezes maiores que o dobro.
paroxetina é extensivamente metabolizada após administração oral. Os principais metabólitos são produtos polares e conjugados de oxidação e metilação, que são prontamente eliminados. Os conjugados com ácido glucurônico e sulfato predominam, e os principais metabólitos foram isolados e identificados. Os dados indicam que os metabolitos não têm mais de 1/50 da potência do composto original na inibição da absorção de serotonina. O metabolismo da paroxetina é realizado em parte pelo CYP2D6. A saturação desta enzima em doses clínicas parece ser responsável pela não linearidade da cinética da paroxetina com o aumento da dose e o aumento da duração do tratamento. O papel desta enzima no metabolismo da paroxetina também sugere potenciais interações medicamentosas [ver INTERAÇÕES MEDICAMENTOSAS ]. O comportamento farmacocinético da paroxetina não foi avaliado em indivíduos com deficiência de CYP2D6 (metabolizadores deficientes).
Excreção
Aproximadamente 64% de uma dose de solução oral de 30 mg de paroxetina foi excretada na urina com 2% como composto original e 62% como metabólitos durante um período de 10 dias após a administração. Cerca de 36% foi excretado nas fezes (provavelmente através da bile), principalmente como metabólitos e menos de 1% como composto original durante o período de 10 dias após a administração.
Estudos de interação medicamentosa
Existem interações medicamentosas conhecidas e clinicamente significativas entre a paroxetina e outros medicamentos [ver INTERAÇÕES MEDICAMENTOSAS ].
Figura 1. Impacto da Paroxetina na Farmacocinética de Medicamentos Coadministrados (escala logarítmica)
Figura 2. Impacto dos Medicamentos Coadministrados na Farmacocinética da Paroxetina
Teofilina
Relatos de níveis elevados de teofilina associados ao tratamento com PAXIL foram relatados. Embora essa interação não tenha sido formalmente estudada, recomenda-se que os níveis de teofilina sejam monitorados quando esses medicamentos são administrados concomitantemente.
Drogas Metabolizadas pelo Citocromo CYP3A4
Um estudo de interação in vivo envolvendo a coadministração em condições de estado de equilíbrio de paroxetina e terfenadina, um substrato para CYP3A4, não revelou nenhum efeito da paroxetina na farmacocinética da terfenadina. Além disso, estudos in vitro mostraram que o cetoconazol, um potente inibidor da atividade do CYP3A4, é pelo menos 100 vezes mais potente que a paroxetina como inibidor do metabolismo de vários substratos dessa enzima, incluindo terfenadina, astemizol, cisaprida, triazolam e ciclosporina. Não se espera que a extensão da inibição da atividade do CYP3A4 pela paroxetina seja de significância clínica.
Populações Específicas
O impacto de populações específicas na farmacocinética da paroxetina é mostrado na Figura 3.
A dose inicial recomendada e a dose máxima de PAXIL são reduzidas em pacientes idosos, pacientes com insuficiência renal grave e pacientes com insuficiência hepática grave. DOSAGEM E ADMINISTRAÇÃO ].
Figura 3. Impacto da População Específica na Farmacocinética da Paroxetina (escala logarítmica)
Estudos clínicos
Transtorno Depressivo Maior
A eficácia de PAXIL como tratamento para transtorno depressivo maior (TDM) foi estabelecida em 6 estudos controlados por placebo de pacientes com TDM (18 a 73 anos). Nesses estudos, o PAXIL demonstrou ser estatisticamente significativamente mais eficaz do que o placebo no tratamento do TDM por pelo menos 2 das seguintes medidas: Escala de Avaliação de Depressão de Hamilton (HDRS), o item de humor deprimido de Hamilton e a Impressão Clínica Global (CGI)- Gravidade da Doença. O PAXIL foi estatisticamente melhor do que o placebo na melhora dos escores do subfator HDRS, incluindo o item humor deprimido, fator de distúrbio do sono e fator de ansiedade.
eficácia a longo prazo de PAXIL 10mg para o tratamento de MDD em pacientes ambulatoriais foi demonstrada em um estudo randomizado de retirada. Os pacientes que responderam ao PAXIL (pontuação total de HDRS
Transtorno obsessivo-compulsivo
eficácia do PAXIL no tratamento do transtorno obsessivo compulsivo (TOC) foi demonstrada em dois estudos multicêntricos controlados por placebo de 12 semanas em pacientes ambulatoriais adultos (Estudos 1 e 2). Os pacientes tinham TOC moderado a grave (DSM-IIIR) com classificações basais médias na pontuação total da Yale Brown Obsessive Compulsive Scale (YBOCS) variando de 23 a 26. No estudo 1, um estudo de descoberta de faixa de dose, os pacientes receberam doses diárias fixas de PAXIL 20 mg, 40 mg ou 60 mg. O estudo 1 demonstrou que as doses diárias de PAXIL 40 mg e 60 mg são eficazes no tratamento do TOC. Os pacientes que receberam doses de PAXIL 40 mg e 60 mg experimentaram uma redução média de aproximadamente 6 e 7 pontos, respectivamente, na pontuação total YBOCS que foi estatisticamente significativamente maior do que a redução aproximada de 4 pontos com 20 mg e uma redução de 3 pontos na os pacientes tratados com placebo. O Estudo 2 foi um estudo de dose flexível comparando PAXIL 20 mg a 60 mg por dia com clomipramina 25 mg a 250 mg por dia ou placebo). Neste estudo, os pacientes que receberam PAXIL tiveram uma redução média de aproximadamente 7 pontos na pontuação total do YBOCS, que foi estatisticamente significativamente maior do que a redução média de aproximadamente 4 pontos em pacientes tratados com placebo.
tabela a seguir fornece a classificação de resultados por grupo de tratamento nos itens de Melhoria Global da escala de Impressão Clínica Global (CGI) para o Estudo 1.
As análises de subgrupo não indicaram que houvesse diferenças nos resultados do tratamento em função da idade ou sexo.
A eficácia a longo prazo do PAXIL para o tratamento do TOC foi estabelecida em uma extensão de longo prazo do Estudo 1. Pacientes que responderam ao PAXIL durante a fase duplo-cega de 3 meses e uma extensão de 6 meses no PAXIL 20 aberto mg a 60 mg por dia foram randomizados para PAXIL 10 mg ou placebo em uma fase de prevenção de recaída duplo-cega de 6 meses. Os pacientes randomizados para PAXIL foram estatisticamente significativamente menos propensos a recaídas do que os pacientes tratados com placebo.
Síndrome do pânico
eficácia de PAXIL 20mg no tratamento do transtorno do pânico (TP) foi demonstrada em três estudos multicêntricos de 10 a 12 semanas, controlados por placebo, em pacientes ambulatoriais adultos (Estudos 1, 2 e 3). Os pacientes apresentavam DP (DSM-IIIR), com ou sem agorafobia. Nesses estudos, o PAXIL demonstrou ser estatisticamente significativamente mais eficaz do que o placebo no tratamento da DP em pelo menos 2 de 3 medidas de frequência de ataque de pânico e no escore de Gravidade de Doença de Impressão Clínica Global.
O estudo 1 foi um estudo de descoberta de intervalo de dose de 10 semanas; os pacientes receberam doses fixas de PAXIL 10 mg, 20 mg ou 40 mg diariamente ou placebo. Uma diferença estatisticamente significativa em relação ao placebo foi observada apenas para o grupo PAXIL 40 mg por dia. No ponto final, 76% dos pacientes que receberam PAXIL 40 mg diariamente estavam livres de ataques de pânico, em comparação com 44% dos pacientes tratados com placebo.
estudo 2 foi um estudo de dose flexível de 12 semanas comparando PAXIL 10 mg a 60 mg por dia e placebo. No ponto final, 51% dos pacientes tratados com PAXIL estavam livres de ataques de pânico em comparação com 32% dos pacientes tratados com placebo.
O Estudo 3 foi um estudo de dose flexível de 12 semanas comparando PAXIL 10 mg a 60 mg por dia com placebo em pacientes recebendo concomitantemente terapia cognitivo-comportamental padronizada. No ponto final, 33% dos pacientes tratados com PAXIL apresentaram uma redução para 0 ou 1 ataques de pânico em comparação com 14% dos pacientes tratados com placebo.
Nos Estudos 2 e 3, a dose média de PAXIL para completadores no ponto final foi de aproximadamente 40 mg por dia.
eficácia a longo prazo do PAXIL 10mg na DP foi demonstrada em uma extensão do Estudo 1. Os pacientes que responderam ao PAXIL 20mg durante a fase duplo-cego de 10 semanas e durante a fase de extensão duplo-cego de 3 meses foram randomizados para PAXIL 10 mg, 20 mg ou 40 mg por dia ou placebo em uma fase de prevenção de recaída duplo-cega de 3 meses. Os pacientes randomizados para PAXIL 20mg foram estatisticamente significativamente menos propensos a recaídas do que os pacientes tratados com placebo.
As análises de subgrupo não indicaram que houvesse diferenças nos resultados do tratamento em função da idade ou sexo.
Transtorno de ansiedade social
eficácia do PAXIL no tratamento do transtorno de ansiedade social (TAS) foi demonstrada em três estudos de 12 semanas, multicêntricos, controlados por placebo (Estudos 1, 2 e 3) de pacientes ambulatoriais adultos com SAD (DSM-IV). Nestes estudos, a eficácia de PAXIL 30mg em comparação com placebo foi avaliada com base em (1) a proporção de respondedores, conforme definido por uma pontuação de Melhoria da Impressão Clínica Global (CGI) de 1 (muito melhorada) ou 2 (muito melhorada ) e (2) mudança da linha de base na Escala de Ansiedade Social de Liebowitz (LSAS).
Os estudos 1 e 2 foram estudos de dose flexível comparando PAXIL 20 mg a 50 mg por dia e placebo. O PAXIL demonstrou superioridade estatisticamente significativa sobre o placebo tanto no critério de resposta CGI Improvement quanto na Liebowitz Social Anxiety Scale (LSAS). No Estudo 1, para os pacientes que completaram a semana 12, 69% dos pacientes tratados com PAXIL em comparação com 29% dos pacientes tratados com placebo eram respondedores de melhora CGI. No Estudo 2, os que responderam ao CGI Improvement foram 77% e 42% para os pacientes tratados com PAXIL e placebo, respectivamente.
O estudo 3 foi um estudo de 12 semanas comparando doses fixas de PAXIL 20 mg, 40 mg ou 60 mg diariamente com placebo. PAXIL 20 mg foi estatisticamente significativamente superior ao placebo tanto no LSAS Total Score quanto no critério de resposta CGI Improvement; houve tendências de superioridade em relação ao placebo para os grupos de dose diária de PAXIL 40 mg e 60 mg. Não houve indicação neste estudo de qualquer benefício adicional para doses superiores a 20 mg por dia.
As análises de subgrupo geralmente não indicaram diferenças nos resultados do tratamento em função da idade, raça ou sexo.
Distúrbio de ansiedade generalizada
A eficácia do PAXIL no tratamento do transtorno de ansiedade generalizada (TAG) foi demonstrada em dois estudos multicêntricos de 8 semanas, controlados por placebo (Estudos 1 e 2) de pacientes ambulatoriais adultos com TAG (DSM-IV).
O estudo 1 foi um estudo de 8 semanas comparando doses fixas de PAXIL 20 mg ou 40 mg diariamente com placebo. As doses de PAXIL 20 mg ou 40 mg demonstraram ser estatisticamente significativamente superiores ao placebo na pontuação total da Escala de Avaliação de Hamilton para Ansiedade (HAM-A).
Não houve evidência suficiente neste estudo para sugerir um benefício maior para a dose diária de 40 mg de PAXIL em comparação com a dose diária de 20 mg.
O estudo 2 foi um estudo de dose flexível comparando PAXIL 20 mg a 50 mg por dia e placebo. O PAXIL demonstrou superioridade estatisticamente significativa sobre o placebo na pontuação total da Escala de Avaliação de Hamilton para Ansiedade (HAM-A).
Um terceiro estudo, um estudo de dose flexível comparando PAXIL 20 mg a 50 mg diários com placebo, não demonstrou superioridade estatisticamente significativa de PAXIL sobre placebo na pontuação total da Escala de Hamilton para Ansiedade (HAM-A), o resultado primário.
As análises de subgrupo não indicaram diferenças nos resultados do tratamento em função da raça ou sexo. Não havia pacientes idosos suficientes para realizar análises de subgrupo com base na idade.
Em um estudo de longo prazo, 566 pacientes que atenderam aos critérios do DSM-IV para TAG, que responderam durante uma fase de tratamento agudo de 8 semanas com PAXIL 20 mg a 50 mg diariamente, foram randomizados para a continuação de PAXIL 30 mg em seu mesma dose, ou placebo, por até 24 semanas de observação para recaída. A resposta durante a fase simples-cega foi definida por uma diminuição de ≥2 pontos em comparação com a linha de base na escala CGI-Severity of Illness, para uma pontuação ≤3. A recaída durante a fase duplo-cega foi definida como um aumento de ≥2 pontos em comparação com a linha de base na escala CGI-Gravidade da Doença para uma pontuação de ≥4, ou retirada devido à falta de eficácia. Os pacientes que continuaram a receber PAXIL 40mg apresentaram uma taxa de recaída estatisticamente significativamente menor nas 24 semanas subsequentes em comparação com aqueles que receberam placebo.
Transtorno de Estresse Pós-Traumático
eficácia do PAXIL 20mg no tratamento do Transtorno de Estresse Pós-Traumático (TEPT) foi demonstrada em dois estudos multicêntricos, controlados por placebo, de 12 semanas (Estudos 1 e 2) de pacientes ambulatoriais adultos que preencheram os critérios do DSM-IV para TEPT. A duração média dos sintomas de TEPT para os 2 estudos combinados foi de 13 anos (variando de 0,1 ano a 57 anos). A porcentagem de pacientes com TDM secundário ou transtornos de ansiedade não-TEPT nos 2 estudos combinados foi de 41% (356 de 858 pacientes) e 40% (345 de 858 pacientes), respectivamente. O resultado do estudo foi avaliado por (1) a pontuação da Escala de PTSD administrada pelo clínico Parte 2 (CAPS-2) e (2) a Escala de Melhoria Global de Impressão Clínica Global (CGI-I). O CAPS-2 é um instrumento multi-item que mede 3 aspectos do TEPT com os seguintes agrupamentos de sintomas: reexperiência/intrusão, evitação/entorpecimento e hiperexcitação. Os 2 desfechos primários para cada estudo foram (1) mudança da linha de base para o desfecho na pontuação total CAPS-2 (17 itens) e (2) proporção de respondedores no CGI-I, onde os respondedores foram definidos como pacientes com uma pontuação de 1 (muito melhorado) ou 2 (muito melhorado).
Estudo 1 foi um estudo de 12 semanas comparando doses fixas de PAXIL 20 mg ou 40 mg diariamente com placebo. As doses de PAXIL 20 mg e 40 mg demonstraram ser estatisticamente significativamente superiores ao placebo na alteração da linha de base para a pontuação total CAPS-2 e na proporção de respondedores no CGI-I. Não houve evidência suficiente neste estudo para sugerir um benefício maior para a dose diária de 40 mg em comparação com a dose diária de 20 mg.
O Estudo 2 foi um estudo de dose flexível de 12 semanas comparando PAXIL 20 mg a 50 mg diariamente com placebo. PAXIL 40mg demonstrou ser significativamente superior ao placebo na alteração da linha de base para a pontuação total CAPS-2 e na proporção de respondedores no CGI-I.
Um terceiro estudo, um estudo de dose flexível comparando PAXIL 20 mg a 50 mg diariamente com placebo, demonstrou que PAXIL 20 mg é estatisticamente significativamente superior ao placebo na alteração da linha de base para o escore total CAPS-2, mas não na proporção de respondedores no CGI -EU.
maioria dos pacientes nestes estudos eram mulheres (68% mulheres: 377 de 551 indivíduos no Estudo 1 e 66% mulheres: 202 de 303 indivíduos no Estudo 2). As análises de subgrupo não indicaram diferenças nos resultados do tratamento em função do sexo. Houve um número insuficiente de pacientes com 65 anos ou mais ou não caucasianos para realizar análises de subgrupo com base na idade ou raça, respectivamente.
INFORMAÇÃO DO PACIENTE
PAXIL® (PAX-il)(paroxetina) comprimidos e suspensão oral
Quais são as informações mais importantes que devo saber sobre o PAXIL?
PAXIL pode causar efeitos colaterais graves, incluindo:
- Aumento do risco de pensamentos ou ações suicidas. PAXIL 10mg e outros medicamentos antidepressivos podem aumentar os pensamentos e ações suicidas em algumas pessoas com 24 anos de idade ou menos, especialmente dentro da primeiros meses de tratamento ou quando a dose é alterada. PAXIL não deve ser utilizado em crianças.
- Depressão ou outras doenças mentais são as causas mais importantes de pensamentos e ações suicidas.
Como posso observar e tentar evitar pensamentos e ações suicidas?
- Preste muita atenção a quaisquer mudanças, especialmente mudanças repentinas de humor, comportamento, pensamentos ou sentimentos ou se você desenvolver pensamentos ou ações suicidas. Isso é muito importante quando um medicamento antidepressivo é iniciado ou quando a dose é alterada.
- Ligue para o seu médico imediatamente para relatar mudanças novas ou repentinas no humor, comportamento, pensamentos ou sentimentos ou se desenvolver pensamentos ou ações suicidas.
- Mantenha todas as visitas de acompanhamento com seu médico conforme programado. Ligue para o seu médico entre as visitas, conforme necessário, especialmente se tiver dúvidas sobre os sintomas.
Ligue para o seu médico ou procure ajuda médica de emergência imediatamente se tiver algum dos seguintes sintomas, especialmente se eles forem novos, piores ou o preocuparem:
- tentativas de suicídio
- agindo de forma agressiva ou violenta
- depressão nova ou pior
- sentindo-se agitado, inquieto, irritado ou irritado
- um aumento na atividade e falar mais do que o normal para você
- agindo em impulsos perigosos
- pensamentos sobre suicídio ou morte
- ansiedade nova ou pior ou ataques de pânico
- problemas para dormir
- outras mudanças incomuns no comportamento ou humor
O que é PAXIL?
PAXIL 30mg é um medicamento de prescrição usado em adultos para tratar:
- Um certo tipo de depressão chamado Transtorno Depressivo Maior (MDD)
- Transtorno Obsessivo Compulsivo (TOC)
- Transtorno do Pânico (TP)
- Transtorno de Ansiedade Social (TAS)
- Transtorno de Ansiedade Generalizada (TAG)
- Transtorno de Estresse Pós-Traumático (TEPT)
Não tome PAXIL se você:
- tomar um inibidor da monoamina oxidase (IMAO)
- pararam de tomar um IMAO nos últimos 14 dias
- estão sendo tratados com o antibiótico linezolida ou o azul de metileno intravenoso
- estão tomando pimozida
- está tomando tioridazina
- são alérgicos à paroxetina ou a qualquer um dos ingredientes de PAXIL. Consulte o final deste Guia de Medicação para obter uma lista completa dos ingredientes do PAXIL.
Pergunte ao seu médico ou farmacêutico se não tiver certeza se toma um IMAO ou um desses medicamentos, incluindo o antibiótico linezolida ou azul de metileno intravenoso.
Não comece a tomar um IMAO por pelo menos 14 dias após parar o tratamento com PAXIL.
Antes de tomar PAXIL, informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem problemas cardíacos
- tem ou teve problemas de sangramento
- tem ou tem histórico familiar de transtorno bipolar, mania ou hipomania
- tem ou teve convulsões ou convulsões
- tem glaucoma (pressão alta no olho)
- tem baixos níveis de sódio no sangue
- tem problemas ósseos
- tem problemas renais ou hepáticos
- estão grávidas ou planejam engravidar. PAXIL 40mg pode prejudicar o feto. Converse com seu médico sobre os riscos para o feto se você tomar PAXIL durante a gravidez. Informe imediatamente o seu médico se engravidar ou se pensa estar grávida durante o tratamento com PAXIL.
- está amamentando ou planeja amamentar. PAXIL passa para o leite materno. Converse com seu médico sobre a melhor maneira de alimentar seu bebê durante o tratamento com PAXIL.
Informe o seu médico sobre todos os medicamentos que toma, incluindo medicamentos prescritos e de venda livre, vitaminas e suplementos de ervas.
PAXIL e alguns outros medicamentos podem afetar um ao outro causando possíveis efeitos colaterais graves. PAXIL 30mg pode afetar o modo de ação de outros medicamentos e outros medicamentos podem afetar o modo de ação de PAXIL.
Informe especialmente o seu médico se você tomar:
- medicamentos usados para tratar enxaquecas chamados triptanos
- antidepressivos tricíclicos
- fentanil
- lítio
- tramadol
- triptofano
- buspirona
- anfetaminas
- Erva de São João
- medicamentos que podem afetar a coagulação do sangue, como aspirina, anti-inflamatórios não esteroides (AINEs), varfarina
- diuréticos
- tamoxifeno
- medicamentos usados para tratar distúrbios de humor, ansiedade, psicóticos ou do pensamento, incluindo recaptação seletiva de serotonina (ISRSs) e inibidores de recaptação de serotonina norepinefrina (IRSNs)
Pergunte ao seu médico se não tiver certeza se está tomando algum desses medicamentos. Seu médico pode lhe dizer se é seguro tomar PAXIL 10mg com seus outros medicamentos.
Não inicie ou interrompa nenhum outro medicamento durante o tratamento com PAXIL sem falar primeiro com seu médico. Parar o PAXIL de repente pode causar efeitos colaterais graves. Ver, “Quais são os possíveis efeitos colaterais do PAXIL 20mg?”
Conheça os medicamentos que você toma. Mantenha uma lista deles para mostrar ao seu médico e farmacêutico quando receber um novo medicamento.
Como devo tomar o PAXIL?
- Tome PAXIL exatamente como prescrito. Seu médico pode precisar alterar a dose de PAXIL 30mg até que seja a dose certa para você.
- Tome PAXIL 1 vez por dia pela manhã.
- PAXIL 30mg pode ser tomado com ou sem alimentos.
- Se estiver a tomar PAXIL suspensão oral, agite bem a suspensão antes de tomar.
- Se você tomar muito PAXIL, ligue para o seu centro de controle de envenenamento em 1-800-222-1222 ou vá para a sala de emergência do hospital mais próximo imediatamente.
Quais são os possíveis efeitos colaterais do PAXIL 10mg?
PAXIL 40mg pode causar efeitos colaterais graves, incluindo:
- Ver, “Qual é a informação mais importante que devo saber sobre o PAXIL?”
- Síndrome serotoninérgica. Um problema potencialmente fatal chamado síndrome serotoninérgica pode ocorrer quando você toma PAXIL 20mg com alguns outros medicamentos. Veja, “Quem não deve tomar PAXIL?” Ligue para o seu médico ou dirija-se imediatamente ao pronto-socorro do hospital mais próximo se tiver algum dos seguintes sinais e sintomas da síndrome serotoninérgica:
- agitação
- ver ou ouvir coisas que não são reais (alucinações)
- confusão
- coma
- batimento cardíaco rápido
- alterações na pressão arterial
- tontura
- sudorese
- rubor
- temperatura corporal elevada (hipertermia)
- tremores (tremores), músculos rígidos ou espasmos musculares
- perda de coordenação
- convulsões
- náuseas, vômitos, diarreia
- Problemas oculares (glaucoma de ângulo fechado). PAXIL 10mg pode causar um tipo de problema ocular chamado glaucoma de ângulo fechado em pessoas com outras condições oculares. Você pode querer se submeter a um exame oftalmológico para ver se está em risco e receber tratamento preventivo, se estiver. Ligue para o seu médico se tiver dor nos olhos, alterações na visão ou inchaço ou vermelhidão dentro ou ao redor do olho.
- Interações medicamentosas. Tomar PAXIL 20mg com alguns outros medicamentos, incluindo tioridazina e pimozida, pode aumentar o risco de desenvolver um problema cardíaco grave chamado prolongamento do intervalo QT.
- Convulsões (convulsões).
- Episódios maníacos. Episódios maníacos podem ocorrer em pessoas com transtorno bipolar que tomam PAXIL. Os sintomas podem incluir:
- energia muito aumentada
- pensamentos descontrolados
- ideias extraordinariamente grandes
- falando mais ou mais rápido do que o habitual
- problemas graves para dormir
- comportamento imprudente
- felicidade excessiva ou irritabilidade
- Síndrome de descontinuação. Parar repentinamente PAXIL 20mg pode causar efeitos colaterais graves. Seu médico pode querer diminuir sua dose lentamente. Os sintomas podem incluir:
- náusea
- sudorese
- mudanças no seu humor
- irritabilidade e agitação
- tontura
- sensação de choque elétrico (parestesia)
- tremor
- ansiedade
- confusão
- dor de cabeça
- cansaço
- problemas para dormir
- hipomania
- zumbido nos ouvidos (zumbido)
- convulsões
- Níveis baixos de sódio no sangue (hiponatremia). Níveis baixos de sódio no sangue, que podem ser graves e causar a morte, podem ocorrer durante o tratamento com PAXIL. Idosos e pessoas que tomam certos medicamentos podem estar em maior risco de desenvolver baixos níveis de sódio no sangue. Os sinais e sintomas podem incluir:
- dor de cabeça
- Dificuldade de concentração
- alterações de memória
- confusão
- fraqueza e instabilidade nos pés, o que pode levar a quedas
Em casos mais graves ou mais súbitos, os sinais e sintomas incluem:
- ver ou ouvir coisas que não são reais (alucinações)
- desmaio
- convulsões
- coma
- parar de respirar (parada respiratória)
- Sangramento anormal. Tomar PAXIL com aspirina, AINEs ou anticoagulantes pode aumentar esse risco. Informe o seu médico sobre qualquer sangramento ou hematoma incomum.
- Fraturas ósseas.
Os efeitos colaterais mais comuns do PAXIL 10mg incluem:
- problemas de função sexual masculina e feminina
- constipação
- diarréia
- boca seca
- problemas para dormir
- nervosismo
- sudorese
- bocejando
- fraqueza (astenia)
- diminuição do apetite
- tontura
- infecção
- náusea
- sonolência
- tremendo (tremor)
Estes não são todos os possíveis efeitos colaterais do PAXIL.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o PAXIL?
- Armazene os comprimidos PAXIL entre 15°C e 30°C (59°F a 86°F).
- Armazene PAXIL 10mg suspensão oral a ou abaixo de 77°F (25°C).
Mantenha PAXIL e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de PAXIL.
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não tome PAXIL para uma condição para a qual não foi prescrito. Não dê PAXIL a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los. Você pode pedir ao seu médico ou farmacêutico informações sobre PAXIL que foram escritas para profissionais de saúde.
Quais são os ingredientes de PAXIL 30mg?
Ingrediente ativo: cloridrato de paroxetina
Ingredientes inativos:
fosfato de cálcio dibásico di-hidratado, hipromelose, estearato de magnésio, polietilenoglicóis, polissorbato 80, amidoglicolato de sódio, dióxido de titânio e 1 ou mais dos seguintes: Laca de alumínio D&C Red No. 30, Laca de alumínio D&C Yellow No. 10, FD&C Blue No . 2 laca de alumínio, laca de alumínio FD&C Yellow No. 6
Suspensão oral: ácido cítrico (anidro), FD&C amarelo nº 6, aromatizantes, glicerina, metilparabeno, celulose microcristalina e carboximetilcelulose sódica, polacrilina potássica, propilenoglicol, propilparabeno, água purificada, sacarina sódica, emulsão de simeticona e citrato de sódio (dihidratado)
Este Guia de Medicação foi aprovado pela Food and Drug Administration dos EUA.
