Seroquel 25mg, 50mg, 100mg, 200mg, 300mg Quetiapine Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Seroquel 100mg e como é usado?
Seroquel 50mg é um medicamento de prescrição usado para tratar os sintomas da Esquizofrenia, Transtorno Bipolar I, Mania; Transtorno Bipolar, Episódios Depressivos; Transtorno Bipolar I, Manutenção; e Transtorno Depressivo Maior. Seroquel 50mg pode ser usado sozinho ou com outros medicamentos.
Seroquel pertence a uma classe de medicamentos denominados Antipsicóticos, 2ª Geração; Agentes Antimaníacos.
Não se sabe se Seroquel 200mg é seguro e eficaz em crianças menores de 12 anos de idade.
Quais são os possíveis efeitos colaterais do Seroquel 50mg?
Seroquel pode causar efeitos colaterais graves, incluindo:
- movimentos musculares descontrolados em seu rosto (mastigação, estalar os lábios, franzir a testa, movimento da língua, piscar ou movimento dos olhos),
- aparência de máscara do rosto,
- dificuldade para engolir,
- problemas com a fala,
- tontura,
- constipação severa,
- micção dolorosa ou difícil,
- visão embaçada,
- visão de túnel,
- dor nos olhos,
- vendo halos ao redor das luzes,
- músculos muito rígidos (rígidos),
- febre alta,
- sudorese,
- confusão,
- batimentos cardíacos rápidos ou irregulares,
- tremores,
- desmaio,
- aumento da sede,
- aumento da micção,
- boca seca,
- odor de hálito frutado,
- febre,
- arrepios,
- aftas,
- feridas na pele,
- dor de garganta,
- tosse, e
- Problemas respiratórios
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Seroquel incluem:
- problemas de fala,
- tontura,
- sonolência,
- cansaço,
- falta de energia,
- batimentos cardíacos acelerados,
- nariz entupido,
- aumento do apetite,
- ganho de peso,
- dor de estômago,
- vômito,
- constipação,
- boca seca e
- teste de função hepática anormal
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Seroquel. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
MORTALIDADE AUMENTADA EM PACIENTES IDOSOS COM PSICOSE RELACIONADA À DEMÊNCIA; e PENSAMENTOS E COMPORTAMENTOS SUICÍDICOS
Aumento da Mortalidade em Pacientes Idosos com Psicose Relacionada à Demência
Pacientes idosos com psicose relacionada à demência tratados com medicamentos antipsicóticos apresentam risco aumentado de morte [ver ADVERTÊNCIAS E PRECAUÇÕES]. SEROQUEL não está aprovado para o tratamento de pacientes com psicose relacionada à demência [ver ADVERTÊNCIAS E PRECAUÇÕES].
Pensamentos e Comportamentos Suicidas
Os antidepressivos aumentaram o risco de pensamentos e comportamentos suicidas em crianças, adolescentes e adultos jovens em estudos de curto prazo. Esses estudos não mostraram aumento do risco de pensamentos e comportamentos suicidas com o uso de antidepressivos em pacientes com mais de 24 anos; houve uma redução no risco com o uso de antidepressivos em pacientes com 65 anos ou mais [ver ADVERTÊNCIAS E PRECAUÇÕES].
Em pacientes de todas as idades que iniciam a terapia antidepressiva, monitore atentamente a piora e o surgimento de pensamentos e comportamentos suicidas. Aconselhe as famílias e os cuidadores sobre a necessidade de observação atenta e comunicação com o prescritor [ver ADVERTÊNCIAS E PRECAUÇÕES].
SEROQUEL 50mg não está aprovado para uso em pacientes pediátricos com menos de dez anos de idade [consulte Uso em populações específicas].
DESCRIÇÃO
SEROQUEL® (fumarato de quetiapina) é um agente psicotrópico pertencente a uma classe química, os derivados de dibenzotiazepina. A designação química é fumarato de 2-[2-(4-dibenzo[b,f][1,4]tiazepin-11-il-1-piperazinil)etoxi]-etanol (2:1) (sal). Está presente em comprimidos como o sal fumarato. Todas as doses e dosagens dos comprimidos são expressas em miligramas de base, não como sal fumarato. Sua fórmula molecular é C42H50N6O4S2•C4H4O4 e tem um peso molecular de 883,11 (sal fumarato). A fórmula estrutural é:
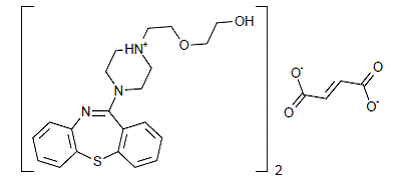
fumarato de quetiapina é um pó cristalino branco a esbranquiçado que é moderadamente solúvel em água.
SEROQUEL é fornecido para administração oral na forma de 25 mg (redondo, pêssego), 50 mg (redondo, branco), 100 mg (redondo, amarelo), 200 mg (redondo, branco), 300 mg (em forma de cápsula, branco) e Comprimidos de 400 mg (em forma de cápsula, amarelos).
Os ingredientes inativos são povidona, fosfato dicálcico dibásico dihidratado, celulose microcristalina, glicolato de amido sódico, lactose monohidratada, estearato de magnésio, hipromelose, polietilenoglicol e dióxido de titânio.
Os comprimidos de 25 mg contêm óxido férrico vermelho e óxido férrico amarelo e os comprimidos de 100 mg e 400 mg contêm apenas óxido férrico amarelo.
INDICAÇÕES
Esquizofrenia
SEROQUEL XR é indicado para o tratamento da esquizofrenia. A eficácia de SEROQUEL XR na esquizofrenia foi estabelecida em um estudo de 6 semanas e um de manutenção em adultos com esquizofrenia. A eficácia foi apoiada por três ensaios de 6 semanas em adultos com esquizofrenia e um ensaio de 6 semanas em adolescentes com esquizofrenia (13-17 anos) tratados com SEROQUEL [ver Estudos clínicos ].
Transtorno bipolar
SEROQUEL 25mg XR é indicado para o tratamento agudo de episódios maníacos ou mistos associados ao transtorno bipolar I, tanto como monoterapia quanto como adjuvante ao lítio ou divalproato. A eficácia de SEROQUEL XR em episódios maníacos ou mistos de transtorno bipolar I foi estabelecida em um estudo de 3 semanas em adultos com episódios maníacos ou mistos associados ao transtorno bipolar I. A eficácia foi apoiada por dois ensaios de monoterapia de 12 semanas e um ensaio adjuvante de 3 semanas em adultos com episódios maníacos associados ao transtorno bipolar I, bem como um ensaio de monoterapia de 3 semanas em crianças e adolescentes (10 - 17 anos) com episódios maníacos associados com transtorno bipolar I tratado com SEROQUEL [ver Estudos clínicos ].
SEROQUEL 100mg XR é indicado para o tratamento agudo de episódios depressivos associados ao transtorno bipolar. A eficácia de SEROQUEL XR foi estabelecida em um estudo de 8 semanas em adultos com transtorno bipolar I ou II e apoiada por dois estudos de 8 semanas em adultos com transtorno bipolar I ou II tratados com SEROQUEL [ver Estudos clínicos ].
SEROQUEL 100mg XR é indicado para o tratamento de manutenção do transtorno bipolar I, como adjuvante ao lítio ou divalproato. A eficácia foi extrapolada a partir de dois ensaios de manutenção em adultos com transtorno bipolar I tratados com SEROQUEL. A eficácia da monoterapia para o tratamento de manutenção do transtorno bipolar I não foi sistematicamente avaliada em ensaios clínicos controlados [ver Estudos clínicos ].
Tratamento Adjuvante do Transtorno Depressivo Maior (TDM)
SEROQUEL 100mg XR é indicado para uso como terapia adjuvante aos antidepressivos para o tratamento do TDM. A eficácia de SEROQUEL XR como terapia adjuvante aos antidepressivos no TDM foi estabelecida em dois estudos de 6 semanas em adultos com TDM que tiveram uma resposta inadequada ao tratamento antidepressivo [ver Estudos clínicos ].
Considerações Especiais no Tratamento da Esquizofrenia Pediátrica e do Transtorno Bipolar I
esquizofrenia pediátrica e o transtorno bipolar I são transtornos mentais graves, no entanto, o diagnóstico pode ser desafiador. Para esquizofrenia pediátrica, os perfis de sintomas podem ser variáveis, e para transtorno bipolar I, os pacientes podem ter padrões variáveis de periodicidade de sintomas maníacos ou mistos. Recomenda-se que a terapia medicamentosa para esquizofrenia pediátrica e transtorno bipolar I seja iniciada somente após uma avaliação diagnóstica completa e consideração cuidadosa dos riscos associados ao tratamento medicamentoso. O tratamento medicamentoso para esquizofrenia pediátrica e transtorno bipolar I é indicado como parte de um programa de tratamento total que geralmente inclui intervenções psicológicas, educacionais e sociais.
DOSAGEM E ADMINISTRAÇÃO
Instruções importantes de administração
Os comprimidos de SEROQUEL XR devem ser engolidos inteiros e não partidos, mastigados ou esmagados.
Recomenda-se que SEROQUEL 50mg XR seja tomado sem alimentos ou com uma refeição leve (aproximadamente 300 calorias) [ver FARMACOLOGIA CLÍNICA ].
SEROQUEL 25mg XR deve ser administrado uma vez ao dia, preferencialmente à noite.
Dosagem Recomendada
A dose inicial recomendada, titulação, intervalo de dose e dose máxima de SEROQUEL 50mg XR para cada indicação aprovada são apresentados na Tabela 1 abaixo. Após a dosagem inicial, os ajustes podem ser feitos para cima ou para baixo, se necessário, dependendo da resposta clínica e tolerabilidade do paciente [ver Estudos clínicos ].
Tratamento de manutenção para esquizofrenia e transtorno bipolar I
Tratamento de manutenção
Os pacientes devem ser reavaliados periodicamente para determinar a necessidade de tratamento de manutenção e a dose apropriada para tal tratamento. Estudos clínicos ].
Modificações de dose em pacientes idosos
Deve-se considerar uma taxa mais lenta de titulação da dose e uma dose-alvo mais baixa em idosos e em pacientes debilitados ou com predisposição a reações hipotensivas [ver Uso em populações específicas , e FARMACOLOGIA CLÍNICA ]. Quando indicado, o aumento da dose deve ser realizado com cautela nesses pacientes.
Pacientes idosos devem iniciar o tratamento com SEROQUEL XR 50 mg/dia e a dose pode ser aumentada em incrementos de 50 mg/dia, dependendo da resposta clínica e tolerabilidade de cada paciente.
Modificações de dose em pacientes com insuficiência hepática
Pacientes com insuficiência hepática devem iniciar o tratamento com SEROQUEL XR 50 mg/dia. A dose pode ser aumentada diariamente em incrementos de 50 mg/dia até uma dose efetiva, dependendo da resposta clínica e tolerabilidade do paciente.
Modificações de dose quando usado com inibidores de CYP3A4
A dose de SEROQUEL XR deve ser reduzida para um sexto da dose original quando comedicada com um inibidor potente do CYP3A4 (por exemplo, cetoconazol, itraconazol, indinavir, ritonavir, nefazodona, etc.). Quando o inibidor do CYP3A4 é descontinuado, a dose de SEROQUEL XR deve ser aumentada em 6 vezes. FARMACOLOGIA CLÍNICA e INTERAÇÕES MEDICAMENTOSAS ].
Modificações de dose quando usado com indutores CYP3A4
dose de SEROQUEL XR deve ser aumentada em até 5 vezes a dose original quando usado em combinação com um tratamento crônico (p. . Erva de John etc.). A dose deve ser titulada com base na resposta clínica e tolerância de cada paciente. Quando o indutor CYP3A4 é descontinuado, a dose de SEROQUEL 100mg XR deve ser reduzida ao nível original dentro de 7-14 dias [ver FARMACOLOGIA CLÍNICA e INTERAÇÕES MEDICAMENTOSAS ].
Reinício do tratamento em pacientes previamente descontinuados
Embora não existam dados para abordar especificamente o reinício do tratamento, recomenda-se que, ao reiniciar a terapia de pacientes que estiveram sem SEROQUEL 50mg XR por mais de uma semana, o esquema posológico inicial seja seguido. Ao reiniciar pacientes que estiveram sem SEROQUEL 300mg XR por menos de uma semana, o aumento gradual da dose pode não ser necessário e a dose de manutenção pode ser reiniciada.
Mudança de pacientes de comprimidos SEROQUEL 50mg para comprimidos SEROQUEL 100mg XR
Pacientes que estão sendo tratados com SEROQUEL (formulação de liberação imediata) podem ser trocados para SEROQUEL XR na dose diária total equivalente tomada uma vez ao dia. Podem ser necessários ajustes de dosagem individuais.
Mudando de antipsicóticos
Não há dados coletados sistematicamente para abordar especificamente a mudança de pacientes de outros antipsicóticos para SEROQUEL 200mg XR, ou sobre a administração concomitante com outros antipsicóticos. Embora a descontinuação imediata do tratamento antipsicótico anterior possa ser aceitável para alguns pacientes, a descontinuação mais gradual pode ser mais apropriada para outros. Em todos os casos, o período de sobreposição de administração de antipsicóticos deve ser minimizado. Ao trocar os pacientes de antipsicóticos de depósito, se medicamente apropriado, inicie a terapia com SEROQUEL XR no lugar da próxima injeção programada. A necessidade de continuar a medicação para síndrome extrapiramidal existente deve ser reavaliada periodicamente.
COMO FORNECIDO
Formas de dosagem e pontos fortes
- Os comprimidos de libertação prolongada de 50 mg são comprimidos revestidos por película, em forma de cápsula, biconvexos, cor de pêssego, com “XR 50” numa das faces e lisos na outra face.
- Os comprimidos de libertação prolongada de 150 mg são comprimidos brancos, revestidos por película, em forma de cápsula, biconvexos, com entalhes com “XR 150” numa das faces e lisos na outra face.
- Os comprimidos de libertação prolongada de 200 mg são amarelos, revestidos por película, em forma de cápsula, biconvexos, com intaglia, com “XR 200” numa das faces e liso na outra face.
- Os comprimidos de libertação prolongada de 300 mg são amarelos pálidos, revestidos por película, em forma de cápsula, biconvexos, com marcação “XR 300” numa das faces e lisos na outra face.
- Os comprimidos de libertação prolongada de 400 mg são comprimidos brancos, revestidos por película, em forma de cápsula, biconvexos, com o nome “XR 400” numa das faces e lisos na outra face.
Armazenamento e manuseio
Comprimidos de 50 mg ( NDC 0310-0280-60) comprimidos revestidos por película, em forma de cápsula, biconvexos, cor de pêssego, com “XR 50” de um lado e lisos do outro, são fornecidos em frascos de 60 comprimidos.
Comprimidos de 150 mg ( NDC 0310-0281-60) comprimidos brancos, revestidos por película, em forma de cápsula, biconvexos, gravados com “XR 150” de um lado e lisos do outro são fornecidos em frascos de 60 comprimidos.
Comprimidos de 200 mg ( NDC 0310-0282-60) amarelo, revestido por película, em forma de cápsula, biconvexo, intagliado com “XR 200” de um lado e liso do outro são fornecidos em frascos de 60 comprimidos.
Comprimidos de 300 mg ( NDC 0310-0283-60) amarelo pálido, revestido por película, em forma de cápsula, biconvexo, intagliado com “XR 300” de um lado e liso do outro são fornecidos em frascos de 60 comprimidos.
Comprimidos de 400 mg ( NDC 0310-0284-60) comprimidos brancos, revestidos por película, em forma de cápsula, biconvexos, gravados com “XR 400” de um lado e lisos do outro são fornecidos em frascos de 60 comprimidos.
Armazenar SEROQUEL XR a 25°C (77°F); excursões permitidas para 15-30°C (59-86°F) [Consulte USP ].
Distribuído por: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Revisado: março de 2020
EFEITOS COLATERAIS
As seguintes reações adversas são discutidas com mais detalhes em outras seções da bula:
- Aumento da mortalidade em pacientes idosos com psicose relacionada à demência [ver AVISOS E PRECAUÇÕES ]
- Pensamentos e comportamentos suicidas em adolescentes e adultos jovens [ver AVISOS E PRECAUÇÕES ]
- Reações adversas cerebrovasculares, incluindo acidente vascular cerebral em pacientes idosos com psicose relacionada à demência [ver AVISOS E PRECAUÇÕES ]
- Síndrome Neuroléptica Maligna (SNM) [ver AVISOS E PRECAUÇÕES ]
- Alterações metabólicas (hiperglicemia, dislipidemia, ganho de peso) [ver AVISOS E PRECAUÇÕES ]
- Discinesia tardia [ver AVISOS E PRECAUÇÕES ]
- Hipotensão [ver AVISOS E PRECAUÇÕES ]
- Cataratas [ver AVISOS E PRECAUÇÕES ]
- Aumento da pressão arterial (crianças e adolescentes) [ver AVISOS E PRECAUÇÕES ]
- Leucopenia, neutropenia e agranulocitose [ver AVISOS E PRECAUÇÕES ]
- Catarata [ver AVISOS E PRECAUÇÕES ]
- Prolongamento QT [ver AVISOS E PRECAUÇÕES ]
- Convulsões [ver AVISOS E PRECAUÇÕES ]
- Hipotireoidismo [ver AVISOS E PRECAUÇÕES ]
- Hiperprolactinemia [ver AVISOS E PRECAUÇÕES ]
- Potencial para comprometimento cognitivo e motor [ver AVISOS E PRECAUÇÕES ]
- Regulação da temperatura corporal [ver AVISOS E PRECAUÇÕES ]
- Disfagia [ver AVISOS E PRECAUÇÕES ]
- Síndrome de descontinuação [ver AVISOS E PRECAUÇÕES ]
- Efeitos anticolinérgicos (antimuscarínicos) [ver AVISOS E PRECAUÇÕES ]
Experiência em Estudos Clínicos
Como os estudos clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos estudos clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Adultos
As informações abaixo são derivadas de um banco de dados de ensaios clínicos para SEROQUEL 200mg composto por mais de 4300 pacientes. Este banco de dados inclui 698 pacientes expostos ao SEROQUEL para o tratamento da depressão bipolar, 405 pacientes expostos ao SEROQUEL 200mg para o tratamento da mania bipolar aguda (monoterapia e terapia adjuvante), 646 pacientes expostos ao SEROQUEL para o tratamento de manutenção do transtorno bipolar I como adjuvante terapia e aproximadamente 2.600 pacientes e/ou indivíduos normais expostos a 1 ou mais doses de SEROQUEL 200mg para o tratamento da esquizofrenia.
Desses aproximadamente 4.300 indivíduos, aproximadamente 4.000 (2.300 em esquizofrenia, 405 em mania bipolar aguda, 698 em depressão bipolar e 646 para o tratamento de manutenção do transtorno bipolar I) eram pacientes que participaram de ensaios de eficácia de dose múltipla, e sua experiência correspondeu a aproximadamente 2.400 pacientes-ano. As condições e a duração do tratamento com SEROQUEL 200mg variaram muito e incluíram (em categorias sobrepostas) fases de estudos abertos e duplo-cegos, pacientes internados e ambulatoriais, estudos de dose fixa e de titulação de dose e estudos de curto ou longo prazo exposição. As reações adversas foram avaliadas pela coleta de reações adversas, resultados de exames físicos, sinais vitais, pesos, análises laboratoriais, ECGs e resultados de exames oftalmológicos.
As frequências declaradas de reações adversas representam a proporção de indivíduos que sofreram, pelo menos uma vez, uma reação adversa do tipo listado.
Reações Adversas Associadas à Descontinuação do Tratamento em Ensaios de Curto Prazo Controlados por Placebo
Esquizofrenia
No geral, houve pouca diferença na incidência de descontinuação devido a reações adversas (4% para SEROQUEL vs. 3% para placebo) em um conjunto de estudos controlados. No entanto, as interrupções devido a sonolência (0,8% SEROQUEL 100mg versus 0% placebo) e hipotensão (0,4% SEROQUEL 200mg versus 0% placebo) foram consideradas relacionadas ao medicamento [ver AVISOS E PRECAUÇÕES ].
Transtorno bipolar
Mania
No geral, as descontinuações devido a reações adversas foram de 5,7% para SEROQUEL 25mg versus 5,1% para placebo em monoterapia e 3,6% para SEROQUEL versus 5,9% para placebo em terapia adjuvante.
Depressão
No geral, as descontinuações devido a reações adversas foram de 12,3% para SEROQUEL 300 mg versus 19,0% para SEROQUEL 600 mg e 5,2% para placebo.
Reações Adversas Comumente Observadas em Ensaios de Curto Prazo Controlados por Placebo
Nos estudos de terapia aguda de esquizofrenia (até 6 semanas) e mania bipolar (até 12 semanas), as reações adversas mais comumente observadas associadas ao uso de SEROQUEL em monoterapia (incidência de 5% ou mais) e observadas em uma taxa de SEROQUEL pelo menos duas vezes maior que o placebo foram sonolência (18%), tontura (11%), boca seca (9%), constipação (8%), aumento da ALT (5%), ganho de peso (5%) e dispepsia ( 5%).
Reações Adversas Ocorrendo com Incidência de 2% ou Mais entre Pacientes Tratados com SEROQUEL em Ensaios de Curto Prazo Controlados por Placebo
prescritor deve estar ciente de que os números das tabelas e tabulações não podem ser usados para prever a incidência de efeitos colaterais no curso da prática médica habitual, onde as características do paciente e outros fatores diferem daqueles que prevaleceram nos ensaios clínicos. Da mesma forma, as frequências citadas não podem ser comparadas com números obtidos de outras investigações clínicas envolvendo diferentes tratamentos, usos e pesquisadores. Os números citados, no entanto, fornecem ao médico prescritor alguma base para estimar a contribuição relativa de fatores medicamentosos e não medicamentosos para a incidência de efeitos colaterais na população estudada.
Tabela 9 enumera a incidência, arredondada para o percentual mais próximo, de reações adversas que ocorreram durante a terapia aguda de esquizofrenia (até 6 semanas) e mania bipolar (até 12 semanas) em 2% ou mais dos pacientes tratados com SEROQUEL (doses variando de 75 a 800 mg/dia) onde a incidência em pacientes tratados com SEROQUEL foi maior do que a incidência em pacientes tratados com placebo.
Nos estudos de terapia adjuvante aguda de mania bipolar (até 3 semanas), as reações adversas mais comumente observadas associadas ao uso de SEROQUEL (incidência de 5% ou mais) e observadas em uma taxa de SEROQUEL pelo menos duas vezes maior que a do placebo foram sonolência (34%), boca seca (19%), astenia (10%), constipação (10%), dor abdominal (7%), hipotensão postural (7%), faringite (6%) e ganho de peso (6). %).
Tabela 10 enumera a incidência, arredondada para o percentual mais próximo, de reações adversas que ocorreram durante a terapia (até 3 semanas) de mania aguda em 2% ou mais dos pacientes tratados com SEROQUEL (doses variando de 100 a 800 mg/dia) usado como terapia adjuvante ao lítio e divalproex, onde a incidência em pacientes tratados com SEROQUEL foi maior do que a incidência em pacientes tratados com placebo.
Em estudos de depressão bipolar (até 8 semanas), as reações adversas mais comumente observadas associadas ao uso de SEROQUEL (incidência de 5% ou mais) e observadas em uma taxa de SEROQUEL 200mg pelo menos duas vezes maior que a do placebo foram sonolência (57% ), boca seca (44%), tontura (18%), constipação (10%) e letargia (5%).
Tabela 11 enumera a incidência, arredondada para o percentual mais próximo, de reações adversas que ocorreram durante a terapia (até 8 semanas) de depressão bipolar em 2% ou mais dos pacientes tratados com SEROQUEL (doses de 300 e 600 mg/dia) onde a a incidência em pacientes tratados com SEROQUEL foi maior do que a incidência em pacientes tratados com placebo.
Explorações de interações com base em gênero, idade e raça não revelaram diferenças clinicamente significativas na ocorrência de reações adversas com base nesses fatores demográficos.
Dependência de Dose de Reações Adversas em Ensaios de Curto Prazo Controlados por Placebo
Reações Adversas Relacionadas à Dose
Dados de reações adversas espontaneamente induzidas de um estudo de esquizofrenia comparando cinco doses fixas de SEROQUEL (75 mg, 150 mg, 300 mg, 600 mg e 750 mg/dia) com placebo foram explorados para relação de dose de reações adversas. As análises de regressão logística revelaram uma dose-resposta positiva (p
Reações Adversas em ensaios clínicos com quetiapina e não listadas em outras partes do rótulo:
As seguintes reações adversas também foram relatadas com quetiapina: pesadelos, hipersensibilidade e elevações na creatina fosfoquinase sérica (não associada à SNM), galactorreia, bradicardia (que pode ocorrer no início ou próximo ao início do tratamento e estar associada a hipotensão e/ou síncope ) diminuição de plaquetas, sonambulismo (e outros eventos relacionados), elevação dos níveis de gama-GT, hipotermia, dispneia, eosinofilia, retenção urinária, obstrução intestinal e priapismo.
Sintomas Extrapiramidais (EPS)
Distonia
Efeito de classe
Sintomas de distonia, contrações anormais prolongadas de grupos musculares, podem ocorrer em indivíduos suscetíveis durante os primeiros dias de tratamento. Os sintomas distônicos incluem: espasmo dos músculos do pescoço, algumas vezes progredindo para aperto na garganta, dificuldade para engolir, dificuldade para respirar e/ou protrusão da língua. Embora esses sintomas possam ocorrer em doses baixas, eles ocorrem com mais frequência e com maior gravidade com alta potência e em doses mais altas de medicamentos antipsicóticos de primeira geração. Um risco elevado de distonia aguda é observado em homens e grupos etários mais jovens.
Quatro métodos foram usados para medir EPS: (1) pontuação total Simpson-Angus (mudança média da linha de base) que avalia Parkinsonismo e acatisia, (2) Escala de Avaliação de Acatisia de Barnes (BARS) Pontuação de Avaliação Global, (3) incidência de queixas espontâneas de EPS (acatisia, acinesia, rigidez de roda dentada, síndrome extrapiramidal, hipertonia, hipocinesia, rigidez do pescoço e tremor) e (4) uso de medicamentos anticolinérgicos para tratar EPS.
Adultos
Dados de um ensaio clínico de 6 semanas de esquizofrenia comparando cinco doses fixas de SEROQUEL (75, 150, 300, 600, 750 mg/dia) forneceram evidências para a ausência de sintomas extrapiramidais (SEP) e relação com a dose de SEP associada ao SEROQUEL 100mg tratamento. Três métodos foram usados para medir o EPS: (1) escore total Simpson-Angus (variação média da linha de base) que avalia parkinsonismo e acatisia, (2) incidência de queixas espontâneas de EPS (catisia, acinesia, rigidez de roda dentada, síndrome extrapiramidal, hipertonia, hipocinesia, rigidez do pescoço e tremor) e (3) uso de medicamentos anticolinérgicos para EPS.
Na Tabela 12, o evento distônico inclui rigidez de nuca, hipertonia, distonia, rigidez muscular, oculorização; parkinsonismo incluía rigidez de roda dentada, tremor, baba, hipocinesia; acatisia incluía acatisia, agitação psicomotora; evento discinético incluiu discinesia tardia, discinesia, coreoatetose; e outros eventos extrapiramidais incluíram inquietação, distúrbio extrapiramidal, distúrbio do movimento.
As taxas de incidência de parkinsonismo medidas pelo escore total Simpson-Angus para placebo e as cinco doses fixas (75, 150, 300, 600, 750 mg/dia) foram: -0,6; -1,0, -1,2; -1,6; -1,8 e -1,8. A taxa de uso de medicação anticolinérgica para tratamento de EPS para placebo e as cinco doses fixas foi: 14%; 11%; 10%; 8%; 12% e 11%.
Em seis ensaios clínicos adicionais controlados por placebo (3 em mania aguda e 3 em esquizofrenia) usando doses variáveis de SEROQUEL, não houve diferenças entre os grupos de tratamento com SEROQUEL e placebo na incidência de EPS, conforme avaliado pelos escores totais de Simpson-Angus, queixas espontâneas de EPS e uso concomitante de medicações anticolinérgicas para tratamento de EPS.
Em dois ensaios clínicos controlados por placebo para o tratamento da depressão bipolar usando 300 mg e 600 mg de SEROQUEL 100 mg, a incidência de reações adversas potencialmente relacionadas ao EPS foi de 12% em ambos os grupos de dose e 6% no grupo placebo. Nesses estudos, a incidência das reações adversas individuais (catisia, distúrbio extrapiramidal, tremor, discinesia, distonia, inquietação, contrações musculares involuntárias, hiperatividade psicomotora e rigidez muscular) foi geralmente baixa e não excedeu 4% em nenhum grupo de tratamento.
Os 3 grupos de tratamento foram semelhantes na alteração média no escore total do SAS e no escore de Avaliação Global do BARS no final do tratamento. O uso concomitante de medicamentos anticolinérgicos foi pouco frequente e semelhante nos três grupos de tratamento.
Crianças e adolescentes
As informações abaixo são derivadas de um banco de dados de ensaios clínicos para SEROQUEL 200mg que consiste em mais de 1.000 pacientes pediátricos. Este banco de dados inclui 677 pacientes expostos ao SEROQUEL 200mg para o tratamento da esquizofrenia e 393 crianças e adolescentes (10-17 anos) expostos ao SEROQUEL para o tratamento da mania bipolar aguda.
Reações Adversas Associadas à Descontinuação do Tratamento em Ensaios de Curto Prazo Controlados por Placebo
Esquizofrenia
incidência de descontinuação devido a reações adversas para pacientes tratados com quetiapina e tratados com placebo foi de 8,2% e 2,7%, respectivamente. O evento adverso que levou à descontinuação em 1% ou mais dos pacientes em uso de SEROQUEL e com maior incidência do que placebo foi sonolência (2,7% e 0% para placebo).
Bipolar I Mania
A incidência de descontinuação devido a reações adversas para pacientes tratados com quetiapina e tratados com placebo foi de 11,4% e 4,4%, respectivamente. As reações adversas que levaram à descontinuação em 2% ou mais dos pacientes com SEROQUEL e com maior incidência do que placebo foram sonolência (4,1% vs. 1,1%) e fadiga (2,1% vs. 0).
Reações Adversas Comumente Observadas em Ensaios de Curto Prazo Controlados por Placebo
Na terapia para esquizofrenia (até 6 semanas), as reações adversas mais comumente observadas associadas ao uso de quetiapina em adolescentes (incidência de 5% ou mais e incidência de quetiapina pelo menos o dobro do placebo) foram sonolência (34%), tontura (12%), boca seca (7%), taquicardia (7%).
Na terapia de mania bipolar (até 3 semanas), as reações adversas mais comumente observadas associadas ao uso de quetiapina em crianças e adolescentes (incidência de 5% ou mais e incidência de quetiapina pelo menos o dobro do placebo) foram sonolência (53%), tontura (18%), fadiga (11%), aumento do apetite (9%), náusea (8%), vômito (8%), taquicardia (7%), boca seca (7%) e aumento de peso (6% ).
Em um estudo agudo (8 semanas) SEROQUEL 100mg XR em crianças e adolescentes (10-17 anos de idade) com depressão bipolar, no qual a eficácia não foi estabelecida, as reações adversas mais comumente observadas associadas ao uso de SEROQUEL XR (incidência de 5% ou mais e pelo menos o dobro do placebo) foram tonturas 7%, diarreia 5%, fadiga 5% e náuseas 5%.
Reações Adversas Ocorrendo com Incidência ≥ 2% entre Pacientes Tratados com SEROQUEL 300mg em Estudos de Curto Prazo Controlados por Placebo
Esquizofrenia (adolescentes, 13-17 anos)
Os achados a seguir foram baseados em um estudo controlado por placebo de 6 semanas no qual a quetiapina foi administrada em doses de 400 ou 800 mg/dia.
A Tabela 13 enumera a incidência, arredondada para o percentual mais próximo, de reações adversas que ocorreram durante a terapia (até 6 semanas) de esquizofrenia em 2% ou mais dos pacientes tratados com SEROQUEL (doses de 400 ou 800 mg/dia) onde a incidência em pacientes tratados com SEROQUEL foi pelo menos duas vezes a incidência em pacientes tratados com placebo.
As reações adversas potencialmente relacionadas à dose com maior frequência no grupo de 800 mg em comparação com o grupo de 400 mg incluíram tontura (8% vs. 15%), boca seca (4% vs. 10%) e taquicardia (6% vs. . 11%).
Bipolar I Mania (crianças e adolescentes de 10 a 17 anos)
Os achados a seguir foram baseados em um estudo controlado por placebo de 3 semanas no qual a quetiapina foi administrada em doses de 400 ou 600 mg/dia.
Reações Adversas Comumente Observadas
Na terapia de mania bipolar (até 3 semanas), as reações adversas mais comumente observadas associadas ao uso de quetiapina em crianças e adolescentes (incidência de 5% ou mais e incidência de quetiapina pelo menos o dobro do placebo) foram sonolência (53%), tontura (18%), fadiga (11%), aumento do apetite (9%), náusea (8%), vômito (8%), taquicardia (7%), boca seca (7%) e aumento de peso (6% ).
Tabela 14 enumera a incidência, arredondada para o percentual mais próximo, de reações adversas que ocorreram durante a terapia (até 3 semanas) de mania bipolar em 2% ou mais dos pacientes tratados com SEROQUEL (doses de 400 ou 600 mg/dia) onde a a incidência em pacientes tratados com SEROQUEL foi maior do que a incidência em pacientes tratados com placebo.
As reações adversas potencialmente relacionadas à dose com maior frequência no grupo de 600 mg em comparação com o grupo de 400 mg incluíram sonolência (50% vs. 57%), náusea (6% vs. 10%) e taquicardia (6% vs. 9%).
Sintomas extrapiramidais
Em um estudo de monoterapia de curto prazo controlado por placebo em pacientes adolescentes com esquizofrenia (duração de 6 semanas), a incidência agregada de sintomas extrapiramidais foi de 12,9% (19/147) para SEROQUEL 100mg e 5,3% (4/75) para placebo, embora a incidência das reações adversas individuais (catisia, tremor, distúrbio extrapiramidal, hipocinesia, inquietação, hiperatividade psicomotora, rigidez muscular, discinesia) não tenha excedido 4,1% em nenhum grupo de tratamento. Em um estudo de monoterapia de curto prazo controlado por placebo em crianças e adolescentes com mania bipolar (duração de 3 semanas), a incidência agregada de sintomas extrapiramidais foi de 3,6% (7/193) ou SEROQUEL e 1,1% (1/90) para placebo.
A Tabela 15 apresenta uma lista de pacientes com reações adversas potencialmente associadas a sintomas extrapiramidais no estudo de monoterapia de curto prazo controlado por placebo em pacientes adolescentes com esquizofrenia (duração de 6 semanas).
Nas Tabelas 15-16, o evento distônico inclui rigidez de nuca, hipertonia e rigidez muscular; parkinsonismo incluía rigidez de roda dentada e tremor; acatisia incluiu apenas acatisia; evento discinético incluiu discinesia tardia, discinesia e coreoatetose; e outros eventos extrapiramidais incluíram inquietação e distúrbio extrapiramidal.
A Tabela 16 apresenta uma lista de pacientes com reações adversas associadas a sintomas extrapiramidais em um estudo de monoterapia de curto prazo controlado por placebo em crianças e adolescentes com mania bipolar (duração de 3 semanas).
Alterações laboratoriais, ECG e sinais vitais observadas em estudos clínicos
Alterações laboratoriais
Contagem de neutrófilos
Adultos
Em ensaios clínicos de monoterapia controlados por placebo envolvendo 3.368 pacientes em uso de fumarato de quetiapina e 1.515 em placebo, a incidência de pelo menos uma ocorrência de contagem de neutrófilos AVISOS E PRECAUÇÕES ].
Elevações de Transaminases
Adultos
Foram relatadas elevações assintomáticas, transitórias e reversíveis das transaminases séricas (principalmente ALT). Em estudos de esquizofrenia em adultos, as proporções de pacientes com elevações das transaminases > 3 vezes os limites superiores do intervalo normal de referência em um conjunto de estudos controlados por placebo de 3 a 6 semanas foram de aproximadamente 6% (29/483) para SEROQUEL comparado a 1% (3/194) para placebo. Em estudos de mania bipolar aguda em adultos, a proporção de pacientes com elevações das transaminases > 3 vezes os limites superiores do intervalo de referência normal em um conjunto de estudos controlados por placebo de 3 a 12 semanas foi de aproximadamente 1% para ambos SEROQUEL (3 /560) e placebo (3/294). Essas elevações das enzimas hepáticas geralmente ocorreram nas primeiras 3 semanas de tratamento com o medicamento e retornaram prontamente aos níveis pré-estudo com o tratamento contínuo com SEROQUEL. Em estudos de depressão bipolar, a proporção de pacientes com elevações de transaminase >3 vezes os limites superiores do intervalo normal de referência em dois estudos de 8 semanas controlados por placebo foi de 1% (5/698) para SEROQUEL 50mg e 2% (6/6 347) para placebo.
Hemoglobina diminuída
Adultos
Em estudos de curto prazo controlados por placebo, a diminuição da hemoglobina para ≤ 13 g/dL do sexo masculino, ≤ 12 g/dL do sexo feminino em pelo menos uma ocasião ocorreu em 8,3% (594/7155) dos pacientes tratados com quetiapina em comparação com 6,2% ( 219/3536) de pacientes tratados com placebo. Em um banco de dados de ensaios clínicos controlados e não controlados, reduções na hemoglobina para ≤13 g/dL homens, ≤12 g/dL mulheres em pelo menos uma ocasião ocorreram em 11% (2277/20729) dos pacientes tratados com quetiapina.
Interferência com telas de drogas de urina
Houve relatos na literatura sugerindo resultados falso-positivos em imunoensaios enzimáticos de urina para metadona e antidepressivos tricíclicos em pacientes que tomaram quetiapina. Deve-se ter cautela na interpretação de resultados positivos de triagem de drogas na urina para esses medicamentos, e a confirmação por técnica analítica alternativa (por exemplo, métodos cromatográficos) deve ser considerada.
Alterações de ECG
Adultos
Comparações entre grupos para estudos controlados por placebo agrupados não revelaram diferenças estatisticamente significativas de SEROQUEL/placebo nas proporções de pacientes que experimentaram alterações potencialmente importantes nos parâmetros de ECG, incluindo intervalos QT, QTc e PR. No entanto, as proporções de pacientes que atendem aos critérios para taquicardia foram comparadas em quatro ensaios clínicos controlados por placebo de 3 a 6 semanas para o tratamento da esquizofrenia, revelando uma incidência de 1% (4/399) para SEROQUEL 100mg em comparação com 0,6% (1 /156) incidência para placebo. Em estudos de mania bipolar aguda (monoterapia), a proporção de pacientes que preencheram os critérios para taquicardia foi de 0,5% (1/192) para SEROQUEL 200mg em comparação com 0% (0/178) de incidência para placebo. Em ensaios de mania bipolar aguda (adjuntos), a proporção de pacientes que atendeu aos mesmos critérios foi de 0,6% (1/166) para SEROQUEL 100mg em comparação com 0% (0/171) de incidência para placebo. Em estudos de depressão bipolar, nenhum paciente teve aumento da frequência cardíaca para > 120 batimentos por minuto. O uso de SEROQUEL 50mg foi associado a um aumento médio da frequência cardíaca, avaliada por ECG, de 7 batimentos por minuto em comparação com um aumento médio de 1 batimento por minuto entre os pacientes que receberam placebo. Essa leve tendência à taquicardia em adultos pode estar relacionada ao potencial do SEROQUEL para induzir alterações ortostáticas [ver AVISOS E PRECAUÇÕES ].
Crianças e Adolescentes
No estudo de esquizofrenia aguda (6 semanas) em adolescentes, ocorreram aumentos na frequência cardíaca (>110 bpm) em 5,2% (3/73) dos pacientes que receberam SEROQUEL 400 mg e 8,5% (5/74) dos pacientes que receberam SEROQUEL 800 mg em comparação com 0% (0/75) dos pacientes que receberam placebo. Os aumentos médios da frequência cardíaca foram de 3,8 bpm e 11,2 bpm para os grupos SEROQUEL 400 mg e 800 mg, respectivamente, em comparação com uma diminuição de 3,3 bpm no grupo placebo [ver AVISOS E PRECAUÇÕES ].
No estudo de mania bipolar aguda (3 semanas) em crianças e adolescentes, ocorreram aumentos na frequência cardíaca (>110 bpm) em 1,1% (1/89) dos pacientes que receberam SEROQUEL 400 mg e 4,7% (4/85) dos pacientes recebendo SEROQUEL 600 mg em comparação com 0% (0/98) dos pacientes que receberam placebo. Os aumentos médios da frequência cardíaca foram de 12,8 bpm e 13,4 bpm para os grupos SEROQUEL 400 mg e 600 mg, respectivamente, em comparação com uma diminuição de 1,7 bpm no grupo placebo [ver AVISOS E PRECAUÇÕES ].
Em um estudo agudo (8 semanas) de SEROQUEL XR em crianças e adolescentes (10-17 anos de idade) com depressão bipolar, no qual a eficácia não foi estabelecida, aumento da frequência cardíaca (>110 bpm 10-12 anos e 13-17 anos) ocorreu em 0% dos pacientes que receberam SEROQUEL XR e 1,2% dos pacientes que receberam placebo. Os aumentos médios da frequência cardíaca foram de 3,4 bpm para SEROQUEL XR, em comparação com 0,3 bpm no grupo placebo [ver AVISOS E PRECAUÇÕES ].
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante a pós-aprovação de SEROQUEL. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
As reações adversas relatadas desde a introdução no mercado que foram temporariamente relacionadas à terapia com quetiapina incluem reação anafilática, cardiomiopatia, reação medicamentosa com eosinofilia e sintomas sistêmicos (DRESS), hiponatremia, miocardite, enurese noturna, pancreatite, amnésia retrógrada, rabdomiólise, síndrome de secreção inadequada de hormônio antidiurético (SIADH), síndrome de Stevens-Johnson (SSJ), necrólise epidérmica tóxica (NET), diminuição da contagem de plaquetas, reações hepáticas graves (incluindo hepatite, necrose hepática e insuficiência hepática), agranulocitose, obstrução intestinal, íleo, isquemia do cólon, retenção urinária , apnéia do sono e pustulose exantemática generalizada aguda (PEGA).
INTERAÇÕES MEDICAMENTOSAS
Efeito de outras drogas na quetiapina
Os riscos do uso de SEROQUEL em combinação com outras drogas não foram amplamente avaliados em estudos sistemáticos. Devido aos efeitos primários de SEROQUEL no SNC, deve-se ter cautela quando administrado em combinação com outros medicamentos de ação central. SEROQUEL 300mg potencializou os efeitos cognitivos e motores do álcool em um ensaio clínico em indivíduos com transtornos psicóticos selecionados, e as bebidas alcoólicas devem ser limitadas durante o uso de quetiapina.
A exposição à quetiapina é aumentada pelos inibidores protótipos do CYP3A4 (por exemplo, cetoconazol, itraconazol, indinavir, ritonavir, nefazodona, etc.) . O ajuste da dose de quetiapina será necessário se for coadministrado com indutores ou inibidores potentes do CYP3A4.
Inibidores de CYP3A4
coadministração de cetoconazol, um potente inibidor do citocromo CYP3A4, resultou em aumento significativo na exposição à quetiapina. A dose de SEROQUEL 200mg deve ser reduzida para um sexto da dose original se coadministrada com um forte inibidor de CYP3A4 [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
Indutores CYP3A4
A coadministração de quetiapina e fenitoína, um indutor do CYP3A4, aumentou a depuração oral média da quetiapina em 5 vezes. Doses aumentadas de SEROQUEL 50mg em até 5 vezes podem ser necessárias para manter o controle dos sintomas de esquizofrenia em pacientes recebendo quetiapina e fenitoína, ou outros indutores potentes conhecidos do CYP3A4 [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ]. Quando o indutor CYP3A4 é descontinuado, a dose de SEROQUEL 25mg deve ser reduzida ao nível original dentro de 7-14 dias [ver DOSAGEM E ADMINISTRAÇÃO ].
Os efeitos potenciais de vários medicamentos concomitantes na farmacocinética da quetiapina foram estudados [ver FARMACOLOGIA CLÍNICA ].
Efeito da quetiapina em outras drogas
Devido ao seu potencial para induzir hipotensão, SEROQUEL 50mg pode potencializar os efeitos de certos agentes anti-hipertensivos.
SEROQUEL 25mg pode antagonizar os efeitos da levodopa e dos agonistas da dopamina.
Não existem interações farmacocinéticas clinicamente relevantes de Seroquel com outros medicamentos baseados na via CYP. Seroquel 50mg e seus metabólitos não são inibidores dos principais CYPs metabolizadores (1A2, 2C9, 2C19, 2D6 e 3A4).
Abuso e Dependência de Drogas
Substância controlada
SEROQUEL não é uma substância controlada.
Abuso
SEROQUEL não foi sistematicamente estudado, em animais ou humanos, por seu potencial de abuso, tolerância ou dependência física. Embora os ensaios clínicos não tenham revelado qualquer tendência para qualquer comportamento de busca de drogas, essas observações não foram sistemáticas e não é possível prever com base nesta experiência limitada até que ponto um medicamento ativo no SNC será mal utilizado, desviado, e/ou abusado uma vez comercializado. Consequentemente, os pacientes devem ser avaliados cuidadosamente para uma história de abuso de drogas, e tais pacientes devem ser observados atentamente quanto a sinais de uso indevido ou abuso de SEROQUEL, por exemplo, desenvolvimento de tolerância, aumento da dose, comportamento de busca de drogas.
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Aumento da mortalidade em pacientes idosos com psicose relacionada à demência
Pacientes idosos com psicose relacionada à demência tratados com medicamentos antipsicóticos apresentam risco aumentado de morte. A análise de 17 ensaios controlados por placebo (duração modal de 10 semanas), principalmente em pacientes que tomam antipsicóticos atípicos, revelou um risco de morte em pacientes tratados com drogas entre 1,6 a 1,7 vezes o risco de morte em pacientes tratados com placebo. Ao longo de um estudo controlado típico de 10 semanas, a taxa de morte em pacientes tratados com drogas foi de cerca de 4,5%, em comparação com uma taxa de cerca de 2,6% no grupo placebo. Embora as causas de morte fossem variadas, a maioria das mortes parecia ser de natureza cardiovascular (por exemplo, insuficiência cardíaca, morte súbita) ou infecciosa (por exemplo, pneumonia). Estudos observacionais sugerem que, semelhante aos antipsicóticos atípicos, o tratamento com antipsicóticos convencionais pode aumentar a mortalidade. A extensão em que os achados de aumento da mortalidade em estudos observacionais podem ser atribuídos ao medicamento antipsicótico em oposição a algumas características dos pacientes não é clara. SEROQUEL não está aprovado para o tratamento de pacientes com psicose relacionada à demência [ver AVISO EM CAIXA ].
Pensamentos e Comportamentos Suicidas em Adolescentes e Jovens Adultos
Pacientes com transtorno depressivo maior (TDM), adultos e pediátricos, podem apresentar piora de sua depressão e/ou surgimento de ideação e comportamento suicida (suicidalidade) ou mudanças incomuns de comportamento, estejam ou não tomando medicamentos antidepressivos, e isso risco pode persistir até que ocorra remissão significativa. O suicídio é um risco conhecido de depressão e alguns outros distúrbios psiquiátricos, e esses distúrbios são os mais fortes preditores de suicídio. Há uma preocupação de longa data, no entanto, de que os antidepressivos possam ter um papel na indução do agravamento da depressão e do surgimento de tendências suicidas em certos pacientes durante as fases iniciais do tratamento. Análises combinadas de ensaios de curto prazo controlados por placebo de medicamentos antidepressivos (ISRSs e outros) mostraram que esses medicamentos aumentam o risco de pensamento e comportamento suicida (suicidalidade) em crianças, adolescentes e adultos jovens (idades de 18 a 24 anos) com depressão maior. (MDD) e outros transtornos psiquiátricos. Estudos de curto prazo não mostraram um aumento no risco de suicídio com antidepressivos em comparação com placebo em adultos com mais de 24 anos; houve uma redução com antidepressivos em comparação com placebo em adultos com 65 anos ou mais.
As análises agrupadas de estudos controlados por placebo em crianças e adolescentes com TDM, transtorno obsessivo-compulsivo (TOC) ou outros transtornos psiquiátricos incluíram um total de 24 estudos de curto prazo de 9 medicamentos antidepressivos em mais de 4.400 pacientes. As análises agrupadas de estudos controlados por placebo em adultos com TDM ou outros transtornos psiquiátricos incluíram um total de 295 estudos de curto prazo (duração média de 2 meses) de 11 medicamentos antidepressivos em mais de 77.000 pacientes. Houve variação considerável no risco de suicídio entre as drogas, mas uma tendência de aumento nos pacientes mais jovens para quase todas as drogas estudadas. Houve diferenças no risco absoluto de suicídio entre as diferentes indicações, com maior incidência no TDM. As diferenças de risco (droga versus placebo), no entanto, foram relativamente estáveis dentro dos estratos de idade e entre as indicações. Essas diferenças de risco (diferença droga-placebo no número de casos de suicídio por 1.000 pacientes tratados) são fornecidas na Tabela 2.
Nenhum suicídio ocorreu em qualquer um dos ensaios pediátricos. Houve suicídios nos ensaios com adultos, mas o número não foi suficiente para chegar a qualquer conclusão sobre o efeito da droga no suicídio.
Não se sabe se o risco de suicídio se estende ao uso a longo prazo, ou seja, além de vários meses. No entanto, há evidências substanciais de ensaios de manutenção controlados por placebo em adultos com depressão de que o uso de antidepressivos pode retardar a recorrência da depressão.
Todos os pacientes em tratamento com antidepressivos para qualquer indicação devem ser monitorados adequadamente e observados de perto quanto a piora clínica, tendências suicidas e mudanças incomuns de comportamento, especialmente durante os primeiros meses de um curso de terapia medicamentosa, ou em momentos de mudanças de dose, ou aumentos ou diminui.
Os seguintes sintomas, ansiedade, agitação, ataques de pânico, insônia, irritabilidade, hostilidade, agressividade, impulsividade, acatisia (agitação psicomotora), hipomania e mania, foram relatados em pacientes adultos e pediátricos em tratamento com antidepressivos para transtorno depressivo maior. quanto a outras indicações, tanto psiquiátricas como não psiquiátricas. Embora não tenha sido estabelecida uma relação causal entre o surgimento de tais sintomas e o agravamento da depressão e/ou o surgimento de impulsos suicidas, existe a preocupação de que tais sintomas possam representar precursores de tendências suicidas emergentes.
Deve-se considerar a mudança do regime terapêutico, incluindo a possibilidade de descontinuação da medicação, em pacientes cuja depressão é persistentemente pior, ou que estão experimentando tendências suicidas emergentes ou sintomas que podem ser precursores de piora da depressão ou tendências suicidas, especialmente se esses sintomas forem graves, abruptos no início, ou não faziam parte dos sintomas de apresentação do paciente.
Familiares e cuidadores de pacientes em tratamento com antidepressivos para transtorno depressivo maior ou outras indicações, tanto psiquiátricas quanto não psiquiátricas, devem ser alertados sobre a necessidade de monitorar os pacientes quanto ao surgimento de agitação, irritabilidade, alterações incomuns de comportamento e outros sintomas descritos acima, bem como o surgimento de tendências suicidas, e relatar tais sintomas imediatamente aos profissionais de saúde. Tal monitoramento deve incluir observação diária por familiares e cuidadores. As prescrições de SEROQUEL devem ser feitas para a menor quantidade de comprimidos compatível com o bom manejo do paciente, a fim de reduzir o risco de superdosagem.
Triagem de pacientes para transtorno bipolar
Um episódio depressivo maior pode ser a apresentação inicial do transtorno bipolar. Acredita-se geralmente (embora não estabelecido em ensaios controlados) que o tratamento de tal episódio com um antidepressivo sozinho pode aumentar a probabilidade de precipitação de um episódio misto/maníaco em pacientes com risco de transtorno bipolar. Não se sabe se algum dos sintomas descritos acima representa tal conversão. No entanto, antes de iniciar o tratamento com um antidepressivo, incluindo SEROQUEL, os pacientes com sintomas depressivos devem ser adequadamente avaliados para determinar se estão em risco de transtorno bipolar; essa triagem deve incluir uma história psiquiátrica detalhada, incluindo uma história familiar de suicídio, transtorno bipolar e depressão.
Reações Adversas Cerebrovasculares, Incluindo AVC, em Pacientes Idosos com Psicose Relacionada à Demência
Em estudos controlados por placebo com risperidona, aripiprazol e olanzapina em indivíduos idosos com demência, houve uma maior incidência de reações adversas cerebrovasculares (acidentes cerebrovasculares e ataques isquêmicos transitórios), incluindo fatalidades em comparação com indivíduos tratados com placebo. SEROQUEL não está aprovado para o tratamento de pacientes com psicose relacionada à demência [ver também AVISO EM CAIXA e Aumento da mortalidade em pacientes idosos com psicose relacionada à demência ].
Síndrome Neuroléptica Maligna (SNM)
Um complexo de sintomas potencialmente fatal, algumas vezes referido como Síndrome Neuroléptica Maligna (SNM), foi relatado em associação com a administração de medicamentos antipsicóticos, incluindo SEROQUEL. Casos raros de SNM foram relatados com SEROQUEL. As manifestações clínicas da SNM são hiperpirexia, rigidez muscular, estado mental alterado e evidência de instabilidade autonômica (pulso ou pressão arterial irregulares, taquicardia, sudorese e disritmia cardíaca). Sinais adicionais podem incluir creatinina fosfoquinase elevada, mioglobinúria (rabdomiólise) e insuficiência renal aguda.
avaliação diagnóstica de pacientes com esta síndrome é complicada. Ao chegar a um diagnóstico, é importante excluir casos em que a apresentação clínica inclui doença médica grave (por exemplo, pneumonia, infecção sistêmica, etc.) e sinais e sintomas extrapiramidais (SEP) não tratados ou tratados inadequadamente. Outras considerações importantes no diagnóstico diferencial incluem toxicidade anticolinérgica central, insolação, febre medicamentosa e patologia primária do sistema nervoso central (SNC).
O manejo da SNM deve incluir: 1) descontinuação imediata de drogas antipsicóticas e outras drogas não essenciais à terapia concomitante; 2) tratamento sintomático intensivo e acompanhamento médico; e 3) tratamento de quaisquer problemas médicos graves concomitantes para os quais existam tratamentos específicos disponíveis. Não há acordo geral sobre regimes de tratamento farmacológico específico para SNM.
Se um paciente necessitar de tratamento medicamentoso antipsicótico após a recuperação da SNM, a potencial reintrodução da terapia medicamentosa deve ser cuidadosamente considerada. O paciente deve ser cuidadosamente monitorado, uma vez que foram relatadas recorrências de SNM.
Alterações metabólicas
Os antipsicóticos atípicos têm sido associados a alterações metabólicas que incluem hiperglicemia/diabetes mellitus, dislipidemia e ganho de peso corporal. Embora todos os medicamentos da classe tenham demonstrado produzir algumas alterações metabólicas, cada medicamento tem seu próprio perfil de risco específico. Em alguns pacientes, foi observada uma piora de mais de um dos parâmetros metabólicos de peso, glicose no sangue e lipídios em estudos clínicos. As alterações nestes perfis metabólicos devem ser tratadas conforme clinicamente apropriado.
Hiperglicemia e Diabetes Mellitus
Hiperglicemia, em alguns casos extrema e associada a cetoacidose ou coma hiperosmolar ou morte, foi relatada em pacientes tratados com antipsicóticos atípicos, incluindo quetiapina. A avaliação da relação entre o uso de antipsicóticos atípicos e anormalidades da glicose é complicada pela possibilidade de um risco aumentado de diabetes mellitus em pacientes com esquizofrenia e o aumento da incidência de diabetes mellitus na população em geral. Diante desses fatores de confusão, a relação entre o uso de antipsicóticos atípicos e as reações adversas relacionadas à hiperglicemia não é completamente compreendida. No entanto, estudos epidemiológicos sugerem um risco aumentado de reações adversas relacionadas à hiperglicemia em pacientes tratados com antipsicóticos atípicos. Não estão disponíveis estimativas de risco precisas para reações adversas relacionadas à hiperglicemia em pacientes tratados com antipsicóticos atípicos.
Pacientes com diagnóstico estabelecido de diabetes mellitus que iniciaram antipsicóticos atípicos devem ser monitorados regularmente quanto à piora do controle glicêmico. Pacientes com fatores de risco para diabetes mellitus (p. Qualquer paciente tratado com antipsicóticos atípicos deve ser monitorado quanto a sintomas de hiperglicemia, incluindo polidipsia, poliúria, polifagia e fraqueza. Os pacientes que desenvolvem sintomas de hiperglicemia durante o tratamento com antipsicóticos atípicos devem ser submetidos ao teste de glicemia em jejum. Em alguns casos, a hiperglicemia foi resolvida quando o antipsicótico atípico foi descontinuado; entretanto, alguns pacientes necessitaram de continuação do tratamento antidiabético apesar da descontinuação do medicamento suspeito.
Adultos
Em um estudo de 24 semanas (controlado ativo, 115 pacientes tratados com SEROQUEL) projetado para avaliar o estado glicêmico com teste oral de tolerância à glicose de todos os pacientes, na Semana 24 a incidência de um nível de glicose pós-desafio com glicose ≥200 mg/dL foi 1,7% e a incidência de glicemia de jejum ≥126 mg/dL foi de 2,6%. A alteração média na glicemia de jejum da linha de base foi de 3,2 mg/dL e a alteração média na glicose de 2 horas da linha de base foi de -1,8 mg/dL para a quetiapina.
Em 2 ensaios clínicos randomizados de longa duração controlados por placebo para manutenção do transtorno bipolar I, exposição média de 213 dias para SEROQUEL (646 pacientes) e 152 dias para placebo (680 pacientes), a alteração média na glicose da linha de base foi de +5,0 mg /dL para SEROQUEL 100mg e –0,05 mg/dL para placebo. A taxa ajustada de exposição de qualquer aumento do nível de glicose no sangue (≥126 mg/dL) para pacientes mais de 8 horas desde uma refeição (no entanto, alguns pacientes podem não ter sido impedidos de ingerir calorias de líquidos durante o período de jejum) foi de 18,0 por 100 pacientes-ano para SEROQUEL (10,7% dos pacientes; n=556) e 9,5 para placebo por 100 pacientes-ano (4,6% dos pacientes; n=581).
Crianças e Adolescentes
Em um estudo de monoterapia com SEROQUEL 25mg controlado por placebo em pacientes adolescentes (13-17 anos de idade) com esquizofrenia (duração de 6 semanas), a alteração média nos níveis de glicose em jejum para SEROQUEL (n=138) em comparação com placebo (n=67) foi – 0,75 mg/dL versus –1,70 mg/dL. Em um estudo de monoterapia com SEROQUEL 300mg controlado por placebo em crianças e adolescentes (10-17 anos de idade) com mania bipolar (duração de 3 semanas), a alteração média no nível de glicose em jejum para SEROQUEL (n = 170) em comparação com placebo (n =81) foi de 3,62 mg/dL versus -1,17 mg/dL. Nenhum paciente em nenhum dos estudos com um nível basal de glicemia de jejum normal (
Em um estudo de monoterapia com SEROQUEL XR controlado por placebo (duração de 8 semanas) em crianças e adolescentes (1017 anos de idade) com depressão bipolar, no qual a eficácia não foi estabelecida, a alteração média nos níveis de glicose em jejum para SEROQUEL 300mg XR (n= 60) comparado ao placebo (n=62) foi de 1,8 mg/dL versus 1,6 mg/dL. Neste estudo, não houve pacientes nos grupos tratados com SEROQUEL XR ou placebo com nível basal normal de glicose em jejum (126 mg/dL. Houve um paciente no grupo SEROQUEL 25mg XR com nível basal de glicose em jejum limítrofe (>100 mg/dL e 126 mg/dL em comparação com zero pacientes no grupo grupo placebo.
Dislipidemia
Adultos
A Tabela 4 mostra a porcentagem de pacientes adultos com alterações no colesterol total, triglicerídeos, LDL-colesterol e HDL-colesterol desde a linha de base por indicação em ensaios clínicos com SEROQUEL.
Crianças e Adolescentes
Tabela 5 mostra a porcentagem de crianças e adolescentes com alterações no colesterol total, triglicerídeos, LDL-colesterol e HDL-colesterol desde a linha de base em ensaios clínicos com SEROQUEL.
Em um estudo de monoterapia com SEROQUEL XR controlado por placebo (duração de 8 semanas) de crianças e adolescentes (1017 anos de idade) com depressão bipolar, no qual a eficácia não foi estabelecida, a porcentagem de crianças e adolescentes com alterações no colesterol total (≥200 mg/dL), triglicerídeos (≥150 mg/dL), LDL-colesterol (≥ 130 mg/dL) e HDL-colesterol (≤40 mg/dL) desde a linha de base até os níveis clinicamente significativos foram: colesterol total 8% (7 /83) para SEROQUEL 50mg XR vs. 6% (5/84) para placebo; triglicerídeos 28% (22/80) para SEROQUEL 100mg XR vs. 9% (7/82) para placebo; Colesterol LDL 2% (2/86) para SEROQUEL XR vs. 4% (3/85) para placebo e colesterol HDL 20% (13/65) para SEROQUEL XR vs. 15% (11/74) para placebo.
Ganho de peso
Aumentos de peso foram observados em ensaios clínicos. Pacientes recebendo quetiapina devem receber monitoramento regular do peso.
Adultos
Em ensaios clínicos com SEROQUEL 50mg foram relatados os seguintes aumentos de peso.
Crianças e Adolescentes
Em dois ensaios clínicos com SEROQUEL 25mg, um na mania bipolar e outro na esquizofrenia, os aumentos de peso relatados estão incluídos na Tabela 7.
A mudança média no peso corporal no estudo de esquizofrenia foi de 2,0 kg no grupo SEROQUEL 25mg e -0,4 kg no grupo placebo e no estudo de mania bipolar, foi de 1,7 kg no grupo SEROQUEL 200mg e 0,4 kg no grupo placebo.
Em um estudo aberto que envolveu pacientes dos dois estudos pediátricos acima, 63% dos pacientes (241/380) completaram 26 semanas de terapia com SEROQUEL. Após 26 semanas de tratamento, o aumento médio do peso corporal foi de 4,4 kg. Quarenta e cinco por cento dos pacientes ganharam ≥7% do seu peso corporal, não ajustado para o crescimento normal. Para ajustar o crescimento normal ao longo de 26 semanas, um aumento de pelo menos 0,5 desvio padrão da linha de base no IMC foi usado como medida de uma alteração clinicamente significativa; 18,3% dos pacientes em SEROQUEL preencheram este critério após 26 semanas de tratamento.
Em um ensaio clínico para SEROQUEL XR em crianças e adolescentes (10-17 anos de idade) com depressão bipolar, no qual a eficácia não foi estabelecida, a porcentagem de pacientes com ganho de peso ≥7% do peso corporal em qualquer momento foi de 15% ( 14/92) para SEROQUEL 25mg XR vs. 10% (10/100) para placebo. A alteração média no peso corporal foi de 1,4 kg no grupo SEROQUEL 50mg XR versus 0,6 kg no grupo placebo.
Ao tratar pacientes pediátricos com SEROQUEL 50mg para qualquer indicação, o ganho de peso deve ser avaliado em relação ao esperado para um crescimento normal.
Discinesia tardia
Uma síndrome de movimentos discinéticos involuntários e potencialmente irreversíveis pode se desenvolver em pacientes tratados com drogas antipsicóticas, incluindo quetiapina. Embora a prevalência da síndrome pareça ser maior entre os idosos, especialmente as mulheres idosas, é impossível confiar nas estimativas de prevalência para prever, no início do tratamento antipsicótico, quais pacientes provavelmente desenvolverão a síndrome. Se os medicamentos antipsicóticos diferem em seu potencial para causar discinesia tardia é desconhecido.
Acredita-se que o risco de desenvolver discinesia tardia e a probabilidade de que se torne irreversível aumente à medida que a duração do tratamento e a dose cumulativa total de drogas antipsicóticas administradas ao paciente aumentam. No entanto, a síndrome pode se desenvolver, embora muito menos comumente, após períodos de tratamento relativamente breves em doses baixas ou pode até surgir após a descontinuação do tratamento.
A discinesia tardia pode regredir, parcial ou completamente, se o tratamento antipsicótico for retirado. O tratamento antipsicótico, no entanto, pode suprimir (ou suprimir parcialmente) os sinais e sintomas da síndrome e, assim, pode mascarar o processo subjacente. O efeito que a supressão sintomática tem sobre o curso a longo prazo da síndrome é desconhecido.
Dadas essas considerações, SEROQUEL 50mg deve ser prescrito da maneira mais provável de minimizar a ocorrência de discinesia tardia. O tratamento antipsicótico crônico geralmente deve ser reservado para pacientes que parecem sofrer de uma doença crônica que (1) responde aos medicamentos antipsicóticos e (2) para os quais tratamentos alternativos igualmente eficazes, mas potencialmente menos prejudiciais, não estão disponíveis ou são apropriados. . Em pacientes que necessitam de tratamento crônico, deve-se buscar a menor dose e a menor duração do tratamento que produza uma resposta clínica satisfatória. A necessidade de continuação do tratamento deve ser reavaliada periodicamente.

Se surgirem sinais e sintomas de discinesia tardia em um paciente em uso de SEROQUEL 200mg, a descontinuação do medicamento deve ser considerada. No entanto, alguns pacientes podem necessitar de tratamento com SEROQUEL 200mg apesar da presença da síndrome.
Hipotensão
quetiapina pode induzir hipotensão ortostática associada a tontura, taquicardia e, em alguns pacientes, síncope, especialmente durante o período inicial de titulação da dose, provavelmente refletindo suas propriedades antagonistas α1-adrenérgicas. Síncope foi relatada em 1% (28/3265) dos pacientes tratados com SEROQUEL, comparado com 0,2% (2/954) com placebo e cerca de 0,4% (2/527) com drogas de controle ativo. Hipotensão ortostática, tontura e síncope podem levar a quedas.
SEROQUEL 25mg deve ser usado com cuidado especial em pacientes com doença cardiovascular conhecida (história de infarto do miocárdio ou doença cardíaca isquêmica, insuficiência cardíaca ou anormalidades de condução), doença cerebrovascular ou condições que predisponham os pacientes à hipotensão (desidratação, hipovolemia e tratamento com medicamentos anti-hipertensivos). O risco de hipotensão ortostática e síncope pode ser minimizado limitando a dose inicial a 25 mg duas vezes ao dia [ver DOSAGEM E ADMINISTRAÇÃO ]. Se ocorrer hipotensão durante a titulação até a dose alvo, é apropriado retornar à dose anterior no esquema de titulação.
Cataratas
Os antipsicóticos atípicos, incluindo o SEROQUEL, podem causar sonolência, hipotensão postural, instabilidade motora e sensorial, podendo levar a quedas e, consequentemente, fraturas ou outras lesões. Para pacientes com doenças, condições ou medicamentos que possam exacerbar esses efeitos, complete as avaliações de risco de queda ao iniciar o tratamento antipsicótico e recorrentemente para pacientes em terapia antipsicótica de longo prazo.
Aumento da pressão arterial (crianças e adolescentes)
Em estudos controlados por placebo em crianças e adolescentes com esquizofrenia (duração de 6 semanas) ou mania bipolar (duração de 3 semanas), a incidência de aumentos a qualquer momento na pressão arterial sistólica (≥20 mmHg) foi de 15,2% (51/335 ) para SEROQUEL 50mg e 5,5% (9/163) para placebo; a incidência de aumentos a qualquer momento na pressão arterial diastólica (≥10 mmHg) foi de 40,6% (136/335) para SEROQUEL e 24,5% (40/163) para placebo. No ensaio clínico aberto de 26 semanas, uma criança com histórico relatado de hipertensão experimentou uma crise hipertensiva. A pressão arterial em crianças e adolescentes deve ser medida no início e periodicamente durante o tratamento.
Em um ensaio clínico controlado por placebo SEROQUEL XR (duração de 8 semanas) em crianças e adolescentes (10-17 anos de idade) com depressão bipolar, no qual a eficácia não foi estabelecida, a incidência de aumentos a qualquer momento na pressão arterial sistólica (≥ 20 mmHg) foi de 6,5% (6/92) para SEROQUEL XR e 6,0% (6/100) para placebo; a incidência de aumentos a qualquer momento na pressão arterial diastólica (≥10 mmHg) foi de 46,7% (43/92) para SEROQUEL 25mg XR e 36,0% (36/100) para placebo.
Leucopenia, neutropenia e agranulocitose
Em ensaios clínicos e experiência pós-comercialização, eventos de leucopenia/neutropenia foram relatados temporariamente relacionados a agentes antipsicóticos atípicos, incluindo SEROQUEL. Agranulocitose foi relatada.
Agranulocitose (definida como contagem absoluta de neutrófilos
Possíveis fatores de risco para leucopenia/neutropenia incluem baixa contagem de glóbulos brancos (WBC) pré-existente e história de leucopenia/neutropenia induzida por drogas. Pacientes com leucócitos baixos preexistentes ou história de leucopenia/neutropenia induzida por drogas devem ter seu hemograma completo (CBC) monitorado frequentemente durante os primeiros meses de terapia e devem descontinuar SEROQUEL 50mg ao primeiro sinal de declínio no leucograma ausência de outros fatores causais.
Pacientes com neutropenia devem ser cuidadosamente monitorados quanto a febre ou outros sintomas ou sinais de infecção e tratados imediatamente se tais sintomas ou sinais ocorrerem. Pacientes com neutropenia grave (contagem absoluta de neutrófilos
Catarata
O desenvolvimento de catarata foi observado em associação com o tratamento com quetiapina em estudos crônicos em cães [ver Toxicologia não clínica ]. Alterações do cristalino também foram observadas em adultos, crianças e adolescentes durante o tratamento de longo prazo com SEROQUEL 100mg, mas uma relação causal com o uso de SEROQUEL 200mg não foi estabelecida. No entanto, a possibilidade de alterações lenticulares não pode ser excluída neste momento. Portanto, o exame do cristalino por métodos adequados para detectar a formação de catarata, como o exame com lâmpada de fenda ou outros métodos adequadamente sensíveis, é recomendado no início do tratamento ou logo após, e em intervalos de 6 meses durante o tratamento crônico.
Prolongamento QT
Em ensaios clínicos, a quetiapina não foi associada a um aumento persistente dos intervalos QT. No entanto, o efeito QT não foi sistematicamente avaliado em um estudo QT completo. Na experiência pós-comercialização, houve casos relatados de prolongamento do intervalo QT em pacientes que sofreram overdose de quetiapina [ver SOBREDOSAGEM ], em pacientes com doença concomitante e em pacientes tomando medicamentos conhecidos por causar desequilíbrio eletrolítico ou aumentar o intervalo QT [ver INTERAÇÕES MEDICAMENTOSAS ].
O uso de quetiapina deve ser evitado em combinação com outros medicamentos conhecidos por prolongar o intervalo QTc, incluindo antiarrítmicos de classe 1A (por exemplo, quinidina, procainamida) ou antiarrítmicos de classe III (por exemplo, amiodarona, sotalol), medicamentos antipsicóticos (por exemplo, ziprasidona, clorpromazina, tioridazina), antibióticos (por exemplo, gatifloxacina, moxifloxacina) ou qualquer outra classe de medicamentos conhecidos por prolongar o intervalo QTc (por exemplo, pentamidina, acetato de levometadil, metadona).
quetiapina também deve ser evitada em circunstâncias que possam aumentar o risco de ocorrência de torsade de pointes e/ou morte súbita, incluindo (1) histórico de arritmias cardíacas, como bradicardia; (2) hipocalemia ou hipomagnesemia; (3) uso concomitante de outras drogas que prolongam o intervalo QTc; e (4) presença de prolongamento congênito do intervalo QT.
Deve-se ter cautela também quando a quetiapina é prescrita em pacientes com risco aumentado de prolongamento do intervalo QT (por exemplo, doença cardiovascular, histórico familiar de prolongamento do intervalo QT, idosos, insuficiência cardíaca congestiva e hipertrofia cardíaca).
Convulsões
Durante os ensaios clínicos, ocorreram convulsões em 0,5% (20/3490) dos pacientes tratados com SEROQUEL em comparação com 0,2% (2/954) com placebo e 0,7% (4/527) com drogas de controle ativo. Assim como outros antipsicóticos, SEROQUEL 25mg deve ser usado com cautela em pacientes com histórico de convulsões ou com condições que potencialmente diminuem o limiar convulsivo, por exemplo, demência de Alzheimer. Condições que diminuem o limiar convulsivo podem ser mais prevalentes em uma população de 65 anos ou mais.
Hipotireoidismo
Adultos
Ensaios clínicos com quetiapina demonstraram diminuições relacionadas à dose nos níveis de hormônio da tireóide. A redução na tiroxina total e livre (T4) de aproximadamente 20% na extremidade superior da faixa de dose terapêutica foi máxima nas primeiras seis semanas de tratamento e mantida sem adaptação ou progressão durante a terapia mais crônica. Em quase todos os casos, a interrupção do tratamento com quetiapina foi associada à reversão dos efeitos no T4 total e livre, independentemente da duração do tratamento. O mecanismo pelo qual a quetiapina afeta o eixo da tireoide não é claro. Se houver um efeito no eixo hipotálamo-hipofisário, a medição do TSH isoladamente pode não refletir com precisão o estado da tireoide do paciente. Portanto, tanto o TSH quanto o T4 livre, além da avaliação clínica, devem ser medidos na linha de base e no seguimento.
Nos estudos adjuntos de mania, onde SEROQUEL 50mg foi adicionado ao lítio ou divalproato, 12% (24/196) dos pacientes tratados com SEROQUEL 200mg comparados a 7% (15/203) dos pacientes tratados com placebo apresentaram níveis elevados de TSH. Dos pacientes tratados com SEROQUEL 300mg com níveis elevados de TSH, 3 apresentaram níveis baixos simultâneos de T4 livre (T4 livre
Cerca de 0,7% (26/3489) dos pacientes com SEROQUEL apresentaram aumentos de TSH em estudos de monoterapia. Alguns pacientes com aumento de TSH necessitaram de tratamento de reposição da tireoide.
Em todos os ensaios com quetiapina, a incidência de alterações nos hormônios tireoidianos e TSH foi1: diminuição do T4 livre (5mIU/L), 4,9% (956/19412). Em oito pacientes, onde a TBG foi medida, os níveis de TBG permaneceram inalterados.
Tabela 8 mostra a incidência dessas mudanças em ensaios clínicos de curto prazo controlados por placebo.
Em ensaios de monoterapia de curto prazo controlados por placebo, a incidência de mudanças recíprocas em T3 e TSH foi de 0,0% para quetiapina (1/4800) e placebo (0/2190) e para T4 e TSH as mudanças foram de 0,1% (7 /6154) para quetiapina versus 0,0% (1/3007) para placebo.
Crianças e adolescentes
Em estudos agudos controlados com placebo em crianças e adolescentes com esquizofrenia (duração de 6 semanas) ou mania bipolar (duração de 3 semanas), a incidência de alterações nos valores da função tireoidiana a qualquer momento para pacientes tratados com SEROQUEL 100mg e pacientes tratados com placebo para TSH elevado foi de 2,9% (8/280) vs. 0,7% (1/138), respectivamente, e para tiroxina total diminuída foi de 2,8% (8/289) vs. 0% (0/145), respectivamente. Dos pacientes tratados com SEROQUEL com níveis elevados de TSH, 1 apresentou simultaneamente níveis baixos de T4 livre no final do tratamento.
Hiperprolactinemia
Adultos
Durante os ensaios clínicos com quetiapina, a incidência de alterações nos níveis de prolactina para um valor clinicamente significativo ocorreu em 3,6% (158/4416) dos doentes tratados com quetiapina em comparação com 2,6% (51/1968) com placebo.
Crianças e adolescentes
Em estudos agudos controlados com placebo em crianças e adolescentes com mania bipolar (duração de 3 semanas) ou esquizofrenia (duração de 6 semanas), a incidência de mudanças nos níveis de prolactina para um valor (>20 μg/L homens; >26 μg /L mulheres a qualquer momento) foi de 13,4% (18/134) para SEROQUEL comparado a 4% (3/75) para placebo em homens e 8,7% (9/104) para SEROQUEL 25mg comparado a 0% (0/39) para placebo em mulheres.
Assim como outras drogas que antagonizam os receptores D2 da dopamina, SEROQUEL 300mg eleva os níveis de prolactina em alguns pacientes e a elevação pode persistir durante a administração crônica. A hiperprolactinemia, independentemente da etiologia, pode suprimir o GnRH hipotalâmico, resultando em redução da secreção de gonadotrofina hipofisária. Isso, por sua vez, pode inibir a função reprodutiva, prejudicando a esteroidogênese gonadal em pacientes do sexo feminino e masculino. Galactorreia, amenorreia, ginecomastia e impotência foram relatadas em pacientes recebendo compostos que aumentam a prolactina. A hiperprolactinemia de longa duração quando associada ao hipogonadismo pode levar à diminuição da densidade óssea em indivíduos do sexo feminino e masculino.
Experimentos em cultura de tecidos indicam que aproximadamente um terço dos cânceres de mama humanos são dependentes de prolactina in vitro, um fator de potencial importância se a prescrição desses medicamentos for considerada em uma paciente com câncer de mama previamente detectado. Como é comum com compostos que aumentam a liberação de prolactina, a neoplasia da glândula mamária e das ilhotas pancreáticas (adenocarcinomas mamários, adenomas hipofisários e pancreáticos) foi observada em estudos de carcinogenicidade realizados em camundongos e ratos. Nem os estudos clínicos nem os estudos epidemiológicos realizados até o momento mostraram uma associação entre a administração crônica dessa classe de medicamentos e a tumorigênese em humanos, mas as evidências disponíveis são muito limitadas para serem conclusivas [ver Toxicologia não clínica ].
Potencial para comprometimento cognitivo e motor
sonolência foi um evento adverso comumente relatado em pacientes tratados com SEROQUEL, especialmente durante o período de 3-5 dias da titulação inicial da dose. Em estudos de esquizofrenia, a sonolência foi relatada em 18% (89/510) dos pacientes tratados com SEROQUEL 200mg em comparação com 11% (22/206) dos pacientes tratados com placebo. Em estudos de mania bipolar aguda usando SEROQUEL 200mg como monoterapia, foi relatada sonolência em 16% (34/209) dos pacientes que receberam SEROQUEL 300mg em comparação com 4% dos pacientes que receberam placebo. Em estudos de mania bipolar aguda usando SEROQUEL como terapia adjuvante, a sonolência foi relatada em 34% (66/196) dos pacientes tratados com SEROQUEL em comparação com 9% (19/203) dos pacientes tratados com placebo. Em ensaios de depressão bipolar, foi notificada sonolência em 57% (398/698) dos doentes tratados com SEROQUEL 50 mg em comparação com 15% (51/347) dos doentes tratados com placebo. Uma vez que SEROQUEL 25mg tem o potencial de prejudicar o julgamento, pensamento ou habilidades motoras, os pacientes devem ser alertados sobre a realização de atividades que exijam alerta mental, como dirigir veículos motorizados (incluindo automóveis) ou operar máquinas perigosas até que tenham certeza razoável de que a terapia com SEROQUEL funciona. não os afete negativamente. A sonolência pode levar a quedas.
Regulação da temperatura corporal
Embora não relatado com SEROQUEL 100mg, a interrupção da capacidade do corpo de reduzir a temperatura corporal central tem sido atribuída a agentes antipsicóticos. Recomenda-se o cuidado apropriado ao prescrever SEROQUEL 300mg para pacientes que apresentarão condições que possam contribuir para a elevação da temperatura corporal central, por exemplo, exercícios extenuantes, exposição a calor extremo, uso concomitante de medicação com atividade anticolinérgica ou estarem sujeitos a desidratação.
Disfagia
A dismotilidade esofágica e a aspiração têm sido associadas ao uso de drogas antipsicóticas. A pneumonia aspirativa é uma causa comum de morbidade e mortalidade em pacientes idosos, em particular naqueles com demência de Alzheimer avançada. SEROQUEL 100mg e outros antipsicóticos devem ser usados com cautela em pacientes com risco de pneumonia por aspiração.
Síndrome de descontinuação
Sintomas agudos de abstinência, como insônia, náusea e vômito, foram descritos após a interrupção abrupta de antipsicóticos atípicos, incluindo SEROQUEL. Em ensaios clínicos de monoterapia de curta duração controlados por placebo com SEROQUEL 25mg XR que incluíram uma fase de descontinuação que avaliou os sintomas de descontinuação, a incidência agregada de pacientes que apresentaram um ou mais sintomas de descontinuação após interrupção abrupta foi de 12,1% (241/1993) para SEROQUEL XR e 6,7% (71/1065) para placebo. A incidência das reações adversas individuais (ou seja, insônia, náusea, dor de cabeça, diarreia, vômito, tontura e irritabilidade) não excedeu 5,3% em qualquer grupo de tratamento e geralmente se resolveu após 1 semana após a descontinuação. A retirada gradual é aconselhada. [Vejo Uso em populações específicas ]
Efeitos anticolinérgicos (antimuscarínicos)
norquetiapina, um metabólito ativo da quetiapina, tem afinidade moderada a forte por vários subtipos de receptores muscarínicos. Isso contribui para reações adversas anticolinérgicas quando SEROQUEL 25mg é usado em doses terapêuticas, tomado concomitantemente com outros medicamentos anticolinérgicos ou tomado em superdosagem. SEROQUEL deve ser usado com cautela em pacientes recebendo medicamentos com efeitos anticolinérgicos (antimuscarínicos) [ver SOBREDOSAGEM e FARMACOLOGIA CLÍNICA ].
A constipação foi um evento adverso comumente relatado em pacientes tratados com quetiapina e representa um fator de risco para obstrução intestinal. Obstrução intestinal foi relatada com quetiapina, incluindo relatos fatais em pacientes que estavam recebendo múltiplas medicações concomitantes que diminuem a motilidade intestinal.
SEROQUEL 300mg deve ser usado com cautela em pacientes com diagnóstico atual ou história prévia de retenção urinária, hipertrofia prostática clinicamente significativa, constipação ou aumento da pressão intraocular.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA (Guia de Medicação).
Os pacientes devem ser avisados sobre os seguintes problemas e solicitados a alertar seu prescritor se ocorrerem durante o tratamento com SEROQUEL.
Aumento da Mortalidade em Pacientes Idosos com Psicose Relacionada à Demência Pacientes e cuidadores devem ser informados de que pacientes idosos com psicose relacionada à demência tratados com medicamentos antipsicóticos atípicos apresentam risco aumentado de morte em comparação com placebo. A quetiapina não é aprovada para pacientes idosos com psicose relacionada à demência [ver AVISOS E PRECAUÇÕES ].
Pensamentos e Comportamentos Suicidas
Os pacientes, seus familiares e seus cuidadores devem ser encorajados a estarem alertas para o surgimento de ansiedade, agitação, ataques de pânico, insônia, irritabilidade, hostilidade, agressividade, impulsividade, acatisia (inquietação psicomotora), hipomania, mania, outras alterações incomuns de comportamento , agravamento da depressão e ideação suicida, especialmente no início do tratamento antidepressivo e quando a dose é ajustada para cima ou para baixo. Familiares e cuidadores de pacientes devem ser orientados a procurar diariamente o surgimento de tais sintomas, pois as alterações podem ser abruptas. Tais sintomas devem ser relatados ao prescritor ou profissional de saúde do paciente, principalmente se forem graves, de início abrupto ou não fizerem parte dos sintomas apresentados pelo paciente. Sintomas como esses podem estar associados a um risco aumentado de pensamento e comportamento suicida e indicam a necessidade de monitoramento muito próximo e possivelmente mudanças na medicação [ver AVISOS E PRECAUÇÕES ].
Síndrome Neuroléptica Maligna (SNM)
Os pacientes devem ser aconselhados a relatar ao seu médico quaisquer sinais ou sintomas que possam estar relacionados à SNM. Estes podem incluir rigidez muscular e febre alta [ver AVISOS E PRECAUÇÕES ].
Hiperglicemia e Diabetes Mellitus
Os pacientes devem estar cientes dos sintomas de hiperglicemia (açúcar elevado no sangue) e diabetes mellitus. Pacientes diagnosticados com diabetes, aqueles com fatores de risco para diabetes ou aqueles que desenvolvem esses sintomas durante o tratamento devem ter sua glicemia monitorada no início e periodicamente durante o tratamento [ver AVISOS E PRECAUÇÕES ].
Hiperlipidemia
Os doentes devem ser avisados de que podem ocorrer elevações do colesterol total, colesterol LDL e triglicéridos e diminuição do colesterol HDL. Os pacientes devem ter seu perfil lipídico monitorado no início e periodicamente durante o tratamento. AVISOS E PRECAUÇÕES ].
Ganho de peso
Os pacientes devem ser avisados de que podem apresentar ganho de peso. Os pacientes devem ter seu peso monitorado regularmente [ver AVISOS E PRECAUÇÕES ].
Hipotensão ortostática
Os pacientes devem ser avisados sobre o risco de hipotensão ortostática (os sintomas incluem tonturas ou vertigens ao ficar em pé, o que pode levar a quedas), especialmente durante o período de titulação da dose inicial e também nos momentos de reinício do tratamento ou aumento da dose. Vejo AVISOS E PRECAUÇÕES ].
Aumento da pressão arterial em crianças e adolescentes
Crianças e adolescentes devem ter sua pressão arterial medida no início e periodicamente durante o tratamento [ver AVISOS E PRECAUÇÕES ].
Leucopenia/neutropenia
Pacientes com leucócitos baixos preexistentes ou história de leucopenia/neutropenia induzida por drogas devem ser avisados de que devem ter seus hemogramas monitorados enquanto estiverem tomando SEROQUEL. Os pacientes devem ser aconselhados a falar com seu médico o mais rápido possível se tiverem febre, sintomas semelhantes aos da gripe, dor de garganta ou qualquer outra infecção, pois isso pode ser resultado de uma contagem de leucócitos muito baixa, o que pode exigir que SEROQUEL 100mg seja interrompido e/ou tratamento a ser administrado [ver AVISOS E PRECAUÇÕES ].
Interferência com o desempenho cognitivo e motor
Os pacientes devem ser avisados do risco de sonolência ou sedação (que pode levar a quedas), especialmente durante o período de titulação da dose inicial. Os pacientes devem ser advertidos sobre a realização de qualquer atividade que requeira alerta mental, como dirigir veículos motorizados (incluindo automóveis) ou operar máquinas, até que tenham certeza razoável de que a terapia com quetiapina não os afeta adversamente [ver AVISOS E PRECAUÇÕES ].
Exposição ao calor e desidratação
Os pacientes devem ser aconselhados sobre os cuidados apropriados para evitar superaquecimento e desidratação [ver AVISOS E PRECAUÇÕES ].
Medicação concomitante
Assim como com outros medicamentos, os pacientes devem ser aconselhados a notificar seus médicos se estiverem tomando ou planejam tomar qualquer medicamento prescrito ou de venda livre [ver INTERAÇÕES MEDICAMENTOSAS ].
Gravidez
Aconselhe as mulheres grávidas a notificarem o seu médico se engravidarem ou pretendem engravidar durante o tratamento com SEROQUEL. Avise os pacientes que SEROQUEL pode causar sintomas extrapiramidais e/ou de abstinência (agitação, hipertonia, hipotonia, tremor, sonolência, desconforto respiratório e distúrbio alimentar) em um recém-nascido. Avisar as pacientes que existe um registro de gravidez que monitora os resultados da gravidez em mulheres expostas a SEROQUEL 25mg durante a gravidez [ver Uso em populações específicas ].
Infertilidade
Avise as mulheres com potencial reprodutivo que SEROQUEL pode prejudicar a fertilidade devido a um aumento nos níveis séricos de prolactina. Os efeitos sobre a fertilidade são reversíveis [ver Uso em populações específicas ].
Necessidade de Programa de Tratamento Abrangente
SEROQUEL é indicado como parte integrante de um programa de tratamento total para adolescentes com esquizofrenia e transtorno bipolar pediátrico que pode incluir outras medidas (psicológicas, educacionais e sociais). A eficácia e a segurança de SEROQUEL 100mg não foram estabelecidas em pacientes pediátricos com menos de 13 anos de idade para esquizofrenia ou com menos de 10 anos de idade para mania bipolar. A colocação educacional apropriada é essencial e a intervenção psicossocial é muitas vezes útil. A decisão de prescrever medicação antipsicótica atípica dependerá da avaliação do médico sobre a cronicidade e gravidade dos sintomas do paciente [ver INDICAÇÕES ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogênese
Estudos de carcinogenicidade foram realizados em camundongos C57BL e ratos Wistar. A quetiapina foi administrada na dieta a camundongos em doses de 20, 75, 250 e 750 mg/kg e a ratos por gavagem em doses de 25, 75 e 250 mg/kg por dois anos. Essas doses são equivalentes a 0,1, 0,5, 1,5 e 4,5 vezes a MRHD de 800 mg/dia com base em mg/m2 de área de superfície corporal (camundongos) ou 0,3, 1 e 3 vezes a MRHD com base em mg/m2 de área de superfície corporal (ratos). Houve aumentos estatisticamente significativos nos adenomas foliculares da glândula tireóide em camundongos machos em doses 1,5 e 4,5 vezes a MRHD com base em mg/m2 de área de superfície corporal e em ratos machos em uma dose de 3 vezes a MRHD em mg/m2 de área de superfície corporal. Os adenocarcinomas da glândula mamária aumentaram estatisticamente significativamente em ratos fêmeas em todas as doses testadas (0,3, 1 e 3 vezes o MRHD com base em mg/m2 de área de superfície corporal).
Os adenomas de células foliculares da tireoide podem ter resultado da estimulação crônica da glândula tireoide pelo hormônio estimulador da tireoide (TSH) resultante do aumento do metabolismo e da depuração da tiroxina pelo fígado de roedores. Alterações na depuração de TSH, tiroxina e tiroxina consistentes com este mecanismo foram observadas em estudos de toxicidade subcrônica em ratos e camundongos e em um estudo de toxicidade de 1 ano em ratos; no entanto, os resultados desses estudos não foram definitivos. A relevância dos aumentos de adenomas de células foliculares da tireoide para o risco humano, seja qual for o mecanismo, é desconhecida.
Fármacos antipsicóticos demonstraram elevar cronicamente os níveis de prolactina em roedores. As medições séricas em um estudo de toxicidade de 1 ano mostraram que a quetiapina aumentou os níveis médios de prolactina sérica em um máximo de 32 e 13 vezes em ratos machos e fêmeas, respectivamente. Aumentos de neoplasias mamárias foram encontrados em roedores após administração crônica de outras drogas antipsicóticas e são considerados mediados por prolactina. A relevância deste aumento da incidência de tumores da glândula mamária mediados por prolactina em ratos para o risco humano é desconhecida. AVISOS E PRECAUÇÕES ].
Mutagênese
quetiapina não foi mutagênica ou clastogênica em testes padrão de genotoxicidade. O potencial mutagénico da quetiapina foi testado no ensaio in vitro de mutação genética bacteriana Ames e no ensaio in vitro de mutação genética de mamífero em células de ovário de hamster chinês. O potencial clastogênico da quetiapina foi testado no ensaio de aberração cromossômica in vitro em linfócitos humanos cultivados e no ensaio de micronúcleo de medula óssea in vivo em ratos até 500 mg/kg, que é 6 vezes a dose humana máxima recomendada com base em mg/m2 área de superfície corporal.
Prejuízo da Fertilidade
quetiapina diminuiu o acasalamento e a fertilidade em ratos machos Sprague-Dawley em doses orais de 50 e 150 mg/kg ou aproximadamente 1 e 3 vezes a MRHD de 800 mg/dia com base em mg/m2 de área de superfície corporal. Os efeitos relacionados à droga incluíram aumentos no intervalo para acasalar e no número de acasalamentos necessários para a impregnação bem-sucedida. Esses efeitos continuaram a ser observados em 3 vezes a MRHD, mesmo após um período de duas semanas sem tratamento. A dose sem efeito para acasalamento prejudicada e fertilidade em ratos machos foi de 25 mg/kg, ou 0,3 vezes a dose de MRHD com base em mg/m2 de área de superfície corporal. A quetiapina afetou negativamente o acasalamento e a fertilidade em ratas Sprague-Dawley fêmeas em uma dose oral de aproximadamente 1 vez a MRHD de 800 mg/dia com base em mg/m2 de área de superfície corporal. Os efeitos relacionados com as drogas incluíram diminuições nos acasalamentos e nos acasalamentos resultando em gravidez e um aumento no intervalo para acasalar. Um aumento nos ciclos de estro irregular foi observado em doses de 10 e 50 mg/kg, ou aproximadamente 0,1 e 1 vez a MRHD de 800 mg/dia com base em mg/m2 de área de superfície corporal. A dose sem efeito em ratas foi de 1 mg/kg, ou 0,01 vezes a MRHD de 800 mg/dia com base na área de superfície corporal em mg/m2.
Uso em populações específicas
Gravidez
Registro de Exposição à Gravidez
Existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas a antipsicóticos atípicos, incluindo SEROQUEL 50mg, durante a gravidez. Os profissionais de saúde são incentivados a registrar pacientes entrando em contato com o Registro Nacional de Gravidez para Antipsicóticos Atípicos em 1-866-961-2388 ou on-line em http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
Resumo do risco
Recém-nascidos expostos a medicamentos antipsicóticos (incluindo SEROQUEL) durante o terceiro trimestre estão em risco de sintomas extrapiramidais e/ou de abstinência após o parto (ver Considerações Clínicas ). Os dados gerais disponíveis de estudos epidemiológicos publicados de mulheres grávidas expostas à quetiapina não estabeleceram um risco associado ao medicamento de defeitos congênitos graves, aborto espontâneo ou desfechos maternos ou fetais adversos (ver Dados ). Existem riscos para a mãe associados à esquizofrenia não tratada, transtorno bipolar I ou transtorno depressivo maior e à exposição a antipsicóticos, incluindo SEROQUEL 200mg, durante a gravidez (ver Considerações Clínicas ).
Em estudos com animais, ocorreu toxicidade embriofetal incluindo atrasos na ossificação esquelética em aproximadamente 1 e 2 vezes a dose humana máxima recomendada (MRHD) de 800 mg/dia em ratos e coelhos, e um aumento da incidência de flexura carpal/tarsal (menor anomalia do tecido mole) em fetos de coelho em aproximadamente 2 vezes a MRHD. Além disso, os pesos fetais foram reduzidos em ambas as espécies. A toxicidade materna (observada como diminuição do peso corporal e/ou morte) ocorreu em 2 vezes a MRHD em ratos e aproximadamente 1-2 vezes a MRHD em coelhos.
risco de fundo estimado de grandes defeitos congênitos e aborto para as populações indicadas é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2 a 4% e 15 a 20%, respectivamente.
Considerações Clínicas
Risco Materno e/ou Fetal Associado à Doença
Existe um risco para a mãe de esquizofrenia não tratada ou transtorno bipolar I, incluindo aumento do risco de recaída, hospitalização e suicídio. A esquizofrenia e o transtorno bipolar I estão associados ao aumento de resultados perinatais adversos, incluindo parto prematuro. Não se sabe se isso é resultado direto da doença ou de outros fatores comórbidos.
Estudo prospectivo, longitudinal, acompanhou 201 gestantes com histórico de transtorno depressivo maior, eutímicas e em uso de antidepressivos no início da gestação. As mulheres que descontinuaram os antidepressivos durante a gravidez eram mais propensas a ter uma recaída de depressão maior do que as mulheres que continuaram os antidepressivos. Considere o risco de depressão não tratada ao interromper ou alterar o tratamento com medicação antidepressiva durante a gravidez e pós-parto.
Reações Adversas Fetais/Neonatais
Sintomas extrapiramidais e/ou de abstinência, incluindo agitação, hipertonia, hipotonia, tremor, sonolência, dificuldade respiratória e distúrbios alimentares foram relatados em recém-nascidos que foram expostos a drogas antipsicóticas, incluindo SEROQUEL 50mg, durante o terceiro trimestre de gravidez. Esses sintomas variaram em gravidade. Monitore os neonatos quanto a sintomas extrapiramidais e/ou de abstinência e gerencie os sintomas adequadamente. Alguns neonatos se recuperaram em horas ou dias sem tratamento específico; outros necessitaram de hospitalização prolongada.
Dados
Dados humanos
Dados publicados de estudos observacionais, registros de nascimento e relatos de casos sobre o uso de antipsicóticos atípicos durante a gravidez não relatam uma associação clara com antipsicóticos e defeitos congênitos maiores. Um estudo de coorte retrospectivo de um banco de dados Medicaid de 9.258 mulheres expostas a antipsicóticos durante a gravidez não indicou um aumento geral do risco de defeitos congênitos graves.
Dados de animais
Quando ratas e coelhas grávidas foram expostas à quetiapina durante a organogênese, não houve efeito teratogênico em fetos. As doses foram 25, 50 e 200 mg/kg em ratos e 25, 50 e 100 mg/kg em coelhos que são aproximadamente 0,3, 0,6 e 2 vezes (ratos) e 0,6, 1 e 2 vezes (coelhos) o MRHD para esquizofrenia de 800 mg/dia com base em mg/m2 de área de superfície corporal. No entanto, houve evidência de toxicidade embriofetal incluindo atrasos na ossificação esquelética em aproximadamente 1 e 2 vezes a MRHD de 800 mg/dia em ratos e coelhos, e um aumento da incidência de flexura carpal/tarsal (menor anomalia dos tecidos moles) em fetos de coelho em aproximadamente 2 vezes a MRHD. Além disso, os pesos fetais foram reduzidos em ambas as espécies. A toxicidade materna (observada como diminuição do peso corporal e/ou morte) ocorreu em 2 vezes a MRHD em ratos e aproximadamente 1-2 vezes a MRHD (todas as doses testadas) em coelhos.
Em um estudo reprodutivo peri/pós-natal em ratos, não foram observados efeitos relacionados ao medicamento quando mães gestantes foram tratadas com quetiapina em doses 0,01, 0,1 e 0,2 vezes a MRHD de 800 mg/dia com base em mg/m2 de área de superfície corporal. No entanto, em um estudo peri/pós-natal preliminar, houve aumento na mortalidade fetal e de filhotes e diminuição no peso médio da ninhada em 3 vezes o MRHD.
Lactação
Resumo do risco
Dados limitados da literatura publicada relatam a presença de quetiapina no leite materno humano em uma dose infantil relativa
Fêmeas e Machos com Potencial Reprodutivo
Infertilidade
Mulheres
Com base na ação farmacológica da quetiapina (antagonismo D2), o tratamento com SEROQUEL pode resultar em aumento nos níveis séricos de prolactina, o que pode levar a uma redução reversível da fertilidade em mulheres com potencial reprodutivo [ver AVISOS E PRECAUÇÕES ].
Uso Pediátrico
Em geral, as reações adversas observadas em crianças e adolescentes durante os ensaios clínicos foram semelhantes às da população adulta, com poucas exceções. Aumentos na pressão arterial sistólica e diastólica ocorreram em crianças e adolescentes e não ocorreram em adultos. A hipotensão ortostática ocorreu mais frequentemente em adultos (4-7%) em comparação com crianças e adolescentes ( AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS ].
Esquizofrenia
A eficácia e segurança de SEROQUEL 50mg no tratamento da esquizofrenia em adolescentes de 13 a 17 anos foram demonstradas em um estudo duplo-cego, controlado por placebo, de 6 semanas [ver INDICAÇÕES , DOSAGEM E ADMINISTRAÇÃO , REAÇÕES ADVERSAS , e Estudos clínicos ].
A segurança e eficácia de SEROQUEL 300mg em pacientes pediátricos com menos de 13 anos de idade com esquizofrenia não foram estabelecidas.
Manutenção
segurança e eficácia de SEROQUEL no tratamento de manutenção do transtorno bipolar não foram estabelecidas em pacientes pediátricos com menos de 18 anos de idade. A segurança e eficácia de SEROQUEL no tratamento de manutenção da esquizofrenia não foram estabelecidas em nenhuma população de pacientes, incluindo pacientes pediátricos.
Mania Bipolar
A eficácia e segurança de SEROQUEL no tratamento da mania em crianças e adolescentes com idades entre 10-17 anos com transtorno bipolar I foi demonstrada em um estudo multicêntrico, duplo-cego, controlado por placebo, de 3 semanas [ver INDICAÇÕES , DOSAGEM E ADMINISTRAÇÃO , REAÇÕES ADVERSAS , e Estudos clínicos ]. A segurança e eficácia de SEROQUEL em pacientes pediátricos com menos de 10 anos de idade com mania bipolar não foram estabelecidas.
Depressão Bipolar
A segurança e eficácia de SEROQUEL 300mg em pacientes pediátricos com menos de 18 anos de idade com depressão bipolar não foram estabelecidas. Um ensaio clínico com SEROQUEL XR foi realizado em crianças e adolescentes (10-17 anos de idade) com depressão bipolar, a eficácia não foi estabelecida.
Algumas diferenças na farmacocinética da quetiapina foram observadas entre crianças/adolescentes (10-17 anos de idade) e adultos. Quando ajustado para o peso, a AUC e Cmax da quetiapina foram 41% e 39% menores, respectivamente, em crianças e adolescentes em comparação com adultos. A farmacocinética do metabólito ativo, norquetiapina, foi semelhante entre crianças/adolescentes e adultos após ajuste para peso [ver FARMACOLOGIA CLÍNICA ].
Uso Geriátrico
Dos aproximadamente 3.700 pacientes em estudos clínicos com SEROQUEL 300mg, 7% (232) tinham 65 anos de idade ou mais. Em geral, não houve indicação de qualquer tolerabilidade diferente de SEROQUEL em idosos em comparação com adultos mais jovens. No entanto, a presença de fatores que podem diminuir a depuração farmacocinética, aumentar a resposta farmacodinâmica ao SEROQUEL 200mg, ou causar menor tolerância ou ortostase, deve levar a consideração de uma dose inicial mais baixa, titulação mais lenta e monitoramento cuidadoso durante o período de dosagem inicial no idoso. A depuração plasmática média de SEROQUEL 25mg foi reduzida em 30% a 50% em pacientes idosos quando comparado a pacientes mais jovens [ver FARMACOLOGIA CLÍNICA e DOSAGEM E ADMINISTRAÇÃO ].
Insuficiência renal
A experiência clínica com SEROQUEL em pacientes com insuficiência renal é limitada [ver FARMACOLOGIA CLÍNICA ].
Insuficiência hepática
Uma vez que a quetiapina é extensivamente metabolizada pelo fígado, são esperados níveis plasmáticos mais elevados em pacientes com insuficiência hepática. Nesta população, uma dose inicial baixa de 25 mg/dia é recomendada e a dose pode ser aumentada em incrementos de 25 mg/dia-50 mg/dia [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Experiência Humana
Em ensaios clínicos, a sobrevivência foi relatada em overdoses agudas de até 30 gramas de quetiapina. A maioria dos pacientes que sofreram overdose não apresentou reações adversas ou se recuperou totalmente dos eventos relatados. A morte foi relatada em um ensaio clínico após uma overdose de 13,6 gramas de quetiapina isolada. Em geral, os sinais e sintomas relatados foram aqueles resultantes de um exagero dos efeitos farmacológicos conhecidos da droga, ou seja, sonolência, sedação, taquicardia, hipotensão e toxicidade anticolinérgica incluindo coma e delírio. Pacientes com doença cardiovascular grave pré-existente podem ter um risco aumentado dos efeitos da superdosagem [ver AVISOS E PRECAUÇÕES ]. Um caso, envolvendo uma overdose estimada de 9.600 mg, foi associado a hipocalemia e bloqueio cardíaco de primeiro grau. Na experiência pós-comercialização, foram notificados casos de prolongamento do intervalo QT com sobredosagem.
Gerenciamento de superdosagem
Estabelecer e manter uma via aérea e assegurar oxigenação e ventilação adequadas. O monitoramento cardiovascular deve começar imediatamente e deve incluir monitoramento eletrocardiográfico contínuo para detectar possíveis arritmias.
As medidas de suporte adequadas são a base da gestão. Para obter as informações mais atualizadas sobre o manejo da superdosagem de Seroquel XR, entre em contato com um Centro Regional de Controle de Intoxicações certificado (1-800-222-1222).
CONTRA-INDICAÇÕES
Hipersensibilidade à quetiapina ou a qualquer excipiente da formulação de SEROQUEL XR. Reações anafiláticas foram relatadas em pacientes tratados com SEROQUEL XR.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
mecanismo de ação da quetiapina nas indicações listadas não é claro. No entanto, a eficácia da quetiapina nestas indicações pode ser mediada por uma combinação de antagonismo da dopamina tipo 2 (D2) e serotonina tipo 2 (5HT2). O metabólito ativo, N-desalquil quetiapina (norquetiapina), tem atividade semelhante em D2, mas maior atividade nos receptores 5HT2A, do que a droga original (quetiapina).
Farmacodinâmica
A quetiapina e seu metabólito, a norquetiapina, têm afinidade por múltiplos receptores de neurotransmissores com ligação à norquetiapina com maior afinidade do que a quetiapina em geral. Os valores de Ki para quetiapina e norquetiapina na dopamina D1 são 428/99,8 nM, em D2 626/489 nM, em serotonina 5HT1A 1040/191 nM em 5HT2A 38/2,9 nM, em histamina H1 4,4/1,1 nM, em muscarínico M1 1086/ 38,3 nM, e nos receptores adrenérgicos α1b 14,6/46,4 nM e nos receptores α2 617/1290 nM, respectivamente. A quetiapina e a norquetiapina não possuem afinidade apreciável com os receptores de benzodiazepínicos.
Efeito no intervalo QT
Em ensaios clínicos, a quetiapina não foi associada a um aumento persistente dos intervalos QT. No entanto, o efeito QT não foi sistematicamente avaliado em um estudo QT completo. Na experiência pós-comercialização, houve casos relatados de prolongamento do intervalo QT em pacientes que sofreram overdose de quetiapina [ver SOBREDOSAGEM ], em pacientes com doença concomitante e em pacientes tomando medicamentos conhecidos por causar desequilíbrio eletrolítico ou aumentar o intervalo QT.
Farmacocinética
Adultos
A atividade do fumarato de quetiapina deve-se principalmente ao fármaco original. A farmacocinética de doses múltiplas da quetiapina é proporcional à dose dentro da faixa de dose clínica proposta, e o acúmulo de quetiapina é previsível com doses múltiplas. A eliminação da quetiapina ocorre principalmente por metabolismo hepático com meia-vida terminal média de cerca de 6 horas dentro da faixa de dose clínica proposta. Espera-se que as concentrações no estado estacionário sejam alcançadas dentro de dois dias após a administração. É improvável que a quetiapina interfira no metabolismo de drogas metabolizadas pelas enzimas do citocromo P450.
Crianças e adolescentes
No estado de equilíbrio, a farmacocinética do composto original, em crianças e adolescentes (10-17 anos de idade), foi semelhante à dos adultos. No entanto, quando ajustado para dose e peso, a AUC e Cmax do composto original foram 41% e 39% menores, respectivamente, em crianças e adolescentes do que em adultos. Para o metabólito ativo, norquetiapina, AUC e Cmax foram 45% e 31% maiores, respectivamente, em crianças e adolescentes do que em adultos. Quando ajustada para dose e peso, a farmacocinética do metabólito norquetiapina foi semelhante entre crianças, adolescentes e adultos [ver Uso em populações específicas ].
Absorção
O fumarato de quetiapina é rapidamente absorvido após administração oral, atingindo concentrações plasmáticas máximas em 1,5 horas. A formulação do comprimido é 100% biodisponível em relação à solução. A biodisponibilidade da quetiapina é marginalmente afetada pela administração com alimentos, com valores de Cmax e AUC aumentados em 25% e 15%, respectivamente.
Distribuição
quetiapina está amplamente distribuída por todo o corpo com um volume aparente de distribuição de 10±4 L/kg. Liga-se 83% às proteínas plasmáticas em concentrações terapêuticas. In vitro, a quetiapina não afetou a ligação da varfarina ou diazepam à albumina sérica humana. Por sua vez, nem a varfarina nem o diazepam alteraram a ligação da quetiapina.
Metabolismo e eliminação
Após uma dose oral única de 14C-quetiapina, menos de 1% da dose administrada foi excretada como droga inalterada, indicando que a quetiapina é altamente metabolizada. Aproximadamente 73% e 20% da dose foi recuperada na urina e nas fezes, respectivamente.
quetiapina é extensamente metabolizada pelo fígado. As principais vias metabólicas são a sulfoxidação no metabólito sulfóxido e a oxidação no metabólito ácido original; ambos os metabólitos são farmacologicamente inativos. Estudos in vitro utilizando microssomas hepáticos humanos revelaram que a isoenzima citocromo P450 3A4 está envolvida no metabolismo da quetiapina no seu metabolito sulfóxido principal, mas inactivo, e no metabolismo do seu metabolito activo N-desalquil quetiapina.
Era
A depuração oral da quetiapina foi reduzida em 40% em pacientes idosos (≥ 65 anos, n=9) em comparação com pacientes jovens (n=12), e o ajuste da dose pode ser necessário [ver DOSAGEM E ADMINISTRAÇÃO ].
Gênero
Não há efeito de gênero na farmacocinética da quetiapina.
Corrida
Não há efeito racial na farmacocinética da quetiapina.
Fumar
Fumar não afeta a depuração oral da quetiapina.
Insuficiência renal
Pacientes com insuficiência renal grave (Clcr=10-30 mL/min/1,73 m2, n=8) tiveram uma depuração oral média 25% menor do que os indivíduos normais (Clcr > 80 mL/min/1,73 m2, n=8), mas as concentrações plasmáticas de quetiapina nos indivíduos com insuficiência renal estavam dentro da faixa de concentrações observadas em indivíduos normais recebendo a mesma dose. Portanto, o ajuste de dose não é necessário nesses pacientes [ver Uso em populações específicas ].
Insuficiência Hepática
Pacientes com insuficiência hepática (n=8) tiveram uma depuração oral média de quetiapina 30% menor do que os indivíduos normais. Em dois dos 8 doentes com insuficiência hepática, a AUC e a Cmax foram 3 vezes superiores às observadas tipicamente em indivíduos saudáveis. Uma vez que a quetiapina é extensivamente metabolizada pelo fígado, níveis plasmáticos mais elevados são esperados na população com insuficiência hepática, e pode ser necessário ajuste de dose. DOSAGEM E ADMINISTRAÇÃO e USO EM POPULAÇÕES ESPECÍFICAS ].
Estudos de interação medicamentosa
As avaliações in vivo do efeito de outras drogas na farmacocinética da quetiapina estão resumidas na Tabela 17 [ver DOSAGEM E ADMINISTRAÇÃO e INTERAÇÕES MEDICAMENTOSAS ].
Os dados de inibição enzimática in vitro sugerem que a quetiapina e 9 de seus metabólitos teriam pouco efeito inibitório no metabolismo in vivo mediado pelos citocromos CYP 1A2, 2C9, 2C19, 2D6 e 3A4. A quetiapina em doses de 750 mg/dia não afetou a farmacocinética de dose única de antipirina, lítio ou lorazepam (Tabela 18) [ver INTERAÇÕES MEDICAMENTOSAS ].
Toxicologia e/ou Farmacologia Animal
quetiapina causou um aumento relacionado à dose na deposição de pigmento na glândula tireoide em estudos de toxicidade em ratos com duração de 4 semanas ou mais e em um estudo de carcinogenicidade em camundongos de 2 anos. As doses foram 10, 25, 50, 75, 150 e 250 mg/kg em estudos com ratos que são aproximadamente 0,1, 0,3, 0,6, 1, 2 e 3 vezes a MRHD de 800 mg/dia com base em mg/m2 de área de superfície corporal , respectivamente. As doses no estudo de carcinogenicidade em camundongos foram de 20, 75, 250 e 750 mg/kg que são aproximadamente 0,1, 0,5, 1,5 e 4,5 vezes a MRHD de 800 mg/dia com base em mg/m2 de área de superfície corporal. A deposição de pigmento mostrou-se irreversível em ratos. A identidade do pigmento não pôde ser determinada, mas foi encontrada co-localizada com a quetiapina nas células epiteliais foliculares da glândula tireóide. Os efeitos funcionais e a relevância deste achado para o risco humano são desconhecidos.
Em cães que receberam quetiapina por 6 ou 12 meses, mas não por 1 mês, ocorreu catarata triangular focal na junção das suturas posteriores no córtex externo do cristalino na dose de 100 mg/kg, ou 4 vezes a MRHD de 800 mg/dia com base na área de superfície corporal em mg/m2. Esse achado pode ser devido à inibição da biossíntese do colesterol pela quetiapina. A quetiapina causou uma redução relacionada com a dose nos níveis de colesterol plasmático em estudos de dose repetida em cães e macacos; no entanto, não houve correlação entre o colesterol plasmático e a presença de catarata em cães individuais. O aparecimento de delta-8colestanol no plasma é consistente com a inibição de uma fase tardia na biossíntese de colesterol nestas espécies. Houve também uma redução de 25% no teor de colesterol do córtex externo do cristalino observada em um estudo especial em cadelas tratadas com quetiapina. A catarata relacionada a drogas não foi observada em nenhuma outra espécie; no entanto, em um estudo de 1 ano em macacos, uma aparência estriada da superfície anterior do cristalino foi detectada em 2/7 mulheres com uma dose de 225 mg/kg ou 5,5 vezes a MRHD de 800 mg/dia com base em mg/m2 corporal área de superfície.
Estudos clínicos
Esquizofrenia
Testes de Curto Prazo - Adultos
A eficácia de SEROQUEL 50mg no tratamento da esquizofrenia foi estabelecida em 3 estudos controlados de curto prazo (6 semanas) de pacientes internados com esquizofrenia que preenchiam os critérios do DSM III-R para esquizofrenia. Embora um braço de dose única fixa de haloperidol tenha sido incluído como tratamento comparativo em um dos três estudos, esse grupo de dose única de haloperidol foi inadequado para fornecer uma comparação confiável e válida de SEROQUEL 200mg e haloperidol.
Vários instrumentos foram utilizados para avaliar sinais e sintomas psiquiátricos nesses estudos, entre eles a Escala de Avaliação Psiquiátrica Breve (BPRS), um inventário multi-item de psicopatologia geral tradicionalmente usado para avaliar os efeitos do tratamento medicamentoso na esquizofrenia. O cluster de psicose BPRS (desorganização conceitual, comportamento alucinatório, suspeita e conteúdo de pensamento incomum) é considerado um subconjunto particularmente útil para avaliar pacientes esquizofrênicos ativamente psicóticos. Uma segunda avaliação tradicional, a Impressão Clínica Global (CGI), reflete a impressão de um observador habilidoso, totalmente familiarizado com as manifestações da esquizofrenia, sobre o estado clínico geral do paciente.
Seguem os resultados dos testes:
Os resultados primários de eficácia desses três estudos no tratamento da esquizofrenia em adultos são apresentados na Tabela 19.
O exame dos subgrupos populacionais (raça, sexo e idade) não revelou qualquer responsividade diferencial com base na raça ou sexo, com um efeito aparentemente maior em pacientes com idade inferior a 40 anos em comparação com aqueles com mais de 40 anos. este achado é desconhecido.
Adolescentes (13-17 anos)
eficácia de SEROQUEL 300mg no tratamento da esquizofrenia em adolescentes (13-17 anos de idade) foi demonstrada em um estudo duplo-cego, controlado por placebo, de 6 semanas (estudo 4). Os pacientes que preencheram os critérios diagnósticos do DSM-IV para esquizofrenia foram randomizados em um dos três grupos de tratamento: SEROQUEL 400 mg/dia (n=73), SEROQUEL 800 mg/dia (n=74) ou placebo (n=75). A medicação do estudo foi iniciada com 50 mg/dia e no dia 2 aumentada para 100 mg/dia (dividida e administrada duas ou três vezes por dia). Subsequentemente, a dose foi titulada para a dose alvo de 400 mg/dia ou 800 mg/dia usando incrementos de 100 mg/dia, dividida e administrada duas ou três vezes ao dia. A variável de eficácia primária foi a alteração média da linha de base na Escala de Síndrome Positiva e Negativa total (PANSS).
SEROQUEL na dose de 400 mg/dia e 800 mg/dia foi superior ao placebo na redução do escore total da PANSS. Os resultados primários de eficácia deste estudo no tratamento da esquizofrenia em adolescentes são apresentados na Tabela 19.
Transtorno bipolar
Transtorno Bipolar I, Episódios Maníacos ou Mistos
Adultos
A eficácia de SEROQUEL no tratamento agudo de episódios maníacos foi estabelecida em 3 estudos controlados por placebo em pacientes que preencheram os critérios do DSM-IV para transtorno bipolar I com episódios maníacos. Esses estudos incluíram pacientes com ou sem características psicóticas e excluíram pacientes com ciclagem rápida e episódios mistos. Destes ensaios, 2 foram monoterapia (12 semanas) e 1 foi terapia adjuvante (3 semanas) para lítio ou divalproex. Os principais resultados nestes estudos foram a alteração da linha de base na pontuação da Young Mania Rating Scale (YMRS) em 3 e 12 semanas para monoterapia e em 3 semanas para terapia adjunta. A terapia adjuvante é definida como o início simultâneo ou administração subsequente de SEROQUEL 100mg com lítio ou divalproato.
principal instrumento de classificação usado para avaliar os sintomas maníacos nesses estudos foi o YMRS, uma escala de 11 itens classificada pelo médico tradicionalmente usada para avaliar o grau de sintomatologia maníaca (irritabilidade, comportamento disruptivo/agressivo, sono, humor elevado, fala, atividade aumentada, interesse sexual, transtorno de linguagem/pensamento, conteúdo de pensamento, aparência e insight) em uma faixa de 0 (sem características maníacas) a 60 (pontuação máxima).
Seguem os resultados dos testes:
Monoterapia
A eficácia de SEROQUEL no tratamento agudo da mania bipolar foi estabelecida em 2 estudos controlados por placebo. Em dois estudos de 12 semanas (n=300, n=299) comparando SEROQUEL com placebo, SEROQUEL 300mg foi superior ao placebo na redução da pontuação total YMRS nas semanas 3 e 12. A maioria dos pacientes nestes estudos tomando SEROQUEL 100mg foram dosados em uma faixa entre 400 mg/dia e 800 mg por dia (estudos 1 e 2 na Tabela 20).
Terapia Adjunta
Neste estudo controlado por placebo de 3 semanas, 170 pacientes com mania bipolar (YMRS ≥20) foram randomizados para receber SEROQUEL 100mg ou placebo como tratamento adjuvante ao lítio ou divalproato. Os pacientes podem ou não ter recebido um tratamento adequado de lítio ou divalproato antes da randomização. SEROQUEL 50mg foi superior ao placebo quando adicionado ao lítio ou divalproex isoladamente na redução do escore total YMRS (estudo 3 na Tabela 20).
A maioria dos pacientes neste estudo tomando SEROQUEL 25mg recebeu doses entre 400 mg/dia e 800 mg por dia. Em um estudo semelhante (n=200), SEROQUEL foi associado a uma melhora nos escores YMRS, mas não demonstrou superioridade ao placebo, possivelmente devido a um efeito placebo maior.
Os resultados primários de eficácia desses estudos no tratamento da mania em adultos são apresentados na Tabela 20.
Crianças e adolescentes (10-17 anos)
eficácia de SEROQUEL no tratamento agudo de episódios maníacos associados ao transtorno bipolar I em crianças e adolescentes (10-17 anos de idade) foi demonstrada em um estudo multicêntrico, duplo-cego, controlado por placebo, de 3 semanas (estudo 4 em Tabela 20). Os pacientes que preencheram os critérios diagnósticos do DSM-IV para um episódio maníaco foram randomizados em um dos três grupos de tratamento: SEROQUEL 400 mg/dia (n=95), SEROQUEL 600 mg/dia (n=98) ou placebo (n=91) . A medicação do estudo foi iniciada com 50 mg/dia e no dia 2 aumentada para 100 mg/dia (doses divididas duas ou três vezes ao dia). Subsequentemente, a dose foi titulada para uma dose alvo de 400 mg/dia ou 600 mg/dia usando incrementos de 100 mg/dia, administrados em doses divididas duas ou três vezes ao dia. A variável de eficácia primária foi a alteração média da linha de base na pontuação total de YMRS.
SEROQUEL 400 mg/dia e 600 mg/dia foram superiores ao placebo na redução do escore total YMRS (Tabela 20).
Transtorno Bipolar, Episódios Depressivos
Adultos
eficácia de SEROQUEL 25mg para o tratamento agudo de episódios depressivos associados ao transtorno bipolar foi estabelecida em 2 estudos de 8 semanas, randomizados, duplo-cegos, controlados por placebo, de desenho idêntico (N = 1.045) (estudos 5 e 6 na Tabela 21) . Esses estudos incluíram pacientes com transtorno bipolar I ou II e aqueles com ou sem ciclo rápido. Os pacientes randomizados para SEROQUEL 200mg receberam doses fixas de 300mg ou 600mg uma vez ao dia.
instrumento de classificação primário usado para avaliar os sintomas depressivos nesses estudos foi a Escala de Avaliação de Depressão de Montgomery-Asberg (MADRS), uma escala de classificação clínica de 10 itens com pontuações variando de 0 a 60. O desfecho primário em ambos os estudos foi a mudança de basal na pontuação MADRS na semana 8. Em ambos os estudos, SEROQUEL 50mg foi superior ao placebo na redução da pontuação MADRS. A melhora nos sintomas, medida pela mudança na pontuação MADRS em relação ao placebo, foi observada em ambos os estudos no Dia 8 (semana 1) e em diante. Nesses estudos, nenhum benefício adicional foi observado com a dose de 600 mg. Para o grupo de dose de 300 mg, melhorias estatisticamente significativas em relação ao placebo foram observadas na qualidade de vida geral e satisfação relacionada a várias áreas de funcionamento, conforme medido usando o Q-LES-Q(SF).
Os resultados primários de eficácia desses estudos no tratamento agudo de episódios depressivos associados ao transtorno bipolar em adultos são apresentados na Tabela 21.
Tratamento de manutenção como adjuvante ao lítio ou divalproex
eficácia de SEROQUEL 100mg no tratamento de manutenção do transtorno bipolar I foi estabelecida em 2 estudos controlados por placebo em pacientes (n=1326) que preenchiam os critérios do DSM-IV para transtorno bipolar I (estudos 7 e 8 nas Figuras 1 e 2). Os ensaios incluíram pacientes cujo episódio mais recente foi maníaco, deprimido ou misto, com ou sem características psicóticas. Na fase de rótulo aberto, os pacientes deveriam permanecer estáveis com SEROQUEL mais lítio ou divalproex por pelo menos 12 semanas para serem randomizados. Em média, os pacientes foram estabilizados por 15 semanas. Na fase de randomização, os pacientes continuaram o tratamento com lítio ou divalproato e foram randomizados para receber SEROQUEL (administrado duas vezes ao dia totalizando 400 mg/dia a 800 mg/dia) ou placebo. Aproximadamente 50% dos pacientes descontinuaram o grupo SEROQUEL no dia 280 e 50% do grupo placebo descontinuaram no dia 117 do tratamento duplo-cego. O desfecho primário nesses estudos foi o tempo de recorrência de um evento de humor (episódio maníaco, misto ou depressivo). Um evento de humor foi definido como início de medicação ou hospitalização por um episódio de humor; pontuação YMRS≥20 ou pontuação MADRS≥20 em 2 avaliações consecutivas; ou descontinuação do estudo devido a um evento de humor (Figura 1 e Figura 2).
Em ambos os estudos, SEROQUEL foi superior ao placebo no aumento do tempo de recorrência de qualquer evento de humor. O efeito do tratamento estava presente para aumentar o tempo de recorrência de episódios maníacos e depressivos. O efeito de SEROQUEL foi independente de qualquer subgrupo específico (estabilizador de humor atribuído, sexo, idade, raça, episódio bipolar mais recente ou curso de ciclismo rápido).
Figura 1: Curvas de Kaplan-Meier de Tempo para Recorrência de um Evento de Humor (Estudo 7)
Figura 2: Curvas de Kaplan-Meier de Tempo para Recorrência de um Evento de Humor (Estudo 8)
INFORMAÇÃO DO PACIENTE
SEROQUEL (SER-oh-kwell)(fumarato de quetiapina) Comprimidos
Leia este Guia de Medicação antes de começar a tomar SEROQUEL e cada vez que receber um refil. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou seu tratamento.
Quais são as informações mais importantes que devo saber sobre SEROQUEL?
SEROQUEL 100mg pode causar efeitos colaterais graves, incluindo:
- Converse com seu médico ou com o profissional de saúde de seu familiar sobre:
- todos os riscos e benefícios do tratamento com medicamentos antidepressivos.
- todas as opções de tratamento para depressão ou outra doença mental grave
- Os medicamentos antidepressivos podem aumentar os pensamentos ou ações suicidas em algumas crianças, adolescentes e adultos jovens nos primeiros meses de tratamento.
- Depressão e outras doenças mentais graves são as causas mais importantes de pensamentos e ações suicidas. Algumas pessoas podem ter um risco particularmente alto de ter pensamentos ou ações suicidas. Estes incluem pessoas que têm (ou têm histórico familiar de) depressão, doença bipolar (também chamada de doença maníaco-depressiva) ou pensamentos ou ações suicidas.
- Como posso observar e tentar evitar pensamentos e ações suicidas em mim ou em um membro da família?
- Preste muita atenção a quaisquer mudanças, especialmente mudanças repentinas, de humor, comportamentos, pensamentos ou sentimentos. Isso é muito importante quando um medicamento antidepressivo é iniciado ou quando a dose é alterada.
- Ligue para o profissional de saúde imediatamente para relatar mudanças novas ou repentinas no humor, comportamento, pensamentos ou sentimentos.
- Mantenha todas as visitas de acompanhamento com o profissional de saúde conforme programado. Ligue para o médico entre as visitas, conforme necessário, especialmente se tiver dúvidas sobre os sintomas.
Ligue para um profissional de saúde imediatamente se você ou seu familiar tiver algum dos seguintes sintomas, especialmente se forem novos, piores ou se preocuparem:
- pensamentos sobre suicídio ou morte
- tentativas de suicídio
- depressão nova ou pior
- ansiedade nova ou pior
- sentindo-se muito agitado ou inquieto
- ataques de pânico
- problemas para dormir (insônia)
- irritabilidade nova ou pior
- agindo de forma agressiva, com raiva ou violento
- agindo em impulsos perigosos
- um aumento extremo na atividade e na fala (mania)
- outras mudanças incomuns no comportamento ou humor
O que mais eu preciso saber sobre medicamentos antidepressivos?
- Nunca interrompa um medicamento antidepressivo sem primeiro falar com seu médico. Parar um medicamento antidepressivo de repente pode causar outros sintomas.
- Os antidepressivos são medicamentos usados para tratar a depressão e outras doenças. É importante discutir todos os riscos de tratar a depressão, e também os riscos de não tratá-la. Os pacientes e suas famílias ou outros cuidadores devem discutir todas as opções de tratamento com o profissional de saúde, não apenas o uso de antidepressivos.
- medicamentos antidepressivos têm outros efeitos colaterais. Converse com o médico sobre os efeitos colaterais do medicamento prescrito para você ou seu familiar.
- Medicamentos antidepressivos podem interagir com outros medicamentos. Conheça todos os medicamentos que você ou seu familiar toma. Mantenha uma lista de todos os medicamentos para mostrar ao profissional de saúde. Não inicie novos medicamentos sem primeiro consultar seu médico.
- Nem todos os medicamentos antidepressivos prescritos para crianças são aprovados pela FDA para uso em crianças. Fale com o profissional de saúde do seu filho para obter mais informações.
O que é SEROQUEL 300mg?
SEROQUEL 100mg é um medicamento de prescrição usado para tratar:
- esquizofrenia em pessoas com 13 anos de idade ou mais
- transtorno bipolar em adultos, incluindo:
- episódios depressivos associados ao transtorno bipolar
- episódios maníacos associados ao transtorno bipolar I sozinho ou com lítio ou divalproato
- tratamento a longo prazo do transtorno bipolar I com lítio ou divalproato
- episódios maníacos associados ao transtorno bipolar I em crianças de 10 a 17 anos
Não se sabe se SEROQUEL 100mg é seguro e eficaz em crianças menores de 10 anos de idade.
O que devo dizer ao meu médico antes de tomar SEROQUEL 100mg?
Antes de tomar SEROQUEL 200mg, informe o seu médico se você tem ou teve:
- diabetes ou açúcar elevado no sangue em você ou sua família. Seu médico deve verificar seu nível de açúcar no sangue antes de iniciar SEROQUEL 300mg, e também durante o tratamento.
- níveis elevados de colesterol total, triglicerídeos ou colesterol LDL, ou níveis baixos de colesterol HDL
- pressão arterial baixa ou alta
- baixa contagem de glóbulos brancos
- catarata
- convulsões
- testes de tireóide anormais
- altos níveis de prolactina
- Problemas cardíacos
- problemas de fígado
- qualquer outra condição médica
- gravidez ou planos de engravidar. Não se sabe se SEROQUEL 100mg prejudicará o feto.
- Se você engravidar enquanto estiver recebendo SEROQUEL, converse com seu médico sobre o registro no Registro Nacional de Gravidez para Antipsicóticos Atípicos. Você pode se registrar ligando para 1-866-961-2388 ou acesse http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- amamentando ou planeja amamentar. SEROQUEL pode passar para o leite materno. Converse com seu médico sobre a melhor maneira de alimentar seu bebê se você receber SEROQUEL.
- se você tem ou teve uma condição em que não consegue esvaziar completamente a bexiga (retenção urinária), tem próstata aumentada, constipação ou aumento da pressão dentro dos olhos.
Informe o profissional de saúde sobre todos os medicamentos que você toma ou tomou recentemente incluindo medicamentos prescritos, medicamentos de venda livre, suplementos de ervas e vitaminas.
SEROQUEL 300mg e outros medicamentos podem afetar uns aos outros causando efeitos colaterais graves. SEROQUEL 200mg pode afetar o funcionamento de outros medicamentos, e outros medicamentos podem afetar o funcionamento de SEROQUEL 200mg.
Informe o seu médico se estiver fazendo uma triagem de drogas na urina, pois SEROQUEL pode afetar os resultados do seu teste. Diga a quem está fazendo o teste que você está tomando SEROQUEL.
Como devo tomar SEROQUEL?
- Tome SEROQUEL exatamente como seu médico lhe disse para tomá-lo. Não altere a dose você mesmo.
- Tome SEROQUEL 25mg por via oral, com ou sem alimentos.
- Se você achar que precisa parar de SEROQUEL 25mg, converse primeiro com seu médico. Se você parar de tomar SEROQUEL de repente, você pode ter efeitos colaterais como dificuldade para dormir ou dificuldade para manter o sono (insônia), náusea e vômito.
- Se você esquecer de uma dose de SEROQUEL 25mg, tome-a assim que se lembrar. Se estiver perto da próxima dose, pule a dose esquecida. Apenas tome a próxima dose no horário habitual. Não tome 2 doses ao mesmo tempo, a menos que seu médico lhe diga. Se você não tiver certeza sobre sua dosagem, ligue para seu médico.
O que devo evitar ao tomar SEROQUEL 100mg?
- Não conduza, opere máquinas ou faça outras atividades perigosas até saber como SEROQUEL o afeta. SEROQUEL pode causar sonolência.
- Evite ficar superaquecido ou desidratado.
- Não exagere.
- Em clima quente, fique dentro de casa em um local fresco, se possível.
- Fique longe do sol. Não use roupas demais ou pesadas.
- Beba bastante água.
- Não beba álcool enquanto estiver tomando SEROQUEL. Pode piorar alguns efeitos colaterais de SEROQUEL.
Quais são os possíveis efeitos colaterais do SEROQUEL 300mg?
SEROQUEL 200mg pode causar efeitos colaterais graves, incluindo:
- Consulte “Quais são as informações mais importantes que devo saber sobre SEROQUEL 200mg?”
- acidente vascular cerebral que pode levar à morte pode acontecer em idosos com demência que tomam medicamentos como SEROQUEL
- síndrome neuroléptica maligna (SNM). A SNM é uma condição rara, mas muito grave, que pode ocorrer em pessoas que tomam medicamentos antipsicóticos, incluindo SEROQUEL. NMS pode causar a morte e deve ser tratado em um hospital. Ligue para o seu médico imediatamente se ficar gravemente doente e tiver alguns ou todos estes sintomas:
- febre alta
- suor excessivo
- músculos rígidos
- confusão
- alterações na respiração, batimentos cardíacos e pressão arterial
- cai pode acontecer em algumas pessoas que tomam SEROQUEL. Essas quedas podem causar ferimentos graves.
- açúcar elevado no sangue (hiperglicemia). Açúcar elevado no sangue pode acontecer se você já tem diabetes ou se nunca teve diabetes. Açúcar elevado no sangue pode levar a:
- acúmulo de ácido no sangue devido a cetonas (cetoacidose)
- coma
- morte
Aumentos de açúcar no sangue podem ocorrer em algumas pessoas que tomam SEROQUEL. Açúcar no sangue extremamente alto pode levar ao coma ou à morte. Se você tem diabetes ou fatores de risco para diabetes (como excesso de peso ou histórico familiar de diabetes), seu médico deve verificar seu nível de açúcar no sangue antes de iniciar SEROQUEL 50mg e durante o tratamento. Ligue para o seu médico se tiver algum destes sintomas de açúcar elevado no sangue (hiperglicemia) enquanto estiver tomando SEROQUEL:
- sinto muita sede
- necessidade de urinar mais do que o habitual
- sinto muita fome
- sentir-se fraco ou cansado
- sentir-se mal do estômago
- sente-se confuso ou seu hálito cheira a fruta
- níveis elevados de gordura no sangue (colesterol e triglicéridos aumentados). Níveis elevados de gordura podem ocorrer em pessoas tratadas com SEROQUEL. Você pode não ter nenhum sintoma, então seu médico pode decidir verificar seu colesterol e triglicerídeos durante o tratamento com SEROQUEL.
- aumento de peso (ganho de peso). ganho de peso é comum em pessoas que tomam SEROQUEL, então você e seu médico devem verificar seu peso regularmente. Converse com seu médico sobre maneiras de controlar o ganho de peso, como comer uma dieta saudável e equilibrada e se exercitar.
- movimentos que você não pode controlar em seu rosto, língua ou outras partes do corpo (discinesia tardia). Estes podem ser sinais de uma doença grave. A discinesia tardia pode não desaparecer, mesmo se você parar de tomar SEROQUEL. A discinesia tardia também pode começar após você parar de tomar SEROQUEL.
- diminuição da pressão arterial (hipotensão ortostática), incluindo tonturas ou desmaios causados por uma mudança repentina na frequência cardíaca e pressão arterial ao subir muito rapidamente de uma posição sentada ou deitada.
- aumento da pressão arterial em crianças e adolescentes. Seu médico deve verificar a pressão arterial em crianças e adolescentes antes de iniciar SEROQUEL e durante o tratamento.
- baixa contagem de glóbulos brancos. Informe o seu médico o mais rápido possível se tiver febre, sintomas semelhantes aos da gripe ou qualquer outra infecção, pois isso pode ser resultado de uma contagem muito baixa de glóbulos brancos. Seu médico pode verificar seu nível de glóbulos brancos para determinar se é necessário mais tratamento ou outra ação.
- catarata
- convulsões
- testes anormais da tireoide. Seu médico pode fazer exames de sangue para verificar seu nível de hormônio da tireoide.
- aumento dos níveis de prolactina
- sonolência, sonolência, sensação de cansaço, dificuldade em pensar e fazer atividades normais
- aumento da temperatura corporal
- dificuldade em engolir
- dificuldade em dormir ou dificuldade em manter o sono (insónia), náuseas ou vómitos se parar subitamente de tomar SEROQUEL. Esses sintomas geralmente melhoram 1 semana depois de começar a tê-los.
Os efeitos colaterais mais comuns de SEROQUEL 50mg incluem:
Em Adultos:
- sonolência
- queda repentina na pressão arterial ao ficar em pé
- ganho de peso
- lentidão
- testes anormais do fígado
- dor de estômago
- boca seca
- tontura
- fraqueza
- dor abdominal
- constipação
- dor de garganta
Em Crianças e Adolescentes:
- sonolência
- tontura
- fadiga
- náusea
- boca seca
- ganho de peso
- aumento do apetite
- vômito
- batimento cardíaco acelerado
Estes não são todos os possíveis efeitos colaterais do SEROQUEL. Para mais informações, pergunte ao seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
Como devo armazenar o SEROQUEL 100mg?
- Armazenar SEROQUEL 100mg em temperatura ambiente, entre 20°C e 25°C (68°F a 77°F).
- Mantenha SEROQUEL e todos os medicamentos fora do alcance das crianças.
Informações gerais sobre o uso seguro e eficaz de SEROQUEL
Os medicamentos às vezes são prescritos para outros fins que não os listados em um Guia de Medicamentos. Não use SEROQUEL para uma condição para a qual não foi prescrito. Não dê SEROQUEL a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este Guia de Medicação resume as informações mais importantes sobre SEROQUEL. Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu farmacêutico ou profissional de saúde informações sobre SEROQUEL 100mg que foi escrito para profissionais de saúde.
Para mais informações, acesse www.SEROQUEL.com ou ligue para 1-800-236-9933.
Quais são os ingredientes de SEROQUEL 200mg?
Ingrediente ativo: fumarato de quetiapina
Ingredientes inativos: povidona, fosfato dicálcico dibásico dihidratado, celulose microcristalina, glicolato de amido sódico, lactose monohidratada, estearato de magnésio, hipromelose, polietilenoglicol e dióxido de titânio. Os comprimidos de 25 mg contêm óxido férrico vermelho e amarelo. Os comprimidos de 100 mg e 400 mg contêm apenas óxido férrico amarelo.
Este Guia de Medicação foi aprovado pela Food and Drug Administration dos EUA.
