Augmentin 250/125mg, 500/125mg, 750/250mg, 875/125mg Clavulanate Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Augmentin 875mg e como é usado?
Augmentin 250mg é um medicamento de prescrição usado para tratar os sintomas de muitas infecções diferentes causadas por bactérias, como infecções do trato respiratório inferior, doença pulmonar obstrutiva crônica, sinusite bacteriana, feridas por mordidas de animais/humanos e infecções de pele. Augmentin 125mg pode ser usado sozinho ou com outros medicamentos.
- Augmentin é uma penicilina, amino.
Quais são os possíveis efeitos colaterais do Augmentin?
Augmentin 750mg pode causar efeitos colaterais graves, incluindo:
- dor de estômago severa,
- diarreia aquosa ou sanguinolenta,
- pele pálida ou amarelada,
- urina de cor escura,
- febre,
- confusão,
- fraqueza,
- perda de apetite,
- dor de estômago superior,
- amarelecimento da pele ou dos olhos (icterícia),
- hematomas ou sangramentos fáceis,
- pouca ou nenhuma micção,
- dor de garganta,
- inchaço no rosto ou na língua,
- queimando em seus olhos,
- dor na pele seguida por uma erupção cutânea vermelha ou roxa que se espalha (no rosto ou na parte superior do corpo) com bolhas e descamação
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Augmentin incluem:
- náusea,
- diarréia,
- coceira ou corrimento vaginal,
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Augmentin. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
AUGMENTIN 500mg é uma combinação antibacteriana oral que consiste em amoxicilina e o inibidor de beta-lactamase, clavulanato de potássio (o sal de potássio do ácido clavulânico).
A amoxicilina é um análogo da ampicilina, derivado do núcleo básico da penicilina, o ácido 6 aminopenicilânico. A fórmula molecular da amoxicilina é C16H19N3O5S•3H2O e o peso molecular é 419,46. Quimicamente, a amoxicilina é (2S,5R,6R)-6-[(R)-(-)-2-Amino-2-(p-hidroxifenil)acetamido]-3,3-dimetil-7-oxo-4-tia Trihidrato de ácido -1-azabiciclo[3.2.0]heptano-2-carboxílico e pode ser representado estruturalmente como:
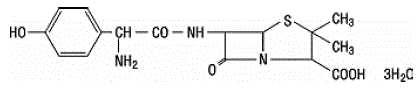
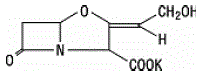
ácido clavulânico é produzido pela fermentação de Streptomyces clavuligerus. É um beta-lactâmico estruturalmente relacionado às penicilinas e possui a capacidade de inativar algumas beta-lactamases bloqueando os sítios ativos dessas enzimas. A fórmula molecular do clavulanato de potássio é C8H8KNO5 e o peso molecular é 237,25. Quimicamente, clavulanato de potássio é potássio (Z)(2R,5R)-3-(2-hidroxietilideno)-7-oxo-4-oxa-1-azabiciclo[3.2.0]-heptano-2-carboxilato e pode ser representado estruturalmente Como:
Ingredientes inativos
- Comprimidos- Dióxido de silício coloidal, hipromelose, estearato de magnésio, celulose microcristalina, polietilenoglicol, glicolato de amido sódico e dióxido de titânio. Cada comprimido de AUGMENTIN contém 0,63 mEq de potássio.
- Pó para Suspensão Oral - Dióxido de silício coloidal, aromatizantes, goma xantana e um ou mais dos seguintes: hipromelose, manitol, sílica gel, dióxido de silício, ácido succínico, sacarina sódica e aspartame. [Vejo AVISOS E PRECAUÇÕES ]
- Comprimidos mastigáveis - Dióxido de silício coloidal, aromatizantes, estearato de magnésio, manitol e um ou mais dos seguintes: D&C Amarelo Nº 10, FD&C Vermelho Nº 40, glicina, sacarina sódica e aspartame. [Vejo AVISOS E PRECAUÇÕES]
- Cada comprimido mastigável de 125 mg e cada 5 mL de suspensão oral reconstituída de 125/5 mL de AUGMENTIN 750 mg contém 0,16 mEq de potássio
- Cada comprimido mastigável de 250 mg e cada 5 mL de suspensão oral reconstituída de 250/5 mL de AUGMENTIN contém 0,32 mEq de potássio
- Cada comprimido mastigável de 200 mg e cada 5 mL de suspensão oral reconstituída de 200/5 mL de AUGMENTIN contém 0,14 mEq de potássio
- Cada comprimido mastigável de 400 mg e cada 5 mL de suspensão oral reconstituída de 400/5 mL de AUGMENTIN 500 mg contém 0,29 mEq de potássio
INDICAÇÕES
Para reduzir o desenvolvimento de bactérias resistentes aos medicamentos e manter a eficácia de AUGMENTIN (amoxicilina/clavulanato de potássio) e outros medicamentos antibacterianos, AUGMENTIN 500mg deve ser usado apenas para tratar infecções comprovadas ou fortemente suspeitas de serem causadas por bactérias suscetíveis. Quando as informações de cultura e suscetibilidade estiverem disponíveis, elas devem ser consideradas na seleção ou modificação da terapia antibacteriana. Na ausência de tais dados, a epidemiologia local e os padrões de suscetibilidade podem contribuir para a seleção empírica da terapia.
AUGMENTIN® é uma combinação de antibacteriano da classe da penicilina e inibidor de beta-lactamase indicado no tratamento de infecções causadas por isolados sensíveis da bactéria designada nas condições listadas abaixo*:
Infecções do Trato Respiratório Inferior
Causada por isolados produtores de beta lactamase de Haemophilus influenzae e Moraxella catarrhalis.
Otite Média Bacteriana Aguda
Causada por isolados produtores de beta lactamase de H. influenzae e M. catarrhalis.
Sinusite
Causada por isolados produtores de beta lactamase de H. influenzae e M. catarrhalis.
Infecções da pele e da estrutura da pele
Causada por isolados produtores de beta lactamase das espécies Staphylococcus aureus, Escherichia coli e Klebsiella.
Infecções do trato urinário
Causada por isolados produtores de beta lactamase de E. coli, espécies de Klebsiella e espécies de Enterobacter.
Limitações de uso
Quando os resultados do teste de suscetibilidade mostram suscetibilidade à amoxicilina, indicando ausência de produção de beta-lactamase, AUGMENTIN não deve ser usado.
DOSAGEM E ADMINISTRAÇÃO
AUGMENTIN 875mg pode ser tomado independentemente das refeições; entretanto, a absorção de clavulanato de potássio é aumentada quando AUGMENTIN 250mg é administrado no início de uma refeição. Para minimizar o potencial de intolerância gastrointestinal, AUGMENTIN 125mg deve ser tomado no início de uma refeição.
Adultos
dose habitual para adultos é um comprimido de 500 mg de AUGMENTIN a cada 12 horas ou um comprimido de 250 mg de AUGMENTIN 125 mg a cada 8 horas. Para infecções mais graves e infecções do trato respiratório, a dose deve ser um comprimido de 875 mg de AUGMENTIN 875 mg a cada 12 horas ou um comprimido de 500 mg de AUGMENTIN a cada 8 horas. Os adultos com dificuldade em engolir podem receber a suspensão de 125 mg/5 mL ou 250 mg/5 mL no lugar do comprimido de 500 mg. A suspensão de 200 mg/5 mL ou a suspensão de 400 mg/5 mL podem ser usadas no lugar do comprimido de 875 mg.
Dois comprimidos de AUGMENTIN de 250 mg não devem ser substituídos por um comprimido de AUGMENTIN de 500 mg. Como os comprimidos de 250 mg e 500 mg de AUGMENTIN contêm a mesma quantidade de ácido clavulânico (125 mg, que o sal de potássio), dois comprimidos de 250 mg não são equivalentes a um comprimido de 500 mg de AUGMENTIN.
comprimido de 250 mg de AUGMENTIN e o comprimido mastigável de 250 mg não devem ser substituídos, pois não são intercambiáveis. O comprimido de 250 mg de AUGMENTIN 250 mg e o comprimido mastigável de 250 mg não contêm a mesma quantidade de ácido clavulânico (que o sal de potássio). O comprimido de 250 mg de AUGMENTIN contém 125 mg de ácido clavulânico, enquanto o comprimido mastigável de 250 mg contém 62,5 mg de ácido clavulânico.
Pacientes pediátricos
Com base no componente amoxicilina, AUGMENTIN deve ser administrado da seguinte forma:
Recém-nascidos e bebês com idade
A dose recomendada de AUGMENTIN é de 30 mg/kg/dia dividida a cada 12 horas, com base no componente amoxicilina. A experiência com a formulação de 200 mg/5 mL nessa faixa etária é limitada e, portanto, recomenda-se o uso da suspensão oral de 125 mg/5 mL.
Pacientes com 12 semanas (3 meses) e mais velhos
Consulte os regimes de dosagem fornecidos na Tabela 1. O regime a cada 12 horas é recomendado, pois está associado a significativamente menos diarreia [consulte Estudos clínicos ]. No entanto, a suspensão a cada 12 horas (200 mg/5 mL e 400 mg/5 mL) e os comprimidos mastigáveis (200 mg e 400 mg) contêm aspartame e não devem ser usados por fenilcetonúricos. [Vejo AVISOS E PRECAUÇÕES ]
Pacientes com peso igual ou superior a 40 kg
Os doentes pediátricos com peso igual ou superior a 40 kg devem ser administrados de acordo com as recomendações dos adultos.
O comprimido de 250 mg de AUGMENTIN não deve ser usado até que a criança pese pelo menos 40 kg, devido às diferentes proporções de amoxicilina para ácido clavulânico no comprimido de 250 mg de AUGMENTIN (250/125) versus o comprimido mastigável de 250 mg de AUGMENTIN. AUMENTAR (250/62,5).
Pacientes com Insuficiência Renal
Pacientes com insuficiência renal geralmente não necessitam de redução da dose, a menos que a insuficiência seja grave. Pacientes com insuficiência renal com taxa de filtração glomerular
Pacientes em hemodiálise devem receber 500 mg ou 250 mg a cada 24 horas, dependendo da gravidade da infecção. Eles devem receber uma dose adicional durante e no final da diálise.
Instruções para Misturar Suspensão Oral
Prepare uma suspensão no momento da distribuição da seguinte forma: Bata no frasco até que todo o pó flua livremente. Adicione aproximadamente 2/3 da quantidade total de água para reconstituição (ver Tabela 2 abaixo) e agite vigorosamente para suspender o pó. Adicione o restante da água e agite novamente vigorosamente.
Observação: Agite bem a suspensão oral antes de usar. A suspensão reconstituída deve ser armazenada sob refrigeração e descartada após 10 dias.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Comprimidos
- Comprimidos de 250 mg/125 mg: Cada comprimido revestido por película branco oval, gravado com AUGMENTIN 750 mg de um lado e 250/125 do outro lado, contém 250 mg de amoxicilina e 125 mg de ácido clavulânico como sal de potássio.
- Comprimidos de 500 mg/125 mg: Cada comprimido revestido por película branco oval, gravado com AUGMENTIN 125 mg de um lado e 500/125 do outro lado, contém 500 mg de amoxicilina e 125 mg de ácido clavulânico como sal de potássio.
- Comprimidos de 875 mg/125 mg: Cada comprimido branco em forma de cápsula, gravado com AUGMENTIN 875 de um lado e sulcado do outro lado, contém 875 mg de amoxicilina e 125 mg de ácido clavulânico como sal de potássio.
Pó para Suspensão Oral
- 125 mg/31,25 mg por 5 mL: Pó sabor banana para suspensão oral (cada 5 mL de suspensão reconstituída contém 125 mg de amoxicilina e 31,25 mg de ácido clavulânico como sal de potássio).
- 200 mg/28,5 mg por 5 mL: Pó de laranja para suspensão oral (cada 5 mL de suspensão reconstituída contém 200 mg de amoxicilina e 28,5 mg de ácido clavulânico como sal de potássio).
- 250 mg/62,5 mg por 5 mL: Pó para suspensão oral com sabor a laranja (cada 5 mL de suspensão reconstituída contém 250 mg de amoxicilina e 62,5 mg de ácido clavulânico como sal de potássio).
- 400 mg/57 mg por 5 mL Pó para suspensão oral sabor laranja (cada 5 mL de suspensão reconstituída contém 400 mg de amoxicilina e 57,0 mg de ácido clavulânico como sal de potássio).
Comprimidos mastigáveis
- Comprimidos mastigáveis de 125 mg/31,25 mg: Cada comprimido mosqueado amarelo, redondo, com sabor a lima-limão, gravado com BMP 189 contém 125 mg de amoxicilina e 31,25 mg de ácido clavulânico como sal de potássio.
- Comprimidos mastigáveis de 200 mg/28,5 mg: Cada comprimido mosqueado, redondo, biconvexo com sabor de cereja e banana, gravado com AUGMENTIN 200 contém 200 mg de amoxicilina e 28,5 mg de ácido clavulânico como sal de potássio.
- Comprimidos mastigáveis de 250 mg/62,5 mg: Cada comprimido amarelo mosqueado, redondo, com sabor a lima-limão, gravado com BMP 190 contém 250 mg de amoxicilina e 62,5 mg de ácido clavulânico como sal de potássio.
- Comprimidos mastigáveis de 400 mg/57 mg: Cada comprimido mosqueado, redondo, biconvexo com sabor de cereja e banana, gravado com AUGMENTIN 400 contém 400 mg de amoxicilina e 57,0 mg de ácido clavulânico como sal de potássio.
O comprimido de 250 mg de AUGMENTIN 750 mg e o comprimido mastigável de 250 mg NÃO devem ser substituídos, pois não são intercambiáveis e o comprimido de 250 mg não deve ser usado em crianças com peso inferior a 40 kg. O comprimido de 250 mg de AUGMENTIN e o comprimido mastigável de 250 mg não contêm a mesma quantidade de ácido clavulânico. O comprimido de 250 mg de AUGMENTIN contém 125 mg de ácido clavulânico, enquanto o comprimido mastigável de 250 mg contém 62,5 mg de ácido clavulânico.
Dois comprimidos de 250 mg de AUGMENTIN 750 mg NÃO devem ser substituídos por um comprimido de 500 mg de AUGMENTIN. Uma vez que os comprimidos de 250 mg e 500 mg de AUGMENTIN contêm a mesma quantidade de ácido clavulânico (125 mg, que o sal de potássio), dois comprimidos de 250 mg de AUGMENTIN 750 mg não são equivalentes a um comprimido de 500 mg de AUGMENTIN.
Armazenamento e manuseio
Comprimidos
Comprimidos de 250 mg/125 mg: Cada comprimido revestido por película branco oval, gravado com AUGMENTIN 750mg de um lado e 250/125 do outro lado, contém 250 mg de amoxicilina como tri-hidrato e 125 mg de ácido clavulânico como sal de potássio.
NDC 43598-018-30 garrafas de 30 NDC 43598-018-78 Dose Unitária (10x10) 100 comprimidos
Comprimidos de 500 mg/125 mg: Cada comprimido revestido por película branco oval, gravado com AUGMENTIN de um lado e 500/125 do outro lado, contém 500 mg de amoxicilina como tri-hidrato e 125 mg de ácido clavulânico como sal de potássio.
NDC 43598-006-14 garrafas de 20 NDC 43598-006-78 Dose Unitária (10x10) 100 comprimidos
Comprimidos de 875 mg/125 mg: Cada comprimido branco ranhurado em forma de cápsula, gravado com AUGMENTIN 875 em um lado e ranhurado no outro lado, contém 875 mg de amoxicilina como o tri-hidrato e 125 mg de ácido clavulânico como o sal de potássio.
NDC 43598-021-14 garrafas de 20 NDC 43598-021-78 Dose unitária (10x10) 100 comprimidos
Pó para suspensão oral: 125 mg/31,25 mg por 5 mL: Pó sabor banana para suspensão oral (cada 5 mL de suspensão reconstituída contém 125 mg de amoxicilina e 31,25 mg de ácido clavulânico como sal de potássio).
NDC 43598-012-51 frasco de 75 mL NDC 43598-012-52 frasco de 100 mL NDC 43598-012-53 frasco de 150 mL
200 mg/28,5 mg por 5 mL: Pó de laranja para suspensão oral (cada 5 mL de suspensão reconstituída contém 200 mg de amoxicilina e 28,5 mg de ácido clavulânico como sal de potássio).
NDC 43598-013-50 Frasco de 50 mL NDC 43598-013-51 frasco de 75 mL NDC 43598-013-52 frasco de 100 mL
250 mg/62,5 mg por 5 mL: Pó para suspensão oral com sabor a laranja (cada 5 mL de suspensão reconstituída contém 250 mg de amoxicilina e 62,5 mg de ácido clavulânico como sal de potássio).
NDC 43598-004-51 frasco de 75 mL NDC 43598-004-52 frasco de 100 mL NDC 43598-004-53 frasco de 150 mL
400 mg/57 mg por 5 mL Pó para suspensão oral sabor laranja (cada 5 mL de suspensão reconstituída contém 400 mg de amoxicilina e 57,0 mg de ácido clavulânico como sal de potássio).
NDC 43598-008-50 Frasco de 50 mL NDC 43598-008-51 frasco de 75 mL NDC 43598-008-52 frasco de 100 mL
Comprimidos mastigáveis: Comprimidos mastigáveis de 125 mg/31,25 mg: Cada comprimido amarelo mosqueado, redondo, sabor limão-limão, gravado com BMP 189, contém 125 mg de amoxicilina e 31,25 mg de ácido clavulânico como sal de potássio.
NDC 43598-014-31 embalagem de 30 (5x6) comprimidos
Comprimidos mastigáveis de 200 mg/28,5 mg: Cada comprimido mosqueado rosa, redondo, biconvexo, sabor banana cereja, gravado com AUGMENTIN 200, contém 200 mg de amoxicilina e 28,5 mg de ácido clavulânico como sal de potássio.
NDC 43598-015-14 embalagem de 20 comprimidos
Comprimidos mastigáveis de 250 mg/62,5 mg: Cada comprimido mosqueado amarelo, redondo, com sabor a lima-limão, gravado com BMP 190, contém 250 mg de amoxicilina e 62,5 mg de ácido clavulânico como sal de potássio.
NDC 43598-016-31 embalagem de 30 (5x6) comprimidos
Comprimidos mastigáveis de 400 mg/57 mg: Cada comprimido mosqueado, redondo, biconvexo, sabor banana cereja, gravado com AUGMENTIN 400, contém 400 mg de amoxicilina e 57,0 mg de ácido clavulânico como sal de potássio.
NDC 43598-017-14 embalagem de 20 comprimidos
Dispensar no recipiente original.
Armazene os comprimidos e o pó seco a uma temperatura igual ou inferior a 25°C (77°F).
Armazenar a suspensão reconstituída sob refrigeração. Descarte a suspensão não utilizada após 10 dias. Manter fora do alcance das crianças.
REFERÊNCIAS
1. Swanson-Biearman B, Dean BS, Lopez G, Krenzelok EP. Os efeitos da ingestão de penicilina e cefalosporina em crianças menores de seis anos de idade.Vet Hum Toxicol. 1988; 30: 66 67.
2. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Métodos para Testes de Susceptibilidade Antimicrobiana de Diluição para Bactérias que Crescem Aerobicamente; Norma Aprovada – 8ª. Documento CLSI M7-A9. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
3. Instituto de Padrões Clínicos e Laboratoriais (CLSI). Padrão de Desempenho para Testes de Susceptibilidade de Disco Antimicrobiano; Padrão Aprovado – 11º. Documento CLSI M2-A11. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
4. CLSI. Padrões de Desempenho para Testes de Susceptibilidade Antimicrobiana: 22º Suplemento Informativo. Documento CLSI M100-S22. CLSI, Wayne, PA, 2012.
Distribuído por: Dr. Reddy's Laboratories Inc.Bridgewater, NJ 08807. Revisado: março de 2013
EFEITOS COLATERAIS
Os itens a seguir são discutidos com mais detalhes em outras seções da rotulagem:
- Reações anafiláticas [ver AVISOS E PRECAUÇÕES ]
- Disfunção hepática [ver AVISOS E PRECAUÇÕES ]
- CDAD [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaio Clínico
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
As reações adversas mais frequentemente notificadas foram diarreia/fezes moles (9%), náuseas (3%), erupções cutâneas e urticária (3%), vómitos (1%) e vaginite (1%). Menos de 3% dos pacientes descontinuaram a terapia devido a reações adversas relacionadas ao medicamento. A incidência global de reações adversas e, em particular, diarreia, aumentou com a dose mais elevada recomendada. Outras reações adversas relatadas com menos frequência (
Em pacientes pediátricos (2 meses a 12 anos), foi realizado 1 ensaio clínico nos EUA/Canadá que comparou 45/6,4 mg/kg/dia (dividido a cada 12 horas) de AUGMENTIN por 10 dias versus 40/10 mg/kg/dia (dividido a cada 8 horas) de AUGMENTIN 125mg por 10 dias no tratamento de otite média aguda. Um total de 575 pacientes foram inscritos e apenas as formulações de suspensão foram usadas neste estudo. Em geral, as reações adversas observadas foram comparáveis às observadas acima; no entanto, houve diferenças nas taxas de diarreia, erupções cutâneas/urticária e erupções na área da fralda. [Ver Estudos clínicos ]
Experiência pós-marketing
Além das reações adversas relatadas em ensaios clínicos, as seguintes reações foram identificadas durante o uso pós-comercialização de AUGMENTIN. Por serem relatados voluntariamente por uma população de tamanho desconhecido, não é possível fazer estimativas de frequência. Esses eventos foram escolhidos para inclusão devido a uma combinação de sua gravidade, frequência de notificação ou potencial conexão causal com AUGMENTIN.
Gastrointestinal
Indigestão, gastrite, estomatite, glossite, língua preta “peluda”, candidíase mucocutânea, enterocolite e colite hemorrágica/pseudomembranosa. O início dos sintomas de colite pseudomembranosa pode ocorrer durante ou após o tratamento com antibióticos. [Vejo AVISOS E PRECAUÇÕES ]
Reações de hipersensibilidade
Prurido, angioedema, reações semelhantes à doença do soro (urticária ou erupção cutânea acompanhada de artrite, artralgia, mialgia e frequentemente febre), eritema multiforme, síndrome de Stevens Johnson, pustulose exantematosa generalizada aguda, vasculite de hipersensibilidade e casos de dermatite esfoliativa (incluindo epidérmica tóxica necrólise) foram relatados. [Vejo AVISOS E PRECAUÇÕES ]
Fígado
Disfunção hepática, incluindo hepatite e icterícia colestática, aumento das transaminases séricas (AST e/ou ALT), bilirrubina sérica e/ou fosfatase alcalina, foi relatada com AUGMENTIN. Tem sido relatada mais comumente em idosos, em homens ou em pacientes em tratamento prolongado. Os achados histológicos na biópsia hepática consistiram em tratamento predominantemente colestático. Os achados histológicos na biópsia hepática consistiram em alterações hepatocelulares predominantemente colestáticas, hepatocelulares ou colestáticas mistas. O aparecimento de sinais/sintomas de disfunção hepática pode ocorrer durante ou várias semanas após a descontinuação da terapia. A disfunção hepática, que pode ser grave, geralmente é reversível. As mortes foram relatadas. [Vejo CONTRA-INDICAÇÕES , AVISOS E PRECAUÇÕES ]
Renal
Nefrite intersticial, hematúria e cristalúria foram relatadas. [Vejo SOBREDOSAGEM ]

Sistemas Hemicos e Linfáticos
Anemia, incluindo anemia hemolítica, trombocitopenia, púrpura trombocitopênica, eosinofilia, leucopenia e agranulocitose foram relatadas. Essas reações geralmente são reversíveis com a descontinuação da terapia e acredita-se que sejam fenômenos de hipersensibilidade. Trombocitose foi observada em menos de 1% dos pacientes tratados com AUGMENTIN. Houve relatos de aumento do tempo de protrombina em pacientes recebendo AUGMENTIN 125mg e terapia anticoagulante concomitantemente. [Vejo INTERAÇÕES MEDICAMENTOSAS ]
Sistema nervoso central
Agitação, ansiedade, alterações comportamentais, confusão, convulsões, tonturas, insônia e hiperatividade reversível foram relatados.
Diversos
Descoloração do dente (coloração marrom, amarela ou cinza) foi relatada. A maioria dos relatos ocorreu em pacientes pediátricos. A descoloração foi reduzida ou eliminada com escovação ou limpeza dental na maioria dos casos.
INTERAÇÕES MEDICAMENTOSAS
probenecida
probenecida diminui a secreção tubular renal de amoxicilina, mas não retarda a excreção renal de ácido clavulânico. O uso concomitante com AUGMENTIN 875mg pode resultar em concentrações sanguíneas aumentadas e prolongadas de amoxicilina. A coadministração de probenecida não é recomendada.
Anticoagulantes orais
Prolongamento anormal do tempo de protrombina (aumento da razão normalizada internacional [INR]) foi relatado em pacientes recebendo amoxicilina e anticoagulantes orais. A monitorização apropriada deve ser realizada quando os anticoagulantes são prescritos concomitantemente com AUGMENTIN. Ajustes na dose de anticoagulantes orais podem ser necessários para manter o nível desejado de anticoagulação.
Alopurinol
A administração concomitante de alopurinol e amoxicilina aumenta a incidência de erupções cutâneas em pacientes que recebem ambas as drogas em comparação com pacientes que recebem apenas amoxicilina. Não se sabe se essa potencialização das erupções cutâneas com amoxicilina se deve ao alopurinol ou à hiperuricemia presente nesses pacientes.
Contraceptivos orais
AUGMENTIN 750mg pode afetar a flora intestinal, levando a uma menor reabsorção de estrogênio e redução da eficácia dos contraceptivos orais combinados de estrogênio/progesterona.
Efeitos em testes de laboratório
Altas concentrações de amoxicilina na urina podem resultar em reações falso-positivas ao testar a presença de glicose na urina usando CLINITEST®, Solução de Benedict ou Solução de Fehling. Uma vez que este efeito também pode ocorrer com AUGMENTIN, recomenda-se a utilização de testes de glicose baseados em reações enzimáticas de glicose oxidase.
Após a administração de amoxicilina a mulheres grávidas, observou-se uma diminuição transitória na concentração plasmática de estriol conjugado total, estriol-glicuronídeo, estrona conjugada e estradiol.
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Reações de hipersensibilidade
Reações de hipersensibilidade (anafiláticas) graves e ocasionalmente fatais foram relatadas em pacientes recebendo antibacterianos beta-lactâmicos, incluindo AUGMENTIN. Essas reações são mais prováveis de ocorrer em indivíduos com história de hipersensibilidade à penicilina e/ou história de sensibilidade a múltiplos alérgenos. Antes de iniciar a terapia com AUGMENTIN 250mg, deve-se fazer uma investigação cuidadosa sobre reações de hipersensibilidade anteriores a penicilinas, cefalosporinas ou outros alérgenos. Se ocorrer uma reação alérgica, AUGMENTIN deve ser descontinuado e a terapia apropriada instituída.
Disfunção Hepática
A disfunção hepática, incluindo hepatite e icterícia colestática, tem sido associada ao uso de AUGMENTIN. A toxicidade hepática é geralmente reversível; no entanto, as mortes foram relatadas. A função hepática deve ser monitorada em intervalos regulares em pacientes com insuficiência hepática.
Diarreia Associada a Clostridium Difficile (CDAD)
Diarreia associada a Clostridium difficile (CDAD) foi relatada com o uso de quase todos os agentes antibacterianos, incluindo AUGMENTIN 250mg, e pode variar em gravidade de diarreia leve a colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas A e B que contribuem para o desenvolvimento de CDAD. Cepas produtoras de hipertoxina de C. difficile causam aumento da morbidade e mortalidade, pois essas infecções podem ser refratárias à terapia antimicrobiana e podem requerer colectomia. CDAD deve ser considerado em todos os pacientes que apresentam diarreia após o uso de antibacterianos. É necessário um histórico médico cuidadoso, pois foi relatado que CDAD ocorre mais de 2 meses após a administração de agentes antibacterianos.
Se houver suspeita ou confirmação de CDAD, o uso contínuo de antibacterianos não direcionados contra C. difficile pode precisar ser descontinuado. O manejo adequado de fluidos e eletrólitos, suplementação proteica, tratamento antibacteriano de C. difficile e avaliação cirúrgica devem ser instituídos conforme indicação clínica.
Erupção cutânea em pacientes com mononucleose
Uma alta porcentagem de pacientes com mononucleose que recebem amoxicilina desenvolve uma erupção cutânea eritematosa. Assim, AUGMENTIN não deve ser administrado a pacientes com mononucleose.
Potencial para supercrescimento microbiano
A possibilidade de superinfecções com patógenos fúngicos ou bacterianos deve ser considerada durante a terapia. Se ocorrer superinfecção, amoxicilina/clavulanato de potássio deve ser descontinuado e a terapia apropriada instituída.
Fenilcetonúricos
AUGMENTIN 500mg comprimidos mastigáveis e AUGMENTIN Pó para Solução Oral contêm aspartame que contém fenilalanina. Cada comprimido mastigável de 200 mg de AUGMENTIN 750 mg contém 2,1 mg de fenilalanina; cada comprimido mastigável de 400 mg contém 4,2 mg de fenilalanina; cada 5 mL da suspensão oral de 200 mg/5 mL ou 400 mg/5 mL contém 7 mg de fenilalanina. As outras formulações de AUGMENTIN 875mg não contêm fenilalanina.
Desenvolvimento de bactérias resistentes a drogas
A prescrição de AUGMENTIN 250mg na ausência de uma infecção bacteriana comprovada ou fortemente suspeita é improvável de trazer benefícios ao paciente e aumenta o risco de desenvolvimento de bactérias resistentes aos medicamentos.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Estudos de longa duração em animais não foram realizados para avaliar o potencial carcinogênico.
AUGMENTIN (formulação de proporção 4:1 de amoxicilina:clavulanato) não foi mutagênico no ensaio de mutação bacteriana de Ames e no ensaio de conversão de genes de levedura. AUGMENTIN foi fracamente positivo no ensaio de linfoma de camundongo, mas a tendência de aumento das frequências de mutação neste ensaio ocorreu em doses que também foram associadas à diminuição da sobrevivência celular. AUGMENTIN foi negativo no teste de micronúcleo em camundongos e no ensaio letal dominante em camundongos. O clavulanato de potássio sozinho foi testado no ensaio de mutação bacteriana de Ames e no teste de micronúcleo de camundongo, e foi negativo em cada um desses ensaios.
AUGMENTIN (formulação de amoxicilina:clavulanato na proporção 2:1) em doses orais de até 1.200 mg/kg/dia não teve efeito sobre a fertilidade e o desempenho reprodutivo em ratos. Com base na área de superfície corporal, esta dose de amoxicilina é aproximadamente 4 vezes a dose oral máxima recomendada para humanos adultos (875 mg a cada 12 horas). Para o clavulanato, a dose múltipla é aproximadamente 9 vezes maior do que a dose oral máxima recomendada para humanos adultos (125 mg a cada 8 horas), também com base na área de superfície corporal.
Uso em populações específicas
Gravidez
Efeitos teratogênicos
Gravidez Categoria B. Estudos de reprodução realizados em ratas e camundongos grávidas que receberam AUGMENTIN (formulação de proporção 2:1 de amoxicilina:clavulanato) em doses orais de até 1200 mg/kg/dia não revelaram evidência de dano ao feto devido a AUGMENTIN. As doses de amoxicilina em ratos e camundongos (com base na área de superfície corporal) foram aproximadamente 4 e 2 vezes a dose oral máxima recomendada para humanos adultos (875 mg a cada 12 horas). Para o clavulanato, esses múltiplos de dose foram aproximadamente 9 e 4 vezes a dose oral máxima recomendada para humanos adultos (125 mg a cada 8 horas). No entanto, não existem estudos adequados e bem controlados em mulheres grávidas. Como os estudos de reprodução em animais nem sempre são preditivos da resposta humana, este medicamento deve ser usado durante a gravidez somente se for claramente necessário.
Trabalho e entrega
Os antibióticos orais da classe da ampicilina são pouco absorvidos durante o trabalho de parto. Não se sabe se o uso de amoxicilina/clavulanato de potássio em humanos durante o trabalho de parto ou parto tem efeitos adversos imediatos ou tardios no feto, prolonga a duração do trabalho de parto ou aumenta a probabilidade da necessidade de intervenção obstétrica.
Mães que amamentam
A amoxicilina demonstrou ser excretada no leite humano. O uso de amoxicilina/clavulanato de potássio por lactantes pode levar à sensibilização dos lactentes. Deve-se ter cautela quando amoxicilina/clavulanato de potássio é administrado a uma lactante.
Uso Pediátrico
A segurança e eficácia de AUGMENTIN Pó para Suspensão Oral e Comprimidos Mastigáveis foram estabelecidas em pacientes pediátricos. O uso de AUGMENTIN 125mg em pacientes pediátricos é apoiado por evidências de estudos de AUGMENTIN comprimidos em adultos com dados adicionais de um estudo de AUGMENTIN Pó para Suspensão Oral em pacientes pediátricos de 2 meses a 12 anos com otite média aguda. [Vejo Estudos clínicos ]
Devido ao desenvolvimento incompleto da função renal em recém-nascidos e lactentes, a eliminação da amoxicilina pode ser retardada; a eliminação do clavulanato é inalterada nesta faixa etária. A dosagem de AUGMENTIN 500mg deve ser modificada em pacientes pediátricos com idade DOSAGEM E ADMINISTRAÇÃO ]
Uso Geriátrico
Dos 3.119 pacientes em uma análise de estudos clínicos de AUGMENTIN, 32% tinham ≥65 anos e 14% tinham ≥75 anos. Não foram observadas diferenças gerais na segurança ou eficácia entre esses indivíduos e indivíduos mais jovens, e outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os pacientes mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada.
Este fármaco é conhecido por ser substancialmente excretado pelos rins, e o risco de reações adversas a este fármaco pode ser maior em pacientes com função renal comprometida. Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se ter cuidado na seleção da dose e pode ser útil monitorar a função renal.
Dosagem na Insuficiência Renal
A amoxicilina é eliminada principalmente pelo rim e geralmente é necessário ajuste de dose em pacientes com insuficiência renal grave (TFG Pacientes com Insuficiência Renal para recomendações específicas em pacientes com insuficiência renal.
SOBREDOSAGEM
Em caso de superdosagem, descontinuar a medicação, tratar sintomaticamente e instituir medidas de suporte conforme necessário. Um estudo prospectivo de 51 pacientes pediátricos em um centro de controle de intoxicações sugeriu que superdosagens de menos de 250 mg/kg de amoxicilina não estão associadas a sintomas clínicos significativos1.
Nefrite intersticial resultando em insuficiência renal oligúrica foi relatada em pacientes após superdosagem com amoxicilina/clavulanato de potássio.
Cristalúria, em alguns casos levando a insuficiência renal, também foi relatada após superdosagem de amoxicilina/clavulanato de potássio em pacientes adultos e pediátricos. Em caso de superdosagem, a ingestão adequada de líquidos e a diurese devem ser mantidas para reduzir o risco de cristalúria de amoxicilina/clavulanato de potássio. A insuficiência renal parece ser reversível com a interrupção da administração do medicamento. Níveis sanguíneos elevados podem ocorrer mais facilmente em pacientes com função renal comprometida devido à diminuição da depuração renal de amoxicilina/clavulanato de potássio. A amoxicilina/clavulanato de potássio pode ser removida da circulação por hemodiálise. [Vejo DOSAGEM E ADMINISTRAÇÃO ]
CONTRA-INDICAÇÕES
Reações Graves de Hipersensibilidade
AUGMENTIN é contraindicado em pacientes com histórico de reações de hipersensibilidade graves (por exemplo, anafilaxia ou síndrome de Stevens-Johnson) à amoxicilina, clavulanato ou a outros medicamentos antibacterianos beta-lactâmicos (por exemplo, penicilinas e cefalosporinas).
Icterícia Colestática/Disfunção Hepática
AUGMENTIN 250mg é contraindicado em pacientes com história prévia de icterícia colestática/disfunção hepática associada a AUGMENTIN.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
AUGMENTIN é um medicamento antibacteriano. [Vejo Microbiologia ]
Farmacocinética
Os parâmetros farmacocinéticos médios de amoxicilina e clavulanato de potássio em adultos normais após a administração de AUGMENTIN 250mg comprimidos são mostrados na Tabela 3 e após a administração de AUGMENTIN 250mg Pó para Suspensão Oral e Comprimidos Mastigáveis são mostrados na Tabela 4.
administração oral de 5 mL de 250 mg/5 mL de suspensão de AUGMENTIN ou a dose equivalente de 10 mL de 125 mg/5 mL de suspensão de AUGMENTIN fornece concentrações séricas máximas médias aproximadamente 1 hora após a administração de 6,9 mcg/mL para amoxicilina e 1,6 mcg /mL para ácido clavulânico. As áreas sob as curvas de concentração sérica obtidas durante as primeiras 4 horas após a administração foram 12,6 mcg*h/mL para amoxicilina e 2,9 mcg*h/mL para ácido clavulânico quando 5 mL de 250 mg/5 mL de suspensão de AUGMENTIN ou dose equivalente de 10 mL de 125 mg/5 mL de suspensão de AUGMENTIN foram administrados a adultos normais. Um comprimido mastigável de 250 mg de AUGMENTIN ou dois comprimidos mastigáveis de 125 mg de AUGMENTIN são equivalentes a 5 mL de 250 mg/5 mL de suspensão de AUGMENTIN e fornecem concentrações séricas semelhantes de amoxicilina e ácido clavulânico.
As concentrações séricas de amoxicilina alcançadas com AUGMENTIN 250mg são semelhantes às produzidas pela administração oral de doses equivalentes de amoxicilina isolada. O tempo acima da concentração inibitória mínima de 1 mcg/mL para amoxicilina demonstrou ser semelhante após os regimes de dosagem correspondentes a cada 12 horas e a cada 8 horas de AUGMENTIN 250mg em adultos e crianças.
Absorção
A dosagem no estado de jejum ou alimentado tem efeito mínimo sobre a farmacocinética da amoxicilina. Embora AUGMENTIN possa ser administrado independentemente das refeições, a absorção de clavulanato de potássio quando ingerido com alimentos é maior em relação ao estado de jejum. Em um estudo, a biodisponibilidade relativa do clavulanato foi reduzida quando AUGMENTIN foi administrado 30 e 150 minutos após o início de um café da manhã com alto teor de gordura.
Distribuição
Nenhum dos componentes do AUGMENTIN é altamente ligado às proteínas; o ácido clavulânico liga-se aproximadamente 25% ao soro humano e a amoxicilina liga-se aproximadamente 18%. A amoxicilina difunde-se facilmente na maioria dos tecidos e fluidos corporais, com exceção do cérebro e do fluido espinhal.
Duas horas após a administração oral de uma dose única de 35 mg/kg de suspensão de AUGMENTIN 500 mg em crianças em jejum, foram detectadas concentrações médias de 3 mcg/mL de amoxicilina e 0,5 mcg/mL de ácido clavulânico nos derrames da orelha média.
Metabolismo e Excreção
A meia-vida da amoxicilina após a administração oral de AUGMENTIN 125mg é de 1,3 horas e a do ácido clavulânico é de 1 hora.
Aproximadamente 50% a 70% da amoxicilina e aproximadamente 25% a 40% do ácido clavulânico são excretados inalterados na urina durante as primeiras 6 horas após a administração de um único comprimido de 250 mg ou 500 mg de AUGMENTIN.
Microbiologia
amoxicilina é um antibiótico semissintético com atividade bactericida in vitro contra bactérias Gram-positivas e Gram-negativas. A amoxicilina é, no entanto, suscetível à degradação por beta-lactamases e, portanto, o espectro de atividade não inclui organismos que produzem essas enzimas. O ácido clavulânico é um beta-lactâmico, estruturalmente relacionado às penicilinas, que possui a capacidade de inativar algumas enzimas beta-lactamases comumente encontradas em microrganismos resistentes às penicilinas e cefalosporinas. Em particular, tem boa atividade contra as betalactamases mediadas por plasmídeos, clinicamente importantes, frequentemente responsáveis pela resistência a drogas transferidas.
A formulação de amoxicilina e ácido clavulânico em AUGMENTIN protege a amoxicilina da degradação por algumas enzimas beta-lactamases e estende o espectro antibiótico da amoxicilina para incluir muitas bactérias normalmente resistentes à amoxicilina.
amoxicilina/ácido clavulânico demonstrou ser ativo contra a maioria dos isolados das seguintes bactérias, tanto in vitro quanto em infecções clínicas, conforme descrito na seção INDICAÇÕES E USO.
Bactérias Gram-positivas
Staphylococcus aureus
Bactérias Gram-Negativas
Espécies Enterobacter Escherichia coli Haemophilus influenzae Klebsiella espécies Moraxella catarrhalis
Os seguintes dados in vitro estão disponíveis, mas sua significância clínica é desconhecida . Pelo menos 90 por cento das seguintes bactérias exibem uma concentração inibitória mínima in vitro (CIM) menor ou igual ao ponto de quebra suscetível para amoxicilina/ácido clavulânico. No entanto, a eficácia da amoxicilina/ácido clavulânico no tratamento de infecções clínicas causadas por essas bactérias não foi estabelecido em ensaios clínicos adequados e bem controlados.
Bactérias Gram-positivas
Enterococcus faecalis Staphylococcus epidermidis Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes Grupo Viridans Streptococcus
Bactérias Gram-Negativas
Eikenella corrodens Proteus mirabilis
Bactérias anaeróbicas
Espécies de Bacteroides incluindo Bacteroides fragilis Espécies de Fusobacterium Espécies de Peptostreptococcus
Métodos de teste de suscetibilidade
Quando disponível, o laboratório de microbiologia clínica deve fornecer ao médico os resultados dos testes de suscetibilidade in vitro para medicamentos antimicrobianos usados em hospitais residentes como relatórios periódicos que descrevem o perfil de suscetibilidade de patógenos nosocomiais e adquiridos na comunidade. Esses relatórios devem ajudar o médico a selecionar um medicamento antibacteriano para tratamento.
Técnicas de diluição
Métodos quantitativos são usados para determinar as concentrações inibitórias mínimas antimicrobianas (MICs). Esses MICs fornecem estimativas da suscetibilidade das bactérias aos compostos antimicrobianos. As CIMs devem ser determinadas usando um método de teste padronizado2,3 (caldo e/ou ágar). Os valores de CIM devem ser interpretados de acordo com os critérios fornecidos na Tabela 5.
Técnicas de difusão
Os métodos quantitativos que requerem a medição dos diâmetros das zonas também podem fornecer estimativas reprodutíveis da suscetibilidade das bactérias aos compostos antimicrobianos. O tamanho da zona fornece uma estimativa da suscetibilidade das bactérias aos compostos antimicrobianos. O tamanho da zona deve ser determinado usando um método de teste padronizado3,4. Este procedimento utiliza discos de papel impregnados com 30 mcg de amoxicilina/ácido clavulânico (20 mcg de amoxicilina mais 10 mcg de ácido clavulânico) para testar a suscetibilidade das bactérias à amoxicilina/ácido clavulânico. Os critérios interpretativos de difusão de disco são fornecidos na Tabela 5.
Controle de qualidade
Procedimentos padronizados de teste de suscetibilidade requerem o uso de controles laboratoriais para monitorar e garantir a exatidão e precisão dos insumos e reagentes usados no ensaio, e as técnicas dos indivíduos que realizam o teste2,3,4. O pó padrão de amoxicilina/ácido clavulânico deve fornecer a seguinte faixa de valores de CIM observados na Tabela 6 para a técnica de difusão usando o disco de 30 mcg de amoxicilina/ácido clavulânico (20 mcg de amoxicilina mais 10 mcg de ácido clavulânico), os critérios na Tabela 6 devem ser alcançados .
Estudos clínicos
Infecções do Trato Respiratório Inferior e Infecções Complicadas do Trato Urinário
Dados de 2 estudos principais em 1.191 pacientes tratados para infecções do trato respiratório inferior ou infecções complicadas do trato urinário compararam um regime de comprimidos de 875 mg de AUGMENTIN a cada 12 horas com comprimidos de 500 mg de AUGMENTIN 125 mg administrados a cada 8 horas (584 e 607 pacientes, respectivamente ). A eficácia comparável foi demonstrada entre os regimes de dosagem a cada 12 horas e a cada 8 horas. Não houve diferença significativa na porcentagem de eventos adversos em cada grupo. O evento adverso mais frequentemente relatado foi diarreia; as taxas de incidência foram semelhantes para os regimes de dosagem de 875 mg a cada 12 horas e 500 mg a cada 8 horas (15% e 14%, respectivamente); no entanto, houve diferença estatisticamente significativa (p
Em um desses estudos principais, pacientes com pielonefrite (n = 361) ou infecção complicada do trato urinário (ou seja, pacientes com anormalidades do trato urinário que predispõem à recidiva da bacteriúria após a erradicação, n = 268) foram randomizados (1: 1) receber comprimidos de 875 mg de AUGMENTIN 125 mg a cada 12 horas (n=308) ou comprimidos de 500 mg de AUGMENTIN a cada 8 horas (n=321).
O número de pacientes bacteriologicamente avaliáveis foi comparável entre os dois regimes de dosagem. AUGMENTIN 250mg produziu taxas de sucesso bacteriológico comparáveis em pacientes avaliados 2 a 4 dias imediatamente após o término da terapia. As taxas de eficácia bacteriológica foram comparáveis em uma das visitas de acompanhamento (5 a 9 dias após a terapia) e em uma visita tardia após a terapia (na maioria dos casos, isso ocorreu de 2 a 4 semanas após a terapia), conforme visto na Tabela 7.
Como observado anteriormente, embora não tenha havido diferença significativa na porcentagem de eventos adversos em cada grupo, houve uma diferença estatisticamente significativa nas taxas de diarreia grave ou retiradas com diarreia entre os regimes.
Otite média bacteriana aguda e diarreia em pacientes pediátricos
Foi realizado um ensaio clínico nos EUA/Canadá que comparou 45/6,4 mg/kg/dia (dividido a cada 12 horas) de AUGMENTIN por 10 dias versus 40/10 mg/kg/dia (dividido a cada 8 horas) de AUGMENTIN por 10 dias em tratamento da otite média aguda. Apenas as formulações de suspensão foram usadas neste ensaio. Um total de 575 pacientes pediátricos (de 2 meses a 12 anos) foram incluídos, com distribuição uniforme entre os 2 grupos de tratamento e um número comparável de pacientes foi avaliado (ou seja, ³ 84%) por grupo de tratamento. Critérios específicos de otite média foram necessários para elegibilidade e uma forte correlação foi encontrada no final da terapia e acompanhamento entre esses critérios e avaliação médica da resposta clínica. As taxas de eficácia clínica no final da visita de terapia (definida como 2 a 4 dias após a conclusão da terapia) e na visita de acompanhamento (definida como 22 a 28 dias após a conclusão da terapia) foram comparáveis para os 2 grupos de tratamento, com o seguinte taxas de cura obtidas para os pacientes avaliados: Ao final da terapia, 87% (n = 265) e 82% (n = 260) para 45 mg/kg/dia a cada 12 horas e 40 mg/kg/dia a cada 8 horas, respectivamente . No acompanhamento, 67% (n = 249) e 69% (n = 243) para 45 mg/kg/dia a cada 12 horas e 40 mg/kg/dia a cada 8 horas, respectivamente.
Diarreia foi definida como: (a) 3 ou mais fezes aquosas ou 4 ou mais fezes moles/aguadas em 1 dia; OU (b) 2 fezes aquosas por dia ou 3 fezes moles/águas por dia durante 2 dias consecutivos. A incidência de diarreia foi significativamente menor nos pacientes que receberam o regime a cada 12 horas em comparação com os pacientes que receberam o regime a cada 8 horas (14% e 34%, respectivamente). Além disso, o número de pacientes com diarreia grave ou que foram retirados com diarreia foi significativamente menor no grupo de tratamento a cada 12 horas (3% e 8% para o dia a cada 12 horas/10 e a cada 8 horas/10 dia, respectivamente ). No grupo de tratamento a cada 12 horas, 3 pacientes (1%) foram retirados com reação alérgica, enquanto 1 paciente no grupo a cada 8 horas foi retirado por esse motivo. O número de pacientes com infecção por Candida na área da fralda foi de 4% e 6% para os grupos a cada 12 horas e a cada 8 horas, respectivamente.
Não se sabe se o achado de redução estatisticamente significativa da diarreia com as suspensões orais administradas a cada 12 horas, versus suspensões administradas a cada 8 horas, pode ser extrapolado para os comprimidos mastigáveis. A presença de manitol nos comprimidos mastigáveis pode contribuir para um perfil de diarreia diferente. As suspensões orais a cada 12 horas (200 mg/5 mL e 400 mg/5 mL) são adoçadas com aspartame.
INFORMAÇÃO DO PACIENTE
Os pacientes devem ser informados de que AUGMENTIN pode ser administrado a cada 8 horas ou a cada 12 horas, dependendo da dose prescrita. Cada dose deve ser tomada com uma refeição ou lanche para reduzir a possibilidade de desconforto gastrointestinal.
Os pacientes devem ser informados de que medicamentos antibacterianos, incluindo AUGMENTIN 125mg, devem ser usados apenas para tratar infecções bacterianas. Eles não tratam infecções virais (por exemplo, o resfriado comum). Quando AUGMENTIN é prescrito para tratar uma infecção bacteriana, os pacientes devem ser informados de que, embora seja comum sentir-se melhor no início do tratamento, a medicação deve ser tomada exatamente como indicado. Pular doses ou não completar o curso completo da terapia pode: (1) diminuir a eficácia do tratamento imediato e (2) aumentar a probabilidade de que as bactérias desenvolvam resistência e não sejam tratáveis com AUGMENTIN 250mg ou outros medicamentos antibacterianos no futuro .
Aconselhe os pacientes que a diarreia é um problema comum causado por antibacterianos e geralmente termina quando o antibacteriano é descontinuado. Às vezes, após o início do tratamento com antibacterianos, os pacientes podem desenvolver fezes aquosas e sanguinolentas (com ou sem cólicas estomacais e febre), mesmo 2 ou mais meses após a última dose do antibacteriano. Se a diarreia for grave ou durar mais de 2 ou 3 dias, os pacientes devem entrar em contato com seu médico.
Os pacientes devem ser aconselhados a manter a suspensão refrigerada. Agite bem antes de usar. Ao administrar uma criança com a suspensão (líquida) de AUGMENTIN 125mg, use uma colher de dosagem ou um conta-gotas. Certifique-se de enxaguar a colher ou conta-gotas após cada uso. Os frascos de suspensão de AUGMENTIN podem conter mais líquido do que o necessário. Siga as instruções do seu médico sobre a quantidade a ser usada e os dias de tratamento que seu filho necessita. Descarte qualquer medicamento não utilizado.
Os pacientes devem estar cientes de que AUGMENTIN 125mg contém um medicamento da classe das penicilinas que pode causar reações alérgicas em alguns indivíduos.
