Zyvox 600mg Linezolid Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Zyvox 600mg e como é usado?
Zyvox é um medicamento de prescrição usado para tratar os sintomas de infecções bacterianas, como pneumonia, infecções de pele e infecções resistentes a outros antibióticos. Zyvox 600mg pode ser usado sozinho ou com outros medicamentos.
Zyvox pertence a uma classe de medicamentos chamados Antibióticos, Outros; Oxazolidinonas.
Não se sabe se Zyvox é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Zyvox?
Zyvox pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço no rosto ou na garganta,
- reação cutânea grave,
- febre,
- dor de garganta,
- Olhos queimando,
- dor de pele,
- erupção cutânea vermelha ou roxa com bolhas e descamação,
- problemas de visão,
- mudanças na sua visão,
- dor de estômago severa,
- diarreia aquosa ou sanguinolenta,
- convulsões,
- sudorese,
- sentindo-se ansioso ou tremendo,
- agitação,
- alucinações,
- febre,
- tremendo,
- ritmo cardíaco acelerado,
- rigidez muscular,
- contraindo-se,
- perda de coordenação,
- náusea,
- vômito,
- diarréia,
- dores musculares incomuns,
- Problemas respiratórios,
- dor de estômago,
- frequência cardíaca irregular,
- tontura,
- sentindo frio,
- sentindo-se muito fraco ou cansado,
- confusão,
- aftas,
- feridas na pele,
- contusões fáceis,
- sangramento incomum,
- pele pálida,
- mãos e pés frios,
- tontura, e
- falta de ar
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Zyvox incluem:
- náusea,
- vômito,
- diarréia,
- erupção cutânea leve,
- anemia (glóbulos vermelhos baixos),
- dor de cabeça, e
- tontura
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Zyvox. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
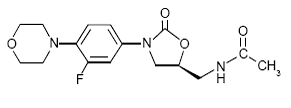
ZYVOX 600mg IV Injeção, ZYVOX Comprimidos e ZYVOX para Suspensão Oral contêm linezolida, que é um agente antibacteriano sintético da classe das oxazolidinonas. O nome químico da linezolida é (S)-N-[[3-[3-Fluoro-4-(4morfolinil)fenil]-2-oxo-5-oxazolidinil]metil]-acetamida.
A fórmula empírica é C16H20FN3O4. Seu peso molecular é 337,35, e sua estrutura química é representada abaixo:
ZYVOX 600mg IV Injection é fornecido como uma solução isotônica estéril pronta para uso para infusão intravenosa. Cada mL contém 2 mg de linezolida. Os ingredientes inativos são citrato de sódio, ácido cítrico e dextrose em um veículo aquoso para administração intravenosa. O teor de sódio (Na+) é de 0,38 mg/mL (saco de 5 mEq/300 mL e saco de 1,7 mEq/100 mL).
ZYVOX Tablet para administração oral contém 600 mg de linezolida na forma de comprimido comprimido revestido por película. Os ingredientes inativos são amido de milho, celulose microcristalina, hidroxipropilcelulose, glicolato de amido sódico, estearato de magnésio, hipromelose, polietilenoglicol, dióxido de titânio e cera de carnaúba. O teor de sódio (Na+) é de 2,92 mg por comprimido de 600 mg (0,1 mEq/comprimido).
ZYVOX 600mg para Suspensão Oral é fornecido como um grânulo/pó com sabor a laranja para constituição em suspensão para administração oral. Após a constituição, cada 5 mL contém 100 mg de linezolida. Os ingredientes inativos são sacarose, ácido cítrico, citrato de sódio, celulose microcristalina e carboximetilcelulose sódica, aspartame, goma xantana, manitol, benzoato de sódio, dióxido de silício coloidal, cloreto de sódio e aromas [ver INFORMAÇÃO DO PACIENTE ]. O teor de sódio (Na+) é de 8,52 mg/5 mL (0,4 mEq/5 mL).
INDICAÇÕES
Pneumonia nosocomial
ZYVOX é indicado para o tratamento de pneumonia nosocomial causada por Staphylococcus aureus (isolados sensíveis e resistentes à meticilina) ou Streptococcus pneumoniae [ver Estudos clínicos ].
Pneumonia adquirida na comunidade
ZYVOX 600mg é indicado para o tratamento de pneumonia adquirida na comunidade causada por Streptococcus pneumoniae, incluindo casos com bacteremia concomitante, ou Staphylococcus aureus (somente isolados sensíveis à meticilina) [ver Estudos clínicos ].
Infecções complicadas da pele e da estrutura da pele
ZYVOX 600mg é indicado para o tratamento de infecções complicadas da pele e estruturas da pele, incluindo infecções do pé diabético, sem osteomielite concomitante, causadas por Staphylococcus aureus (isolados sensíveis e resistentes à meticilina), Streptococcus pyogenes ou Streptococcus agalactiae. ZYVOX não foi estudado no tratamento de úlceras de decúbito [ver Estudos clínicos ].
Infecções não complicadas da pele e da estrutura da pele
ZYVOX 600mg é indicado para o tratamento de infecções não complicadas da pele e estruturas da pele causadas por Staphylococcus aureus (somente isolados sensíveis à meticilina) ou Streptococcus pyogenes [ver Estudos clínicos ].
Infecções por Enterococcus faecium resistentes à vancomicina
ZYVOX 600mg é indicado para o tratamento de infecções por Enterococcus faecium resistentes à vancomicina, incluindo casos com bacteremia concomitante. Estudos clínicos ].
Limitações de uso
- ZYVOX 600mg não é indicado para o tratamento de infecções Gram-negativas. É fundamental que a terapia específica para Gram-negativos seja iniciada imediatamente se houver suspeita ou documentação de um patógeno Gram-negativo concomitante [ver AVISOS E PRECAUÇÕES ].
- A segurança e eficácia das formulações de ZYVOX 600mg administradas por mais de 28 dias não foram avaliadas em ensaios clínicos controlados [ver Estudos clínicos ].
Uso
Para reduzir o desenvolvimento de bactérias resistentes aos medicamentos e manter a eficácia de ZYVOX 600mg e outros medicamentos antibacterianos, ZYVOX deve ser usado apenas para tratar ou prevenir infecções comprovadamente ou fortemente suspeitas de serem causadas por bactérias suscetíveis. Quando as informações de cultura e suscetibilidade estiverem disponíveis, elas devem ser consideradas na seleção ou modificação da terapia antibacteriana. Na ausência de tais dados, a epidemiologia local e os padrões de suscetibilidade podem contribuir para a seleção empírica da terapia.
DOSAGEM E ADMINISTRAÇÃO
Dosagem geral e administração
A dosagem recomendada para formulações de ZYVOX 600mg para o tratamento de infecções está descrita na Tabela 1.
Não é necessário ajuste de dose ao mudar de administração intravenosa para oral.
Administração intravenosa
ZYVOX 600mg IV Injection é fornecido em bolsas de infusão de dose única, prontas para uso. Os medicamentos parenterais devem ser inspecionados visualmente quanto à presença de partículas antes da administração. Verifique se há vazamentos minúsculos apertando firmemente o saco. Se forem detectados vazamentos, descarte a solução, pois a esterilidade pode ser prejudicada. Mantenha os sacos de infusão no invólucro até que estejam prontos para uso. Armazenar em temperatura ambiente. Proteger do congelamento. ZYVOX 600mg IV injeção pode exibir uma cor amarela que pode se intensificar ao longo do tempo sem afetar adversamente a potência.
ZYVOX IV deve ser administrado por infusão intravenosa durante um período de 30 a 120 minutos. Não use esta bolsa de infusão intravenosa em conexões em série. Não devem ser introduzidos aditivos nesta solução. Se ZYVOX 600mg IV for administrado concomitantemente com outro medicamento, cada medicamento deve ser administrado separadamente de acordo com a dosagem e via de administração recomendadas para cada produto. Descarte a porção não utilizada.
Se a mesma linha intravenosa for usada para infusão sequencial de vários medicamentos, a linha deve ser lavada antes e após a infusão de ZYVOX IV Injection com uma solução de infusão compatível com ZYVOX 600mg IV Injection e com qualquer outro medicamento administrado através desta linha comum .
Compatibilidades
As soluções intravenosas compatíveis incluem injeção de cloreto de sódio a 0,9%, USP, injeção de dextrose a 5%, USP e injeção de Ringer com lactato, USP.
Incompatibilidades
Incompatibilidades físicas resultaram quando ZYVOX 600mg IV foi combinado com os seguintes medicamentos durante a administração simulada no local Y: anfotericina B, clorpromazina HCl, diazepam, isotionato de pentamidina, lactobionato de eritromicina, fenitoína sódica e sulfametoxazol-trimetoprim. Além disso, a incompatibilidade química ocorreu quando a injeção de ZYVOX IV foi combinada com ceftriaxona sódica.
Constituição da Suspensão Oral
ZYVOX para Suspensão Oral é fornecido na forma de pó/grânulo para constituição. Bata suavemente no frasco para soltar o pó. Adicione um total de 123 mL de água destilada em duas porções. Depois de adicionar a primeira metade, agite vigorosamente para molhar todo o pó. Em seguida, adicione a segunda metade da água e agite vigorosamente para obter uma suspensão uniforme. Após a constituição, cada 5 mL da suspensão contém 100 mg de linezolida. Antes de usar, misture suavemente invertendo o frasco 3 a 5 vezes. Não agite. Armazenar a suspensão constituída à temperatura ambiente. Use dentro de 21 dias após a constituição.
COMO FORNECIDO
Formas de dosagem e pontos fortes
ZYVOX 600mg IV Injeção: 200 mg/100 mL (2 mg/mL) e 600 mg/300 mL (2 mg/mL) de linezolida de dose única, sacos de infusão de plástico flexíveis prontos para uso em um invólucro de folha laminada.
ZYVOX 600 mg Comprimido:
Comprimido revestido por película branco, em forma de cápsula, com “ZYV” gravado em um lado e “600” no outro ZYVOX 600mg para Suspensão Oral: granulado/pó seco, branco a esbranquiçado, sabor laranja. Quando constituído conforme indicado, cada frasco conterá 150 mL de uma suspensão fornecendo o equivalente a 100 mg de linezolida por cada 5 mL.
Armazenamento e manuseio
Injeção
ZYVOX 600mg IV A injeção está disponível em sacos de infusão de plástico flexível de dose única, prontos para uso, em um invólucro de folha laminada. As bolsas e portas de infusão não são feitas com látex de borracha natural. Os sacos de infusão estão disponíveis nos seguintes tamanhos de embalagem:
200 mg/100 mL (2 mg/mL) de linezolida x 10 - NDC 0009-5137-04 600 mg/300 mL (2 mg/mL) linezolida x 10 - NDC 0009-5140-04
Comprimidos
ZYVOX 600mg comprimidos estão disponíveis da seguinte forma:
600 mg (comprimidos revestidos por película brancos, em forma de cápsula, com “ZYV” gravado numa das faces e “600” na outra)
20 comprimidos em frasco de HDPE - NDC 0009-5138-02 Embalagens de dose unitária de 30 comprimidos - NDC 0009-5138-03
Suspensão oral
ZYVOX para Suspensão Oral está disponível como um granulado/pó seco, branco a esbranquiçado, com sabor a laranja. Quando constituído conforme indicado, cada frasco conterá 150 mL de uma suspensão fornecendo o equivalente a 100 mg de linezolida por cada 5 mL. ZYVOX para Suspensão Oral é fornecido da seguinte forma:
100 mg/5 mL em frascos de vidro de 240 mL - NDC 0009-5136-01
Armazenamento e manuseio
Armazenar a 25°C (77°F). Proteja da luz. Mantenha os frascos bem fechados para proteger da umidade. Recomenda-se que as bolsas de infusão sejam mantidas no invólucro até que estejam prontas para uso. Proteja os sacos de infusão do congelamento.
Distribuído pela Pharmacia & Upjohn Co Division da Pfizer Inc, NY, NY 10017. Revisado: novembro de 2021.
EFEITOS COLATERAIS
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Adultos
A segurança das formulações de ZYVOX 600mg foi avaliada em 2.046 pacientes adultos inscritos em sete ensaios clínicos controlados por comparador de Fase 3, que foram tratados por até 28 dias.
Dos pacientes tratados para infecções não complicadas da pele e estruturas da pele (uSSSIs), 25,4% dos pacientes tratados com ZYVOX e 19,6% dos pacientes tratados com comparador apresentaram pelo menos um evento adverso relacionado ao medicamento. Para todas as outras indicações, 20,4% dos pacientes tratados com ZYVOX e 14,3% dos pacientes tratados com comparador apresentaram pelo menos um evento adverso relacionado ao medicamento.
A Tabela 2 mostra a incidência de todas as causas, reações adversas emergentes do tratamento relatadas em pelo menos 1% dos pacientes adultos nesses estudos por dose de ZYVOX.
Dos pacientes tratados para uSSSIs, 3,5% dos pacientes tratados com ZYVOX e 2,4% dos pacientes tratados com comparador descontinuaram o tratamento devido a eventos adversos relacionados ao medicamento. Para todas as outras indicações, as descontinuações devido a eventos adversos relacionados ao medicamento ocorreram em 2,1% dos pacientes tratados com ZYVOX e em 1,7% dos pacientes tratados com comparador. Os eventos adversos relacionados ao medicamento relatados mais comuns que levaram à descontinuação do tratamento foram náusea, dor de cabeça, diarreia e vômito.
Pacientes pediátricos
segurança das formulações de ZYVOX foi avaliada em 215 pacientes pediátricos com idades desde o nascimento até 11 anos, e em 248 pacientes pediátricos de 5 a 17 anos (146 destes 248 tinham 5 a 11 anos e 102 tinham 12 a 17 anos). Esses pacientes foram incluídos em dois ensaios clínicos controlados por comparador de Fase 3 e foram tratados por até 28 dias. No estudo de pacientes pediátricos hospitalizados (do nascimento aos 11 anos) com infecções Grampositivas, que foram randomizados 2 para 1 (linezolida: vancomicina), a mortalidade foi de 6,0% (13/215) no braço de linezolida e 3,0% (3/101) no braço de vancomicina. No entanto, dada a doença subjacente grave na população de pacientes, nenhuma causalidade pode ser estabelecida.
Dos pacientes pediátricos tratados para uSSSIs, 19,2% dos pacientes tratados com ZYVOX e 14,1% dos pacientes tratados com comparador apresentaram pelo menos um evento adverso relacionado ao medicamento. Para todas as outras indicações, 18,8% dos pacientes tratados com ZYVOX e 34,3% dos pacientes tratados com comparador apresentaram pelo menos um evento adverso relacionado ao medicamento.
Tabela 3 mostra a incidência de reações adversas emergentes do tratamento de todas as causas relatadas em mais de 1% dos pacientes pediátricos (e mais de 1 paciente) em qualquer grupo de tratamento nos estudos de Fase 3 controlados por comparador.
Dos pacientes pediátricos tratados para uSSSIs, 1,6% dos pacientes tratados com ZYVOX e 2,4% dos pacientes tratados com comparador descontinuaram o tratamento devido a eventos adversos relacionados ao medicamento. Para todas as outras indicações, as descontinuações devido a eventos adversos relacionados ao medicamento ocorreram em 0,9% dos pacientes tratados com ZYVOX e 6,1% dos pacientes tratados com comparador.
Anormalidades laboratoriais
ZYVOX foi associado à trombocitopenia quando usado em doses de até 600 mg, inclusive, a cada 12 horas por até 28 dias. Nos estudos controlados por comparador de Fase 3, a porcentagem de pacientes adultos que desenvolveram uma contagem de plaquetas substancialmente baixa (definida como menos de 75% do limite inferior do normal e/ou basal) foi de 2,4% (intervalo entre os estudos: 0,3 a 10,0%) com ZYVOX 600mg e 1,5% (variação entre os estudos: 0,4 a 7,0%) com um comparador. Em um estudo de pacientes pediátricos hospitalizados com idades desde o nascimento até 11 anos, a porcentagem de pacientes que desenvolveram uma contagem de plaquetas substancialmente baixa (definida como menos de 75% do limite inferior do normal e/ou basal) foi de 12,9% com ZYVOX 600mg e 13,4% com vancomicina. Em um estudo ambulatorial de pacientes pediátricos com idade entre 5 e 17 anos, a porcentagem de pacientes que desenvolveram uma contagem de plaquetas substancialmente baixa foi de 0% com ZYVOX e 0,4% com cefadroxil. A trombocitopenia associada ao uso de ZYVOX parece ser dependente da duração da terapia (geralmente superior a 2 semanas de tratamento). A contagem de plaquetas para a maioria dos pacientes retornou ao intervalo/linha de base normal durante o período de acompanhamento. Não foram identificados eventos adversos clínicos relacionados nos ensaios clínicos de Fase 3 em pacientes que desenvolveram trombocitopenia. Eventos hemorrágicos foram identificados em pacientes trombocitopênicos em um programa de uso compassivo para ZYVOX; o papel da linezolida nesses eventos não pode ser determinado [ver AVISOS E PRECAUÇÕES ].
As alterações observadas em outros parâmetros laboratoriais, independentemente da relação medicamentosa, não revelaram diferenças substanciais entre ZYVOX 600mg e os comparadores. Essas alterações geralmente não foram clinicamente significativas, não levaram à descontinuação da terapia e foram reversíveis. A incidência de pacientes adultos e pediátricos com pelo menos um valor hematológico ou químico sérico substancialmente anormal é apresentada nas Tabelas 4, 5, 6 e 7.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de ZYVOX. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento:
- Mielossupressão (incluindo anemia, leucopenia, pancitopenia e trombocitopenia) [ver AVISOS E PRECAUÇÕES ]; anemia sideroblástica.
- Neuropatia periférica e neuropatia óptica às vezes progredindo para perda de visão [ver AVISOS E PRECAUÇÕES ].
- Acidose láctica [ver AVISOS E PRECAUÇÕES ]. Embora esses relatos tenham ocorrido principalmente em pacientes tratados por mais tempo do que a duração máxima recomendada de 28 dias, esses eventos também foram relatados em pacientes que receberam tratamentos mais curtos.
- A síndrome serotoninérgica foi relatada em pacientes recebendo concomitantemente agentes serotoninérgicos, incluindo antidepressivos, como inibidores seletivos da recaptação da serotonina (ISRSs) e opióides, e ZYVOX [ver AVISOS E PRECAUÇÕES ].
- Convulsões [ver AVISOS E PRECAUÇÕES ].
- Anafilaxia, angioedema, distúrbios da pele bolhosa, incluindo reações adversas cutâneas graves (SCAR), como necrólise epidérmica tóxica e síndrome de Stevens-Johnson, e vasculite de hipersensibilidade.
- Descoloração superficial do dente e descoloração da língua foram relatadas com o uso de linezolida. A descoloração do dente foi removida com limpeza dental profissional (desincrustação manual) em casos com resultado conhecido.
- Hipoglicemia, incluindo episódios sintomáticos [ver AVISOS E PRECAUÇÕES ].
- Hiponatremia e/ou Síndrome de Secreção Inapropriada de Hormônio Antidiurético (SIADH) [ver AVISOS E PRECAUÇÕES ].
INTERAÇÕES MEDICAMENTOSAS
Inibidores da Monoamina Oxidase
A linezolida é um inibidor reversível e não seletivo da monoaminoxidase [ver CONTRA-INDICAÇÕES e FARMACOLOGIA CLÍNICA ].
Agentes adrenérgicos e serotoninérgicos
A linezolida tem potencial para interação com agentes adrenérgicos e serotoninérgicos [ver AVISOS E PRECAUÇÕES e FARMACOLOGIA CLÍNICA ].
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Mielossupressão
Mielossupressão (incluindo anemia, leucopenia, pancitopenia e trombocitopenia) foi relatada em pacientes recebendo linezolida. Nos casos em que o resultado é conhecido, quando a linezolida foi descontinuada, os parâmetros hematológicos afetados aumentaram em direção aos níveis pré-tratamento. Hemogramas completos devem ser monitorados semanalmente em pacientes que recebem linezolida, particularmente naqueles que recebem linezolida por mais de duas semanas, aqueles com mielossupressão pré-existente, aqueles que recebem medicamentos concomitantes que produzem supressão da medula óssea ou aqueles com infecção crônica que têm receberam terapia medicamentosa antibacteriana anterior ou concomitante. A descontinuação da terapia com linezolida deve ser considerada em pacientes que desenvolvem ou têm piora da mielossupressão.
Neuropatia Periférica e Óptica
Neuropatias periféricas e ópticas foram relatadas em pacientes tratados com ZYVOX 600mg, principalmente naqueles pacientes tratados por mais tempo do que a duração máxima recomendada de 28 dias. Nos casos de neuropatia óptica que evoluiu para perda de visão, os pacientes foram tratados por períodos prolongados além da duração máxima recomendada. Embaçamento visual foi relatado em alguns pacientes tratados com ZYVOX por menos de 28 dias. A neuropatia periférica e óptica também foi relatada em crianças.
Se os pacientes apresentarem sintomas de deficiência visual, como alterações na acuidade visual, alterações na visão de cores, visão turva ou defeito no campo visual, recomenda-se uma avaliação oftalmológica imediata. A função visual deve ser monitorada em todos os pacientes que tomam ZYVOX por períodos prolongados (≥ 3 meses) e em todos os pacientes que relatam novos sintomas visuais, independentemente da duração da terapia com ZYVOX. Se ocorrer neuropatia periférica ou óptica, o uso continuado de ZYVOX 600mg nesses pacientes deve ser avaliado em relação aos riscos potenciais.
Síndrome da serotonina
Foram relatados relatos espontâneos de síndrome serotoninérgica, incluindo casos fatais associados à coadministração de ZYVOX e agentes serotoninérgicos, incluindo antidepressivos, como inibidores seletivos da recaptação da serotonina (ISRSs).
menos que clinicamente apropriado e os pacientes sejam cuidadosamente observados quanto a sinais e/ou sintomas de síndrome serotoninérgica ou reações do tipo síndrome neuroléptica maligna (tipo NMS), linezolida não deve ser administrado a pacientes com síndrome carcinoide e/ou pacientes tomando qualquer um dos seguintes medicamentos : inibidores da recaptação da serotonina, antidepressivos tricíclicos, bupropiona, buspirona, agonistas do receptor 5-HT1 da serotonina (triptanos) e opioides, incluindo meperidina [ver INTERAÇÕES MEDICAMENTOSAS e FARMACOLOGIA CLÍNICA ].
Em alguns casos, um paciente que já está recebendo um antidepressivo serotoninérgico ou buspirona pode necessitar de tratamento urgente com linezolida. Se alternativas à linezolida não estiverem disponíveis e os potenciais benefícios da linezolida superarem os riscos de síndrome serotoninérgica ou reações do tipo NMS, o antidepressivo serotoninérgico deve ser interrompido imediatamente e a linezolida administrada. O paciente deve ser monitorado por duas semanas (cinco semanas se fluoxetina foi tomada) ou até 24 horas após a última dose de linezolida, o que ocorrer primeiro. Os sintomas da síndrome serotoninérgica ou reações do tipo NMS incluem hipertermia, rigidez, mioclonia, instabilidade autonômica e alterações do estado mental que incluem agitação extrema progredindo para delírio e coma. O paciente também deve ser monitorado quanto aos sintomas de descontinuação do antidepressivo (consulte a bula do(s) agente(s) especificado(s) para uma descrição dos sintomas de descontinuação associados).
Desequilíbrio da mortalidade em um estudo investigativo em pacientes com infecções da corrente sanguínea relacionadas ao cateter, incluindo aqueles com infecções no local do cateter
Um desequilíbrio na mortalidade foi observado em pacientes tratados com linezolida em relação à vancomicina/dicloxacilina/oxacilina em um estudo aberto em pacientes gravemente enfermos com infecções relacionadas a cateter intravascular [78/363 (21,5%) vs. 58/363 (16,0% ); razão de chances 1,426, IC 95% 0,970, 2,098]. Embora a causalidade não tenha sido estabelecida, esse desequilíbrio observado ocorreu principalmente em pacientes tratados com linezolida nos quais patógenos Gram-negativos, patógenos Gram-negativos e Gram-positivos mistos ou nenhum patógeno foram identificados no início do estudo, mas não foi observado em pacientes com Apenas infecções Gram-positivas.
A linezolida não está aprovada e não deve ser usada para o tratamento de pacientes com infecções da corrente sanguínea relacionadas ao cateter ou infecções no local do cateter.
linezolida não tem atividade clínica contra patógenos Gram-negativos e não é indicada para o tratamento de infecções Gram-negativas. É fundamental que a terapia específica para Gram-negativos seja iniciada imediatamente se houver suspeita ou documentação de um patógeno Gram-negativo concomitante [ver INDICAÇÕES ].
Diarreia Associada a Clostridioides Difficile
Diarreia Associada a Clostridioides difficile (CDAD) foi relatada com o uso de quase todos os agentes antibacterianos, incluindo ZYVOX 600mg, e pode variar em gravidade de diarreia leve a colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas A e B que contribuem para o desenvolvimento de CDAD. Cepas produtoras de hipertoxina de C. difficile causam aumento da morbidade e mortalidade, pois essas infecções podem ser refratárias à terapia antimicrobiana e podem exigir colectomia. CDAD deve ser considerado em todos os pacientes que apresentam diarreia após o uso de drogas antibacterianas.
É necessário um histórico médico cuidadoso, pois foi relatado que a CDAD ocorre mais de dois meses após a administração de agentes antibacterianos.
Se houver suspeita ou confirmação de CDAD, o uso contínuo de drogas antibacterianas não direcionadas contra C. difficile pode precisar ser descontinuado. O manejo adequado de fluidos e eletrólitos, suplementação de proteínas, tratamento com drogas antibacterianas de C. difficile e avaliação cirúrgica devem ser instituídos conforme indicação clínica.
Interações Potenciais Produzindo Elevação da Pressão Arterial
A menos que os pacientes sejam monitorados quanto a potenciais aumentos na pressão arterial, a linezolida não deve ser administrada a pacientes com hipertensão não controlada, feocromocitoma, tireotoxicose e/ou pacientes tomando qualquer um dos seguintes tipos de medicamentos: agentes simpaticomiméticos de ação direta e indireta (por exemplo, pseudoefedrina), agentes vasopressores (por exemplo, epinefrina, norepinefrina), agentes dopaminérgicos (por exemplo, dopamina, dobutamina) [ver INTERAÇÕES MEDICAMENTOSAS e FARMACOLOGIA CLÍNICA ].
Acidose láctica
Acidose láctica foi relatada com o uso de ZYVOX. Nos casos relatados, os pacientes experimentaram episódios repetidos de náuseas e vômitos. Os pacientes que desenvolvem náuseas ou vômitos recorrentes, acidose inexplicável ou um baixo nível de bicarbonato durante o tratamento com ZYVOX devem receber avaliação médica imediata.
Convulsões
Convulsões foram relatadas em pacientes quando tratados com linezolida. Em alguns desses casos, foi relatado um histórico de convulsões ou fatores de risco para convulsões.
Hipoglicemia
Casos pós-comercialização de hipoglicemia sintomática foram relatados em pacientes com diabetes mellitus recebendo insulina ou agentes hipoglicemiantes orais quando tratados com linezolida, um inibidor reversível e não seletivo da MAO. Alguns inibidores da MAO têm sido associados a episódios de hipoglicemia em pacientes diabéticos recebendo insulina ou agentes hipoglicemiantes. Embora uma relação causal entre linezolida e hipoglicemia não tenha sido estabelecida, os pacientes diabéticos devem ser alertados sobre possíveis reações hipoglicêmicas quando tratados com linezolida.
Se ocorrer hipoglicemia, pode ser necessária uma diminuição na dose de insulina ou agente hipoglicemiante oral, ou descontinuação do agente hipoglicemiante oral, insulina ou linezolida.
Hiponatremia e/ou Síndrome de Secreção Inapropriada de Hormônio Antidiurético (SIADH)
Casos pós-comercialização de hiponatremia e/ou Síndrome de Secreção Inapropriada de Hormônio Antidiurético (SIADH) foram observados em pacientes tratados com linezolida. Nos casos relatados, os sinais e sintomas incluíam confusão, sonolência, fraqueza generalizada e, em casos graves, levaram à insuficiência respiratória e até à morte. Monitore os níveis séricos de sódio regularmente em idosos, em pacientes em uso de diuréticos e em outros pacientes com risco de hiponatremia e/ou SIADH enquanto estiverem tomando ZYVOX. Se ocorrerem sinais e sintomas de hiponatremia e/ou SIADH, descontinuar ZYVOX 600mg e instituir medidas de suporte adequadas.
Riscos em pacientes com fenilcetonúria
fenilalanina pode ser prejudicial para pacientes com fenilcetonúria (PKU). ZYVOX para Suspensão Oral contém fenilalanina, um componente do aspartame. Cada 5 mL da suspensão oral de 100 mg/5 mL contém 20 mg de fenilalanina. Antes de prescrever ZYVOX 600mg para Suspensão Oral a um paciente com PKU, considere a quantidade diária combinada de fenilalanina de todas as fontes, incluindo ZYVOX para Suspensão Oral.
As outras formulações de ZYVOX não contêm fenilalanina.
Desenvolvimento de bactérias resistentes a drogas
A prescrição de ZYVOX na ausência de infecção bacteriana comprovada ou fortemente suspeita ou indicação profilática provavelmente não trará benefícios ao paciente e aumenta o risco de desenvolvimento de bactérias resistentes aos medicamentos.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Estudos ao longo da vida em animais não foram conduzidos para avaliar o potencial carcinogênico da linezolida. Nem o potencial mutagênico nem clastogênico foi encontrado em uma bateria de testes, incluindo: ensaios de mutagenicidade (reversão bacteriana de Ames e mutação de células CHO), um ensaio de síntese de DNA não programada (UDS) in vitro, um ensaio de aberração cromossômica in vitro em linfócitos humanos e um ensaio de micronúcleo de camundongo in vivo.
linezolida não afetou a fertilidade ou o desempenho reprodutivo de ratas adultas que receberam doses orais de até 100 mg/kg/dia por 14 dias antes do acasalamento até o 7º dia de gestação. doses ≥ 50 mg/kg/dia, com exposições aproximadamente iguais ou superiores ao nível de exposição humana esperado (as comparações de exposição são baseadas em AUCs). Os efeitos reversíveis da fertilidade foram mediados através da espermatogênese alterada. As espermátides afetadas continham mitocôndrias anormalmente formadas e orientadas e eram inviáveis. A hipertrofia das células epiteliais e a hiperplasia no epidídimo foram observadas em conjunto com a diminuição da fertilidade. Alterações epididimais semelhantes não foram observadas em cães.
Em ratos machos sexualmente maduros expostos ao fármaco quando jovens, observou-se uma ligeira diminuição da fertilidade após o tratamento com linezolida durante a maior parte do período de desenvolvimento sexual (50 mg/kg/dia dos dias 7 a 36 de idade e 100 mg/kg/dia dos dias 37 a 55 de idade), com exposições até 1,7 vezes maiores que as AUCs médias observadas em pacientes pediátricos de 3 meses a 11 anos. A diminuição da fertilidade não foi observada com períodos de tratamento mais curtos, correspondendo à exposição in utero durante o período neonatal precoce (dia 6 da gestação até o dia 5 pós-natal), exposição neonatal (dias pós-natal 5 a 21) ou à exposição juvenil (dias pós-natal 22 a 35). ). Reduções reversíveis na motilidade espermática e morfologia espermática alterada foram observadas em ratos tratados do 22º ao 35º dia pós-natal.
Uso em populações específicas
Gravidez
Resumo do risco
Os dados disponíveis de relatos de casos publicados e pós-comercialização com uso de linezolida em mulheres grávidas não identificaram um risco associado ao medicamento de defeitos congênitos graves, aborto espontâneo ou resultados maternos ou fetais adversos. Quando administrada durante a organogênese, a linezolida não causou malformações em camundongos, ratos ou coelhos em níveis de exposição materna de aproximadamente 6,5 vezes (camundongos), equivalente a (ratos), ou 0,06 vezes (coelhos) a exposição terapêutica clínica, com base nas AUCs. No entanto, a letalidade embriofetal foi observada em camundongos em 6,5 vezes a exposição humana estimada. Quando as ratas foram administradas durante a organogênese até a lactação, a sobrevivência pós-natal dos filhotes foi diminuída em doses aproximadamente equivalentes à exposição humana estimada com base nas AUCs (ver Dados ).
risco de fundo de defeitos congênitos graves e aborto para as populações indicadas é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2-4% e 15-20%, respectivamente.
Dados
Dados de animais
Em camundongos, a toxicidade embriofetal foi observada apenas em doses que causaram toxicidade materna (sinais clínicos e redução do ganho de peso corporal). Uma dose oral de 450 mg/kg/dia administrada a partir do Dia de Gestação (DG) 6-16 (6,5 vezes a exposição humana estimada com base nas AUCs) se correlacionou com aumento da morte embrionária pós-implantação, incluindo perda total da ninhada, diminuição do peso corporal fetal e um aumento da incidência de fusão da cartilagem costal. Nem toxicidade materna nem embriofetal foram observadas em doses de até 150 mg/kg/dia. Não foram observadas malformações fetais.
Em ratos, a toxicidade fetal foi observada em 15 e 50 mg/kg/dia administrados oralmente a partir de GD 6-17 (exposições 0,22 vezes aproximadamente equivalente à exposição humana estimada, respectivamente, com base nas AUCs). Os efeitos consistiram em peso corporal fetal diminuído e ossificação reduzida de esternebras, um achado frequentemente observado em associação com peso corporal fetal diminuído. Não foram observadas malformações fetais. A toxicidade materna, na forma de ganho de peso corporal reduzido, foi observada em 50 mg/kg/dia.
Em coelhos, a redução do peso corporal fetal ocorreu apenas na presença de toxicidade materna (sinais clínicos, ganho de peso corporal reduzido e consumo de alimentos) quando administrado em uma dose oral de 15 mg/kg/dia administrada do GD 6-20 (0,06 vezes a exposição humana estimada com base em AUCs). Não foram observadas malformações fetais.
Quando as ratas foram tratadas com 50 mg/kg/dia (aproximadamente equivalente à exposição humana estimada com base nas AUCs) de linezolida durante a gravidez e lactação (GD 6 até o dia de lactação 20), a sobrevivência dos filhotes foi diminuída nos dias pós-natal 1 a 4 Os filhotes machos e fêmeas que amadureceram até a idade reprodutiva, quando acasalados, mostraram um aumento na perda pré-implantação.
Lactação
Resumo do risco
A linezolida está presente no leite materno. Com base em dados de relatos de casos publicados disponíveis, a dose diária de linezolida que o bebê receberia do leite materno seria de aproximadamente 6% a 9% da dose terapêutica recomendada para bebês (10 mg/kg a cada 8 horas). Não há informações sobre os efeitos da linezolida no lactente; no entanto, diarreia e vômito foram as reações adversas mais comuns relatadas em ensaios clínicos em lactentes recebendo linezolida terapeuticamente [ver REAÇÕES ADVERSAS e (ver Considerações Clínicas). Não há informações sobre os efeitos da linezolida na produção de leite. Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de linezolida e quaisquer potenciais efeitos adversos da linezolida ou da condição materna subjacente na criança amamentada.
Considerações Clínicas
Aconselhe as mulheres lactantes a monitorarem o bebê amamentado quanto à diarreia e vômitos.
Fêmeas e Machos com Potencial Reprodutivo
Infertilidade
Machos
Com base nos achados de estudos em ratos, ZYVOX pode prejudicar reversivelmente a fertilidade em pacientes do sexo masculino [ver Toxicologia não clínica )].
Uso Pediátrico
A segurança e eficácia de ZYVOX 600mg para o tratamento de pacientes pediátricos com as seguintes infecções são apoiadas por evidências de estudos adequados e bem controlados em adultos, dados farmacocinéticos em pacientes pediátricos e dados adicionais de um estudo comparador controlado de Gram-positivos infecções em pacientes pediátricos com idades desde o nascimento até 11 anos [ver INDICAÇÕES , FARMACOLOGIA CLÍNICA e Estudos clínicos ]:
- pneumonia nosocomial
- infecções complicadas da pele e da estrutura da pele
- pneumonia adquirida na comunidade (também apoiada por evidências de um estudo não controlado em pacientes com idade variando de 8 meses a 12 anos)
- Infecções por Enterococcus faecium resistentes à vancomicina
A segurança e eficácia de ZYVOX 600mg para o tratamento de pacientes pediátricos com a seguinte infecção foram estabelecidas em um estudo controlado por comparador em pacientes pediátricos com idades entre 5 e 17 anos [ver Estudos clínicos ]:
- infecções não complicadas da pele e da estrutura da pele causadas por Staphylococcus aureus (somente cepas sensíveis à meticilina) ou Streptococcus pyogenes
As informações farmacocinéticas geradas em pacientes pediátricos com derivações ventriculoperitoneais mostraram concentrações variáveis de linezolida no líquido cefalorraquidiano (LCR) após doses únicas e múltiplas de linezolida; as concentrações terapêuticas não foram consistentemente alcançadas ou mantidas no LCR. Portanto, o uso de linezolida para o tratamento empírico de pacientes pediátricos com infecções do sistema nervoso central não é recomendado.
A farmacocinética da linezolida foi avaliada em pacientes pediátricos desde o nascimento até os 17 anos de idade. Em geral, a depuração da linezolida com base no peso diminui gradualmente com o aumento da idade dos pacientes pediátricos. No entanto, em recém-nascidos prematuros (idade gestacional DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
Na experiência clínica limitada, 5 de 6 (83%) pacientes pediátricos com infecções causadas por patógenos Gram-positivos com concentrações inibitórias mínimas (CIMs) de 4 mcg/mL tratados com ZYVOX 600mg tiveram cura clínica. No entanto, pacientes pediátricos apresentam maior variabilidade na depuração de linezolida e exposição sistêmica (AUC) em comparação com adultos. Em pacientes pediátricos com resposta clínica abaixo do ideal, particularmente aqueles com patógenos com CIM de 4 mcg/mL, menor exposição sistêmica, local e gravidade da infecção e a condição médica subjacente devem ser considerados ao avaliar a resposta clínica [ver FARMACOLOGIA CLÍNICA e DOSAGEM E ADMINISTRAÇÃO ].
Uso Geriátrico
Dos 2.046 pacientes tratados com ZYVOX 600mg em ensaios clínicos controlados por comparador de Fase 3, 589 (29%) tinham 65 anos ou mais e 253 (12%) tinham 75 anos ou mais. Não foram observadas diferenças gerais na segurança ou eficácia entre esses pacientes e pacientes mais jovens, e outras experiências clínicas relatadas não identificaram diferenças nas respostas entre pacientes idosos e pacientes mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada.
SOBREDOSAGEM
Em caso de sobredosagem, aconselham-se cuidados de suporte, com manutenção da filtração glomerular. A hemodiálise pode facilitar a eliminação mais rápida da linezolida. Em um ensaio clínico de Fase 1, aproximadamente 30% de uma dose de linezolida foi removida durante uma sessão de hemodiálise de 3 horas, começando 3 horas após a administração da dose de linezolida. Não há dados disponíveis para remoção de linezolida com diálise peritoneal ou hemoperfusão. Os sinais clínicos de toxicidade aguda em animais foram diminuição da atividade e ataxia em ratos e vômitos e tremores em cães tratados com 3.000 mg/kg/dia e 2.000 mg/kg/dia, respectivamente.
CONTRA-INDICAÇÕES
Hipersensibilidade
As formulações de ZYVOX são contraindicadas para uso em pacientes com hipersensibilidade conhecida à linezolida ou a qualquer outro componente do produto.
Inibidores da Monoamina Oxidase
A linezolida não deve ser utilizada em doentes a tomar qualquer medicamento que iniba as monoaminoxidases A ou B (por exemplo, fenelzina, isocarboxazida) ou nas duas semanas seguintes à toma de qualquer medicamento.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
ZYVOX é um medicamento antibacteriano [ver Microbiologia ].
Farmacodinâmica
Em um estudo QT cruzado randomizado, positivo e controlado por placebo, 40 indivíduos saudáveis receberam uma dose única de ZYVOX 600 mg por infusão IV de 1 hora, uma dose única de ZYVOX 1.200 mg por infusão IV de 1 hora, placebo e um dose oral única de controle positivo. Nas doses de 600 mg e 1.200 mg de ZYVOX 600 mg, nenhum efeito significativo no intervalo QTc foi detectado no pico da concentração plasmática ou em qualquer outro momento.
Farmacocinética
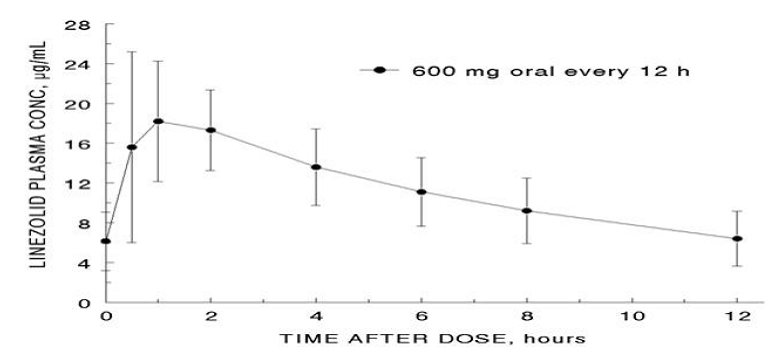
Os parâmetros farmacocinéticos médios de linezolida em adultos após doses orais e intravenosas únicas e múltiplas estão resumidos na Tabela 8. As concentrações plasmáticas de linezolida no estado de equilíbrio após doses orais de 600 mg administradas a cada 12 horas são mostradas na Figura 1.
Figura 1. Concentrações plasmáticas de linezolida em adultos em estado estacionário após dosagem oral a cada 12 horas (média ± desvio padrão, n=16)
Absorção
linezolida é amplamente absorvida após administração oral. As concentrações plasmáticas máximas são atingidas aproximadamente 1 a 2 horas após a administração e a biodisponibilidade absoluta é de aproximadamente 100%. Portanto, a linezolida pode ser administrada por via oral ou intravenosa sem ajuste de dose.
A linezolida pode ser administrada independentemente do horário das refeições. O tempo para atingir a concentração máxima é retardado de 1,5 horas para 2,2 horas e a Cmax é diminuída em cerca de 17% quando alimentos ricos em gordura são administrados com linezolida. No entanto, a exposição total medida como AUC0-∞ é semelhante em ambas as condições.
Distribuição
Estudos farmacocinéticos em animais e humanos demonstraram que a linezolida se distribui prontamente em tecidos bem perfundidos. A ligação da linezolida às proteínas plasmáticas é de aproximadamente 31% e é independente da concentração. O volume de distribuição de linezolida no estado de equilíbrio foi em média de 40 a 50 litros em voluntários adultos saudáveis.
As concentrações de linezolida foram determinadas em vários fluidos de um número limitado de indivíduos em estudos voluntários de Fase 1 após doses múltiplas de linezolida. A proporção de linezolida na saliva em relação ao plasma foi de 1,2 para 1 e a proporção de linezolida no suor em relação ao plasma foi de 0,55 para 1.
Metabolismo
A linezolida é metabolizada principalmente pela oxidação do anel morfolina, que resulta em dois metabólitos de ácido carboxílico inativos: o metabólito ácido aminoetoxiacético (A) e o metabólito hidroxietilglicina (B). Presume-se que a formação do metabólito A seja formada por uma via enzimática, enquanto o metabólito B é mediado por um mecanismo de oxidação química não enzimática in vitro. Estudos in vitro demonstraram que a linezolida é minimamente metabolizada e pode ser mediada pelo citocromo P450 humano. No entanto, a via metabólica da linezolida não é totalmente compreendida.
Excreção
depuração não renal é responsável por aproximadamente 65% da depuração total da linezolida. Sob condições de estado de equilíbrio, aproximadamente 30% da dose aparece na urina como linezolida, 40% como metabólito B e 10% como metabólito A. A depuração renal média de linezolida é de 40 mL/min, o que sugere reabsorção tubular líquida. Praticamente nenhum linezolida aparece nas fezes, enquanto aproximadamente 6% da dose aparece nas fezes como metabólito B e 3% como metabólito A.
Um pequeno grau de não linearidade na depuração foi observado com doses crescentes de linezolida, o que parece ser devido à menor depuração renal e não renal de linezolida em concentrações mais altas. No entanto, a diferença na depuração foi pequena e não se refletiu na meia-vida de eliminação aparente.
Populações Específicas
Pacientes Geriátricos
A farmacocinética da linezolida não é significativamente alterada em pacientes idosos (65 anos ou mais). Portanto, o ajuste de dose para pacientes geriátricos não é necessário.
Pacientes pediátricos
farmacocinética da linezolida após uma dose intravenosa única foi investigada em pacientes pediátricos com idades desde o nascimento até 17 anos (incluindo prematuros e recém-nascidos a termo), em adolescentes saudáveis com idades entre 12 e 17 anos e em pacientes pediátricos com idades entre 12 e 17 anos. na idade de 1 semana a 12 anos. Os parâmetros farmacocinéticos da linezolida estão resumidos na Tabela 9 para as populações pediátricas estudadas e indivíduos adultos saudáveis após administração de doses intravenosas únicas.
Cmax e o volume de distribuição (Vss) da linezolida são semelhantes, independentemente da idade em pacientes pediátricos. No entanto, a depuração plasmática da linezolida varia em função da idade. Com a exclusão de recém-nascidos prematuros com menos de uma semana de idade, a depuração com base no peso é mais rápida nas faixas etárias mais jovens, variando de
Valores médios diários de AUC semelhantes foram observados em pacientes pediátricos desde o nascimento até os 11 anos de idade administrados a cada 8 horas em relação a adolescentes ou adultos administrados a cada 12 horas. Portanto, a dosagem para pacientes pediátricos até 11 anos de idade deve ser de 10 mg/kg a cada 8 horas. Pacientes pediátricos com 12 anos ou mais devem receber 600 mg a cada 12 horas [ver DOSAGEM E ADMINISTRAÇÃO ].
Gênero
As fêmeas têm um volume de distribuição de linezolida ligeiramente menor do que os machos. As concentrações plasmáticas são mais elevadas nas mulheres do que nos homens, o que se deve em parte às diferenças de peso corporal. Após uma dose de 600 mg, a depuração oral média é aproximadamente 38% menor nas mulheres do que nos homens. No entanto, não há diferenças significativas entre os sexos na constante média da taxa de eliminação aparente ou na meia-vida. Assim, não se espera que a exposição à droga em mulheres aumente substancialmente além dos níveis conhecidos por serem bem tolerados. Portanto, o ajuste de dose por sexo não parece ser necessário.
Insuficiência renal
farmacocinética do medicamento original, linezolida, não é alterada em pacientes com qualquer grau de insuficiência renal; entretanto, os dois metabólitos primários da linezolida se acumulam em pacientes com insuficiência renal, com a quantidade de acúmulo aumentando com a gravidade da disfunção renal (ver Tabela 10). A farmacocinética da linezolida e seus dois metabólitos também foram estudados em pacientes com doença renal terminal (ESRD) em hemodiálise. No estudo ESRD, 14 pacientes receberam 600 mg de linezolida a cada 12 horas por 14,5 dias (ver Tabela 11). Como concentrações plasmáticas semelhantes de linezolida são alcançadas independentemente da função renal, nenhum ajuste de dose é recomendado para pacientes com insuficiência renal. No entanto, dada a ausência de informações sobre o significado clínico do acúmulo dos metabólitos primários, o uso de linezolida em pacientes com insuficiência renal deve ser ponderado em relação aos riscos potenciais de acúmulo desses metabólitos. Tanto a linezolida quanto os dois metabólitos são eliminados por hemodiálise. Não há informações disponíveis sobre o efeito da diálise peritoneal na farmacocinética da linezolida. Aproximadamente 30% de uma dose foi eliminada em uma sessão de hemodiálise de 3 horas, iniciada 3 horas após a administração da dose de linezolida; portanto, a linezolida deve ser administrada após a hemodiálise.
Insuficiência hepática
farmacocinética da linezolida não é alterada em pacientes (n=7) com insuficiência hepática leve a moderada (classe A ou B de Child-Pugh). Com base nas informações disponíveis, nenhum ajuste de dose é recomendado para pacientes com insuficiência hepática leve a moderada. A farmacocinética da linezolida em pacientes com insuficiência hepática grave não foi avaliada.
Interações medicamentosas
Fármacos Metabolizados Pelo Citocromo P450
linezolida não é um indutor do citocromo P450 (CYP450) em ratos. Além disso, a linezolida não inibe as atividades de isoformas de CYP humanas clinicamente significativas (por exemplo, 1A2, 2C9, 2C19, 2D6, 2E1, 3A4). Portanto, não se espera que a linezolida afete a farmacocinética de outras drogas metabolizadas por essas enzimas principais. A administração concomitante de linezolida não altera substancialmente as características farmacocinéticas da (S)-varfarina, que é extensamente metabolizada pelo CYP2C9. Medicamentos como varfarina e fenitoína, que são substratos do CYP2C9, podem ser administrados com linezolida sem alterações no regime de dosagem.
Medicamentos Antibacterianos
Aztreonam: A farmacocinética de linezolida ou aztreonam não é alterada quando administrados em conjunto.
Gentamicina: A farmacocinética da linezolida ou da gentamicina não é alterada quando administradas em conjunto.
Antioxidantes
potencial de interações medicamentosas com linezolida e os antioxidantes Vitamina C e Vitamina E foi estudado em voluntários saudáveis. Os indivíduos receberam uma dose oral de 600 mg de linezolida no Dia 1 e outra dose de 600 mg de linezolida no Dia 8. Nos dias 2-9, os indivíduos receberam Vitamina C (1.000 mg/dia) ou Vitamina E (800 UI/ dia). A AUC0-∞ da linezolida aumentou 2,3% quando coadministrada com Vitamina C e 10,9% quando coadministrada com Vitamina E. Nenhum ajuste de dose de linezolida é recomendado durante a coadministração com Vitamina C ou Vitamina E.
Indutores fortes de CYP 3A4
Rifampina
efeito da rifampicina na farmacocinética da linezolida foi avaliado em um estudo com 16 homens adultos saudáveis. Os voluntários receberam linezolida oral 600 mg duas vezes ao dia por 5 doses com e sem rifampicina 600 mg uma vez ao dia por 8 dias. A coadministração de rifampicina com linezolida resultou em uma diminuição de 21% na Cmax da linezolida [90% CI, 15% - 27%] e uma diminuição de 32% na linezolida AUC0-12 [90% CI, 27% - 37%]. O significado clínico desta interação é desconhecido. O mecanismo dessa interação não é totalmente compreendido e pode estar relacionado à indução de enzimas hepáticas. Outros indutores fortes de enzimas hepáticas (por exemplo, carbamazepina, fenitoína, fenobarbital) podem causar uma diminuição semelhante ou menor na exposição à linezolida.
Inibição da Monoamina Oxidase
A linezolida é um inibidor reversível e não seletivo da monoamina oxidase. Portanto, a linezolida tem potencial para interação com agentes adrenérgicos e serotoninérgicos.
Agentes adrenérgicos
Alguns indivíduos que recebem ZYVOX 600mg podem apresentar um aumento reversível da resposta pressora a agentes simpaticomiméticos de ação indireta, vasopressores ou agentes dopaminérgicos. Drogas comumente usadas, como fenilpropanolamina e pseudoefedrina, foram especificamente estudadas. As doses iniciais de agentes adrenérgicos, como dopamina ou epinefrina, devem ser reduzidas e tituladas para alcançar a resposta desejada.
Tiramina
Uma resposta pressora significativa foi observada em indivíduos adultos normais recebendo doses de linezolida e tiramina superiores a 100 mg. Portanto, os pacientes que recebem linezolida precisam evitar o consumo de grandes quantidades de alimentos ou bebidas com alto teor de tiramina [ver INFORMAÇÃO DO PACIENTE ].
Pseudoefedrina HCl ou fenilpropanolamina HCl
Um aumento reversível da resposta pressora de pseudoefedrina HCl (PSE) ou fenilpropanolamina HCl (PPA) é observado quando a linezolida é administrada a indivíduos normotensos saudáveis [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ]. Um estudo semelhante não foi realizado em pacientes hipertensos. Os estudos de interação realizados em indivíduos normotensos avaliaram os efeitos da pressão arterial e da frequência cardíaca de placebo, PPA ou PSE sozinho, linezolida sozinho e a combinação de linezolida em estado de equilíbrio (600 mg a cada 12 horas por 3 dias) com duas doses de PPA ( 25 mg) ou PSE (60 mg) administrados com 4 horas de intervalo. A frequência cardíaca não foi afetada por nenhum dos tratamentos. A pressão arterial foi aumentada com ambos os tratamentos de combinação. Os níveis máximos de pressão arterial foram observados 2 a 3 horas após a segunda dose de PPA ou PSE e retornaram à linha de base 2 a 3 horas após o pico. Seguem os resultados do estudo PPA, mostrando a média (e variação) da pressão arterial sistólica máxima em mm Hg: placebo = 121 (103 a 158); linezolida sozinho = 120 (107 a 135); PPA sozinho = 125 (106 a 139); PPA com linezolida = 147 (129 a 176). Os resultados do estudo PSE foram semelhantes aos do estudo PPA. O aumento médio máximo da pressão arterial sistólica em relação à linha de base foi de 32 mm Hg (intervalo: 20-52 mm Hg) e 38 mm Hg (intervalo: 18-79 mm Hg) durante a coadministração de linezolida com pseudoefedrina ou fenilpropanolamina, respectivamente.
Agentes serotoninérgicos
Dextrometorfano
A potencial interação medicamentosa com dextrometorfano foi estudada em voluntários saudáveis. Os indivíduos receberam dextrometorfano (duas doses de 20 mg administradas com 4 horas de intervalo) com ou sem linezolida. Não foram observados efeitos da síndrome serotoninérgica (confusão, delírio, inquietação, tremores, rubor, sudorese, hiperpirexia) em indivíduos normais recebendo linezolida e dextrometorfano.
Microbiologia
Mecanismo de ação
linezolida é um agente antibacteriano sintético da classe das oxazolidinonas, que tem utilidade clínica no tratamento de infecções causadas por bactérias Gram-positivas aeróbicas. O espectro de atividade in vitro da linezolida também inclui certas bactérias Gram-negativas e bactérias anaeróbicas. A linezolida se liga a um sítio no RNA ribossômico bacteriano 23S da subunidade 50S e previne a formação de um complexo de iniciação funcional 70S, que é essencial para a reprodução bacteriana. Os resultados dos estudos de time-kill mostraram que a linezolida é bacteriostática contra enterococos e estafilococos. Para estreptococos, a linezolida foi bactericida para a maioria dos isolados.
Resistência
Estudos in vitro mostraram que mutações pontuais no rRNA 23S estão associadas à resistência à linezolida. Foram publicados relatos de Enterococcus faecium resistente à vancomicina tornando-se resistente à linezolida durante seu uso clínico. Há relatos de Staphylococcus aureus (resistente à meticilina) desenvolvendo resistência à linezolida durante o uso clínico. A resistência à linezolida nestes organismos está associada a uma mutação pontual no rRNA 23S (substituição de timina por guanina na posição 2576) do organismo. Organismos resistentes a oxazolidinonas por meio de mutações em genes cromossômicos que codificam 23S rRNA ou proteínas ribossomais (L3 e L4) são geralmente resistentes a linezolida. Também foi relatada resistência à linezolida em estafilococos mediada pela enzima metiltransferase. Essa resistência é mediada pelo gene cfr (cloranfenicol-florfenicol) localizado em um plasmídeo que é transferível entre estafilococos.
Interação com outros medicamentos antimicrobianos
Estudos in vitro demonstraram aditividade ou indiferença entre linezolida e vancomicina, gentamicina, rifampicina, imipenem-cilastatina, aztreonam, ampicilina ou estreptomicina.
A linezolida demonstrou ser ativa contra a maioria dos isolados dos seguintes microrganismos, tanto in vitro quanto em infecções clínicas [ver INDICAÇÕES ].
Bactérias Gram-positivas
Enterococcus faecium (somente isolados resistentes à vancomicina) Staphylococcus aureus (incluindo isolados resistentes à meticilina) Streptococcus agalactiae Streptococcus pneumoniae Streptococcus pyogenes
Os seguintes dados in vitro estão disponíveis, mas seu significado clínico é desconhecido. Mais de 90% das seguintes bactérias exibem uma CIM in vitro menor ou igual ao ponto de ruptura suscetível à linezolida para organismos de gênero similar. A segurança e a eficácia da linezolida no tratamento de infecções clínicas causadas por essas bactérias não foram estabelecidas em ensaios clínicos adequados e bem controlados.
Bactérias Gram-positivas
Enterococcus faecalis (incluindo isolados resistentes à vancomicina) Enterococcus faecium (isolados sensíveis à vancomicina) Staphylococcus epidermidis (incluindo isolados resistentes à meticilina) Staphylococcus haemolyticus Estreptococos do grupo Viridans
Bactérias Gram-Negativas
Pasteurella multocida
Teste de suscetibilidade
Para obter informações específicas sobre os critérios interpretativos do teste de suscetibilidade e métodos de teste associados e padrões de controle de qualidade reconhecidos pela FDA para este medicamento, consulte: https://www.fda.gov/STIC.
Toxicologia e/ou Farmacologia Animal
Os órgãos-alvo de toxicidade da linezolida foram semelhantes em ratos e cães juvenis e adultos. Mielossupressão dependente da dose e do tempo, como evidenciado pela hipocelularidade da medula óssea/hematopoiese diminuída, hematopoiese extramedular diminuída no baço e fígado e níveis diminuídos de eritrócitos, leucócitos e plaquetas circulantes foram observados em estudos com animais. A depleção linfóide ocorreu no timo, linfonodos e baço. Geralmente, os achados linfoides foram associados à anorexia, perda de peso e supressão do ganho de peso corporal, o que pode ter contribuído para os efeitos observados.
Em ratos administrados por via oral de linezolida por 6 meses, foi observada degeneração axonal não reversível, mínima a leve dos nervos ciáticos na dose de 80 mg/kg/dia; degeneração mínima do nervo ciático também foi observada em 1 homem neste nível de dose em uma necropsia interina de 3 meses. A avaliação morfológica sensível de tecidos fixados por perfusão foi conduzida para investigar evidências de degeneração do nervo óptico. Degeneração mínima a moderada do nervo óptico foi evidente em 2 ratos machos após 6 meses de dosagem, mas a relação direta com a droga foi equívoca devido à natureza aguda do achado e sua distribuição assimétrica. A degeneração do nervo observada foi microscopicamente comparável à degeneração unilateral espontânea do nervo óptico relatada em ratos idosos e pode ser uma exacerbação da alteração de fundo comum.
Estes efeitos foram observados em níveis de exposição que são comparáveis aos observados em alguns seres humanos. Os efeitos hematopoiéticos e linfoides foram reversíveis, embora em alguns estudos a reversão tenha sido incompleta durante o período de recuperação.
Estudos clínicos
Adultos
Pneumonia nosocomial
Pacientes adultos com pneumonia nosocomial documentada clínica e radiologicamente foram incluídos em um estudo randomizado, multicêntrico e duplo-cego. Os pacientes foram tratados por 7 a 21 dias. Um grupo recebeu injeção de ZYVOX IV 600 mg a cada 12 horas, e o outro grupo recebeu vancomicina 1 g a cada 12 horas por via intravenosa. Ambos os grupos receberam aztreonam concomitante (1 a 2 g a cada 8 horas por via intravenosa), que poderia ser continuado se clinicamente indicado. Havia 203 pacientes tratados com linezolida e 193 pacientes tratados com vancomicina inscritos no estudo. Cento e vinte e dois (60%) pacientes tratados com linezolida e 103 (53%) pacientes tratados com vancomicina foram clinicamente avaliáveis. As taxas de cura em pacientes clinicamente avaliáveis foram de 57% para pacientes tratados com linezolida e 60% para pacientes tratados com vancomicina. As taxas de cura em pacientes clinicamente avaliáveis com pneumonia associada à ventilação mecânica foram de 47% para pacientes tratados com linezolida e 40% para pacientes tratados com vancomicina. Uma análise de intenção de tratamento modificada (MITT) de 94 pacientes tratados com linezolida e 83 pacientes tratados com vancomicina incluiu indivíduos que tiveram um patógeno isolado antes do tratamento. As taxas de cura na análise MITT foram de 57% em pacientes tratados com linezolida e 46% em pacientes tratados com vancomicina. As taxas de cura por patógeno para pacientes microbiologicamente avaliáveis são apresentadas na Tabela 12.
Infecções complicadas da pele e da estrutura da pele
Pacientes adultos com infecções complicadas da pele e da estrutura da pele clinicamente documentadas foram inscritos em um estudo randomizado, multicêntrico, duplo-cego e duplo simulado comparando os medicamentos do estudo administrados por via intravenosa seguidos por medicamentos administrados por via oral por um total de 10 a 21 dias de tratamento. Um grupo de pacientes recebeu ZYVOX IV Injeção 600 mg a cada 12 horas seguido por ZYVOX 600 mg Comprimidos 600 mg a cada 12 horas; o outro grupo recebeu oxacilina 2 g a cada 6 horas por via intravenosa seguida de dicloxacilina 500 mg a cada 6 horas por via oral. Os pacientes podem receber aztreonam concomitante se clinicamente indicado. Havia 400 pacientes tratados com linezolida e 419 pacientes tratados com oxacilina inscritos no estudo. Duzentos e quarenta e cinco (61%) pacientes tratados com linezolida e 242 (58%) pacientes tratados com oxacilina foram clinicamente avaliáveis. As taxas de cura em pacientes clinicamente avaliáveis foram de 90% em pacientes tratados com linezolida e 85% em pacientes tratados com oxacilina. Uma análise de intenção de tratamento modificada (MITT) de 316 pacientes tratados com linezolida e 313 pacientes tratados com oxacilina incluiu indivíduos que preencheram todos os critérios para entrada no estudo. As taxas de cura na análise MITT foram de 86% em pacientes tratados com linezolida e 82% em pacientes tratados com oxacilina. As taxas de cura por patógeno para pacientes microbiologicamente avaliáveis são apresentadas na Tabela 13.
Um estudo separado forneceu experiência adicional com o uso de ZYVOX no tratamento de infecções por Staphylococcus aureus resistentes à meticilina (MRSA). Este foi um estudo randomizado e aberto em pacientes adultos hospitalizados com infecção por MRSA documentada ou suspeita.
Um grupo de pacientes recebeu ZYVOX IV Injeção 600 mg a cada 12 horas seguido por ZYVOX Comprimidos 600 mg a cada 12 horas. O outro grupo de pacientes recebeu vancomicina 1 g a cada 12 horas por via intravenosa. Ambos os grupos foram tratados por 7 a 28 dias, e poderiam receber concomitantemente aztreonam ou gentamicina se clinicamente indicado. As taxas de cura em pacientes microbiologicamente avaliáveis com infecção de pele e estrutura da pele por MRSA foram 26/33 (79%) para pacientes tratados com linezolida e 24/33 (73%) para pacientes tratados com vancomicina.
Infecções do Pé Diabético
Pacientes diabéticos adultos com infecções complicadas da pele e da estrutura da pele clinicamente documentadas ("infecções do pé diabético") foram incluídos em um estudo randomizado (proporção 2:1), multicêntrico, aberto comparando medicamentos do estudo administrados por via intravenosa ou oral para um total de 14 a 28 dias de tratamento. Um grupo de pacientes recebeu ZYVOX 600 mg a cada 12 horas por via intravenosa ou oral; o outro grupo recebeu ampicilina/sulbactam 1,5 a 3 g por via intravenosa ou amoxicilina/clavulanato 500 a 875 mg a cada 8 a 12 horas por via oral. Em países onde ampicilina/sulbactam não é comercializado, amoxicilina/clavulanato 500 mg a 2 g a cada 6 horas foi usado para o regime intravenoso. Os pacientes do grupo comparador também podem ser tratados com vancomicina 1 g a cada 12 horas por via intravenosa se MRSA foi isolado da infecção do pé. Os pacientes em ambos os grupos de tratamento que tiveram bacilos Gram-negativos isolados do local da infecção também podem receber aztreonam 1 a 2 g a cada 8-12 horas por via intravenosa. Todos os pacientes foram elegíveis para receber métodos de tratamento adjuvantes apropriados, como desbridamento e descarga, conforme normalmente necessário no tratamento de infecções do pé diabético, e a maioria dos pacientes recebeu esses tratamentos. Havia 241 pacientes tratados com linezolida e 120 pacientes tratados com comparador na população de estudo com intenção de tratar (ITT). Duzentos e doze (86%) pacientes tratados com linezolida e 105 (85%) pacientes tratados com comparador foram clinicamente avaliados. Na população ITT, as taxas de cura foram de 68,5% (165/241) em pacientes tratados com linezolida e 64% (77/120) em pacientes tratados com comparador, onde aqueles com resultados indeterminados e ausentes foram considerados falhas. As taxas de cura nos pacientes clinicamente avaliáveis (excluindo aqueles com resultados indeterminados e ausentes) foram de 83% (159/192) e 73% (74/101) nos pacientes tratados com linezolida e comparador, respectivamente. Uma análise crítica post-hoc concentrou-se em 121 pacientes tratados com linezolida e 60 pacientes tratados com comparador que tinham um patógeno Gram-positivo isolado do local da infecção ou do sangue, que tinham menos evidência de osteomielite subjacente do que a população geral do estudo e que não receberam antimicrobianos proibidos. Com base nessa análise, as taxas de cura foram de 71% (86/121) nos pacientes tratados com linezolida e 63% (38/60) nos pacientes tratados com o comparador. Nenhuma das análises acima foi ajustada para o uso de terapias adjuvantes. As taxas de cura por patógeno para pacientes microbiologicamente avaliáveis são apresentadas na Tabela 14.
Infecções Enterocócicas Resistentes à Vancomicina
Pacientes adultos com infecção enterocócica resistente à vancomicina documentada ou suspeita foram incluídos em um estudo randomizado, multicêntrico, duplo-cego, comparando uma dose alta de ZYVOX (600 mg) com uma dose baixa de ZYVOX (200 mg) administrada a cada 12 horas. intravenosa (IV) ou oral por 7 a 28 dias. Os pacientes podem receber aztreonam ou aminoglicosídeos concomitantemente. Havia 79 pacientes randomizados para alta dose de linezolida e 66 para baixa dose de linezolida. A população com intenção de tratar (ITT) com infecção enterocócica resistente à vancomicina documentada no início do estudo consistiu de 65 pacientes no braço de alta dose e 52 no braço de baixa dose.
As taxas de cura para a população ITT com infecção enterocócica resistente à vancomicina documentada no início do estudo são apresentadas na Tabela 15 por fonte de infecção. Essas taxas de cura não incluem pacientes com resultados ausentes ou indeterminados. A taxa de cura foi maior no braço de alta dose do que no braço de baixa dose, embora a diferença não tenha sido estatisticamente significativa no nível de 0,05.
Pacientes pediátricos
Infecções por Bactérias Gram-positivas
Um estudo de segurança e eficácia forneceu experiência sobre o uso de ZYVOX 600mg em pacientes pediátricos para o tratamento de pneumonia nosocomial, infecções complicadas da pele e estruturas da pele e outras infecções causadas por patógenos bacterianos Gram-positivos, incluindo Staphylococcus aureus resistente e suscetível à meticilina e Enterococcus faecium resistente à vancomicina. Pacientes pediátricos com idades desde o nascimento até 11 anos com infecções causadas por bactérias Gram-positivas documentadas ou suspeitas foram incluídos em um estudo randomizado, openPage, controlado por comparador. Um grupo de pacientes recebeu ZYVOX 600mg IV Injeção 10 mg/kg a cada 8 horas seguido de ZYVOX 600mg para Suspensão Oral 10 mg/kg a cada 8 horas. Um segundo grupo recebeu vancomicina 10 a 15 mg/kg por via intravenosa a cada 6 a 24 horas, dependendo da idade e da depuração renal. Os pacientes que confirmaram infecções por VRE foram colocados em um terceiro braço do estudo e receberam ZYVOX 10 mg/kg a cada 8 horas por via intravenosa e/ou oral. Todos os pacientes foram tratados por um total de 10 a 28 dias e poderiam receber drogas antibacterianas Gram-negativas concomitantes, se clinicamente indicado. Na população com intenção de tratar (ITT), havia 206 pacientes randomizados para linezolida e 102 pacientes randomizados para vancomicina. As taxas de cura para ITT, MITT e pacientes clinicamente avaliáveis são apresentadas na Tabela 16. Após a conclusão do estudo, 13 pacientes adicionais com idades entre 4 dias e 16 anos foram incluídos em uma extensão aberta do braço VRE do estudar. A Tabela 17 fornece as taxas de cura clínica por patógeno para pacientes microbiologicamente avaliáveis, incluindo pacientes microbiologicamente avaliáveis com Enterococcus faecium resistente à vancomicina da extensão deste estudo.
INFORMAÇÃO DO PACIENTE
Instruções importantes de administração
Avise os pacientes que ZYVOX pode ser tomado com ou sem alimentos.
Neuropatia Periférica e Óptica
Aconselhe os pacientes a informarem seu médico se apresentarem alterações na visão enquanto estiverem tomando ZYVOX [ver AVISOS E PRECAUÇÕES ].
Síndrome da serotonina
Aconselhe os pacientes a informarem seu médico se estiverem tomando agentes serotoninérgicos, incluindo inibidores da recaptação de serotonina ou outros antidepressivos e opióides [ver AVISOS E PRECAUÇÕES ].
Interações Potenciais Produzindo Elevação da Pressão Arterial
- Aconselhe os pacientes a informarem seu médico se tiverem histórico de hipertensão.
- Aconselhe os pacientes a evitarem grandes quantidades de alimentos ou bebidas com alto teor de tiramina enquanto estiverem tomando ZYVOX. Alimentos com alto teor de tiramina incluem aqueles que podem ter sofrido alterações de proteínas por envelhecimento, fermentação, decapagem ou defumação para melhorar o sabor, como queijos envelhecidos, carnes fermentadas ou secas ao ar, chucrute, molho de soja, cervejas e vinhos tintos. O teor de tiramina de qualquer alimento rico em proteínas pode aumentar se armazenado por longos períodos ou refrigerado inadequadamente.
- Aconselhe os pacientes a informarem seu médico se estiverem tomando medicamentos contendo pseudoefedrina HCl ou fenilpropanolamina HCl, como remédios para resfriado e descongestionantes [ver AVISOS E PRECAUÇÕES ].
Acidose láctica
Aconselhe os pacientes a informarem seu médico se apresentarem episódios repetidos de náusea ou vômito durante o tratamento com ZYVOX [ver AVISOS E PRECAUÇÕES ].
Convulsões
Aconselhe os pacientes a informarem seu médico se tiverem histórico de convulsões ou convulsões [ver AVISOS E PRECAUÇÕES ].
Hipoglicemia
Aconselhe os pacientes a informarem seu médico se tiverem diabetes mellitus. Reações hipoglicêmicas, como sudorese e tremores, juntamente com medições baixas de glicose no sangue, podem ocorrer quando tratados com linezolida. Se tais reações ocorrerem, os pacientes devem contatar um médico ou outro profissional de saúde para tratamento adequado [ver AVISOS E PRECAUÇÕES ].
Hiponatremia e/ou SIADH
Aconselhe os pacientes em risco de hiponatremia a informar seu médico se apresentarem sinais e sintomas de hiponatremia e/ou SIADH, incluindo confusão, sonolência, fraqueza generalizada e dificuldade respiratória [ver AVISOS E PRECAUÇÕES ].
Fenilcetonúria
Aconselhe os pacientes com fenilcetonúria (PKU) que cada 5 mL de 100 mg/5 mL de ZYVOX para Suspensão Oral contém 20 mg de fenilalanina. As outras formulações de ZYVOX 600mg não contêm fenilalanina. A fenilalanina pode ser prejudicial para pacientes com fenilcetonúria. Contacte o seu médico ou farmacêutico quando lhe for receitado ZYVOX 600mg para Suspensão Oral [ver AVISOS E PRECAUÇÕES ].
Resistência Antibacteriana
Os pacientes devem ser informados de que os medicamentos antibacterianos, incluindo ZYVOX, devem ser usados apenas para tratar infecções bacterianas. Eles não tratam infecções virais (por exemplo, o resfriado comum). Quando ZYVOX 600mg é prescrito para tratar uma infecção bacteriana, os pacientes devem ser informados de que, embora seja comum sentir-se melhor no início do tratamento, a medicação deve ser tomada exatamente como indicado. Pular doses ou não completar o curso completo da terapia pode diminuir a eficácia do tratamento imediato e aumentar a probabilidade de que as bactérias desenvolvam resistência e não sejam tratáveis por ZYVOX ou outros medicamentos antibacterianos no futuro.
Diarréia
diarreia é um problema comum causado por medicamentos antibacterianos, que geralmente termina quando o medicamento antibacteriano é descontinuado. Às vezes, após o início do tratamento com medicamentos antibacterianos, os pacientes podem desenvolver fezes aquosas e sanguinolentas (com ou sem cólicas estomacais e febre), mesmo dois ou mais meses após a última dose do medicamento antibacteriano. Se isso ocorrer, os pacientes devem entrar em contato com seu médico o mais rápido possível [ver AVISOS E PRECAUÇÕES ].
Infertilidade
Aconselhe os pacientes do sexo masculino que ZYVOX pode prejudicar reversivelmente a fertilidade [ver Uso em populações específicas ].
A rotulagem deste produto pode ter sido atualizada. Para obter as informações de prescrição mais recentes, visite www.pfizer.com.
