Biaxin 250mg, 500mg Clarithromycin Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
que é Biaxin 500mg e como é usado?
Biaxin é um medicamento de prescrição usado para tratar os sintomas de muitas infecções bacterianas diferentes, incluindo úlceras estomacais e Helicobacter pylori. Biaxin pode ser usado sozinho ou com outros medicamentos.
Biaxin 500mg é um antibiótico.
Não se sabe se Biaxin é seguro e eficaz em crianças com menos de 6 meses de idade.
Quais são os possíveis efeitos colaterais do Biaxin 250mg?
Biaxin 500mg pode causar efeitos colaterais graves, incluindo:
- dor de estômago severa,
- diarreia contendo sangue,
- batimentos cardíacos rápidos ou acelerados,
- vibrando em seu peito,
- falta de ar,
- tontura repentina,
- confusão,
- sensação de giro,
- perda de apetite,
- dor de estômago superior,
- cansaço,
- urina escura,
- fezes cor de barro,
- amarelecimento dos olhos e da pele (icterícia),
- pouca ou nenhuma urina,
- inchaço nos pés ou tornozelos,
- sentindo-se cansado,
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Biaxin incluem:
- dor de estômago,
- náusea,
- vômito,
- diarréia,
- gosto incomum ou desagradável na boca,
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Biaxin. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
claritromicina é um antimicrobiano macrolídeo semi-sintético para uso oral. Quimicamente, é 6-0metileritromicina. A fórmula molecular é C38H69NO13 e o peso molecular é 747,96. A fórmula estrutural é:
Figura 1: Estrutura da Claritromicina
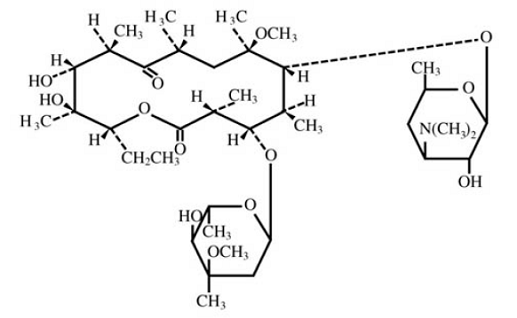
A claritromicina é um pó cristalino branco a esbranquiçado. É solúvel em acetona, ligeiramente solúvel em metanol, etanol e acetonitrila e praticamente insolúvel em água.
BIAXIN está disponível na forma de comprimidos de liberação imediata, comprimidos de liberação prolongada e grânulos para suspensão oral.
Cada comprimido oval amarelo de liberação imediata de BIAXIN Filmtab (comprimidos de claritromicina, USP) contém 250 mg ou 500 mg de claritromicina e os seguintes ingredientes inativos:
- Comprimidos de 250 mg: hipromelose, hidroxipropilcelulose, croscarmelose sódica, D&C Yellow No. 10, FD&C Blue No. 1, estearato de magnésio, celulose microcristalina, povidona, amido pré-gelatinizado, propilenoglicol, dióxido de silício, ácido sórbico, monooleato de sorbitano, ácido esteárico, talco, dióxido de titânio e vanilina.
- Comprimidos de 500 mg: hipromelose, hidroxipropilcelulose, dióxido de silício coloidal, croscarmelose sódica, D&C Amarelo nº 10, estearato de magnésio, celulose microcristalina, povidona, propilenoglicol, ácido sórbico, monooleato de sorbitano, dióxido de titânio e vanilina.
Cada comprimido oval amarelo de BIAXIN XL Filmtab revestido por película (comprimidos de liberação prolongada de claritromicina) contém 500 mg de claritromicina e os seguintes ingredientes inativos: polímeros celulósicos, D&C Amarelo No. 10, lactose monohidratada, estearato de magnésio, propilenoglicol, ácido sórbico, sorbitano monooleato, talco, dióxido de titânio e vanilina.
Cada 5 mL de suspensão reconstituída de BIAXIN 500 mg (claritromicina para suspensão oral, USP) contém 125 mg ou 250 mg de claritromicina. Cada frasco de BIAXIN granulado contém 1250 mg (tamanho de 50 mL), 2500 mg (tamanho de 50 e 100 mL) ou 5000 mg (tamanho de 100 mL) de claritromicina e os seguintes ingredientes inativos: carbômero, óleo de rícino, ácido cítrico, ftalato de hipromelose, maltodextrina, sorbato de potássio, povidona, dióxido de silício, sacarose, goma xantana, dióxido de titânio e aroma de ponche de frutas.
INDICAÇÕES
Exacerbação Bacteriana Aguda da Bronquite Crônica
BIAXIN (Filmtab, Granules) e BIAXIN XL Filmtab são indicados em adultos para o tratamento de infecções leves a moderadas causadas por isolados suscetíveis devido a Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis ou Streptococcus pneumoniae [ver INDICAÇÕES E USO ].
Sinusite Maxilar Aguda
BIAXIN (Filmtab, Granules) e BIAXIN 500mg XL Filmtab (em adultos) são indicados para o tratamento de infecções leves a moderadas causadas por isolados suscetíveis devido a Haemophilus influenzae, Moraxella catarrhalis ou Streptococcus pneumoniae [ver INDICAÇÕES E USO ].
Pneumonia adquirida na comunidade
BIAXIN (Filmtab, Granules) e BIAXIN XL Filmtab são indicados [ver INDICAÇÕES E USO ] para o tratamento de infecções leves a moderadas causadas por isolados suscetíveis devido a:
- Haemophilus influenzae (em adultos)
- Haemophilus parainfluenzae (BIAXIN 500mg XL Filmtab em adultos)
- Moraxella catarrhalis (BIAXIN 250mg XL Filmtab em adultos)
- Mycoplasma pneumoniae, Streptococcus pneumoniae, Chlamydophila pneumoniae (BIAXIN 500mg XL Filmtab [em adultos]; BIAXIN Filmtab e BIAXIN Granules [em adultos e pacientes pediátricos])
Faringite/Amigdalite
BIAXIN 500mg Filmtab e BIAXIN 500mg Granules são indicados para o tratamento de infecções leves a moderadas causadas por isolados suscetíveis por Streptococcus pyogenes como alternativa em indivíduos que não podem utilizar terapia de primeira linha.
Infecções não complicadas da pele e da estrutura da pele
BIAXIN Filmtab e BIAXIN Granules são indicados para o tratamento de infecções leves a moderadas causadas por isolados suscetíveis devido a Staphylococcus aureus ou Streptococcus pyogenes.
Otite Média Aguda
BIAXIN Filmtab e BIAXIN 250mg Granules são indicados em pacientes pediátricos para o tratamento de infecções leves a moderadas causadas por isolados suscetíveis devido a Haemophilus influenzae, Moraxella catarrhalis ou Streptococcus pneumoniae [ver Estudos clínicos ].
Tratamento e profilaxia de infecções micobacterianas disseminadas
BIAXIN 500mg Filmtab e BIAXIN 250mg Granules são indicados para o tratamento de infecções leves a moderadas causadas por isolados suscetíveis devido a Mycobacterium avium ou Mycobacterium intracellulare em pacientes com infecção avançada pelo HIV [ver Estudos clínicos ].
Infecção por Helicobacter Pylori e Doença da Úlcera Duodenal
BIAXIN 250mg Filmtab é administrado em combinação com outros medicamentos em adultos, conforme descrito abaixo, para erradicar o H. pylori. A erradicação do H. pylori demonstrou reduzir o risco de recorrência da úlcera duodenal [ver Estudos clínicos ].
- BIAXIN Filmtab em combinação com amoxicilina e PREVACID (lansoprazol) ou PRILOSEC (omeprazol) Cápsulas de Liberação Retardada, como terapia tripla, são indicados para o tratamento de pacientes com infecção por H. pylori e úlcera duodenal (atividade ou história de cinco anos de doença duodenal úlcera) para erradicar o H. pylori.
- BIAXIN 250mg Filmtab em combinação com PRILOSEC (omeprazol) cápsulas são indicados para o tratamento de pacientes com úlcera duodenal ativa associada à infecção por H. pylori. Os regimes que contêm BIAXIN 250mg Filmtab como agente antibacteriano único têm maior probabilidade de estar associados ao desenvolvimento de resistência à claritromicina em pacientes que falharam na terapia. Regimes contendo claritromicina não devem ser usados em pacientes com isolados conhecidos ou suspeitos de resistência à claritromicina porque a eficácia do tratamento é reduzida neste cenário.
Limitações de uso
BIAXIN 500mg XL Filmtab é indicado apenas para sinusite maxilar aguda, exacerbação bacteriana aguda de bronquite crônica e pneumonia adquirida na comunidade em adultos. A eficácia e segurança de BIAXIN 500mg XL Filmtab no tratamento de outras infecções para as quais BIAXIN Filmtab e BIAXIN Granules são aprovados não foram estabelecidas.
Há resistência aos macrolídeos em certas infecções bacterianas causadas por Streptococcus pneumoniae e Staphylococcus aureus. O teste de suscetibilidade deve ser realizado quando clinicamente indicado.
Uso
Para reduzir o desenvolvimento de bactérias resistentes aos medicamentos e manter a eficácia de BIAXIN e de outros medicamentos antibacterianos, BIAXIN deve ser usado apenas para tratar ou prevenir infecções comprovadas ou fortemente suspeitas de serem causadas por bactérias suscetíveis. Quando as informações de cultura e suscetibilidade estiverem disponíveis, elas devem ser consideradas na seleção ou modificação da terapia antibacteriana. Na ausência de tais dados, a epidemiologia local e os padrões de suscetibilidade podem contribuir para a seleção empírica da terapia.
DOSAGEM E ADMINISTRAÇÃO
Instruções importantes de administração
BIAXIN Filmtab e BIAXIN 250mg Granules podem ser administrados com ou sem alimentos.
BIAXIN XL Filmtab deve ser tomado com alimentos. Engula BIAXIN 500mg XL Filmtab inteiro; não mastigue, quebre ou esmague BIAXIN 500mg XL Filmtab.
Dosagem para Adultos
As dosagens recomendadas de BIAXIN 250mg Filmtab e BIAXIN 250mg XL Filmtab para o tratamento de infecções leves a moderadas em adultos estão listadas na Tabela 1.
Regimes de dosagem de combinação para infecção por H. pylori
- Terapia tripla: BIAXIN 500mg Filmtab/lansoprazol/amoxicilina A dosagem recomendada para adultos é de 500 mg de BIAXIN 500 mg de Filmtab, 30 mg de lansoprazol e 1 grama de amoxicilina, todos administrados a cada 12 horas por 10 ou 14 dias [ver INDICAÇÕES E USO e Estudos clínicos ].
- Terapia tripla: BIAXIN Filmtab/omeprazol/amoxicilina A dosagem recomendada para adultos é de 500 mg de BIAXIN 250 mg de Filmtab, 20 mg de omeprazol e 1 grama de amoxicilina; todos administrados a cada 12 horas por 10 dias. Em pacientes com úlcera presente no momento do início da terapia, recomenda-se 18 dias adicionais de omeprazol 20 mg uma vez ao dia para cicatrização da úlcera e alívio dos sintomas. INDICAÇÕES E USO e Estudos clínicos ].
- Terapia dupla: BIAXIN 500mg Filmtab/omeprazol dosagem recomendada para adultos é de 500 mg de BIAXIN 250 mg de Filmtab administrado a cada 8 horas e 40 mg de omeprazol administrado uma vez todas as manhãs durante 14 dias. Um adicional de 14 dias de omeprazol 20 mg uma vez ao dia é recomendado para cicatrização da úlcera e alívio dos sintomas [ver INDICAÇÕES E USO e Estudos clínicos ].
Dosagem Pediátrica
A dose diária recomendada é de 15 mg/kg/dia dividida a cada 12 horas por 10 dias (até a dose de adulto). Consulte os regimes de dosagem para infecções micobacterianas em pacientes pediátricos para obter informações adicionais sobre a dosagem [ver Regimes de dosagem para infecções micobacterianas ].
Regimes de dosagem para infecções micobacterianas
Para o tratamento de infecção disseminada por Mycobacterium avium complex (MAC), BIAXIN Filmtab e BIAXIN 500mg Granules são recomendados como agentes primários. BIAXIN Filmtab e BIAXIN Granules devem ser usados em combinação com outros medicamentos antimicobacterianos (por exemplo, etambutol) que demonstraram atividade in vitro contra MAC ou benefício clínico no tratamento de MAC [ver Estudos clínicos ].
Pacientes adultos
Para tratamento e profilaxia de infecções micobacterianas em adultos, a dose recomendada de BIAXIN é de 500 mg a cada 12 horas.
Pacientes pediátricos
Para tratamento e profilaxia de infecções micobacterianas em pacientes pediátricos, a dose recomendada é de 7,5 mg/kg a cada 12 horas até 500 mg a cada 12 horas. [Ver Uso em populações específicas e Estudos clínicos ].
A terapia com BIAXIN 250mg deve continuar se for observada resposta clínica. BIAXIN pode ser descontinuado quando o paciente for considerado de baixo risco de infecção disseminada.
Ajuste de Dosagem em Pacientes com Insuficiência Renal
Consulte a Tabela 2 para ajuste de dose em pacientes com insuficiência renal moderada ou grave com ou sem regimes concomitantes contendo atazanavir ou ritonavir [ver INTERAÇÕES MEDICAMENTOSAS ].
Ajuste de dosagem devido a interações medicamentosas
Diminuir a dose de BIAXIN 500mg em 50% quando coadministrado com atazanavir [ver INTERAÇÕES MEDICAMENTOSAS ]. Ajustes de dosagem para outros medicamentos quando coadministrados com BIAXIN 250mg podem ser recomendados devido a interações medicamentosas [ver INTERAÇÕES MEDICAMENTOSAS ].
Reconstituição de grânulos de BIAXIN
Os grânulos de BIAXIN 250mg fornecidos devem ser reconstituídos com água antes da administração de BIAXIN para suspensão oral. A Tabela 3 abaixo indica o volume de água a ser adicionado durante a reconstituição. Para reconstituir:
Agite bem antes de cada uso. Após a mistura, armazene a 15° a 30°C (59° a 86°F) e use dentro de 14 dias. Não refrigerar.
COMO FORNECIDO
Formas de dosagem e pontos fortes
BIAXIN 500mg está disponível como:
- BIAXIN 250mg Filmtab (comprimido revestido por película oval amarelo):
- 250 mg: impresso em azul com o logotipo “a” e KT
- 500 mg: gravado com o logotipo “a” de um lado e KL no lado oposto
- BIAXIN XL Filmtab (comprimido de liberação prolongada revestido por película oval amarelo):
- 500 mg: gravado com o logotipo “a” e KJ
- BIAXIN Granules (grânulos brancos a esbranquiçados antes da reconstituição; suspensão opaca branca a esbranquiçada após a reconstituição):
- Concentração de 125 mg/5 mL disponível em frascos de 50 mL e 100 mL
- Concentração de 250 mg/5 mL disponível em frascos de 50 mL e 100 mL
Armazenamento e manuseio
BIAXIN 250mg Filmtab (comprimidos de claritromicina, USP) é fornecido sob a forma de comprimidos revestidos por película amarelos ovais nas seguintes embalagens: Comprimidos de 250 mg: (impresso a azul com o logótipo “a” e KT)
Garrafas de 60 ( NDC 0074-3368-60) e embalagens de tiras de dose unitária de 100 ( NDC 0074-3368-11).
Armazene BIAXIN Filmtab 250 mg em temperatura ambiente controlada de 15° a 30°C (59° a 86°F) em um recipiente bem fechado. Proteja da luz.
comprimidos de 500 mg : (gravado com o logotipo “a” de um lado e KL no lado oposto)
Frascos de 60 (NDC 0074-2586-60) e embalagens de tiras de dose unitária de 100 ( NDC 0074-2586-11).
Armazene BIAXIN Filmtab 500 mg em temperatura ambiente controlada de 20° a 25°C (68° a 77°F) em um recipiente bem fechado.
BIAXIN XL Filmtab (comprimidos de liberação prolongada de claritromicina) é fornecido sob a forma de comprimidos revestidos por película amarelos ovais nas seguintes dimensões de embalagem:
comprimidos de 500 mg : (gravado com o logotipo “a” e KJ)
Frascos de 60 (NDC 0074-3165-60), embalagens de tiras de dose unitária de 100 ( NDC 0074-3165-11), e BIAXIN XL PAC caixa de 4 embalagens blister de 14 comprimidos cada ( NDC 0074-3165-41).
Armazene BIAXIN 500mg XL Filmtab a 20° a 25°C (68° a 77°F). Excursões permitidas de 15° a 30°C (59° a 86°F). [Ver Temperatura ambiente controlada USP .]
BIAXIN 500mg Granules (claritromicina para suspensão oral, USP) é fornecido como grânulos brancos a esbranquiçados nas seguintes dosagens e tamanhos:
Armazene BIAXIN 500mg Granulados abaixo de 25°C (77°F) em um recipiente bem fechado. Não refrigerar os grânulos reconstituídos de BIAXIN 500mg.
BIAXIN Filmtab 250 mg e 500 mg e BIAXIN 250 mg XL Filmtab 500 mg Mfd. por AbbVie LTD, Barceloneta, PR 00617. BIAXIN Granules, 125 mg/5 mL e 250 mg/5 mL Mfd. por AbbVie Inc., North Chicago, IL 60064 Para AbbVie Inc., North Chicago, IL 60064, EUA Revisado: novembro de 2018.
EFEITOS COLATERAIS
As seguintes reações adversas graves estão descritas abaixo e em outras partes da bula:
- Reações de hipersensibilidade aguda [ver AVISOS E PRECAUÇÕES ]
- Prolongamento QT [ver AVISOS E PRECAUÇÕES ]
- Hepatotoxicidade [ver AVISOS E PRECAUÇÕES ]
- Reações Adversas Graves Devido ao Uso Concomitante com Outros Medicamentos [ver AVISOS E PRECAUÇÕES ]
- Diarreia Associada a Clostridium difficile [ver AVISOS E PRECAUÇÕES ]
- Exacerbação da Miastenia Gravis [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os estudos clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos estudos clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Com base em dados agrupados em todas as indicações, as reações adversas mais frequentes para a população adulta e pediátrica observadas em ensaios clínicos são dor abdominal, diarreia, náuseas, vómitos e disgeusia. Também foram relatados dispepsia, teste de função hepática anormal, reação anafilática, candidíase, dor de cabeça, insônia e erupção cutânea.
As subseções subsequentes listam as reações adversas mais comuns para profilaxia e tratamento de infecções micobacterianas e úlcera duodenal associadas à infecção por H. pylori. Em geral, esses perfis são consistentes com os dados agrupados descritos acima.
Profilaxia de Infecções Micobacterianas
Em pacientes com AIDS tratados com BIAXIN por longos períodos de tempo para profilaxia contra M. avium, muitas vezes foi difícil distinguir reações adversas possivelmente associadas à administração de BIAXIN de doença subjacente pelo HIV ou doença intercorrente. A duração média do tratamento foi de 10,6 meses para o grupo BIAXIN e 8,2 meses para o grupo placebo.
Mudanças nos valores laboratoriais
As experiências adversas laboratoriais selecionadas que foram relatadas durante a terapia em mais de 2% dos pacientes adultos tratados com BIAXIN em um ensaio clínico randomizado duplo-cego envolvendo 682 pacientes são apresentadas na Tabela 5.
Em pacientes imunocomprometidos recebendo profilaxia contra M. avium, as avaliações dos valores laboratoriais foram feitas analisando os valores fora do valor gravemente anormal (ou seja, o limite extremo alto ou baixo) para o teste especificado.
Tratamento de infecções micobacterianas
Os perfis de reações adversas para os regimes de dose de 500 mg e 1000 mg duas vezes ao dia foram semelhantes.
Em pacientes com AIDS e outros pacientes imunocomprometidos tratados com doses mais altas de BIAXIN por longos períodos de tempo para infecções micobacterianas, muitas vezes foi difícil distinguir reações adversas possivelmente associadas à administração de BIAXIN 250mg de sinais subjacentes de doença por HIV ou doença intercorrente.
análise a seguir resume a experiência durante as primeiras 12 semanas de terapia com BIAXIN. Os dados são relatados separadamente para o estudo 1 (randomizado, duplo-cego) e o estudo 2 (aberto, uso compassivo) e também combinados. As reações adversas foram relatadas com menos frequência no estudo 2, o que pode ser devido, em parte, às diferenças no monitoramento entre os dois estudos.
Em pacientes adultos recebendo BIAXIN 500 mg duas vezes ao dia, as reações adversas mais frequentemente relatadas, consideradas possivelmente ou possivelmente relacionadas ao medicamento em estudo, com incidência de 5% ou mais, estão listadas abaixo (Tabela 6). Aproximadamente 8% dos pacientes que receberam 500 mg duas vezes ao dia e 12% dos pacientes que receberam 1000 mg duas vezes ao dia interromperam a terapia devido a reações adversas relacionadas ao medicamento durante as primeiras 12 semanas de terapia; reações adversas que levaram à descontinuação em pelo menos 2 pacientes incluíram náuseas, vômitos, dor abdominal, diarreia, erupção cutânea e astenia.
Um número limitado de pacientes pediátricos com AIDS foi tratado com BIAXIN suspensão para infecções micobacterianas. As reações adversas notificadas com mais frequência, excluindo as devidas às condições concomitantes do doente, foram consistentes com as observadas em doentes adultos.
Mudanças nos valores laboratoriais
Nas primeiras 12 semanas de início de BIAXIN 500 mg duas vezes ao dia, 3% dos pacientes tiveram aumentos de SGOT e 2% dos pacientes tiveram aumentos de SGPT > 5 vezes o limite superior do normal no ensaio 2 (469 pacientes adultos inscritos) enquanto o ensaio 1 (154 pacientes inscritos) não tiveram elevação das transaminases. Isso inclui apenas pacientes com valores basais dentro da faixa normal ou limítrofe baixo.
Úlcera Duodenal Associada à Infecção por H. pylori
Em ensaios clínicos usando terapia combinada com BIAXIN 500mg mais omeprazol e amoxicilina, não foram observadas reações adversas específicas para a combinação desses medicamentos. As reações adversas que ocorreram foram limitadas àquelas que foram previamente relatadas com BIAXIN 250mg, omeprazol ou amoxicilina.
Os perfis de reações adversas são mostrados abaixo (Tabela 7) para quatro ensaios clínicos randomizados duplo-cegos nos quais os pacientes receberam a combinação de BIAXIN 500 mg três vezes ao dia e omeprazol 40 mg diariamente por 14 dias, seguido de omeprazol 20 mg uma vez ao dia dia (três estudos) ou 40 mg uma vez ao dia (um estudo) por mais 14 dias. Dos 346 pacientes que receberam a combinação, 3,5% dos pacientes descontinuaram o medicamento devido a reações adversas.
Mudanças nos valores laboratoriais
As alterações nos valores laboratoriais com possível significado clínico em pacientes tomando BIAXIN e omeprazol em quatro estudos duplo-cegos randomizados em 945 pacientes são as seguintes:
Hepático bilirrubina direta elevada
Reações adversas menos frequentes observadas durante ensaios clínicos de claritromicina
Com base em dados agrupados em todas as indicações, as seguintes reações adversas foram observadas em ensaios clínicos com claritromicina a uma taxa inferior a 1%:
Distúrbios do Sangue e do Sistema Linfático: Leucopenia, neutropenia, trombocitemia, eosinofilia
Distúrbios cardíacos: Eletrocardiograma QT prolongado, parada cardíaca, fibrilação atrial, extrassístoles, palpitações
Distúrbios do ouvido e labirinto: Vertigem, zumbido, deficiência auditiva
Problemas gastrointestinais: Estomatite, glossite, esofagite, doença do refluxo gastroesofágico, gastrite, proctalgia, distensão abdominal, constipação, boca seca, eructação, flatulência
Distúrbios Gerais e Condições do Local de Administração: Mal-estar, pirexia, astenia, dor no peito, calafrios, fadiga
Distúrbios hepatobiliares: Colestase, hepatite
Distúrbios do sistema imunológico: Hipersensibilidade
Infecções e Infestações: Celulite, gastroenterite, infecção, infecção vaginal
Investigações: Aumento da bilirrubina sanguínea, aumento da fosfatase alcalina sanguínea, aumento da lactato desidrogenase sanguínea, razão albumina globulina anormal
Distúrbios do Metabolismo e Nutrição: Anorexia, diminuição do apetite
Distúrbios musculoesqueléticos e do tecido conjuntivo: Mialgia, espasmos musculares, rigidez nucal
Distúrbios do sistema nervoso: Tonturas, tremores, perda de consciência, discinesia, sonolência
Distúrbios psiquiátricos: Ansiedade, nervosismo
Distúrbios Renais e Urinários: Aumento da creatinina no sangue, aumento da ureia no sangue
Distúrbios respiratórios, torácicos e mediastinais: Asma, epistaxe, embolia pulmonar
Distúrbios da Pele e Tecidos Subcutâneos: Urticária, dermatite bolhosa, prurido, hiperidrose, exantema maculopapular
Reações Adversas Gastrointestinais
Nos estudos de exacerbação aguda de bronquite crônica e sinusite maxilar aguda, reações adversas gastrointestinais gerais foram relatadas por uma proporção semelhante de pacientes tomando BIAXIN 250mg Filmtab ou BIAXIN 500mg XL Filmtab; no entanto, os pacientes que tomaram BIAXIN 500mg XL Filmtab relataram sintomas gastrointestinais significativamente menos graves em comparação com os pacientes que tomaram BIAXIN 250mg Filmtab. Além disso, os pacientes que tomaram BIAXIN 500mg XL Filmtab tiveram significativamente menos descontinuações prematuras por reações adversas gastrointestinais ou gustativas anormais relacionadas ao medicamento em comparação com BIAXIN Filmtab.
Mortalidade por todas as causas em pacientes com doença arterial coronariana 1 a 10 anos após exposição a BIAXIN
Em um ensaio clínico que avaliou o tratamento com claritromicina sobre os resultados em pacientes com doença arterial coronariana, foi observado um aumento no risco de mortalidade por todas as causas em pacientes randomizados para claritromicina. A claritromicina para o tratamento da doença arterial coronariana não é uma indicação aprovada. Os pacientes foram tratados com claritromicina ou placebo por 14 dias e observados quanto a eventos de desfecho primário (por exemplo, mortalidade por todas as causas ou eventos cardíacos não fatais) por vários anos.1 Um número numericamente maior de eventos de desfecho primário em pacientes randomizados para receber claritromicina foi observado com uma razão de risco de 1,06 (intervalo de confiança de 95% 0,98 a 1,14). No entanto, no seguimento de 10 anos após o tratamento, houve 866 (40%) mortes no grupo claritromicina e 815 (37%) mortes no grupo placebo, o que representou uma razão de risco para mortalidade por todas as causas de 1,10 (95% intervalo de confiança de 1,00 a 1,21). A diferença no número de óbitos surgiu após um ano ou mais após o término do tratamento.
causa da diferença na mortalidade por todas as causas não foi estabelecida. Outros estudos epidemiológicos avaliando esse risco mostraram resultados variáveis [ver AVISOS E PRECAUÇÕES ].
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de BIAXIN. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Sangue e Sistema Linfático: Trombocitopenia, agranulocitose
Cardíaco: Arritmia ventricular, taquicardia ventricular, torsades de pointes
Ouvido e Labirinto: A surdez foi relatada principalmente em mulheres idosas e geralmente era reversível.
Gastrointestinal: Pancreatite aguda, descoloração da língua, descoloração dos dentes foi relatada e geralmente reversível com limpeza profissional após a descontinuação do medicamento.
Houve relatos de BIAXIN 250mg XL Filmtab nas fezes, muitos dos quais ocorreram em pacientes com distúrbios gastrointestinais anatômicos (incluindo ileostomia ou colostomia) ou funcionais com tempos de trânsito GI encurtados. Em vários relatórios, os resíduos de comprimidos ocorreram no contexto de diarreia. Recomenda-se que os doentes que apresentem resíduos de comprimidos nas fezes e não apresentem melhoria do seu estado sejam trocados por uma formulação diferente de claritromicina (por exemplo, suspensão) ou outro fármaco antibacteriano.
Hepatobiliar: Insuficiência hepática, icterícia hepatocelular. Reações adversas relacionadas à disfunção hepática foram relatadas com claritromicina [ver AVISOS E PRECAUÇÕES ].
Infecções e Infestações: Colite pseudomembranosa [ver AVISOS E PRECAUÇÕES ]
Sistema imunológico: Reações anafiláticas, angioedema
Investigações: Tempo de protrombina prolongado, contagem de leucócitos diminuída, razão normalizada internacional aumentada. Cor anormal da urina foi relatada, associada a insuficiência hepática.
Metabolismo e Nutrição: Hipoglicemia foi relatada em pacientes tomando agentes hipoglicemiantes orais ou insulina.
Tecido Musculoesquelético e Conjuntivo: Miopatia rabdomiólise foi relatada e em alguns dos relatos, claritromicina foi administrada concomitantemente com estatinas, fibratos, colchicina ou alopurinol [ver CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Sistema nervoso: Parosmia, anosmia, ageusia, parestesia e convulsões
Psiquiátrico: Comportamento anormal, estado confusional, despersonalização, desorientação, alucinação, depressão, comportamento maníaco, sonho anormal, transtorno psicótico. Esses distúrbios geralmente se resolvem com a descontinuação do medicamento.
Renal e Urinário: Nefrite intersticial, insuficiência renal
Pele e Tecido Subcutâneo: Síndrome de Stevens-Johnson, necrólise epidérmica tóxica, erupção cutânea medicamentosa com eosinofilia e sintomas sistêmicos (DRESS), púrpura de Henoch-Schonlein, acne, pustulose exantemática generalizada aguda
Vascular: Hemorragia
INTERAÇÕES MEDICAMENTOSAS
coadministração de BIAXIN 250mg é conhecida por inibir o CYP3A, e um medicamento metabolizado principalmente pelo CYP3A pode estar associado a elevações nas concentrações do medicamento que podem aumentar ou prolongar os efeitos terapêuticos e adversos do medicamento concomitante.
BIAXIN deve ser usado com cautela em pacientes recebendo tratamento com outros medicamentos conhecidos como substratos da enzima CYP3A, especialmente se o substrato CYP3A tiver uma margem de segurança estreita (por exemplo, carbamazepina) e/ou o substrato for extensamente metabolizado por essa enzima. Ajustar a dosagem quando apropriado e monitorar de perto as concentrações séricas dos medicamentos metabolizados principalmente pelo CYP3A em pacientes recebendo claritromicina concomitantemente.
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Reações de Hipersensibilidade Aguda
No caso de reações de hipersensibilidade aguda grave, como anafilaxia, síndrome de Stevens-Johnson, necrólise epidérmica tóxica, erupção cutânea medicamentosa com eosinofilia e sintomas sistêmicos (DRESS), púrpura de Henoch-Schonlein e pustulose exantemática generalizada aguda, descontinuar a terapia com BIAXIN 250mg imediatamente e instituir o tratamento adequado.
Prolongamento QT
BIAXIN 500mg foi associado ao prolongamento do intervalo QT e casos infrequentes de arritmia. Casos de torsades de pointes foram relatados espontaneamente durante a vigilância pós-comercialização em pacientes recebendo BIAXIN. Fatalidades foram relatadas.
Evite BIAXIN nos seguintes pacientes:
- pacientes com prolongamento conhecido do intervalo QT, arritmia cardíaca ventricular, incluindo torsades de pointes
- pacientes recebendo medicamentos conhecidos por prolongar o intervalo QT [ver também CONTRA-INDICAÇÕES ]
- pacientes com condições pró-arrítmicas em curso, como hipocalemia ou hipomagnesemia não corrigida, bradicardia clinicamente significativa e em pacientes recebendo agentes antiarrítmicos Classe IA (por exemplo, quinidina, procainamida, disopiramida) ou Classe III (por exemplo, dofetilida, amiodarona, sotalol).
Pacientes idosos podem ser mais suscetíveis aos efeitos associados ao medicamento no intervalo QT [ver Uso em populações específicas ].
Hepatotoxicidade
Disfunção hepática, incluindo aumento das enzimas hepáticas e hepatite hepatocelular e/ou colestática, com ou sem icterícia, foi relatada com claritromicina. Essa disfunção hepática pode ser grave e geralmente reversível. Em alguns casos, foi relatada insuficiência hepática com desfecho fatal e geralmente foi associada a doenças subjacentes graves e/ou medicamentos concomitantes. Os sintomas da hepatite podem incluir anorexia, icterícia, urina escura, prurido ou abdome sensível. Descontinuar BIAXIN 500mg imediatamente se ocorrerem sinais e sintomas de hepatite.
Reações Adversas Graves Devido ao Uso Concomitante com Outros Medicamentos
Drogas Metabolizadas pelo CYP3A4
Reações adversas graves foram relatadas em pacientes tomando BIAXIN concomitantemente com substratos do CYP3A4. Estes incluem toxicidade de colchicina com colchicina; rabdomiólise com sinvastatina, lovastatina e atorvastatina; hipoglicemia e arritmias cardíacas (por exemplo, torsades de pointes) com disopiramida; hipotensão e lesão renal aguda com bloqueadores dos canais de cálcio metabolizados pelo CYP3A4 (por exemplo, verapamil, amlodipina, diltiazem, nifedipina). A maioria dos relatos de lesão renal aguda com bloqueadores dos canais de cálcio metabolizados pelo CYP3A4 envolveu pacientes idosos com 65 anos de idade ou mais. Use BIAXIN 500mg com cautela quando administrado concomitantemente com medicamentos que induzem a enzima citocromo CYP3A4. O uso de BIAXIN 250mg com sinvastatina, lovastatina, ergotamina ou diidroergotamina é contraindicado [ver CONTRA-INDICAÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Colchicina
Interações medicamentosas fatais e com risco de vida foram relatadas em pacientes tratados com BIAXIN e colchicina. A claritromicina é um forte inibidor do CYP3A4 e essa interação pode ocorrer durante o uso de ambos os medicamentos nas doses recomendadas. Se a coadministração de BIAXIN e colchicina for necessária em pacientes com função renal e hepática normais, reduza a dose de colchicina. Monitorar os pacientes quanto a sintomas clínicos de toxicidade por colchicina. A administração concomitante de BIAXIN 500mg e colchicina é contraindicada em pacientes com insuficiência renal ou hepática [ver CONTRA-INDICAÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Inibidores da HMG-CoA Redutase (estatinas)
O uso concomitante de BIAXIN com lovastatina ou sinvastatina é contraindicado [ver CONTRA-INDICAÇÕES uma vez que essas estatinas são extensivamente metabolizadas pelo CYP3A4, e o tratamento concomitante com BIAXIN aumenta sua concentração plasmática, o que aumenta o risco de miopatia, incluindo rabdomiólise. Casos de rabdomiólise foram relatados em pacientes tomando BIAXIN concomitantemente com estas estatinas. Se o tratamento com BIAXIN não puder ser evitado, a terapia com lovastatina ou sinvastatina deve ser suspensa durante o tratamento.
Tenha cuidado ao prescrever BIAXIN 250mg com atorvastatina ou pravastatina. Em situações em que o uso concomitante de BIAXIN com atorvastatina ou pravastatina não pode ser evitado, a dose de atorvastatina não deve exceder 20 mg por dia e a dose de pravastatina não deve exceder 40 mg por dia. O uso de uma estatina que não depende do metabolismo do CYP3A (por exemplo, fluvastatina) pode ser considerado. Recomenda-se a prescrição da dose mais baixa registrada se o uso concomitante não puder ser evitado.
Hipoglicemiantes Orais/Insulina
uso concomitante de BIAXIN 500mg e hipoglicemiantes orais e/ou insulina pode resultar em hipoglicemia significativa. Com certos medicamentos hipoglicemiantes, como nateglinida, pioglitazona, repaglinida e rosiglitazona, a inibição da enzima CYP3A pela claritromicina pode estar envolvida e pode causar hipoglicemia quando usada concomitantemente. Recomenda-se o monitoramento cuidadoso da glicose [ver INTERAÇÕES MEDICAMENTOSAS ].
Quetiapina
Use quetiapina e claritromicina concomitantemente com cautela. A coadministração pode resultar em aumento da exposição à quetiapina e toxicidades relacionadas à quetiapina, como sonolência, hipotensão ortostática, estado alterado de consciência, síndrome neuroléptica maligna e prolongamento do intervalo QT. Consulte as informações de prescrição de quetiapina para recomendações sobre a redução da dose se coadministrada com inibidores do CYP3A4, como a claritromicina [ver INTERAÇÕES MEDICAMENTOSAS ].
Anticoagulantes orais
Existe o risco de hemorragia grave e elevações significativas do INR e do tempo de protrombina quando BIAXIN é coadministrado com varfarina. Monitore o INR e os tempos de protrombina com frequência enquanto os pacientes estiverem recebendo BIAXIN e anticoagulantes orais concomitantemente [ver INTERAÇÕES MEDICAMENTOSAS ].
Benzodiazepínicos
O aumento da sedação e o prolongamento da sedação foram relatados com a administração concomitante de BIAXIN 250mg e triazolobenzodiazepínicos, como triazolam e midazolam. INTERAÇÕES MEDICAMENTOSAS ].
Mortalidade por todas as causas em pacientes com doença arterial coronariana 1 a 10 anos após a exposição à BIAXINA
Em um ensaio clínico que avaliou o tratamento com claritromicina sobre os resultados em pacientes com doença arterial coronariana, foi observado um aumento no risco de mortalidade por todas as causas um ano ou mais após o término do tratamento em pacientes randomizados para receber claritromicina.1 Claritromicina para tratamento de doenças coronarianas doença arterial não é uma indicação aprovada. A causa do risco aumentado não foi estabelecida. Outros estudos epidemiológicos avaliando esse risco mostraram resultados variáveis [ver REAÇÕES ADVERSAS ]. Considere equilibrar esse risco potencial com os benefícios do tratamento ao prescrever BIAXIN em pacientes com suspeita ou confirmação de doença arterial coronariana.
Diarreia Associada a Clostridium Difficile
Diarreia associada a Clostridium difficile (CDAD) foi relatada com o uso de quase todos os agentes antibacterianos, incluindo BIAXIN, e pode variar em gravidade de diarreia leve a colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas A e B que contribuem para o desenvolvimento de CDAD. Cepas produtoras de hipertoxina de C. difficile causam aumento da morbidade e mortalidade, pois essas infecções podem ser refratárias à terapia antimicrobiana e podem exigir colectomia. CDAD deve ser considerado em todos os pacientes que apresentam diarreia após o uso de antibacterianos. É necessário um histórico médico cuidadoso, pois foi relatado que a CDAD ocorre mais de dois meses após a administração de agentes antibacterianos.
Se houver suspeita ou confirmação de CDAD, o uso contínuo de antibacterianos não direcionados contra C. difficile pode precisar ser descontinuado. O manejo adequado de fluidos e eletrólitos, suplementação proteica, tratamento antibacteriano de C. difficile e avaliação cirúrgica devem ser instituídos conforme indicação clínica.
Toxicidade embriofetal
claritromicina não deve ser usada em mulheres grávidas, exceto em circunstâncias clínicas em que nenhuma terapia alternativa seja apropriada. Se BIAXIN 500mg for usado durante a gravidez, ou se ocorrer gravidez enquanto a paciente estiver tomando este medicamento, a paciente deve ser informada do risco potencial para o feto. A claritromicina demonstrou efeitos adversos no resultado da gravidez e/ou desenvolvimento embriofetal em macacos, ratos, camundongos e coelhos em doses que produziram níveis plasmáticos de 2 a 17 vezes os níveis séricos alcançados em humanos tratados com as doses humanas máximas recomendadas [ver Uso em populações específicas ].
Exacerbação da Miastenia Gravis
Exacerbação dos sintomas de miastenia gravis e novo aparecimento de sintomas de síndrome miastênica foram relatados em pacientes recebendo terapia com BIAXIN 250mg.
Desenvolvimento de bactérias resistentes a drogas
prescrição de BIAXIN na ausência de infecção bacteriana comprovada ou fortemente suspeita ou indicação profilática provavelmente não trará benefícios ao paciente e aumenta o risco de desenvolvimento de bactérias resistentes aos medicamentos.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Os seguintes testes de mutagenicidade in vitro foram realizados com claritromicina:
- Teste de Microssomas de Salmonela/Mamífero
- Teste de frequência de mutação induzida por bactérias
- Teste de aberração cromossômica in vitro
- Ensaio de Síntese de DNA de Hepatócito de Rato
- Ensaio de linfoma de camundongo
- Estudo Letal Dominante em Ratos
- Teste de micronúcleo de camundongo
Todos os testes tiveram resultados negativos, exceto o teste de aberração cromossômica in vitro que foi positivo em um teste e negativo em outro. Além disso, um teste de mutação reversa bacteriana (teste de Ames) foi realizado em metabólitos de claritromicina com resultados negativos.
Prejuízo da Fertilidade
Estudos de fertilidade e reprodução mostraram que doses diárias de até 160 mg/kg/ em ratos machos e fêmeas não causaram efeitos adversos no ciclo estral, fertilidade, parto ou número e viabilidade da prole. Os níveis plasmáticos em ratos após 150 mg/kg/dia foram duas vezes os níveis séricos humanos.
A atrofia testicular ocorreu em ratos com doses 7 vezes, em cães com doses 3 vezes e em macacos com doses 8 vezes maiores do que a dose máxima diária humana (com base na área de superfície corporal).
Uso em populações específicas
Gravidez
Efeitos teratogênicos
Gravidez Categoria C
A claritromicina não deve ser usada em mulheres grávidas, exceto em circunstâncias clínicas em que nenhuma terapia alternativa seja apropriada. Se ocorrer gravidez durante o uso deste medicamento, a paciente deve ser informada do risco potencial para o feto [ver AVISOS E PRECAUÇÕES ].
Quatro estudos de teratogenicidade em ratos (três com doses orais e um com doses intravenosas de até 160 mg/kg/dia administrados durante o período de maior organogênese) e dois em coelhos com doses orais de até 125 mg/kg/dia (aproximadamente duas vezes a dose humana máxima recomendada baseada em mg/m²) ou doses intravenosas de 30 mg/kg/dia administradas durante os dias 6 a 18 de gestação não demonstraram qualquer teratogenicidade da claritromicina. Dois estudos orais adicionais em uma cepa de rato diferente em doses semelhantes e condições semelhantes demonstraram uma baixa incidência de anomalias cardiovasculares em doses de 150 mg/kg/dia administradas durante os dias de gestação 6 a 15.
Os níveis plasmáticos após 150 mg/kg/dia foram o dobro dos níveis séricos humanos. Quatro estudos em camundongos revelaram uma incidência variável de fenda palatina após doses orais de 1.000 mg/kg/dia (2 e 4 vezes a dose humana máxima recomendada com base em mg/m², respectivamente) durante os dias 6 a 15 de gestação. observada a 500 mg/kg/dia. A exposição de 1000 mg/kg/dia resultou em níveis plasmáticos 17 vezes maiores que os níveis séricos humanos. Em macacos, uma dose oral de 70 mg/kg/dia produziu retardo do crescimento fetal em níveis plasmáticos que eram o dobro dos níveis séricos humanos.
Mães que amamentam
Deve-se ter cautela quando BIAXIN for administrado a mulheres que amamentam. O desenvolvimento e os benefícios para a saúde da alimentação com leite humano devem ser considerados juntamente com a necessidade clínica da mãe de BIAXIN e quaisquer potenciais efeitos adversos na criança alimentada com leite humano do medicamento ou da condição materna subjacente.
claritromicina e seu metabólito ativo 14-hidroxi claritromicina são excretados no leite humano. Amostras de soro e leite foram obtidas após 3 dias de tratamento, em estado de equilíbrio, de um estudo publicado de 12 mulheres lactantes que estavam tomando BIAXIN 250 mg por via oral duas vezes ao dia. Com base nos dados limitados deste estudo, e assumindo um consumo de leite de 150 mL/kg/dia, um lactente alimentado exclusivamente com leite humano receberia uma média estimada de 136 mcg/kg/dia de claritromicina e seu metabólito ativo, com esta dosagem materna regime. Isso é menos de 2% da dose materna ajustada ao peso (7,8 mg/kg/dia, com base no peso materno médio de 64 kg) e menos de 1% da dose pediátrica (15 mg/kg/dia) para crianças maiores de 6 meses de idade.
Um estudo observacional prospectivo de 55 bebês amamentados de mães que tomaram um antibacteriano macrolídeo (6 foram expostos à claritromicina) foram comparados com 36 bebês amamentados de mães que tomaram amoxicilina. As reações adversas foram comparáveis em ambos os grupos. As reações adversas ocorreram em 12,7% das crianças expostas aos macrolídeos e incluíram erupção cutânea, diarreia, perda de apetite e sonolência.
Uso Pediátrico
A segurança e eficácia de BIAXIN Filmtab e BIAXIN 500mg Granules foram estabelecidas para o tratamento das seguintes condições ou doenças em pacientes pediátricos com 6 meses ou mais. A utilização nestas indicações baseia-se em ensaios clínicos em doentes pediátricos ou estudos adequados e bem controlados em adultos com dados adicionais de farmacocinética e segurança em doentes pediátricos:
- Faringite/Amigdalite
- Pneumonia adquirida na comunidade
- Sinusite maxilar aguda
- Otite média aguda [ver Estudos clínicos ]
- Infecções não complicadas da pele e da estrutura da pele
segurança e eficácia de BIAXIN 500mg Filmtab e BIAXIN 500mg Granules foram estabelecidas para a prevenção da doença disseminada do complexo Mycobacterium avium (MAC) em pacientes pediátricos com 20 meses ou mais de idade com infecção avançada pelo HIV. Nenhum estudo de BIAXIN para profilaxia MAC foi realizado em populações pediátricas e as doses recomendadas para profilaxia são derivadas de estudos de tratamento pediátrico MAC.
A segurança e eficácia de BIAXIN 500mg XL Filmtab no tratamento de pacientes pediátricos não foram estabelecidas.
A segurança e eficácia de BIAXIN 250mg em pacientes pediátricos com menos de 6 meses de idade não foram estabelecidas. A segurança de BIAXIN 500mg não foi estudada em pacientes com MAC com idade inferior a 20 meses.
Uso Geriátrico
Em um estudo de estado de equilíbrio no qual indivíduos idosos saudáveis (65 anos a 81 anos de idade) receberam 500 mg de BIAXIN a cada 12 horas, as concentrações séricas máximas e a área sob as curvas de claritromicina e 14-OH claritromicina aumentaram em comparação com aqueles alcançados em adultos jovens saudáveis. Estas alterações na farmacocinética são paralelas a diminuições da função renal relacionadas com a idade. Em ensaios clínicos, os pacientes idosos não tiveram uma incidência aumentada de reações adversas quando comparados aos pacientes mais jovens. Considerar ajuste de dose em pacientes idosos com insuficiência renal grave. Pacientes idosos podem ser mais suscetíveis ao desenvolvimento de arritmias torsades de pointes do que pacientes mais jovens. AVISOS E PRECAUÇÕES ].
A maioria dos relatos de lesão renal aguda com bloqueadores dos canais de cálcio metabolizados pelo CYP3A4 (p. AVISOS E PRECAUÇÕES ].
Especialmente em pacientes idosos, houve relatos de toxicidade da colchicina com o uso concomitante de claritromicina e colchicina, alguns dos quais ocorreram em pacientes com insuficiência renal. Mortes foram relatadas em alguns pacientes [ver CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
Insuficiência Renal e Hepática
BIAXIN 500mg é excretado principalmente por via hepática e renal. BIAXIN pode ser administrado sem ajuste de dose a pacientes com insuficiência hepática e função renal normal. No entanto, na presença de insuficiência renal grave com ou sem insuficiência hepática coexistente, pode ser apropriado diminuir a dosagem ou prolongar os intervalos entre as doses [ver DOSAGEM E ADMINISTRAÇÃO ].
REFERÊNCIAS
1. Winkel P, Hilden J, Hansen JF, Kastrup J, Kolmos HJ, Kjøller E, et al. Claritromicina para doença cardíaca coronária estável aumenta a mortalidade por todas as causas e cardiovascular e morbidade cerebrovascular em 10 anos no ensaio clínico CLARICOR randomizado e cego. Int J Cardiol 2015;182:459-65.
SOBREDOSAGEM
superdosagem de BIAXIN pode causar sintomas gastrointestinais, como dor abdominal, vômito, náusea e diarreia.
Trate as reações adversas que acompanham a superdosagem pela eliminação imediata do medicamento não absorvido e medidas de suporte. Assim como com outros macrolídeos, não se espera que as concentrações séricas de BIAXIN sejam significativamente afetadas pela hemodiálise ou diálise peritoneal.
CONTRA-INDICAÇÕES
Hipersensibilidade
BIAXIN é contraindicado em pacientes com hipersensibilidade conhecida à claritromicina, eritromicina ou a qualquer um dos medicamentos antibacterianos macrolídeos [ver AVISOS E PRECAUÇÕES ].
Arritmia cardíaca
A administração concomitante de BIAXIN com cisaprida e pimozida é contraindicada [ver INTERAÇÕES MEDICAMENTOSAS ].
Houve relatos pós-comercialização de interações medicamentosas quando a claritromicina é coadministrada com cisaprida ou pimozida, resultando em arritmias cardíacas (prolongamento do intervalo QT, taquicardia ventricular, fibrilação ventricular e torsades de pointes) provavelmente devido à inibição do metabolismo desses medicamentos por BIAXIN . Fatalidades foram relatadas.
Icterícia Colestática/Disfunção Hepática
BIAXIN é contraindicado em pacientes com história de icterícia colestática ou disfunção hepática associada ao uso prévio de claritromicina.
Colchicina
A administração concomitante de BIAXIN e colchicina é contraindicada em pacientes com insuficiência renal ou hepática.
Inibidores da HMG-CoA Redutase
Não use BIAXIN concomitantemente com inibidores da HMG-CoA redutase (estatinas) que são extensamente metabolizados pelo CYP3A4 (lovastatina ou sinvastatina), devido ao risco aumentado de miopatia, incluindo rabdomiólise [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Alcaloides do Ergot
administração concomitante de claritromicina e ergotamina ou diidroergotamina é contraindicada [ver INTERAÇÕES MEDICAMENTOSAS ].
Contraindicações para Medicamentos Coadministrados
Para obter informações sobre as contraindicações de outros medicamentos indicados em combinação com BIAXIN, consulte as informações completas de prescrição (seção de contraindicações).
FARMACOLOGIA CLÍNICA
Mecanismo de ação
A claritromicina é um fármaco antimicrobiano macrolídeo [ver Microbiologia ].
Farmacocinética
Absorção
BIAXIN 250mg Filmtab Comprimidos de Liberação Imediata
biodisponibilidade absoluta dos comprimidos de 250 mg de claritromicina foi de aproximadamente 50%. Para uma dose única de 500 mg de claritromicina, os alimentos atrasam ligeiramente o início da absorção da claritromicina, aumentando o tempo de pico de aproximadamente 2 para 2,5 horas. Os alimentos também aumentam a concentração plasmática máxima da claritromicina em cerca de 24%, mas não afetam a extensão da biodisponibilidade da claritromicina. A alimentação não afeta o início da formação do metabólito ativo, 14-OH claritromicina ou sua concentração plasmática máxima, mas diminui ligeiramente a extensão da formação do metabólito, indicada por uma diminuição de 11% na área sob a curva de concentração plasmática-tempo (AUC) . Portanto, BIAXIN Filmtab pode ser administrado independentemente da alimentação. Em indivíduos humanos saudáveis sem jejum (homens e mulheres), as concentrações plasmáticas máximas foram atingidas dentro de 2 a 3 horas após a administração oral.
BIAXIN 500mg XL Filmtab Comprimidos de Liberação Prolongada
Os comprimidos de liberação prolongada de claritromicina proporcionam absorção prolongada da claritromicina no trato gastrointestinal após administração oral. Em relação a uma dose diária total igual de comprimidos de claritromicina de liberação imediata, os comprimidos de liberação prolongada de claritromicina fornecem concentrações plasmáticas de pico mais baixas e tardias no estado de equilíbrio, mas AUCs de 24 horas equivalentes para claritromicina e seu metabólito microbiologicamente ativo, claritromicina 14-OH. Embora a extensão da formação de 14-OH claritromicina após a administração de BIAXIN 500 mg XL Filmtab (2 comprimidos de 500 mg uma vez ao dia) não seja afetada pelos alimentos, a administração em jejum está associada a uma AUC da claritromicina aproximadamente 30% menor em relação à administração com alimentos . Portanto, BIAXIN 250mg XL Filmtab deve ser tomado com alimentos.
Figura 2: Perfis de tempo de concentração de plasma de claritromicina em estado estacionário 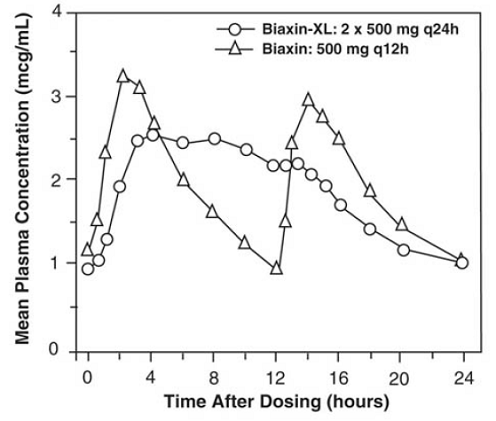
Grânulos de BIAXIN para Suspensão Oral
Quando doses de 250 mg de claritromicina como BIAXIN como suspensão oral foram administradas a indivíduos adultos saudáveis em jejum, as concentrações plasmáticas máximas foram atingidas cerca de 3 horas após a dosagem.
Para pacientes adultos, a biodisponibilidade de 10 mL da suspensão de 125 mg/5 mL ou 10 mL da suspensão de 250 mg/5 mL é semelhante a um comprimido de 250 mg ou 500 mg, respectivamente.
Em adultos que receberam 250 mg de claritromicina como suspensão (n = 22), os alimentos pareciam diminuir as concentrações plasmáticas máximas médias de claritromicina de 1,2 (± 0,4) mcg/mL para 1,0 (± 0,4) mcg/mL e a extensão da absorção de 7,2 (± 0,4) mcg/mL 2,5) h•mcg/mL a 6,5 (± 3,7) h•mcg/mL.
Distribuição
A claritromicina e o metabólito 14-OH claritromicina distribuem-se prontamente nos tecidos e fluidos corporais. Não existem dados disponíveis sobre a penetração do líquido cefalorraquidiano. Devido às altas concentrações intracelulares, as concentrações teciduais são mais altas do que as concentrações séricas. Exemplos de concentrações de tecido e soro são apresentados abaixo.
Metabolismo e eliminação
BIAXIN 500mg Filmtab Comprimidos de Liberação Imediata
As concentrações plasmáticas de pico de claritromicina no estado estacionário foram atingidas em 3 dias e foram de aproximadamente 1 mcg/mL a 2 mcg/mL com uma dose de 250 mg administrada a cada 12 horas e 3 mcg/mL a 4 mcg/mL com uma dose de 500 mg administrada a cada 12 horas. 8 horas a 12 horas. A meia-vida de eliminação da claritromicina foi de cerca de 3 horas a 4 horas com 250 mg administrados a cada 12 horas, mas aumentou para 5 horas a 7 horas com 500 mg administrados a cada 8 horas a 12 horas. A não linearidade da farmacocinética da claritromicina é leve nas doses recomendadas de 250 mg e 500 mg administradas a cada 8 horas a 12 horas. Com uma dosagem de 250 mg a cada 12 horas, o principal metabólito, 14-OH claritromicina, atinge um pico de concentração no estado de equilíbrio de cerca de 0,6 mcg/mL e tem uma meia-vida de eliminação de 5 horas a 6 horas. Com uma dose de 500 mg a cada 8 horas a 12 horas, a concentração máxima no estado de equilíbrio de 14-OH claritromicina é ligeiramente maior (até 1 mcg/mL), e sua meia-vida de eliminação é de cerca de 7 horas a 9 horas. Com qualquer um desses regimes de dosagem, a concentração no estado de equilíbrio deste metabólito é geralmente atingida dentro de 3 dias a 4 dias.
Após um comprimido de 250 mg a cada 12 horas, aproximadamente 20% da dose é excretada na urina como claritromicina, enquanto que após um comprimido de 500 mg a cada 12 horas, a excreção urinária de claritromicina é um pouco maior, aproximadamente 30%. Em comparação, após uma dose oral de 250 mg (125 mg/5 mL) de suspensão a cada 12 horas, aproximadamente 40% é excretado na urina como claritromicina. A depuração renal da claritromicina é, no entanto, relativamente independente do tamanho da dose e aproxima-se da taxa de filtração glomerular normal. O principal metabólito encontrado na urina é a 14-OH claritromicina, que representa um adicional de 10% a 15% da dose com um comprimido de 250 mg ou 500 mg administrado a cada 12 horas.
BIAXIN 250mg XL Filmtab Comprimidos de Liberação Prolongada
Em humanos saudáveis, as concentrações plasmáticas máximas de claritromicina no estado de equilíbrio de aproximadamente 2 mcg/mL a 3 mcg/mL foram alcançadas cerca de 5 horas a 8 horas após a administração oral de 1000 mg de BIAXIN 250 mg XL Filmtab uma vez ao dia; para a 14-OH claritromicina, as concentrações plasmáticas de pico no estado de equilíbrio de aproximadamente 0,8 mcg/mL foram atingidas cerca de 6 horas a 9 horas após a administração. As concentrações plasmáticas de pico de claritromicina no estado estacionário de aproximadamente 1 mcg/mL a 2 mcg/mL foram alcançadas cerca de 5 horas a 6 horas após a administração oral de um único BIAXIN XL Filmtab de 500 mg uma vez ao dia; para a 14-OH claritromicina, as concentrações plasmáticas de pico no estado de equilíbrio de aproximadamente 0,6 mcg/mL foram atingidas cerca de 6 horas após a administração.
As concentrações plasmáticas de pico no estado estacionário foram atingidas em 2 dias a 3 dias e foram de aproximadamente 2 mcg/mL para claritromicina e 0,7 mcg/mL para 14-OH claritromicina quando doses de 250 mg da suspensão de claritromicina foram administradas a cada 12 horas. A meia-vida de eliminação da claritromicina (3 horas a 4 horas) e a de 14-OH claritromicina (5 horas a 7 horas) foram semelhantes às observadas no estado de equilíbrio após a administração de doses equivalentes de BIAXIN Filmtab.
Populações específicas para BIAXIN Filmtab, BIAXIN 500mg XL Filmtab e BIAXIN 250mg Granules Formulations
Grânulos de BIAXIN para suspensão oral em pacientes pediátricos
Claritromicina penetra no fluido do ouvido médio de pacientes pediátricos com otite média secretora.
Quando os pacientes pediátricos (n = 10) receberam uma dose oral única de 7,5 mg/kg de BIAXIN 500 mg como suspensão oral, os alimentos aumentaram as concentrações plasmáticas máximas médias de claritromicina de 3,6 (± 1,5) mcg/mL para 4,6 (± 2,8) mcg/ mL e a extensão da absorção de 10,0 (± 5,5) h•mcg/mL a 14,2 (± 9,4) h•mcg/mL.
Em pacientes pediátricos que necessitam de terapia antibacteriana, a administração de 7,5 mg/kg a cada 12 horas de BIAXIN como suspensão oral geralmente resultou em concentrações plasmáticas de pico no estado de equilíbrio de 3 mcg/mL a 7 mcg/mL para claritromicina e 1 mcg/mL a 2 mcg/mL para 14-OH claritromicina.
Em pacientes pediátricos infectados pelo HIV tomando 15 mg/kg de BIAXIN como suspensão oral a cada 12 horas, as concentrações máximas de claritromicina no estado de equilíbrio geralmente variaram de 6 mcg/mL a 15 mcg/mL.
Infecção pelo HIV
As concentrações de estado de equilíbrio de claritromicina e 14-OH claritromicina observadas após a administração de doses de 500 mg de claritromicina a cada 12 horas em pacientes adultos com infecção pelo HIV foram semelhantes às observadas em voluntários saudáveis. Em pacientes adultos infectados pelo HIV tomando doses de 500 mg ou 1.000 mg de claritromicina a cada 12 horas, os valores de Cmax de claritromicina no estado de equilíbrio variaram de 2 mcg/mL a 4 mcg/mL e 5 mcg/mL a 10 mcg/mL, respectivamente .
Insuficiência hepática
As concentrações de estado de equilíbrio da claritromicina em indivíduos com função hepática comprometida não diferiram daquelas em indivíduos normais; no entanto, as concentrações de 14-OH claritromicina foram mais baixas nos indivíduos com insuficiência hepática. A formação diminuída de 14-OH claritromicina foi pelo menos parcialmente compensada por um aumento na depuração renal de claritromicina em indivíduos com função hepática comprometida quando comparados a indivíduos saudáveis.
Insuficiência renal
farmacocinética da claritromicina também foi alterada em indivíduos com função renal comprometida [ver Uso em populações específicas e DOSAGEM E ADMINISTRAÇÃO ].
Interações medicamentosas
Fluconazol
Após a administração de 200 mg de fluconazol ao dia e 500 mg de claritromicina duas vezes ao dia a 21 voluntários saudáveis, a Cmin e a AUC da claritromicina no estado de equilíbrio aumentaram 33% e 18%, respectivamente. As exposições à claritromicina aumentaram e as concentrações de 14-OH claritromicina no estado de equilíbrio não foram significativamente afetadas pela administração concomitante de fluconazol.
Colchicina
Quando uma dose única de 0,6 mg de colchicina foi administrada com claritromicina 250 mg BID por 7 dias, a Cmax da colchicina aumentou 197% e a AUC0-∞ aumentou 239% em comparação com a administração de colchicina isolada.
Atazanavir
Após a administração de claritromicina (500 mg duas vezes ao dia) com atazanavir (400 mg uma vez ao dia), a AUC da claritromicina aumentou 94%, a AUC da 14-OH claritromicina diminuiu 70% e a AUC do atazanavir aumentou 28%.
Ritonavir
administração concomitante de claritromicina e ritonavir (n = 22) resultou em um aumento de 77% na AUC da claritromicina e uma diminuição de 100% na AUC da 14-OH claritromicina.
Saquinavir
Após a administração de claritromicina (500 mg bid) e saquinavir (cápsulas de gelatina mole, 1200 mg três vezes por dia) a 12 voluntários saudáveis, a AUC e Cmax do saquinavir no estado estacionário aumentaram 177% e 187%, respetivamente, em comparação com a administração de saquinavir isolado. A AUC e a Cmax da claritromicina aumentaram 45% e 39%, respectivamente, enquanto a AUC e a Cmax da claritromicina 14-OH diminuíram 24% e 34%, respectivamente, em comparação com a administração com claritromicina isolada.
Didanosina
A administração simultânea de comprimidos de claritromicina e didanosina a 12 pacientes adultos infectados pelo HIV não resultou em alteração estatisticamente significativa na farmacocinética da didanosina.
Zidovudina
Após a administração de comprimidos de 500 mg de claritromicina duas vezes ao dia com 100 mg de zidovudina a cada 4 horas, a AUC da zidovudina no estado de equilíbrio diminuiu 12% em comparação com a administração de zidovudina isolada (n=4). Os valores individuais variaram de um decréscimo de 34% a um aumento de 14%. Quando os comprimidos de claritromicina foram administrados duas a quatro horas antes da zidovudina, a Cmax da zidovudina no estado de equilíbrio aumentou 100%, enquanto a AUC não foi afetada (n=24).
Omeprazol
Claritromicina 500 mg a cada 8 horas foi administrado em combinação com omeprazol 40 mg diariamente a indivíduos adultos saudáveis. As concentrações plasmáticas de omeprazol no estado de equilíbrio aumentaram (aumentos de Cmax, AUC0-24 e t½ de 30%, 89% e 34%, respectivamente), pela administração concomitante de claritromicina.
Os níveis plasmáticos de claritromicina e 14-OH claritromicina foram aumentados pela administração concomitante de omeprazol. Para a claritromicina, a Cmax média foi 10% maior, a Cmin média foi 27% maior e a AUC0-8 média foi 15% maior quando a claritromicina foi administrada com omeprazol do que quando a claritromicina foi administrada isoladamente. Resultados semelhantes foram observados para claritromicina 14–OH, a Cmax média foi 45% maior, a Cmin média foi 57% maior e a AUC0-8 média foi 45% maior. As concentrações de claritromicina no tecido gástrico e muco também aumentaram com a administração concomitante de omeprazol.
Concentrações teciduais de claritromicina 2 horas após a dose (mcg/mL)/(mcg/g)
Teofilina
Em dois estudos nos quais a teofilina foi administrada com claritromicina (uma formulação de liberação sustentada de teofilina foi administrada a 6,5 mg/kg ou 12 mg/kg junto com 250 ou 500 mg a cada 12 horas de claritromicina), os níveis de estado de equilíbrio de Cmax, Cmin, e a área sob a curva de concentração sérica tempo (AUC) da teofilina aumentou cerca de 20%.
Midazolam
Quando uma dose única de midazolam foi coadministrada com comprimidos de claritromicina (500 mg duas vezes ao dia por 7 dias), a AUC do midazolam aumentou 174% após administração intravenosa de midazolam e 600% após administração oral.
Para obter informações sobre outros medicamentos indicados em combinação com BIAXIN, consulte as informações completas de prescrição, FARMACOLOGIA CLÍNICA seção.
Microbiologia
Mecanismo de ação
A claritromicina exerce sua ação antibacteriana ligando-se à subunidade ribossômica 50S de bactérias suscetíveis, resultando na inibição da síntese proteica.
Resistência
As principais vias de resistência são a modificação do rRNA 23S na subunidade ribossômica 50S para insensibilidade ou bombas de efluxo de drogas. A produção de beta-lactamase não deve ter efeito sobre a atividade da claritromicina.
A maioria dos isolados de estafilococos resistentes à meticilina e resistentes à oxacilina são resistentes à claritromicina.
Se o H. pylori não for erradicado após o tratamento com esquemas de combinação contendo claritromicina, os pacientes podem desenvolver resistência à claritromicina em isolados de H. pylori. Portanto, para pacientes que falharam na terapia, o teste de sensibilidade à claritromicina deve ser feito, se possível. Pacientes com H. pylori resistente à claritromicina não devem ser tratados com nenhum dos seguintes: terapia dupla com omeprazol/claritromicina; terapia tripla com omeprazol/claritromicina/amoxicilina; terapia tripla com lansoprazol/claritromicina/amoxicilina; ou outros regimes que incluem claritromicina como o único agente antibacteriano.
Actividade antimicrobiana
claritromicina demonstrou ser ativa contra a maioria dos isolados dos seguintes microrganismos, tanto in vitro quanto em infecções clínicas [ver INDICAÇÕES E USO ].
Bactérias Gram-positivas
- Staphylococcus aureus
- Streptococcus pneumoniae
- Streptococcus pyogenes
Bactérias Gram-Negativas
- Haemophilus influenzae
- Haemophilus parainfluenzae
- Moraxella catarrhalis
Outros microrganismos
- Chlamydophila pneumoniae
- Helicobacter pylori
- Complexo Mycobacterium avium (MAC) consistindo em M. avium e M. intracellulare
- Mycoplasma pneumoniae
Pelo menos 90 por cento dos microrganismos listados abaixo exibem concentrações inibitórias mínimas in vitro (CIMs) menores ou iguais ao ponto de corte de CIM suscetível à claritromicina para organismos de tipo semelhante aos mostrados na Tabela 11. No entanto, a eficácia da claritromicina no tratamento de infecções clínicas devido a esses microrganismos não foi estabelecido em ensaios clínicos adequados e bem controlados.
Bactérias Gram-positivas
- Streptococcus agalactiae
- Estreptococos (Grupos C, F, G)
- Estreptococos do grupo Viridans
Bactérias Gram-Negativas
- Legionella pneumophila
- Pasteurella multocida
Bactérias anaeróbicas
- Clostridium perfringens
- Peptococcus niger
- Prevotella melaninogenica
- Propionibacterium acnes
Teste de suscetibilidade
Para obter informações específicas sobre os critérios interpretativos do teste de suscetibilidade e métodos de teste associados e padrões de controle de qualidade reconhecidos pela FDA para este medicamento, consulte: http://www.fda.gov/STIC.
Toxicologia e/ou Farmacologia Animal
A opacidade da córnea ocorreu em cães em doses 12 vezes e em macacos em doses 8 vezes maiores do que a dose diária humana máxima (com base na área de superfície corporal). A depleção linfóide ocorreu em cães em doses 3 vezes maiores e em macacos em doses 2 vezes maiores que a dose diária humana máxima (com base na área de superfície corporal).
Estudos clínicos
Infecções micobacterianas
Profilaxia de Infecções Micobacterianas
Um ensaio clínico randomizado e duplo-cego (ensaio 3) comparou claritromicina 500 mg duas vezes ao dia com placebo em pacientes com AIDS definida pelo CDC e contagens de CD4 inferiores a 100 células/μL. Este estudo acumulou 682 pacientes de novembro de 1992 a janeiro de 1994, com uma contagem mediana de células CD4 na entrada de 30 células/mcL. A duração mediana de BIAXIN 500mg foi de 10,6 meses versus 8,2 meses para placebo. Mais pacientes no braço placebo do que no braço BIAXIN descontinuaram prematuramente o estudo (75,6% e 67,4%, respectivamente). No entanto, se descontinuações prematuras devido ao complexo Mycobacterium avium (MAC) ou morte forem excluídas, porcentagens aproximadamente iguais de pacientes em cada braço (54,8%) em BIAXIN e 52,5% em placebo) descontinuaram o medicamento do estudo precocemente por outros motivos. O estudo foi projetado para avaliar os seguintes desfechos:
Bacteremia MAC
Em pacientes randomizados para BIAXIN, o risco de bacteremia por MAC foi reduzido em 69% em comparação com placebo. A diferença entre os grupos foi estatisticamente significativa (p
Sobrevivência
Foi observado um benefício de sobrevivência estatisticamente significativo de BIAXIN em comparação com placebo (ver Figura 3 e Tabela 13). Como a análise aos 18 meses inclui pacientes que não estão mais recebendo profilaxia, o benefício de sobrevida de BIAXIN 250mg pode ser subestimado.
Figura 3: Sobrevivência de todos os pacientes randomizados com AIDS ao longo do tempo no estudo 3 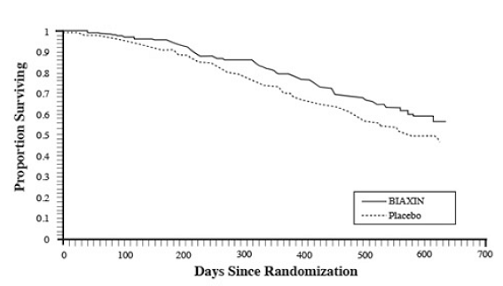
Doença MAC disseminada clinicamente significativa
Em associação com a diminuição da incidência de bacteremia por MAC, os pacientes do grupo randomizado para BIAXIN apresentaram redução nos sinais e sintomas de doença por MAC disseminado, incluindo febre, sudorese noturna, perda de peso e anemia.
Tratamento de Infecções Micobacterianas
Ensaios de monoterapia de variação de dose em pacientes adultos com AIDS com MAC
Dois ensaios clínicos randomizados (Ensaios 1 e 2) compararam diferentes dosagens de BIAXIN em pacientes com AIDS definida pelo CDC e contagens de CD4 inferiores a 100 células/mcL. Esses estudos acumularam pacientes de maio de 1991 a março de 1992. O estudo 500 foi um estudo randomizado, duplo-cego; o julgamento 577 foi um teste de uso compassivo de rótulo aberto. Ambos os estudos usaram 500 mg e 1.000 mg duas vezes ao dia de BIAXIN; o ensaio 1 também teve um grupo de 2.000 mg duas vezes ao dia BIAXIN 500 mg. O ensaio 1 recrutou 154 pacientes adultos e o ensaio 2 recrutou 469 pacientes adultos. A maioria dos pacientes tinha contagens de células CD4 inferiores a 50 células/mcL no início do estudo. Os ensaios foram projetados para avaliar os seguintes pontos finais:
Os resultados para o ensaio 1 são descritos abaixo. Os resultados do ensaio 2 foram semelhantes aos resultados do ensaio 1.
Bacteremia MAC
Diminuições na bacteremia MAC ou hemoculturas negativas foram observadas na maioria dos pacientes em todos os grupos de dosagem de BIAXIN 500mg. As reduções médias nas unidades formadoras de colônias MAC (UFC) da linha de base após 4 semanas de terapia no regime de 1.000 mg (n = 32) duas vezes ao dia e 2.000 mg (n = 26) duas vezes ao dia foi de 2,3 Log UFC em comparação com 1,5 Log UFC em o regime de BIAXIN 500 mg duas vezes ao dia (n=35). Um estudo separado com um regime de quatro drogas2 (ciprofloxacina, etambutol, rifampicina e clofazimina) teve uma redução média de 1,4 Log UFC.
Os resultados clínicos avaliados com os diferentes regimes de dosagem da monoterapia com claritromicina são mostrados na Tabela 14. As doses de 1.000 mg e 2.000 mg duas vezes ao dia mostraram um controle significativamente melhor da bacteremia durante as primeiras quatro semanas de terapia. Não foram observadas diferenças significativas além desse ponto. Todos os isolados tinham CIM inferior a 8 mcg/mL no pré-tratamento. A recaída foi quase sempre acompanhada por um aumento da CIM.
Doença MAC disseminada clinicamente significativa
Entre os pacientes com sudorese noturna antes da terapia, 84% apresentaram resolução ou melhora em algum momento durante as 12 semanas de BIAXIN em doses de 500 mg a 2.000 mg duas vezes ao dia. Da mesma forma, 77% dos pacientes relataram resolução ou melhora da febre em algum momento. As taxas de resposta para sinais clínicos de MAC são apresentadas na Tabela 15 abaixo.
A duração mediana da resposta, definida como melhora ou resolução dos sinais e sintomas clínicos, foi de 2 semanas a 6 semanas.
Como o estudo não foi projetado para determinar o benefício da monoterapia além de 12 semanas, a duração da resposta pode ser subestimada para 25% a 33% dos pacientes que continuaram a apresentar resposta clínica após 12 semanas.
Sobrevivência
O tempo médio de sobrevida desde a entrada no estudo (ensaio 1) foi de 249 dias com a dose de 500 mg duas vezes ao dia em comparação com 215 dias com a dose de 1.000 mg duas vezes ao dia. No entanto, durante as primeiras 12 semanas de terapia, houve 2 mortes em 53 pacientes no grupo de 500 mg duas vezes ao dia versus 13 mortes em 51 pacientes no grupo de 1.000 mg duas vezes ao dia. A razão para esta aparente diferença de mortalidade não é conhecida. A sobrevida nos dois grupos foi semelhante além de 12 semanas. Os tempos médios de sobrevivência para essas dosagens foram semelhantes aos controles históricos recentes com MAC quando tratados com terapias combinadas.2
tempo médio de sobrevivência desde a entrada no ensaio 2 foi de 199 dias para a dose de 500 mg duas vezes ao dia e 179 dias para a dose de 1000 mg duas vezes ao dia. Durante as primeiras quatro semanas de terapia, enquanto os pacientes foram mantidos em sua dose originalmente atribuída, houve 11 mortes em 255 pacientes tomando 500 mg duas vezes ao dia e 18 mortes em 214 pacientes tomando 1.000 mg duas vezes ao dia.
Ensaios de monoterapia de variação de dosagem em pacientes pediátricos com AIDS com MAC
O ensaio 4 foi um ensaio pediátrico de 3,75 mg/kg, 7,5 mg/kg e 15 mg/kg de BIAXIN duas vezes ao dia em pacientes com AIDS definida pelo CDC e contagens de CD4 inferiores a 100 células/mcL. O estudo incluiu 25 pacientes com idades entre 1 e 20 anos. O estudo avaliou os mesmos desfechos dos estudos adultos 1 e 2. Os resultados com a dose de 7,5 mg/kg duas vezes ao dia no estudo pediátrico foram comparáveis aos do estudo pediátrico de 500 mg. duas vezes ao dia nos estudos de adultos.
Terapia combinada em pacientes com AIDS com MAC disseminado
ensaio 5 comparou a segurança e eficácia de BIAXIN 250mg em combinação com etambutol versus BIAXIN 250mg em combinação com etambutol e clofazimina para o tratamento de infecção por MAC disseminado (dMAC). Este estudo de 24 semanas envolveu 106 pacientes com AIDS e dMAC, com 55 pacientes randomizados para receber BIAXIN 500mg e etambutol, e 51 pacientes randomizados para receber claritromicina, etambutol e clofazime. As características basais entre os braços de tratamento foram semelhantes, com exceção das contagens medianas de UFC sendo pelo menos 1 log maior no braço de BIAXIN 500mg, etambutol e clofazime.
Comparado à experiência anterior com a monoterapia com claritromicina, o regime de duas drogas de claritromicina e etambutol estendeu o tempo de recidiva microbiológica, em grande parte por suprimir o surgimento de cepas resistentes à claritromicina. No entanto, a adição de clofazimina ao regime não acrescentou nenhum benefício microbiológico ou clínico adicional. A tolerabilidade de ambos os regimes multidrogas foi comparável com os eventos adversos mais comuns sendo de natureza gastrointestinal. Os pacientes que receberam o regime contendo clofazimina tiveram taxas de sobrevivência reduzidas; no entanto, suas contagens de colônias de micobactérias na linha de base foram maiores. Os resultados deste estudo apoiam a adição de etambutol à claritromicina para o tratamento de infecções iniciais por dMAC, mas não suportam a adição de clofazimina como terceiro agente.
Inflamação na orelha
Ensaio de otite média de BIAXIN vs. cefalosporina oral
Em um ensaio clínico controlado de pacientes pediátricos com otite média aguda realizado nos Estados Unidos, onde foram encontradas taxas significativas de organismos produtores de beta-lactamase, BIAXIN 500mg foi comparado a uma cefalosporina oral. Neste estudo, critérios rigorosos de avaliação foram usados para determinar a resposta clínica. Para os 223 pacientes que foram avaliados quanto à eficácia clínica, a taxa de sucesso clínico (ou seja, cura mais melhora) na visita pós-terapia foi de 88% para BIAXIN 500mg e 91% para a cefalosporina.
Em um número menor de pacientes, as determinações microbiológicas foram feitas na visita de pré-tratamento. Os resultados presumíveis de erradicação bacteriana/cura clínica (ou seja, sucesso clínico) são mostrados na Tabela 16.
Ensaios de otite média de BIAXIN vs. antimicrobiano/inibidor de beta-lactamase
Em dois outros ensaios clínicos controlados de otite média aguda realizados nos Estados Unidos, onde foram encontradas taxas significativas de organismos produtores de beta-lactamase, BIAXIN foi comparado a um agente antimicrobiano oral que continha um inibidor específico de beta-lactamase. Nesses ensaios, critérios rigorosos de avaliação foram usados para determinar as respostas clínicas. Nos 233 pacientes que foram avaliados quanto à eficácia clínica, a taxa de sucesso clínico combinado (ou seja, cura e melhora) na visita pós-terapia foi de 91% tanto para BIAXIN 500mg quanto para o controle.
Para os pacientes que tiveram determinações microbiológicas na visita de pré-tratamento, os resultados presumíveis de erradicação bacteriana/cura clínica (ou seja, sucesso clínico) são mostrados na Tabela 17.
Erradicação do H. pylori para diminuir o risco de recorrência da úlcera duodenal
BIAXINA + Lansoprazol e Amoxicilina
Dois ensaios clínicos randomizados e duplo-cegos nos EUA (ensaio 6 e estudo 7) em pacientes com H. pylori e úlcera duodenal (definida como úlcera ativa ou história de úlcera ativa dentro de um ano) avaliaram a eficácia de BIAXIN 500 mg duas vezes diariamente em combinação com lansoprazol 30 mg duas vezes ao dia e amoxicilina 1 g duas vezes ao dia como terapia tripla de 14 dias para erradicação do H. pylori.
A erradicação do H. pylori foi definida como dois testes negativos (cultura e histologia) em 4 semanas a 6 semanas após o término do tratamento.
A combinação de BIAXIN mais lansoprazol e amoxicilina como terapia tripla foi eficaz na erradicação do H. pylori (ver resultados na Tabela 18). A erradicação do H. pylori demonstrou reduzir o risco de recorrência da úlcera duodenal.
Um ensaio clínico randomizado e duplo-cego (ensaio 8) realizado nos EUA em pacientes com H. pylori e úlcera duodenal (definida como úlcera ativa ou história de úlcera em um ano) comparou a eficácia de BIAXIN 250mg em combinação com lansoprazol e amoxicilina como terapia tripla por 10 dias e 14 dias. Este estudo estabeleceu que a terapia tripla de 10 dias foi equivalente à terapia tripla de 14 dias na erradicação do H. pylori (ver resultados na Tabela 18).
Terapia com BIAXINA + Omeprazol e Amoxicilina
Três ensaios clínicos nos EUA, randomizados e duplo-cegos em pacientes com infecção por H. pylori e úlcera duodenal (n = 558) compararam BIAXIN mais omeprazol e amoxicilina com BIAXIN 250mg mais amoxicilina. Dois ensaios (ensaios 9 e 10) foram conduzidos em pacientes com úlcera duodenal ativa, e o terceiro estudo (ensaio 11) foi realizado em pacientes com úlcera duodenal nos últimos 5 anos, mas sem úlcera presente no momento da inscrição . O regime de dosagem nos estudos foi BIAXIN 500 mg duas vezes ao dia mais omeprazol 20 mg duas vezes ao dia mais amoxicilina 1 grama duas vezes ao dia por 10 dias. Nos ensaios 9 e 10, os pacientes que tomaram o regime de omeprazol também receberam 18 dias adicionais de omeprazol 20 mg uma vez ao dia. Os desfechos estudados foram a erradicação do H. pylori e a cicatrização da úlcera duodenal (somente ensaios 9 e 10). O status de H. pylori foi determinado por CLOtest®, histologia e cultura em todos os três ensaios. Para um determinado paciente, o H. pylori foi considerado erradicado se pelo menos dois desses testes foram negativos e nenhum foi positivo. A combinação de BIAXIN mais omeprazol e amoxicilina foi eficaz na erradicação do H. pylori (ver resultados na Tabela 19).
Terapia com BIAXINA + Omeprazol
Quatro estudos randomizados, duplo-cegos e multicêntricos (ensaios 12, 13, 14 e 15) avaliaram BIAXIN 500 mg três vezes ao dia mais omeprazol 40 mg uma vez ao dia por 14 dias, seguido de omeprazol 20 mg uma vez ao dia ( ensaios 12, 13 e 15) ou por omeprazol 40 mg uma vez ao dia (ensaio 14) por mais 14 dias em pacientes com úlcera duodenal ativa associada a H. pylori. Os ensaios 12 e 13 foram conduzidos nos EUA e Canadá e envolveram 242 e 256 pacientes, respectivamente. A infecção por H. pylori e a úlcera duodenal foram confirmadas em 219 pacientes no estudo 12 e 228 pacientes no estudo 13. Esses estudos compararam o regime de combinação com monoterapias com omeprazol e BIAXIN. Os ensaios 14 e 15 foram conduzidos na Europa e envolveram 154 e 215 pacientes, respectivamente. A infecção por H. pylori e a úlcera duodenal foram confirmadas em 148 pacientes no estudo 14 e em 208 pacientes no estudo 15. Esses estudos compararam o regime de combinação à monoterapia com omeprazol. Os resultados das análises de eficácia para esses ensaios estão descritos nas Tabelas 20, 21 e 22.
Cicatrização de úlcera duodenal
A combinação de BIAXIN 250mg e omeprazol foi tão eficaz quanto o omeprazol isolado na cicatrização de úlcera duodenal (ver Tabela 20).
Erradicação do H. pylori Associado à Úlcera Duodenal
A combinação de BIAXIN 500mg e omeprazol foi eficaz na erradicação do H. pylori (ver Tabela 21). A erradicação do H. pylori foi definida como nenhum teste positivo (cultura ou histologia) em 4 semanas após o término do tratamento, e dois testes negativos foram necessários para serem considerados erradicados. Na análise por protocolo, os seguintes pacientes foram excluídos: desistentes, pacientes com grandes violações de protocolo, pacientes com testes de H. pylori ausentes após o tratamento e pacientes que não foram avaliados para erradicação de H. pylori em 4 semanas após o término do tratamento. tratamento porque se descobriu que tinham uma úlcera não cicatrizada no final do tratamento.
Recorrência de úlcera duodenal
recorrência da úlcera aos 6 meses e aos 12 meses após o final do tratamento foi avaliada para pacientes em que as úlceras foram curadas após o tratamento (veja os resultados na Tabela 22). Assim, em pacientes com úlcera duodenal associada à infecção por H. pylori, a erradicação do H. pylori reduziu a recorrência da úlcera.
REFERÊNCIAS
2.Kemper CA, et al. Tratamento da Bacteremia do Complexo Mycobacterium avium na AIDS com um Regime Oral de Quatro Drogas. Ann Intern Med. 1992;116:466-472.
INFORMAÇÃO DO PACIENTE
Forneça as seguintes instruções ou informações sobre BIAXIN 250mg aos pacientes:
- Aconselhe os pacientes que os medicamentos antibacterianos, incluindo BIAXIN (claritromicina), devem ser usados apenas para tratar infecções bacterianas. Eles não tratam infecções virais (por exemplo, o resfriado comum). Quando BIAXIN 250mg é prescrito para tratar uma infecção bacteriana, os pacientes devem ser informados de que, embora seja comum sentir-se melhor no início do tratamento, a medicação deve ser tomada exatamente como indicado. Pular doses ou não completar o curso completo da terapia pode (1) diminuir a eficácia do tratamento imediato e (2) aumentar a probabilidade de que as bactérias desenvolvam resistência e não sejam tratáveis com BIAXIN 250mg ou outros medicamentos antibacterianos no futuro.
- Aconselhe os pacientes que a diarreia é um problema comum causado por antibacterianos, incluindo BIAXIN (claritromicina), que geralmente termina quando o antibacteriano é descontinuado. Às vezes, após o início do tratamento com antibacterianos, os pacientes podem desenvolver fezes aquosas e sanguinolentas (com ou sem cólicas estomacais e febre), mesmo dois ou mais meses após a última dose do antibacteriano. Se isso ocorrer, instrua os pacientes a entrar em contato com seu médico o mais rápido possível.
- Avisar os pacientes que BIAXIN (claritromicina) pode interagir com alguns medicamentos; portanto, aconselhe os pacientes a relatar ao seu médico o uso de quaisquer outros medicamentos.
- Avise os pacientes que BIAXIN (claritromicina) Filmtab e suspensão oral podem ser tomados com ou sem alimentos e podem ser tomados com leite; no entanto, BIAXIN 250mg XL Filmtab (comprimidos de liberação prolongada de claritromicina) deve ser tomado com alimentos. Não refrigerar a suspensão.
- Não existem dados sobre o efeito de BIAXIN (claritromicina) na capacidade de conduzir ou utilizar máquinas. No entanto, aconselhe os pacientes sobre o potencial de tontura, vertigem, confusão e desorientação, que podem ocorrer com a medicação. O potencial para essas reações adversas deve ser levado em consideração antes de os pacientes dirigirem ou usarem máquinas.
- Aconselhe as pacientes que, se ocorrer gravidez durante o uso deste medicamento, há risco potencial para o feto [ver AVISOS E PRECAUÇÕES e Uso em populações específicas ].
- Aconselhe os pacientes com doença arterial coronariana a continuar com os medicamentos e as modificações no estilo de vida para a doença arterial coronariana, pois BIAXIN 500mg pode estar associado a um risco aumentado de mortalidade anos após o término do tratamento com BIAXIN.
