Aceon 2mg, 4mg, 8mg Perindopril Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Aceon 4mg e como é usado?
Aceon 8mg é um medicamento de prescrição usado para tratar os sintomas de pressão alta (hipertensão) e doença arterial coronariana estável (CAD). Aceon pode ser usado sozinho ou com outros medicamentos.
Aceon pertence a uma classe de medicamentos chamados inibidores da ECA.
Não se sabe se Aceon é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Aceon 4mg?
Aceon pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço do rosto, lábios, língua ou garganta,
- fraqueza,
- batimentos cardíacos lentos ou irregulares,
- desmaio,
- náusea,
- vômito,
- perda de apetite,
- dor abdominal,
- amarelecimento dos olhos ou da pele (icterícia),
- urina escura e
- tontura severa
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Aceon 2mg incluem:
- tontura,
- tontura,
- cansaço, e
- tosse seca
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Aceon. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
TOXICIDADE FETAL
- Quando a gravidez for detectada, interrompa o ACEON 4mg o mais rápido possível. AVISOS E PRECAUÇÕES
- Drogas que atuam diretamente no sistema renina-angiotensina podem causar lesão e morte do feto em desenvolvimento. AVISOS E PRECAUÇÕES
DESCRIÇÃO
Os comprimidos de ACEON® (perindopril erbumina) contêm o sal terc-butilamina de perindopril, o éster etílico de um inibidor da enzima conversora de angiotensina não sulfidrila (ECA). Perindopril erbumina é quimicamente descrita como ácido (2S,3DS,7DS)-1-[(S)-N-[(S)-1-carboxi-butil]alanil]hexahidro-2-indolinocarboxílico, 1-éster etílico, composto com terc-butilamina (1:1). Sua fórmula molecular é C19H32N2O5C4H11N. Sua fórmula estrutural é:
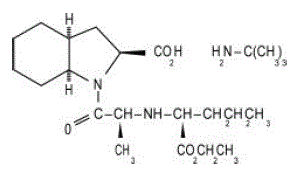
Perindopril erbumina é um pó branco, cristalino com um peso molecular de 368,47 (ácido livre) ou 441,61 (forma de sal). É livremente solúvel em água (60% p/p), álcool e clorofórmio.
Perindopril é a forma de ácido livre da erbumina perindopril, é uma pró-droga e metabolizada in vivo por hidrólise do grupo éster para formar perindoprilato, o metabólito biologicamente ativo.
ACEON está disponível em dosagens de 2 mg, 4 mg e 8 mg para administração oral. Além de perindopril erbumina, cada comprimido contém os seguintes ingredientes inativos: sílica coloidal (hidrofóbica), lactose, estearato de magnésio e celulose microcristalina. Os comprimidos de 4 mg e 8 mg também contêm óxido de ferro.
INDICAÇÕES
Hipertensão
ACEON é indicado para o tratamento de pacientes com hipertensão essencial. ACEON pode ser usado isoladamente ou administrado com outras classes de anti-hipertensivos, especialmente diuréticos tiazídicos.
Doença Arterial Coronariana Estável
ACEON 8mg é indicado para o tratamento de pacientes com doença arterial coronariana estável para reduzir o risco de mortalidade cardiovascular ou infarto do miocárdio não fatal. ACEON pode ser usado com o tratamento convencional para o manejo da doença arterial coronariana, como terapia antiplaquetária, anti-hipertensiva ou hipolipemiante.
DOSAGEM E ADMINISTRAÇÃO
Hipertensão
Uso em pacientes hipertensos não complicados
Em pacientes com hipertensão essencial, a dose inicial recomendada é de 4 mg uma vez ao dia. A dose pode ser titulada, conforme necessário, até um máximo de 16 mg por dia. O intervalo de dose de manutenção usual é de 4 mg a 8 mg administrados em dose única diária ou em duas doses divididas.
Uso em pacientes idosos
A dose diária inicial recomendada de ACEON 4mg para idosos é de 4 mg por dia, administrados em uma ou duas doses divididas. A experiência com ACEON é limitada em idosos com doses superiores a 8 mg. Doses acima de 8 mg devem ser administradas com monitoramento cuidadoso da pressão arterial e titulação da dose. Uso em populações específicas ].
Use com diuréticos
Em pacientes que estão atualmente sendo tratados com um diurético, pode ocorrer hipotensão sintomática após a dose inicial de ACEON. Considere reduzir a dose de diurético antes de iniciar ACEON [ver INTERAÇÕES MEDICAMENTOSAS ].
Doença Arterial Coronariana Estável
Em pacientes com doença arterial coronariana estável, ACEON 4mg deve ser administrado em uma dose inicial de 4mg uma vez ao dia por 2 semanas, e então aumentado conforme tolerado, para uma dose de manutenção de 8mg uma vez ao dia. Em pacientes idosos (mais de 70 anos), ACEON deve ser administrado na dose de 2 mg uma vez ao dia na primeira semana, seguido de 4 mg uma vez ao dia na segunda semana e 8 mg uma vez ao dia para dose de manutenção, se tolerado.
Ajuste de dose na insuficiência renal e diálise
eliminação do perindoprilato está diminuída em pacientes com insuficiência renal. ACEON não é recomendado em pacientes com clearance de creatinina
COMO FORNECIDO
Formas de dosagem e pontos fortes
Os comprimidos são oblongos com uma ranhura de um lado.
O comprimido de 2 mg é branco e gravado no lado não sulcado com "ACN 2".
O comprimido de 4 mg é cor-de-rosa e gravado no lado não sulcado com "ACN 4".
O comprimido de 8 mg é salmão e está gravado no lado não sulcado "ACN 8".
Armazenamento e manuseio
Os comprimidos são oblongos com uma ranhura de um lado.
Manter fora do alcance das crianças.
Armazenar em temperatura ambiente controlada de 20° a 25°C (68° a 77°F) [ver USP]. Proteger da umidade.
Para mais informações, ligue gratuitamente para o nosso departamento de comunicações médicas em 888-985-7657.
Fabricado por: Patheon Pharmaceuticals, Inc. Cincinnati, OH 45237 EUA. Revisado: setembro de 2017
EFEITOS COLATERAIS
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de eventos adversos observadas nos ensaios clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Experiência de Ensaios Clínicos
As seguintes reações adversas são discutidas em outra parte da bula:
- Reações anafilactóides, incluindo angioedema [ver AVISOS E PRECAUÇÕES ]
- Hipotensão [ver AVISOS E PRECAUÇÕES ]
- Neutropenia e agranulocitose [ver AVISOS E PRECAUÇÕES ]
- Função renal prejudicada [ver AVISOS E PRECAUÇÕES ]
- Hipercalemia [ver AVISOS E PRECAUÇÕES ]
- Tosse [ver AVISOS E PRECAUÇÕES ]
Hipertensão
ACEON 4mg foi avaliado quanto à segurança em aproximadamente 3.400 pacientes com hipertensão nos EUA e em ensaios clínicos estrangeiros. Os dados apresentados aqui são baseados em resultados de 1.417 pacientes tratados com ACEON que participaram dos ensaios clínicos nos EUA. Mais de 220 desses pacientes foram tratados com ACEON® (perindopril erbumina) por pelo menos um ano.
Em ensaios clínicos controlados por placebo nos EUA, a incidência de descontinuação prematura da terapia devido a eventos adversos foi de 6,5% em pacientes tratados com ACEON 2mg e 6,7% em pacientes tratados com placebo. As causas mais comuns foram tosse, dor de cabeça, astenia e tontura.
Entre 1.012 pacientes em estudos controlados com placebo nos EUA, a frequência geral de eventos adversos relatados foi semelhante em pacientes tratados com ACEON e naqueles tratados com placebo (aproximadamente 75% em cada grupo). Os únicos eventos adversos cuja incidência com ACEON 4mg foi pelo menos 2% maior do que com placebo foram tosse (12% vs. 4,5%) e dor nas costas (5,8% vs. 3,1%).
A tontura não foi relatada com mais frequência no grupo perindopril (8,2%) do que no grupo placebo (8,5%), mas sua probabilidade aumentou com a dose, sugerindo uma relação causal com o perindopril.
Doença Arterial Coronariana Estável
perindopril foi avaliado quanto à segurança no EUROPA, um estudo duplo-cego, controlado por placebo em 12.218 pacientes com doença arterial coronariana estável. A taxa geral de descontinuação foi de cerca de 22% com a droga e placebo. As razões médicas mais comuns para a descontinuação que foram mais frequentes com perindopril do que com placebo foram tosse, intolerância ao medicamento e hipotensão.
Experiência pós-marketing
Relatos voluntários de eventos adversos em pacientes tomando ACEON que foram recebidos desde a introdução no mercado e cuja relação causal desconhecida com ACEON 8mg incluem: parada cardíaca, pneumonite eosinofílica, neutropenia/agranulocitose, pancitopenia, anemia (incluindo hemolítica e aplástica), trombocitopenia, insuficiência renal, nefrite, insuficiência hepática, icterícia (hepatocelular ou colestática), hiponatremia sintomática, penfigoide bolhoso, pênfigo, pancreatite aguda, quedas, psoríase, dermatite esfoliativa e uma síndrome que pode incluir: artralgia/artrite, vasculite, serosite, mialgia, febre , erupção cutânea ou outras manifestações dermatológicas, um anticorpo antinuclear (ANA) positivo, leucocitose, eosinofilia ou uma velocidade de hemossedimentação (VHS) elevada.
Achados de Testes de Laboratório Clínico
Hematologia
Pequenas diminuições na hemoglobina e no hematócrito ocorrem frequentemente em pacientes hipertensos tratados com ACEON 8mg, mas raramente são de importância clínica. Em ensaios clínicos controlados, nenhum paciente foi descontinuado da terapia devido ao desenvolvimento de anemia. Leucopenia (incluindo neutropenia) foi observada em 0,1% dos pacientes em estudos clínicos nos EUA [ver AVISOS E PRECAUÇÕES ].
Testes de função hepática
Elevações em ALT (1,6% ACEON versus 0,9% placebo) e AST (0,5% ACEON 2mg versus 0,4% placebo) foram observadas em ensaios clínicos controlados por placebo. As elevações foram geralmente leves e transitórias e foram resolvidas após a descontinuação da terapia.
INTERAÇÕES MEDICAMENTOSAS
Diuréticos
Pacientes em uso de diuréticos, e especialmente aqueles iniciados recentemente, podem ocasionalmente apresentar uma redução excessiva da pressão arterial após o início da terapia com ACEON. A possibilidade de efeitos hipotensores pode ser minimizada diminuindo a dose ou descontinuando o diurético ou aumentando a ingestão de sal antes do início do tratamento com perindopril. Se a terapia diurética não puder ser alterada, forneça supervisão médica rigorosa com a primeira dose de ACEON, por pelo menos duas horas e até que a pressão arterial se estabilize por mais uma hora [ver AVISOS E PRECAUÇÕES ].
A velocidade e extensão da absorção e eliminação do perindopril não são afetadas pelos diuréticos concomitantes. A biodisponibilidade do perindoprilato foi reduzida pelos diuréticos, no entanto, e isso foi associado a uma diminuição na inibição da ECA no plasma.
Suplementos de potássio e diuréticos poupadores de potássio
ACEON 8mg pode aumentar o potássio sérico devido ao seu potencial de diminuir a produção de aldosterona. O uso de diuréticos poupadores de potássio (espironolactona, amilorida, triantereno e outros), suplementos de potássio ou outras drogas capazes de aumentar o potássio sérico (indometacina, heparina, ciclosporina e outros) podem aumentar o risco de hipercalemia. Portanto, se o uso concomitante de tais agentes for indicado, monitore frequentemente o potássio sérico do paciente.
Lítio
Aumento do lítio sérico e sintomas de toxicidade do lítio foram relatados em pacientes recebendo terapia concomitante com lítio e inibidores da ECA. Recomenda-se a monitorização frequente da concentração sérica de lítio. O uso de um diurético pode aumentar ainda mais o risco de toxicidade do lítio.
Ouro
Reações nitritoides (sintomas incluem rubor facial, náuseas, vômitos e hipotensão) foram relatadas raramente em pacientes em terapia com ouro injetável (aurotiomalato de sódio) e terapia concomitante com inibidor da ECA, incluindo ACEON.
Digoxina
Um estudo farmacocinético controlado não mostrou efeito nas concentrações plasmáticas de digoxina quando coadministrado com ACEON, mas não foi excluído um efeito da digoxina na concentração plasmática de perindopril/perindoprilato.
Gentamicina
Dados em animais sugeriram a possibilidade de interação entre perindopril e gentamicina. No entanto, isso não foi investigado em estudos humanos.
Agentes anti-inflamatórios não esteroides, incluindo inibidores seletivos de ciclooxigenase-2 (inibidores de COX-2)
Em pacientes idosos, com depleção de volume (incluindo aqueles em terapia diurética) ou com função renal comprometida, a coadministração de AINEs, incluindo inibidores seletivos de COX-2, com inibidores da ECA, incluindo perindopril, pode resultar em deterioração da função renal , incluindo possível insuficiência renal aguda. Estes efeitos são geralmente reversíveis. Monitorar a função renal periodicamente em pacientes recebendo terapia com perindopril e AINEs.
efeito anti-hipertensivo dos inibidores da ECA, incluindo o perindopril, pode ser atenuado pelos AINEs, incluindo os inibidores seletivos da COX-2.
Duplo bloqueio do sistema renina-angiotensina (RAS)
O bloqueio duplo do SRA com bloqueadores dos receptores da angiotensina, inibidores da ECA ou alisquireno está associado a riscos aumentados de hipotensão, hipercalemia e alterações na função renal (incluindo insuficiência renal aguda) em comparação com a monoterapia. A maioria dos pacientes que recebem a combinação de dois inibidores do RAS não obtém nenhum benefício adicional em comparação com a monoterapia. Em geral, evite o uso combinado de inibidores do RAS. Monitore de perto a pressão arterial, função renal e eletrólitos em pacientes em uso de ACEON 2mg e outros agentes que afetam o RAS.
Não coadministre alisquireno com ACEON 8mg em pacientes com diabetes. Evitar o uso de alisquireno com ACEON 2mg em pacientes com insuficiência renal (TFG
Inibidores de mTOR
Pacientes em tratamento concomitante com inibidores de mTOR (alvo de rapamicina em mamíferos) podem apresentar risco aumentado de angioedema [ver AVISOS E PRECAUÇÕES ].
Inibidor de Neprilisina
Pacientes em uso concomitante de inibidores de neprilisina podem apresentar risco aumentado de angioedema. [Vejo AVISOS E PRECAUÇÕES ]
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Reações Anafilactóides e Possivelmente Relacionadas
Presumivelmente, porque os inibidores da enzima conversora de angiotensina afetam o metabolismo de eicosanóides e polipeptídeos, incluindo bradicinina endógena, os pacientes que recebem inibidores da ECA (incluindo ACEON) podem estar sujeitos a uma variedade de eventos adversos, alguns deles graves. Pacientes negros recebendo inibidores da ECA têm maior incidência de angioedema em comparação com não negros.
Angioedema de cabeça e pescoço
Angioedema da face, extremidades, lábios, língua, glote ou laringe foi relatado em pacientes tratados com inibidores da ECA, incluindo ACEON (0,1% dos pacientes tratados com ACEON em ensaios clínicos nos EUA). O angioedema associado ao envolvimento da língua, glote ou laringe pode ser fatal. Nesses casos, interrompa o tratamento com ACEON imediatamente e observe até que o inchaço desapareça. Quando o envolvimento da língua, glote ou laringe parece causar obstrução das vias aéreas, administre a terapia apropriada, como solução de epinefrina subcutânea 1:1.000 (0,3 a 0,5 mL), imediatamente.
Pacientes em tratamento concomitante com inibidor de mTOR (por exemplo, temsirolimus) ou um inibidor de neprilisina podem apresentar risco aumentado de angioedema [ver INTERAÇÕES MEDICAMENTOSAS ].
Angioedema Intestinal
Foi relatado angioedema intestinal em pacientes tratados com inibidores da ECA. Esses pacientes apresentavam dor abdominal (com ou sem náusea ou vômito); em alguns casos não havia história prévia de angioedema facial e os níveis de C-1 esterase estavam normais. O angioedema foi diagnosticado por procedimentos incluindo tomografia computadorizada abdominal ou ultra-som, ou na cirurgia, e os sintomas foram resolvidos após a interrupção do inibidor da ECA. O angioedema intestinal deve ser incluído no diagnóstico diferencial de pacientes em uso de inibidores da ECA apresentando dor abdominal.
Hipotensão
ACEON 4mg pode causar hipotensão sintomática. ACEON foi associado com hipotensão em 0,3% dos pacientes hipertensos não complicados em estudos controlados por placebo nos EUA. Sintomas relacionados à hipotensão ortostática foram relatados em outros 0,8% dos pacientes.
hipotensão sintomática é mais provável de ocorrer em pacientes que sofreram depleção de volume ou sal como resultado de terapia diurética prolongada, restrição de sal na dieta, diálise, diarreia ou vômito [ver DOSAGEM E ADMINISTRAÇÃO ].
Os inibidores da ECA podem causar hipotensão excessiva e podem estar associados a oligúria ou azotemia e raramente a insuficiência renal aguda e morte. Em pacientes com doença isquêmica do coração ou doença cerebrovascular, uma queda excessiva da pressão arterial pode resultar em infarto do miocárdio ou acidente vascular cerebral.
Em pacientes com risco de hipotensão excessiva, a terapia com ACEON deve ser iniciada sob supervisão médica muito rigorosa. Os pacientes devem ser acompanhados de perto durante as primeiras duas semanas de tratamento e sempre que a dose de ACEON 2mg e/ou diurético for aumentada.
Se ocorrer hipotensão excessiva, o paciente deve ser colocado imediatamente em decúbito dorsal e, se necessário, tratado com infusão intravenosa de soro fisiológico. O tratamento com ACEON 4mg geralmente pode ser continuado após a restauração do volume e da pressão arterial.

Neutropenia/Agranulocitose
Os inibidores da ECA têm sido associados a agranulocitose e depressão da medula óssea, mais frequentemente em pacientes com insuficiência renal, especialmente pacientes com doença vascular do colágeno, como lúpus eritematoso sistêmico ou esclerodermia.
Toxicidade Fetal
Gravidez Categoria D
uso de drogas que atuam no sistema renina-angiotensina durante o segundo e terceiro trimestres de gestação reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal. O oligoidrâmnio resultante pode estar associado a hipoplasia pulmonar fetal e deformações esqueléticas. Os potenciais efeitos adversos neonatais incluem hipoplasia do crânio, anúria, hipotensão, insuficiência renal e morte. Quando a gravidez for detectada, interrompa ACEON 4mg o mais rápido possível [ver Uso em populações específicas ].
Função Renal Prejudicada
Como consequência da inibição do sistema renina-angiotensina-aldosterona, podem ser antecipadas alterações na função renal em indivíduos susceptíveis. A função renal deve ser monitorada periodicamente em pacientes recebendo ACEON [ver DOSAGEM E ADMINISTRAÇÃO ], [Vejo INTERAÇÕES MEDICAMENTOSAS ].
Em pacientes com insuficiência cardíaca congestiva grave, onde a função renal pode depender da atividade do sistema renina-angiotensinaldosterona, o tratamento com inibidores da ECA, incluindo ACEON, pode estar associado a oligúria, azotemia progressiva e, raramente, insuficiência renal aguda e morte.
Em pacientes hipertensos com estenose unilateral ou bilateral da artéria renal, podem ocorrer aumentos do nitrogênio ureico no sangue e da creatinina sérica; geralmente reversível com a descontinuação do inibidor da ECA. Nesses pacientes, a função renal deve ser monitorada durante as primeiras semanas de terapia.
Alguns pacientes tratados com ACEON desenvolveram aumentos menores e transitórios no nitrogênio da ureia no sangue e na creatinina sérica, especialmente naqueles tratados concomitantemente com um diurético.
Hipercalemia
Elevações do potássio sérico foram observadas em alguns pacientes tratados com inibidores da ECA, incluindo ACEON. A maioria dos casos eram valores únicos isolados que não pareciam clinicamente relevantes e raramente eram causa de retirada. Os fatores de risco para o desenvolvimento de hipercalemia incluem insuficiência renal, diabetes mellitus e o uso concomitante de agentes como diuréticos poupadores de potássio, suplementos de potássio e/ou substitutos do sal contendo potássio [ver INTERAÇÕES MEDICAMENTOSAS ].
O potássio sérico deve ser monitorado periodicamente em pacientes recebendo ACEON.
Tosse
Presumivelmente devido à inibição da degradação da bradicinina endógena, tosse não produtiva persistente foi relatada com todos os inibidores da ECA, geralmente desaparecendo após a descontinuação da terapia. Considerar tosse induzida por inibidor da ECA no diagnóstico diferencial de tosse.
Insuficiência Hepática
Raramente, os inibidores da ECA têm sido associados a uma síndrome que começa com icterícia colestática e progride para necrose hepática fulminante e, às vezes, morte. O mecanismo desta síndrome não é compreendido. Pacientes recebendo inibidores da ECA que desenvolvem icterícia ou elevações acentuadas das enzimas hepáticas devem descontinuar o inibidor da ECA e receber acompanhamento médico adequado.
Cirurgia/Anestesia
Em pacientes submetidos a cirurgia ou durante anestesia com agentes que produzem hipotensão, ACEON pode bloquear a formação de angiotensina II que de outra forma ocorreria secundariamente à liberação compensatória de renina. A hipotensão atribuível a esse mecanismo pode ser corrigida pela expansão do volume.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Carcinogenicidade
Nenhuma evidência de efeito carcinogênico foi observada em estudos em ratos e camundongos quando o perindopril foi administrado em doses até 20 vezes (mg/kg) ou 2 a 4 vezes (mg/m2) as doses clínicas máximas propostas (16 mg/dia) para 104 semanas.
Mutagênese
Nenhum potencial genotóxico foi detectado para ACEON, perindoprilato e outros metabólitos em várias investigações in vitro e in vivo, incluindo o teste de Ames, o teste de Saccharomyces cerevisiae D4, linfócitos humanos cultivados, ensaio de linfoma de camundongo TK ±, testes de micronúcleo de camundongo e rato e hamster chinês ensaio de medula óssea.
Prejuízo da Fertilidade
Não houve efeito significativo sobre o desempenho reprodutivo ou fertilidade em ratos que receberam até 30 vezes (mg/kg) ou 6 vezes (mg/m2) a dose clínica máxima proposta de ACEON 2mg durante o período de espermatogênese em machos ou ovogênese e gestação nas fêmeas.
Uso em populações específicas
Gravidez
Gravidez Categoria D [ver AVISO DE CAIXA e AVISOS E PRECAUÇÕES ].
uso de drogas que atuam no sistema renina-angiotensina durante o segundo e terceiro trimestres de gestação reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal. O oligoidrâmnio resultante pode estar associado a hipoplasia pulmonar fetal e deformações esqueléticas. Os potenciais efeitos adversos neonatais incluem hipoplasia do crânio, anúria, hipotensão, insuficiência renal e morte. Quando a gravidez for detectada, interrompa o ACEON o mais rápido possível. Esses desfechos adversos geralmente estão associados ao uso desses medicamentos no segundo e terceiro trimestre da gravidez. A maioria dos estudos epidemiológicos examinando anormalidades fetais após exposição ao uso de anti-hipertensivos no primeiro trimestre não distinguiu drogas que afetam o sistema renina-angiotensina de outros agentes anti-hipertensivos.
O manejo adequado da hipertensão materna durante a gravidez é importante para otimizar os resultados tanto para a mãe quanto para o feto.
No caso incomum de não haver alternativa adequada à terapia com medicamentos que afetem o sistema renina-angiotensina para um paciente em particular, informar a mãe sobre o risco potencial para o feto. Realizar exames ultrassonográficos seriados para avaliar o ambiente intra-amniótico. Se for observado oligoidrâmnio, descontinuar ACEON 2mg, a menos que seja considerado salva-vidas para a mãe. O teste fetal pode ser apropriado, com base na semana de gravidez. Pacientes e médicos devem estar cientes, entretanto, de que o oligoidrâmnio pode não aparecer até que o feto tenha sofrido lesão irreversível. Observar de perto bebês com história de exposição in utero ao ACEON para hipotensão, oligúria e hipercalemia [ver Uso Pediátrico ].
A radioatividade foi detectável em fetos após administração de 14C-perindopril a ratas grávidas.
Mães que amamentam
leite de ratas lactantes continha radioatividade após a administração de 14C-perindopril. Não se sabe se o perindopril é secretado no leite humano. Como muitos medicamentos são secretados no leite humano, deve-se ter cautela quando ACEON for administrado a lactantes.
Uso Pediátrico
Recém-nascidos com histórico de exposição in utero ao ACEON
Se ocorrer oligúria ou hipotensão, dirigir a atenção para o suporte da pressão arterial e perfusão renal. Transfusões de troca ou diálise podem ser necessárias como meio de reverter a hipotensão e/ou substituir a função renal desordenada. O perindopril, que atravessa a placenta, pode teoricamente ser removido da circulação neonatal por esses meios, mas a experiência limitada não mostrou que essa remoção seja central para o tratamento desses bebês.
A segurança e eficácia de ACEON 8mg em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
efeito médio da pressão arterial do perindopril foi um pouco menor em pacientes com mais de 60 anos do que em pacientes mais jovens, embora a diferença não tenha sido significativa. As concentrações plasmáticas de perindopril e perindoprilato aumentaram em pacientes idosos em comparação com as concentrações em pacientes mais jovens. Nenhum efeito adverso foi claramente aumentado em pacientes mais velhos, com exceção de tontura e possivelmente erupção cutânea.
Comece com uma dose baixa e titule lentamente conforme necessário. Monitorar tonturas devido ao potencial de quedas.
A experiência com ACEON 8mg em pacientes idosos em doses diárias superiores a 8mg é limitada.
Insuficiência renal
O ajuste da dose pode ser necessário em pacientes com insuficiência renal [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
Insuficiência hepática
A biodisponibilidade do perindoprilato é aumentada em pacientes com insuficiência hepática [ver FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Em animais, doses de perindopril até 2.500 mg/kg em camundongos, 3.000 mg/kg em ratos e 1.600 mg/kg em cães não foram letais. As experiências anteriores foram escassas, mas sugeriram que a superdosagem com outros inibidores da ECA também foi razoavelmente bem tolerada por humanos. A manifestação mais provável é a hipotensão, e o tratamento deve ser sintomático e de suporte. A terapia com o inibidor da ECA deve ser descontinuada e o paciente deve ser observado. Desidratação, desequilíbrio eletrolítico e hipotensão devem ser tratados por procedimentos estabelecidos.
Entre os casos relatados de superdosagem de perindopril, os pacientes que ingeriram uma dose de 80 mg a 120 mg necessitaram de ventilação assistida e suporte circulatório. Um paciente adicional desenvolveu hipotermia, parada circulatória e morreu após ingestão de até 180 mg de perindopril. A intervenção para superdosagem de perindopril pode exigir suporte vigoroso.
As determinações laboratoriais dos níveis séricos de perindopril e seus metabólitos não estão amplamente disponíveis, e tais determinações não têm, em qualquer caso, nenhum papel estabelecido no manejo da superdosagem de perindopril.
Não há dados disponíveis para sugerir manobras fisiológicas (por exemplo, manobras para alterar o pH da urina) que possam acelerar a eliminação do perindopril e seus metabólitos. O perindopril pode ser removido por hemodiálise, com depuração de 52 mL/min para perindopril e 67 mL/min para perindoprilato.
A angiotensina II presumivelmente poderia servir como um antagonista-antídoto específico na resolução da overdose de perindopril, mas a angiotensina II é essencialmente indisponível fora de instalações de pesquisa dispersas. Como o efeito hipotensor do perindopril é obtido por meio de vasodilatação e hipovolemia efetiva, é razoável tratar a superdosagem de perindopril por infusão de solução salina normal.
CONTRA-INDICAÇÕES
ACEON® (perindopril erbumina) é contraindicado em pacientes com hipersensibilidade (incluindo angioedema) a este produto ou a qualquer outro inibidor da ECA. ACEON 4mg também é contraindicado em pacientes com angioedema hereditário ou idiopático.
Não coadministre alisquireno com ACEON em pacientes com diabetes. [Vejo INTERAÇÕES MEDICAMENTOSAS ]
ACEON é contraindicado em combinação com inibidor de neprilisina (por exemplo, sacubitril). Não administre ACEON 8mg dentro de 36 horas após a troca de sacubitril/valsartana, um inibidor da neprilisina [ver AVISOS E PRECAUÇÕES ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
ACEON® (perindopril erbumina) é uma pró-droga do perindoprilato, que inibe a ECA em humanos e animais. Acredita-se que o mecanismo pelo qual o perindoprilato reduz a pressão arterial seja principalmente a inibição da atividade da ECA. A ECA é uma peptidil dipeptidase que catalisa a conversão do decapeptídeo inativo, angiotensina I, no vasoconstritor, angiotensina II. A angiotensina II é um potente vasoconstritor periférico, que estimula a secreção de aldosterona pelo córtex adrenal e fornece feedback negativo sobre a secreção de renina. A inibição da ECA resulta em diminuição da angiotensina II plasmática, levando à diminuição da vasoconstrição, aumento da atividade da renina plasmática e diminuição da secreção de aldosterona. Este último resulta em diurese e natriurese e pode estar associado a um pequeno aumento do potássio sérico.
ECA é idêntica à cininase II, uma enzima que degrada a bradicinina. Se os níveis aumentados de bradicinina, um potente peptídeo vasodepressor, desempenham um papel nos efeitos terapêuticos de ACEON 4mg ainda não foi elucidado.
Embora se acredite que o principal mecanismo do perindopril na redução da pressão arterial seja através do sistema renina-angiotensinaldosterona, os inibidores da ECA têm algum efeito mesmo na aparente hipertensão com baixo teor de renina. O perindopril foi estudado em relativamente poucos pacientes negros, geralmente uma população com baixa renina, e a resposta média da pressão arterial diastólica ao perindopril foi cerca de metade da resposta observada em pacientes não negros, um achado consistente com a experiência anterior de outros inibidores da ECA.
Farmacodinâmica
Após a administração de perindopril, a ECA é inibida de acordo com a dose e a concentração sanguínea, com a inibição máxima de 80 a 90% alcançada por 8 mg persistindo por 10 a 12 horas. A inibição da ECA em 24 horas é de cerca de 60% após essas doses. O grau de inibição da ECA alcançado por uma determinada dose parece diminuir ao longo do tempo (o ID50 aumenta). A resposta pressora a uma infusão de angiotensina I é reduzida pelo perindopril, mas esse efeito não é tão persistente quanto o efeito sobre a ECA; há cerca de 35% de inibição em 24 horas após uma dose de 12 mg.
Farmacocinética
Absorção
administração oral de ACEON resulta em concentrações plasmáticas máximas que ocorrem em aproximadamente 1 hora. A biodisponibilidade oral absoluta do perindopril é de cerca de 75%. Após a absorção, aproximadamente 30 a 50% do perindopril disponível sistemicamente é hidrolisado em seu metabólito ativo, perindoprilato, que tem uma biodisponibilidade média de cerca de 25%. As concentrações plasmáticas máximas de perindoprilato são atingidas 3 a 7 horas após a administração de perindopril. A administração oral de ACEON 8mg com alimentos não diminui significativamente a taxa ou extensão da absorção do perindopril em relação ao estado de jejum. No entanto, a extensão da biotransformação do perindopril no metabólito ativo, perindoprilato, é reduzida em aproximadamente 43%, resultando em uma redução na curva de inibição da ECA plasmática de aproximadamente 20%, provavelmente clinicamente insignificante. Em ensaios clínicos, o perindopril foi geralmente administrado sem jejum.
Com doses de 4 mg, 8 mg e 16 mg de ACEON, a Cmax e a AUC de perindopril e perindoprilato aumentam de forma proporcional à dose após administração oral única e no estado de equilíbrio durante um regime de doses múltiplas uma vez ao dia.
Distribuição
Aproximadamente 60% do perindopril circulante está ligado às proteínas plasmáticas e apenas 10 a 20% do perindoprilato está ligado. Portanto, não são previstas interações medicamentosas mediadas por efeitos na ligação a proteínas.
Metabolismo e eliminação
Após administração oral, o perindopril apresenta farmacocinética multicompartimental, incluindo um compartimento de tecido profundo (sítios de ligação da ECA). A meia-vida média do perindopril associada à maior parte de sua eliminação é de aproximadamente 0,8 a 1 hora.
perindopril é extensamente metabolizado após administração oral, com apenas 4 a 12% da dose recuperada inalterada na urina. Seis metabólitos resultantes da hidrólise, glucuronidação e ciclização por desidratação foram identificados. Estes incluem o inibidor da ECA ativo, perindoprilato (perindopril hidrolisado), perindopril e glicuronídeos de perindoprilato, perindopril desidratado e os diastereoisômeros de perindoprilato desidratado. Em humanos, a esterase hepática parece ser responsável pela hidrólise do perindopril.
metabólito ativo, perindoprilato, também apresenta farmacocinética multicompartimental após a administração oral de ACEON. A formação de perindoprilato é gradual, com picos de concentração plasmática ocorrendo entre 3 e 7 horas. O declínio subsequente na concentração plasmática mostra uma meia-vida média aparente de 3 a 10 horas para a maior parte da eliminação, com uma meia-vida de eliminação terminal prolongada de 30 a 120 horas resultante da dissociação lenta do perindoprilato da ligação da ECA plasma/tecido locais. Durante a administração oral repetida de perindopril uma vez ao dia, o perindoprilato acumula cerca de 1,5 a 2 vezes e atinge níveis plasmáticos em estado de equilíbrio em 3 a 6 dias. A depuração do perindoprilato e dos seus metabolitos é quase exclusivamente renal.
Idoso
As concentrações plasmáticas de perindopril e perindoprilato em pacientes idosos (com mais de 70 anos) são aproximadamente o dobro daquelas observadas em pacientes mais jovens, refletindo tanto a conversão aumentada de perindopril em perindoprilato quanto a excreção renal diminuída de perindoprilato. DOSAGEM E ADMINISTRAÇÃO e Uso em populações específicas ].
Insuficiência cardíaca
A depuração do perindoprilato é reduzida em pacientes com insuficiência cardíaca congestiva, resultando em uma AUC do intervalo de dose 40% maior.
Insuficiência renal
Com doses de perindopril de 2 mg a 4 mg, a AUC do perindoprilato aumenta com a diminuição da função renal. Em depurações de creatinina de 30 a 80 mL/min, a AUC é aproximadamente o dobro da de 100 mL/min. Quando a depuração da creatinina cai abaixo de 30 mL/min, a AUC aumenta mais acentuadamente.
Em um número limitado de pacientes estudados, a depuração do perindopril por diálise variou de cerca de 40 a 80 mL/min. A depuração do perindoprilato por diálise variou de cerca de 40 a 90 mL/min [ver DOSAGEM E ADMINISTRAÇÃO ].
Insuficiência hepática
biodisponibilidade do perindoprilato é aumentada em pacientes com insuficiência hepática. As concentrações plasmáticas de perindoprilato em pacientes com função hepática comprometida foram cerca de 50% maiores do que aquelas observadas em indivíduos saudáveis ou pacientes hipertensos com função hepática normal.
Estudos clínicos
Hipertensão
Em estudos controlados com placebo de monoterapia com perindopril (2 mg a 16 mg uma vez ao dia) em pacientes com pressão arterial média de cerca de 150/100 mm Hg, 2 mg tiveram pouco efeito, mas doses de 4 mg a 16 mg reduziram a pressão arterial. As doses de 8 mg e 16 mg foram indistinguíveis, e ambas tiveram um efeito maior do que a dose de 4 mg. Nesses estudos, doses de 8 mg e 16 mg por dia resultaram em decúbito dorsal, com reduções da pressão arterial de 9 a 15/5 a 6 mm Hg. Quando a dosagem uma vez ao dia e duas vezes ao dia foram comparadas, o regime de dosagem duas vezes ao dia foi geralmente ligeiramente superior, mas não mais do que cerca de 0,5 mm Hg a 1 mm Hg. Após doses de 2 mg a 16 mg de perindopril, os efeitos mínimos da pressão arterial sistólica e diastólica foram de cerca de 75 a 100% dos efeitos de pico.
Os efeitos do perindopril na pressão arterial foram semelhantes quando administrado isoladamente ou com 25 mg de hidroclorotiazida. Em geral, o efeito do perindopril ocorreu prontamente, com efeitos aumentando ligeiramente ao longo de várias semanas.
Estudos formais de interação de ACEON® (perindopril erbumina) não foram realizados com outros agentes anti-hipertensivos além das tiazidas. A experiência limitada em estudos controlados e não controlados de coadministração de ACEON 2mg com um bloqueador dos canais de cálcio, um diurético de alça ou terapia tripla (betabloqueador, vasodilatador e diurético), não sugere interações inesperadas. Em geral, os inibidores da ECA têm menos efeitos aditivos quando administrados com bloqueadores beta-adrenérgicos, presumivelmente porque ambos atuam em parte através do sistema renina angiotensina.
Em estudos não controlados em pacientes com diabetes insulino-dependente, o perindopril não pareceu afetar o controle glicêmico. No uso a longo prazo, nenhum efeito na excreção urinária de proteínas foi observado nesses pacientes.
eficácia de ACEON 4mg não foi influenciada pelo sexo e foi menos eficaz em pacientes negros do que em pacientes não negros. Em pacientes idosos (maior ou igual a 60 anos), o efeito da pressão arterial média foi um pouco menor do que em pacientes mais jovens, embora a diferença não tenha sido significativa.
Doença Arterial Coronariana Estável
estudo europeu On redução de eventos cardíacos com perindopril na doença arterial coronariana estável (EUROPA) foi um estudo multicêntrico, randomizado, duplo-cego e controlado por placebo realizado em 12.218 pacientes que apresentavam evidência de doença arterial coronariana estável sem insuficiência cardíaca clínica. Os pacientes tinham evidência de doença arterial coronariana documentada por infarto do miocárdio prévio mais de 3 meses antes da triagem, revascularização coronária mais de 6 meses antes da triagem, evidência angiográfica de estenose (estreitamento de pelo menos 70% de uma ou mais artérias coronárias principais) ou estresse positivo teste em homens com história de dor torácica. Após um período inicial de 4 semanas durante o qual todos os pacientes receberam perindopril 2 mg a 8 mg, os pacientes foram aleatoriamente designados para perindopril 8 mg uma vez ao dia (n=6.110) ou placebo correspondente (n=6.108). O seguimento médio foi de 4,2 anos. O estudo examinou os efeitos a longo prazo do perindopril no tempo até o primeiro evento de mortalidade cardiovascular, infarto do miocárdio não fatal ou parada cardíaca em pacientes com doença arterial coronariana estável.
média de idade dos pacientes foi de 60 anos; 85% eram do sexo masculino, 92% estavam em uso de inibidores de plaquetas, 63% estavam em uso de betabloqueadores e 56% estavam em terapia hipolipemiante. O estudo EUROPA mostrou que o perindopril reduziu significativamente o risco relativo para os eventos de desfecho primário (Tabela 1). Esse efeito benéfico é amplamente atribuído à redução do risco de infarto do miocárdio não fatal. Este efeito benéfico do perindopril no desfecho primário ficou evidente após cerca de um ano de tratamento (Figura 1). O resultado foi semelhante em todos os subgrupos predefinidos por idade, doença de base ou medicação concomitante (Figura 2).
Figura 1. Tempo até a primeira ocorrência do endpoint primário 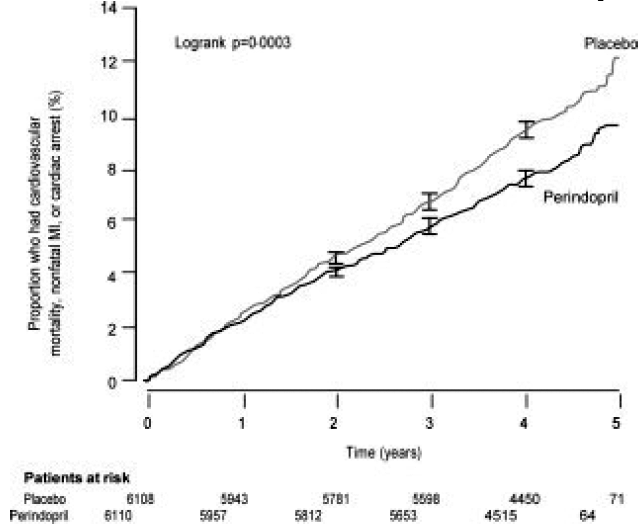
Figura 2. Efeito benéfico do tratamento com perindopril no desfecho primário em subgrupos predefinidos 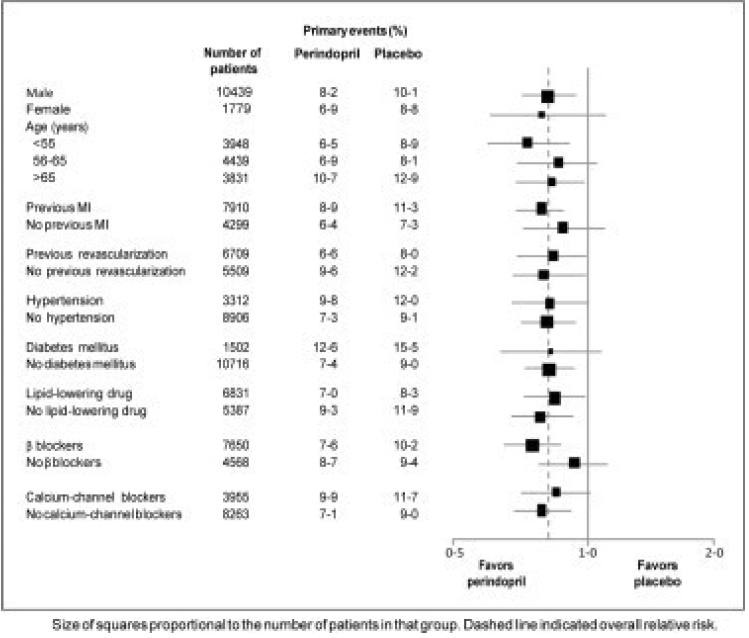
INFORMAÇÃO DO PACIENTE
Pacientes do sexo feminino em idade fértil devem ser informadas sobre as consequências da exposição a ACEON 2mg durante a gravidez. Discuta as opções de tratamento com as mulheres que planejam engravidar. As pacientes devem ser solicitadas a relatar a gravidez aos seus médicos o mais rápido possível.
Diga aos pacientes para relatar imediatamente qualquer indicação de infecção (por exemplo, dor de garganta, febre) que possa ser um sinal de neutropenia.
