Prinivil 2.5mg, 5mg, 10mg Lisinopril Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Prinivil 2,5mg e como é usado?
Prinivil é um medicamento de prescrição utilizado para tratar os sintomas de pressão arterial elevada (hipertensão) após um ataque cardíaco ou insuficiência cardíaca. Prinivil pode ser usado sozinho ou com outros medicamentos.
- Prinivil pertence a uma classe de medicamentos chamados inibidores da ECA.
- Não se sabe se Prinivil é seguro e eficaz em crianças com menos de 6 anos de idade.
Quais são os possíveis efeitos colaterais do Prinivil?
Prinivil pode causar efeitos colaterais graves, incluindo:
- tontura,
- febre,
- dor de garganta,
- náusea,
- fraqueza,
- sensação de formigamento,
- dor no peito,
- batimentos cardíacos irregulares,
- perda de movimento,
- pouca ou nenhuma micção,
- inchaço nos pés ou tornozelos,
- sentindo-se cansado,
- falta de ar,
- dor de estômago superior,
- coceira,
- sensação de cansaço,
- perda de apetite,
- urina escura,
- fezes cor de barro e
- amarelecimento da pele ou dos olhos (icterícia)
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns de Prinivil 5mg incluem:
- dor de cabeça,
- tontura,
- tosse, e
- dor no peito
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Prinivil. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
TOXICIDADE FETAL
- Quando a gravidez for detectada, interrompa o PRINIVIL assim que possível [ver ADVERTÊNCIAS E PRECAUÇÕES].
- Os medicamentos que atuam diretamente no sistema renina-angiotensina podem causar lesões e morte do feto em desenvolvimento [ver ADVERTÊNCIAS E PRECAUÇÕES].
DESCRIÇÃO
PRINIVIL contém lisinopril, um derivado peptídico sintético e um inibidor oral da enzima conversora de angiotensina de ação prolongada. O lisinopril é quimicamente descrito como (S)-1-[N2-(1-carboxi-3-fenilpropil)-Lisil]-L-prolina di-hidratado. Sua fórmula empírica é C21H31N3O5•2H2O e sua fórmula estrutural é:
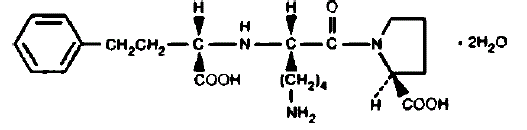
O lisinopril é um pó cristalino branco a esbranquiçado, com peso molecular de 441,52. É solúvel em água e pouco solúvel em metanol e praticamente insolúvel em etanol.
PRINIVIL 10 mg é fornecido em comprimidos de 5 mg, 10 mg e 20 mg para administração oral. Além do ingrediente ativo, lisinopril, cada comprimido contém os seguintes ingredientes inativos: fosfato de cálcio, manitol, estearato de magnésio e amido. Os comprimidos de 10 mg e 20 mg também contêm óxido de ferro.
INDICAÇÕES
Hipertensão
PRINIVIL é indicado para o tratamento da hipertensão em pacientes adultos e pacientes pediátricos com 6 anos de idade ou mais para baixar a pressão arterial. A redução da pressão arterial reduz o risco de eventos cardiovasculares fatais e não fatais, principalmente derrames e infartos do miocárdio. Esses benefícios foram observados em ensaios controlados de drogas anti-hipertensivas de uma ampla variedade de classes farmacológicas.
controle da hipertensão arterial deve fazer parte do gerenciamento abrangente do risco cardiovascular, incluindo, conforme apropriado, controle lipídico, controle do diabetes, terapia antitrombótica, cessação do tabagismo, exercícios e ingestão limitada de sódio. Muitos pacientes precisarão de mais de 1 medicamento para atingir as metas de pressão arterial. Para aconselhamento específico sobre metas e gerenciamento, consulte as diretrizes publicadas, como as do Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) do National High Blood Pressure Education Program.
Numerosos medicamentos anti-hipertensivos, de várias classes farmacológicas e com diferentes mecanismos de ação, têm demonstrado em ensaios clínicos randomizados reduzir a morbimortalidade cardiovascular, podendo-se concluir que é a redução da pressão arterial, e não alguma outra propriedade farmacológica do medicamento. os medicamentos, que é o grande responsável por esses benefícios. O maior e mais consistente benefício de resultado cardiovascular tem sido a redução do risco de acidente vascular cerebral, mas reduções no infarto do miocárdio e na mortalidade cardiovascular também foram observadas regularmente.
pressão sistólica ou diastólica elevada causa aumento do risco cardiovascular, e o aumento do risco absoluto por mmHg é maior em pressões sanguíneas mais altas, de modo que mesmo reduções modestas da hipertensão grave podem proporcionar benefícios substanciais. A redução do risco relativo da redução da pressão arterial é semelhante em populações com risco absoluto variável, portanto, o benefício absoluto é maior em pacientes que estão em maior risco independentemente de sua hipertensão (por exemplo, pacientes com diabetes ou hiperlipidemia), e esses pacientes seriam esperados beneficiar de um tratamento mais agressivo para uma meta de pressão arterial mais baixa.
Alguns medicamentos anti-hipertensivos têm efeitos menores na pressão arterial (como monoterapia) em pacientes negros, e muitos medicamentos anti-hipertensivos têm indicações e efeitos adicionais aprovados (por exemplo, na angina, insuficiência cardíaca ou doença renal diabética). Essas considerações podem orientar a seleção da terapia.
PRINIVIL pode ser administrado isoladamente ou com outros agentes anti-hipertensivos [ver Estudos clínicos ].
Insuficiência cardíaca
PRINIVIL é indicado para reduzir os sinais e sintomas de insuficiência cardíaca em pacientes que não respondem adequadamente a diuréticos e digitálicos [ver Estudos clínicos ].
Infarto agudo do miocárdio
PRINIVIL é indicado para a redução da mortalidade no tratamento de pacientes hemodinamicamente estáveis dentro de 24 horas após o infarto agudo do miocárdio. Os pacientes devem receber, conforme apropriado, os tratamentos padrão recomendados, como trombolíticos, aspirina e betabloqueadores [ver Estudos clínicos ].
DOSAGEM E ADMINISTRAÇÃO
Hipertensão
Terapia inicial em adultos: A dose inicial recomendada é de 10 mg uma vez ao dia. Ajustar a dosagem de acordo com a resposta da pressão arterial. A faixa de dosagem usual é de 20 a 40 mg por dia administrados em uma única dose diária. Doses de até 80 mg foram usadas, mas não parecem ter um efeito maior.
Uso com diuréticos em adultos
Se a pressão arterial não for controlada com PRINIVIL 10mg isoladamente, uma dose baixa de um diurético pode ser adicionada (por exemplo, hidroclorotiazida 12,5mg).
dose inicial recomendada em pacientes adultos com hipertensão em uso de diuréticos é de 5 mg uma vez ao dia [ver INTERAÇÕES MEDICAMENTOSAS ].
Pacientes pediátricos com 6 anos de idade ou mais com hipertensão
Para pacientes pediátricos com taxa de filtração glomerular >30 mL/min/1,73 m², a dose inicial recomendada é de 0,07 mg/kg uma vez ao dia (até 5 mg no total). A dosagem deve ser ajustada de acordo com a resposta da pressão arterial até um máximo de 0,61 mg/kg (até 40 mg) uma vez ao dia. Doses acima de 0,61 mg/kg (ou acima de 40 mg) não foram estudadas em pacientes pediátricos [ver FARMACOLOGIA CLÍNICA ].
PRINIVIL 2,5mg não é recomendado em pacientes pediátricos Uso em populações específicas e Estudos clínicos ].
Insuficiência cardíaca
dose inicial recomendada para PRINIVIL 2,5 mg, quando usado com diuréticos e (geralmente) digitálicos como terapia adjuvante, é de 5 mg uma vez ao dia. A dose inicial recomendada nesses pacientes com hiponatremia (sódio sérico
A dose do diurético pode precisar ser ajustada para ajudar a minimizar a hipovolemia, que pode contribuir para a hipotensão [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ]. O aparecimento de hipotensão após a dose inicial de PRINIVIL não exclui a subsequente titulação cuidadosa da dose com o fármaco, após tratamento eficaz da hipotensão.
Infarto agudo do miocárdio
Em pacientes hemodinamicamente estáveis dentro de 24 horas do início dos sintomas de infarto agudo do miocárdio, administrar PRINIVIL 5 mg por via oral, seguido de 5 mg após 24 horas, 10 mg após 48 horas e depois 10 mg uma vez ao dia. A dosagem deve continuar por pelo menos 6 semanas.
Iniciar terapia com 2,5 mg em pacientes com pressão arterial sistólica baixa (100-120 mmHg) durante os primeiros 3 dias após o infarto [ver AVISOS E PRECAUÇÕES ]. Se ocorrer hipotensão (pressão arterial sistólica ≤100 mmHg) considerar doses de 2,5 ou 5 mg. Se ocorrer hipotensão prolongada (pressão arterial sistólica
Dose em pacientes com insuficiência renal
Não é necessário ajuste de dose de PRINIVIL 2,5mg em pacientes com clearance de creatinina >30 mL/min. Em pacientes com depuração de creatinina de 10-30 mL/min, reduza a dose inicial de PRINIVIL para metade da dose usual recomendada (ou seja, hipertensão, 5 mg; insuficiência cardíaca ou infarto agudo do miocárdio, 2,5 mg). Para pacientes em hemodiálise ou depuração de creatinina Uso em populações específicas e FARMACOLOGIA CLÍNICA ].
Preparação da Suspensão
Para fazer 200 mL de uma suspensão a 1,0 mg/mL, adicione 10 mL de Água Purificada USP a um frasco de polietileno tereftalato (PET) contendo dez comprimidos de 20 mg de PRINIVIL 5mg e agite por pelo menos um minuto. Adicione 30 mL de solução oral de citrato de sódio e ácido cítrico ou diluente Cytra-2 e 160 mL de Ora-Sweet SF™ ao concentrado na garrafa PET e agite suavemente por vários segundos para dispersar os ingredientes. A suspensão deve ser armazenada a uma temperatura igual ou inferior a 25°C (77°F) e pode ser armazenada até quatro semanas. Agite a suspensão antes de cada uso.
COMO FORNECIDO
Formas de dosagem e pontos fortes
Os comprimidos PRINIVIL, 5 mg, são comprimidos comprimidos brancos, ovais, com o código MSD 19 numa das faces e ranhurado na outra face.
Os comprimidos PRINIVIL, 10 mg, são comprimidos comprimidos ovais, amarelo-claros, com o código MSD 106 numa das faces e ranhurado na outra face.
Os comprimidos PRINIVIL, 20 mg, são comprimidos comprimidos ovais, cor de pêssego, com o código MSD 207 numa das faces e ranhurados na outra face.
Armazenamento e manuseio
PRINIVIL 10mg é fornecido na forma de comprimidos ovais, com ranhura em um dos lados.
Armazenar
Armazenar em temperatura ambiente controlada, 15-30°C (59-86°F), e proteger da umidade.
Dispensar em um recipiente apertado, se a embalagem do produto for subdividida.
Distribuído por: Merck Sharp & Dohme Corp., uma subsidiária da MERCK & CO., INC., Whitehouse Station, NJ 08889, EUA. Revisado: novembro de 2021
EFEITOS COLATERAIS
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos estudos clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos estudos clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
Hipertensão
As seguintes reações adversas (eventos 2% maiores com PRINIVIL 5mg do que com placebo) foram observadas com PRINIVIL 2,5mg vs placebo: dor de cabeça (5,7% vs 1,9%), tontura (5,4% vs 1,9%), tosse (3,5% vs 1,0% ).
Insuficiência cardíaca
Em estudos controlados em pacientes com insuficiência cardíaca, a terapia foi descontinuada em 8,1% dos pacientes tratados com PRINIVIL 10mg por 12 semanas, em comparação com 7,7% dos pacientes tratados com placebo por 12 semanas.
As seguintes reações adversas (eventos 2% maiores com PRINIVIL 2,5mg do que com placebo) foram observadas com PRINIVIL vs placebo: hipotensão (4,4% vs 0,6%), dor torácica (3,4% vs 1,3%).
No ensaio ATLAS [ver Estudos clínicos ] em pacientes com insuficiência cardíaca, as retiradas por reações adversas foram semelhantes nos grupos de baixa e alta dose. As seguintes reações adversas, principalmente relacionadas à inibição da ECA, foram relatadas mais comumente no grupo de alta dose:
Infarto agudo do miocárdio
Os pacientes do estudo GISSI-3, tratados com PRINIVIL 10mg, apresentaram maior incidência de hipotensão (9,0% vs 3,7%) e disfunção renal (2,4% vs 1,1%) em comparação com os pacientes que não tomaram PRINIVIL.
Outras reações adversas clínicas que ocorrem em 1% ou mais dos pacientes com hipertensão ou insuficiência cardíaca tratados com PRINIVIL 2,5 mg em ensaios clínicos controlados e que não aparecem em outras seções da bula estão listadas abaixo:
Corpo como um todo: Fadiga, astenia, efeitos ortostáticos.
Digestivo: Pancreatite, constipação, flatulência, boca seca, diarréia.
Hematologico: Raros casos de depressão da medula óssea, anemia hemolítica, leucopenia/neutropenia e trombocitopenia.
Endócrino: Diabetes mellitus, secreção inadequada de hormônio antidiurético.
Metabólico: Gota
Pele: Urticária, alopecia, fotossensibilidade, eritema, rubor, sudorese, pseudolinfoma cutâneo, necrólise epidérmica tóxica, síndrome de Stevens-Johnson e prurido.
Sentidos Especiais: Perda visual, diplopia, visão turva, zumbido, fotofobia, distúrbios do paladar, distúrbios olfativos.
Urogenital: Impotência
Diversos: Foi relatado um complexo de sintomas que pode incluir ANA positivo, velocidade de hemossedimentação elevada, artralgia/artrite, mialgia, febre, vasculite, eosinofilia, leucocitose, parestesia e vertigem. Erupção cutânea, fotossensibilidade ou outras manifestações dermatológicas podem ocorrer isoladamente ou em combinação com esses sintomas.
Achados de Testes de Laboratório Clínico
Potássio sérico
Em ensaios clínicos, ocorreu hipercalemia (potássio sérico > 5,7 mEq/L) em 2,2% e 4,8% dos pacientes tratados com PRINIVIL com hipertensão e insuficiência cardíaca, respectivamente [ver AVISOS E PRECAUÇÕES ].
Creatinina, Nitrogênio de Uréia no Sangue
Pequenos aumentos no nitrogênio da ureia no sangue e na creatinina sérica, reversíveis após a descontinuação da terapia, foram observados em cerca de 2% dos pacientes com hipertensão tratados com PRINIVIL 5mg isolado. Os aumentos foram mais comuns em pacientes recebendo diuréticos concomitantemente e em pacientes com estenose da artéria renal [ver AVISOS E PRECAUÇÕES ]. Pequenos aumentos reversíveis no nitrogênio da ureia no sangue e na creatinina sérica foram observados em 11,6% dos pacientes com insuficiência cardíaca em terapia diurética concomitante. Frequentemente, essas anormalidades se resolvem quando a dosagem do diurético é diminuída.
Pacientes com infarto agudo do miocárdio no estudo GISSI-3 tratados com PRINIVIL tiveram uma incidência maior (2,4% versus 1,1% no placebo) de disfunção renal no hospital e em 6 semanas (aumentando a concentração de creatinina para mais de 3 mg/dL ou duplicando ou mais da concentração sérica de creatinina basal).
Hemoglobina e Hematócrito
Pequenas diminuições na hemoglobina (média de 0,4 mg/dL) e hematócrito (média de 1,3%) ocorreram frequentemente em pacientes tratados com PRINIVIL 5mg, mas raramente tiveram importância clínica em pacientes sem alguma outra causa de anemia. Em ensaios clínicos, menos de 0,1% dos pacientes descontinuaram a terapia por anemia.
Enzimas do Fígado
Raramente, ocorreram elevações das enzimas hepáticas e/ou bilirrubina sérica [ver AVISOS E PRECAUÇÕES ].
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de lisinopril que não estão incluídas em outras seções da bula. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. Outras reações incluem:
Distúrbios do Metabolismo e Nutrição
Hiponatremia [ver AVISOS E PRECAUÇÕES ], casos de hipoglicemia em pacientes diabéticos em uso de antidiabéticos orais ou insulina [ver INTERAÇÕES MEDICAMENTOSAS ]
Distúrbios do Sistema Nervoso e Psiquiátricos
Alterações de humor (incluindo sintomas depressivos), confusão mental
INTERAÇÕES MEDICAMENTOSAS
Diuréticos
O início de PRINIVIL em pacientes em uso de diuréticos pode resultar em redução excessiva da pressão arterial. A possibilidade de efeitos hipotensores com PRINIVIL pode ser minimizada pela diminuição ou descontinuação do diurético ou pelo aumento da ingestão de sal antes do início do tratamento com PRINIVIL. Se isso não for possível, reduza a dose inicial de PRINIVIL [ver DOSAGEM E ADMINISTRAÇÃO e AVISOS E PRECAUÇÕES ].
PRINIVIL 2,5mg atenua a perda de potássio causada por diuréticos tiazídicos. Diuréticos poupadores de potássio (espironolactona, amilorida, triantereno e outros) ou outros medicamentos que podem aumentar o potássio sérico podem aumentar o risco de hipercalemia. Portanto, se o uso concomitante de tais agentes for indicado, monitore frequentemente o potássio sérico do paciente.
Antidiabéticos
A administração concomitante de PRINIVIL 10mg e medicamentos antidiabéticos (insulina, agentes hipoglicemiantes orais) pode causar um aumento do efeito hipoglicemiante com risco de hipoglicemia.
Agentes anti-inflamatórios não esteroides, incluindo inibidores seletivos de ciclooxigenase-2 (inibidores de COX-2)
Em pacientes idosos, com depleção de volume (incluindo aqueles em terapia diurética) ou com função renal comprometida, a coadministração de AINEs, incluindo inibidores seletivos de COX-2, com inibidores da ECA, incluindo lisinopril, pode resultar em deterioração da função renal, incluindo possível insuficiência renal aguda. Estes efeitos são geralmente reversíveis. Monitorar a função renal periodicamente em pacientes recebendo terapia com lisinopril e AINEs.
O efeito anti-hipertensivo dos inibidores da ECA, incluindo o lisinopril, pode ser atenuado pelos AINEs.
Duplo bloqueio do sistema renina-angiotensina (RAS)
O bloqueio duplo do SRA com bloqueadores dos receptores da angiotensina, inibidores da ECA ou inibidores diretos da renina (como alisquireno) está associado a riscos aumentados de hipotensão, síncope, hipercalemia e alterações na função renal (incluindo insuficiência renal aguda) em comparação com a monoterapia.
estudo Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) recrutou 1.448 pacientes com diabetes tipo 2, razão elevada de albumina-creatinina e diminuição da taxa de filtração glomerular estimada (TFG 30 a 89,9 ml/min), randomizando-os para lisinopril ou placebo em um histórico de terapia com losartana e os acompanhou por uma média de 2,2 anos. Os pacientes que receberam a combinação de losartana e lisinopril não obtiveram nenhum benefício adicional em comparação com a monoterapia para o desfecho combinado de declínio na TFG, doença renal em estágio final ou morte, mas experimentaram um aumento da incidência de hipercalemia e lesão renal aguda em comparação com o grupo de monoterapia .
Em geral, evite o uso combinado de inibidores do RAS. Monitorar a pressão arterial, função renal e eletrólitos em pacientes em uso de PRINIVIL 5mg e outros agentes que afetam o SRA.
Não coadministre alisquireno com PRINIVIL em pacientes com diabetes. Evitar o uso de alisquireno com PRINIVIL 2,5mg em pacientes com insuficiência renal (TFG
Lítio
A toxicidade do lítio foi relatada em pacientes recebendo lítio concomitantemente com medicamentos que causam eliminação de sódio, incluindo inibidores da ECA. A toxicidade do lítio foi geralmente reversível com a descontinuação do lítio e do inibidor da ECA. Monitorar os níveis séricos de lítio durante o uso concomitante.
Ouro
Reações nitritóides (sintomas incluem rubor facial, náuseas, vômitos e hipotensão) foram relatadas raramente em pacientes em terapia com ouro injetável (aurotiomalato de sódio) e terapia concomitante com inibidores da ECA, incluindo PRINIVIL.
Inibidores do Alvo da Rapamicina em Mamíferos (mTOR)
Pacientes em tratamento concomitante com inibidor de mTOR (por exemplo, temsirolimus, sirolimus, everolimus) podem apresentar risco aumentado de angioedema [ver AVISOS E PRECAUÇÕES ].
Inibidores de Neprilisina
Pacientes tomando concomitantemente um inibidor de neprilisina (por exemplo, sacubitril) podem apresentar risco aumentado de angioedema [ver CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES ].
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Toxicidade Fetal
PRINIVIL pode causar danos ao feto quando administrado a mulheres grávidas. O uso de drogas que atuam no sistema reninangiotensina durante o segundo e terceiro trimestres de gestação reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal. O oligoidrâmnio resultante pode estar associado a hipoplasia pulmonar fetal e deformações esqueléticas. Os potenciais efeitos adversos neonatais incluem hipoplasia do crânio, anúria, hipotensão, insuficiência renal e morte. Quando a gravidez for detectada, descontinue PRINIVIL assim que possível [ver Uso em populações específicas ].
Angioedema e reações anafilactóides
Angioedema
Angioedema de cabeça e pescoço
Angioedema da face, extremidades, lábios, língua, glote e/ou laringe, incluindo algumas reações fatais, ocorreram em pacientes tratados com inibidores da enzima de conversão da angiotensina, incluindo PRINIVIL, em qualquer momento durante o tratamento. Pacientes com envolvimento da língua, glote ou laringe são propensos a apresentar obstrução das vias aéreas, especialmente aqueles com histórico de cirurgia das vias aéreas. PRINIVIL 5mg deve ser imediatamente descontinuado e terapia e monitoramento apropriados devem ser fornecidos até a resolução completa e sustentada dos sinais e sintomas de angioedema.
Pacientes com história de angioedema não relacionado à terapia com inibidores da ECA podem apresentar risco aumentado de angioedema enquanto estiverem recebendo um inibidor da ECA [ver CONTRA-INDICAÇÕES ]. Os inibidores da ECA foram associados a uma maior taxa de angioedema em pacientes negros do que em pacientes não negros.
Pacientes recebendo terapia concomitante com inibidor da ECA e inibidor de mTOR (alvo de rapamicina em mamíferos) (por exemplo, temsirolimus, sirolimus, everolimus) podem apresentar risco aumentado de angioedema [ver INTERAÇÕES MEDICAMENTOSAS ].
Pacientes recebendo terapia concomitante com inibidor da ECA e inibidor da neprilisina podem apresentar risco aumentado de angioedema [ver CONTRA-INDICAÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
Angioedema Intestinal
Ocorreu angioedema intestinal em pacientes tratados com inibidores da ECA. Esses pacientes apresentavam dor abdominal (com ou sem náusea ou vômito); em alguns casos não havia história prévia de angioedema facial e os níveis de C-1 esterase estavam normais. Em alguns casos, o angioedema foi diagnosticado por procedimentos incluindo tomografia computadorizada abdominal ou ultra-som, ou na cirurgia, e os sintomas foram resolvidos após a interrupção do inibidor da ECA.
Reações Anafilactóides
Reações anafilactóides durante a dessensibilização
Dois pacientes submetidos a tratamento de dessensibilização com veneno de Hymenoptera enquanto recebiam inibidores da ECA sofreram reações anafilactóides com risco de vida.
Reações anafilactóides durante a diálise
Reações anafilactóides súbitas e potencialmente fatais ocorreram em alguns pacientes dialisados com membranas de alto fluxo e tratados concomitantemente com um inibidor da ECA. Nesses pacientes, a diálise deve ser interrompida imediatamente e a terapia agressiva para reações anafilactóides deve ser iniciada. Os sintomas não foram aliviados por anti-histamínicos nessas situações. Nesses pacientes, deve-se considerar o uso de um tipo diferente de membrana de diálise ou uma classe diferente de agente anti-hipertensivo. Reações anafilactóides também foram relatadas em pacientes submetidos a aférese de lipoproteínas de baixa densidade com absorção de sulfato de dextrano.
Função Renal Prejudicada
Monitore a função renal periodicamente em pacientes tratados com PRINIVIL. Alterações na função renal, incluindo insuficiência renal aguda, podem ser causadas por drogas que inibem o sistema renina-angiotensina. Pacientes cuja função renal pode depender em parte da atividade do sistema renina-angiotensina (p. insuficiência renal aguda em PRINIVIL. Considere suspender ou descontinuar a terapia em pacientes que desenvolvem uma diminuição clinicamente significativa da função renal com PRINIVIL [ver REAÇÕES ADVERSAS e INTERAÇÕES MEDICAMENTOSAS ].
Hipotensão
PRINIVIL pode causar hipotensão sintomática, algumas vezes complicada por oligúria, azotemia progressiva, insuficiência renal aguda ou morte. Os pacientes com risco de hipotensão excessiva incluem aqueles com as seguintes condições ou características: insuficiência cardíaca com pressão arterial sistólica abaixo de 100 mmHg, doença cardíaca isquêmica, doença cerebrovascular, hiponatremia, terapia diurética em altas doses, diálise renal ou depleção grave de volume e/ou sal de qualquer etiologia.
Nestes pacientes, iniciar PRINIVIL sob supervisão médica e acompanhá-los nas primeiras duas semanas de tratamento e sempre que a dose de PRINIVIL e/ou diurético for aumentada. Evitar o uso de PRINIVIL 2,5mg em pacientes hemodinamicamente instáveis após infarto agudo do miocárdio.
A hipotensão sintomática também é possível em pacientes com estenose aórtica grave ou cardiomiopatia hipertrófica.
Cirurgia/Anestesia
Em pacientes submetidos a cirurgias de grande porte ou durante anestesia com agentes que produzem hipotensão, PRINIVIL pode bloquear a formação de angiotensina II secundária à liberação compensatória de renina. Se ocorrer hipotensão e for considerada decorrente desse mecanismo, ela pode ser corrigida pela expansão do volume.
Hipercalemia
Monitore o potássio sérico periodicamente em pacientes recebendo PRINIVIL. Drogas que inibem o sistema reninangiotensina podem causar hipercalemia. Os fatores de risco para o desenvolvimento de hipercalemia incluem insuficiência renal, diabetes mellitus e o uso concomitante de diuréticos poupadores de potássio, suplementos de potássio, substitutos do sal contendo potássio ou outros medicamentos que podem aumentar o potássio sérico [ver INTERAÇÕES MEDICAMENTOSAS ].
Insuficiência Hepática
Os inibidores da ECA têm sido associados a uma síndrome que começa com icterícia colestática ou hepatite e progride para necrose hepática fulminante e, às vezes, morte. O mecanismo desta síndrome não é compreendido. Pacientes recebendo inibidores da ECA que desenvolvem icterícia ou elevações acentuadas das enzimas hepáticas devem descontinuar o inibidor da ECA e receber tratamento médico apropriado.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Não houve evidência de efeito tumorigênico quando o lisinopril foi administrado por 105 semanas a ratos machos e fêmeas em doses de até 90 mg por kg por dia ou por 92 semanas a camundongos machos e fêmeas em doses de até 135 mg por kg por dia. Essas doses são 10 vezes e 7 vezes, respectivamente, a MRHDD quando comparadas com base na área de superfície corporal.
lisinopril não foi mutagênico no teste de mutagênico microbiano de Ames com ou sem ativação metabólica. Também foi negativo em um ensaio de mutação direta usando células de pulmão de hamster chinês. O lisinopril não produziu quebras de DNA de fita simples em um ensaio de hepatócitos de rato com eluição alcalina in vitro. Além disso, o lisinopril não produziu aumentos nas aberrações cromossômicas em um teste in vitro em células de ovário de hamster chinês ou em um estudo in vivo em medula óssea de camundongo.
Não houve efeitos adversos no desempenho reprodutivo em ratos machos e fêmeas tratados com até 300 mg/kg/dia de lisinopril (33 vezes o MRHDD quando comparado com base na área de superfície corporal).
Estudos em ratos indicam que o lisinopril atravessa mal a barreira hematoencefálica. Doses múltiplas de lisinopril em ratos não resultam em acúmulo em nenhum tecido. O leite de ratas lactantes contém radioatividade após a administração de 14C lisinopril. Por autorradiografia de corpo inteiro, a radioatividade foi encontrada na placenta após a administração da droga marcada a ratas grávidas, mas nenhuma foi encontrada nos fetos.
Uso em populações específicas
Gravidez
Resumo do risco
PRINIVIL pode causar danos ao feto quando administrado a mulheres grávidas. O uso de drogas que atuam no sistema reninangiotensina durante o segundo e terceiro trimestres de gestação reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal. A maioria dos estudos epidemiológicos examinando anormalidades fetais após exposição ao uso de anti-hipertensivos no primeiro trimestre não distinguiu drogas que afetam o sistema reninaangiotensina de outros agentes anti-hipertensivos. Quando a gravidez for detectada, descontinue PRINIVIL 5mg o mais rápido possível.
risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2-4% e 15-20%, respectivamente.
Considerações Clínicas
Risco Materno e/ou Embrião/Fetal Associado à Doença
A hipertensão na gravidez aumenta o risco materno de pré-eclâmpsia, diabetes gestacional, parto prematuro e complicações no parto (por exemplo, necessidade de cesariana e hemorragia pós-parto). A hipertensão aumenta o risco fetal de restrição de crescimento intrauterino e morte intrauterina. Mulheres grávidas com hipertensão devem ser cuidadosamente monitoradas e tratadas adequadamente.
Reações adversas fetais/neonatais
Oligoidrâmnio em mulheres grávidas que usam drogas que afetam o sistema renina-angiotensina no segundo e terceiro trimestres de gravidez pode resultar no seguinte: redução da função renal fetal levando a anúria e insuficiência renal, hipoplasia pulmonar fetal e deformações esqueléticas, incluindo hipoplasia do crânio, hipotensão , e morte. No caso incomum de não haver terapia alternativa apropriada para drogas que afetam o sistema renina-angiotensina para um determinado paciente, informar a mãe sobre o risco potencial para o feto.
Em pacientes que tomam PRINIVIL durante a gravidez, realize exames ultrassonográficos seriados para avaliar o ambiente intra-amniótico. O teste fetal pode ser apropriado, com base na semana de gestação. Se for observado oligoidrâmnio, descontinuar PRINIVIL 10mg, a menos que seja considerado salva-vidas para a mãe. Pacientes e médicos devem estar cientes, entretanto, de que o oligoidrâmnio pode não aparecer até que o feto tenha sofrido lesão irreversível.
Observe atentamente os bebês com história de exposição in utero ao PRINIVIL para hipotensão, oligúria e hipercalemia. Em recém-nascidos com história de exposição in utero a PRINIVIL, se ocorrer oligúria ou hipotensão, apoiar a pressão arterial e a perfusão renal. Transfusões de troca ou diálise podem ser necessárias como meio de reverter a hipotensão e/ou substituir a função renal desordenada.
Lactação
Resumo do risco
Não existem dados disponíveis sobre a presença de lisinopril no leite humano ou os efeitos do lisinopril no lactente ou na produção de leite. O lisinopril está presente no leite de rato. Como muitos medicamentos são secretados no leite humano e devido ao potencial de reações adversas graves nos bebês amamentados por inibidores da ECA, interrompa a amamentação ou descontinue PRINIVIL.
Uso Pediátrico
Os efeitos anti-hipertensivos e a segurança de PRINIVIL foram estabelecidos em pacientes pediátricos com idade entre 6 e 16 anos [ver DOSAGEM E ADMINISTRAÇÃO e Estudos clínicos ]. Não foram identificadas diferenças relevantes entre o perfil de reações adversas para pacientes pediátricos e pacientes adultos.
A segurança e eficácia de PRINIVIL não foram estabelecidas em pacientes pediátricos com idade inferior a 6 anos ou em pacientes pediátricos com taxa de filtração glomerular FARMACOLOGIA CLÍNICA e Estudos clínicos ].
Uso Geriátrico
Não é necessário ajuste de dose com PRINIVIL 2,5mg em pacientes idosos. Em um estudo clínico de PRINIVIL 10mg em pacientes com infarto do miocárdio (ensaio GISSI-3), 4.413 (47%) tinham 65 anos ou mais, enquanto 1.656 (18%) tinham 75 anos ou mais. Neste estudo, 4,8% dos pacientes com 75 anos ou mais descontinuaram o tratamento com PRINIVIL 5mg devido à disfunção renal versus 1,3% dos pacientes com menos de 75 anos. Não foram observadas outras diferenças na segurança ou eficácia entre pacientes idosos e mais jovens, mas a maior sensibilidade de alguns indivíduos mais velhos não pode ser descartada.
Corrida
Os inibidores da ECA, incluindo PRINIVIL, têm um efeito na pressão arterial menor em pacientes negros do que em não negros.
Insuficiência renal
ajuste da dose de PRINIVIL é necessário em pacientes submetidos à hemodiálise ou cuja depuração de creatinina é ≤30 mL/min. Não é necessário ajuste de dose de PRINIVIL 5mg em pacientes com clearance de creatinina >30 mL/min [ver DOSAGEM E ADMINISTRAÇÃO e FARMACOLOGIA CLÍNICA ].
SOBREDOSAGEM
Após uma dose oral única de 20 g/kg, não ocorreu letalidade em ratos e a morte ocorreu em um dos 20 camundongos que receberam a mesma dose. A manifestação mais provável de superdosagem seria a hipotensão, para a qual o tratamento usual seria a infusão intravenosa de solução salina normal.
O lisinopril pode ser removido por hemodiálise [ver AVISOS E PRECAUÇÕES ].
CONTRA-INDICAÇÕES
PRINIVIL 10mg é contraindicado em pacientes com:
- história de angioedema ou hipersensibilidade relacionada a tratamento anterior com um inibidor da enzima conversora de angiotensina
- angioedema hereditário ou idiopático.
Não coadministre alisquireno com PRINIVIL 5mg em pacientes com diabetes [ver INTERAÇÕES MEDICAMENTOSAS ]. PRINIVIL é contraindicado em combinação com um inibidor de neprilisina (por exemplo, sacubitril). Não administre PRINIVIL 2,5 mg dentro de 36 horas após a troca de sacubitril/valsartana, um produto que contém um inibidor de neprilisina [ver AVISOS E PRECAUÇÕES e INTERAÇÕES MEDICAMENTOSAS ].
FARMACOLOGIA CLÍNICA
Mecanismo de ação
lisinopril inibe a enzima conversora da angiotensina (ECA) em humanos e animais. A ECA é uma peptidil dipeptidase que catalisa a conversão da angiotensina I na substância vasoconstritora, angiotensina II. A angiotensina II também estimula a secreção de aldosterona pelo córtex adrenal. Os efeitos benéficos do lisinopril na hipertensão e insuficiência cardíaca parecem resultar principalmente da supressão do sistema renina-angiotensinaldosterona. A inibição da ECA resulta na diminuição da angiotensina II plasmática, o que leva à diminuição da atividade vasopressora e à diminuição da secreção de aldosterona. A última diminuição pode resultar em um pequeno aumento do potássio sérico. Em pacientes hipertensos com função renal normal tratados apenas com PRINIVIL 10mg por até 24 semanas, o aumento médio do potássio sérico foi de aproximadamente 0,1 mEq/L; no entanto, aproximadamente 15% dos pacientes tiveram aumentos superiores a 0,5 mEq/L e aproximadamente 6% tiveram uma diminuição superior a 0,5 mEq/L. No mesmo estudo, os pacientes tratados com PRINIVIL 2,5mg e hidroclorotiazida por até 24 semanas apresentaram diminuição média do potássio sérico de 0,1 mEq/L; aproximadamente 4% dos pacientes tiveram aumentos superiores a 0,5 mEq/L e aproximadamente 12% tiveram uma diminuição superior a 0,5 mEq/L [ver AVISOS E PRECAUÇÕES ]. A remoção do feedback negativo da angiotensina II na secreção de renina leva ao aumento da atividade da renina plasmática.
A ECA é idêntica à cininase, uma enzima que degrada a bradicinina. Se os níveis aumentados de bradicinina, um potente peptídeo vasodepressor, desempenham um papel nos efeitos terapêuticos de PRINIVIL 5mg ainda não foi elucidado.
Embora se acredite que o mecanismo pelo qual PRINIVIL 2,5 mg reduz a pressão arterial seja principalmente a supressão do sistema renina-angiotensina-aldosterona, PRINIVIL é anti-hipertensivo mesmo em pacientes com hipertensão com baixo teor de renina. Embora PRINIVIL 10mg tenha sido anti-hipertensivo em todas as raças estudadas, os pacientes hipertensos negros (geralmente uma população hipertensa com baixa renina) tiveram uma resposta média menor à monoterapia do que os pacientes não negros.
A administração concomitante de PRINIVIL 5mg e hidroclorotiazida reduziu ainda mais a pressão arterial em pacientes negros e não negros e qualquer diferença racial na resposta da pressão arterial não foi mais evidente.
Farmacodinâmica
Hipertensão
Pacientes adultos
administração de PRINIVIL a pacientes com hipertensão resulta na redução da pressão arterial em posição supina e em pé aproximadamente na mesma extensão, sem taquicardia compensatória. Hipotensão postural sintomática geralmente não é observada, embora possa ocorrer e deva ser antecipada em pacientes com depleção de volume e/ou sal [ver AVISOS E PRECAUÇÕES ]. Quando administrados em conjunto com diuréticos do tipo tiazídico, os efeitos de redução da pressão arterial dos dois medicamentos são aproximadamente aditivos.
Na maioria dos pacientes estudados, o início da atividade anti-hipertensiva foi observado uma hora após a administração oral de uma dose individual de PRINIVIL, com redução máxima da pressão arterial alcançada em 6 horas. Embora um efeito anti-hipertensivo tenha sido observado 24 horas após a administração de doses únicas diárias recomendadas, o efeito foi mais consistente e o efeito médio foi consideravelmente maior em alguns estudos com doses de 20 mg ou mais do que com doses mais baixas. No entanto, em todas as doses estudadas, o efeito anti-hipertensivo médio foi substancialmente menor 24 horas após a administração do que 6 horas após a administração.
Os efeitos anti-hipertensivos de PRINIVIL são mantidos durante a terapia de longo prazo. A retirada abrupta de PRINIVIL 10mg não foi associada a um rápido aumento da pressão arterial ou a um aumento significativo da pressão arterial em comparação com os níveis pré-tratamento.
Farmacocinética
Pacientes adultos
Após a administração oral de PRINIVIL, as concentrações séricas máximas de lisinopril ocorrem em cerca de 7 horas, embora tenha havido uma tendência a um pequeno atraso no tempo necessário para atingir as concentrações séricas máximas em pacientes com infarto agudo do miocárdio. Concentrações séricas decrescentes exibem uma fase terminal prolongada que não contribui para o acúmulo do fármaco. Esta fase terminal provavelmente representa uma ligação saturável à ECA e não é proporcional à dose. Em doses múltiplas, o lisinopril apresenta uma meia-vida efetiva de 12 horas.
lisinopril não parece estar ligado a outras proteínas séricas. O lisinopril não sofre metabolismo e é excretado totalmente inalterado na urina. Com base na recuperação urinária, a extensão média de absorção do lisinopril é de aproximadamente 25 por cento, com grande variabilidade inter-indivíduos (6-60 por cento) em todas as doses testadas (5-80 mg). A absorção de lisinopril não é influenciada pela presença de alimentos no trato gastrointestinal. A biodisponibilidade absoluta do lisinopril é reduzida para cerca de 16% em pacientes com insuficiência cardíaca congestiva Classe II-IV da NYHA estável, e o volume de distribuição parece ser ligeiramente menor do que em indivíduos normais.
A biodisponibilidade oral do lisinopril em doentes com enfarte agudo do miocárdio é semelhante à de voluntários saudáveis.
função renal prejudicada diminui a eliminação do lisinopril, que é excretado principalmente pelos rins, mas essa diminuição torna-se clinicamente importante apenas quando a taxa de filtração glomerular está abaixo de 30 mL/min. Acima desta taxa de filtração glomerular, a meia-vida de eliminação é pouco alterada. Com maior comprometimento, no entanto, os níveis de pico e vale de lisinopril aumentam, o tempo até a concentração de pico aumenta e o tempo para atingir o estado de equilíbrio é prolongado. Pacientes mais velhos, em média, têm (aproximadamente o dobro) níveis sanguíneos e área sob a curva de concentração plasmática (AUC) mais altos do que pacientes mais jovens [ver DOSAGEM E ADMINISTRAÇÃO ]. O lisinopril pode ser removido por hemodiálise.
Estudos em ratos indicam que o lisinopril atravessa mal a barreira hematoencefálica. Doses múltiplas de lisinopril em ratos não resultam em acúmulo em nenhum tecido. O leite de ratas lactantes contém radioatividade após a administração de 14C lisinopril. Por autorradiografia de corpo inteiro, a radioatividade foi encontrada na placenta após a administração da droga marcada a ratas grávidas, mas nenhuma foi encontrada nos fetos.
Pacientes pediátricos
A farmacocinética do lisinopril foi estudada em 29 pacientes hipertensos pediátricos entre 6 e 16 anos com taxa de filtração glomerular >30 mL/min/1,73 m². Após doses de 0,1 a 0,2 mg/kg, as concentrações plasmáticas máximas de lisinopril no estado de equilíbrio ocorreram em 6 horas e a extensão da absorção com base na recuperação urinária foi de cerca de 28%. Esses valores são semelhantes aos obtidos anteriormente em adultos. O valor típico da depuração oral do lisinopril (depuração sistémica/biodisponibilidade absoluta) numa criança com peso de 30 kg é de 10 L/h, que aumenta proporcionalmente à função renal.
Estudos clínicos
Hipertensão
Pacientes adultos
Dois estudos de dose-resposta utilizando um regime de uma vez ao dia foram conduzidos em 438 pacientes hipertensos leves a moderados que não tomavam diuréticos. A pressão arterial foi medida 24 horas após a dosagem. Um efeito anti-hipertensivo de PRINIVIL foi observado com 5 mg em alguns pacientes. No entanto, em ambos os estudos, a redução da pressão arterial ocorreu mais cedo e foi maior em pacientes tratados com 10, 20 ou 80 mg de PRINIVIL. Em estudos clínicos controlados em pacientes com hipertensão leve a moderada, PRINIVIL 20-80 mg foi comparado com hidroclorotiazida 12,5-50 mg e com atenolol 50-500 mg, e em pacientes com hipertensão moderada a grave com metoprolol 100-200 mg. Foi superior à hidroclorotiazida nos efeitos sobre a pressão arterial sistólica e diastólica em uma população que era 75% caucasiana. PRINIVIL 10mg foi aproximadamente equivalente ao atenolol e metoprolol nos efeitos sobre a pressão arterial diastólica e teve efeitos um pouco maiores na pressão arterial sistólica.
PRINIVIL teve eficácia e efeitos adversos semelhantes em pacientes mais jovens e mais velhos (>65 anos). Foi menos eficaz em negros do que em caucasianos.
Em estudos hemodinâmicos de PRINIVIL 5mg em pacientes com hipertensão essencial, a redução da pressão arterial foi acompanhada por uma redução na resistência arterial periférica com pouca ou nenhuma alteração no débito cardíaco e na frequência cardíaca. Em um estudo em nove pacientes hipertensos, após a administração de PRINIVIL 5mg, houve um aumento no fluxo sanguíneo renal médio que não foi significativo. Os dados de vários pequenos estudos são inconsistentes em relação ao efeito do lisinopril na taxa de filtração glomerular em pacientes hipertensos com função renal normal, mas sugerem que as alterações, se houver, não são grandes.
Em pacientes com hipertensão renovascular, PRINIVIL demonstrou ser bem tolerado e eficaz na redução da pressão arterial [ver AVISOS E PRECAUÇÕES ].
Pacientes pediátricos
Em um estudo clínico envolvendo 115 pacientes pediátricos hipertensos de 6 a 16 anos de idade, pacientes com peso 1,25 mg (0,02 mg/kg). Este efeito foi confirmado em uma fase de retirada, onde a pressão diastólica aumentou cerca de 9 mmHg mais em pacientes randomizados para placebo do que em pacientes que foram randomizados para permanecer em doses médias e altas de lisinopril. O efeito anti-hipertensivo dependente da dose do lisinopril foi consistente em vários subgrupos demográficos: idade, estágio de Tanner, sexo e raça. Neste estudo, o lisinopril foi geralmente bem tolerado.
Nos estudos pediátricos acima, o lisinopril foi administrado na forma de comprimidos ou em suspensão para crianças e lactentes que não conseguiam engolir os comprimidos ou que necessitavam de uma dose menor do que a disponível na forma de comprimidos [ver DOSAGEM E ADMINISTRAÇÃO ].
Insuficiência cardíaca
Em dois estudos clínicos de 12 semanas, controlados com placebo, compararam a adição de PRINIVIL 2,5 mg até 20 mg diários a digitálicos e diuréticos isolados. A combinação de PRINIVIL, digitálicos e diuréticos reduziu os seguintes sinais e sintomas de insuficiência cardíaca: edema, estertores, dispneia paroxística noturna e distensão venosa jugular. Em um dos estudos, a associação de PRINIVIL 2,5mg, digitálicos e diuréticos reduziu a ortopneia, a presença de terceira bulha e o número de pacientes classificados como Classe III e IV da NYHA, e melhorou a tolerância ao exercício. Um grande estudo de sobrevivência (mais de 3.000 pacientes), o estudo ATLAS, comparando 2,5 e 35 mg de lisinopril em pacientes com insuficiência cardíaca sistólica, mostrou que a dose mais alta de lisinopril teve resultados pelo menos tão favoráveis quanto a dose mais baixa. Durante os ensaios clínicos controlados na linha de base, em pacientes recebendo digitálicos e diuréticos, doses únicas de PRINIVIL 5mg resultaram em diminuição da pressão capilar pulmonar, resistência vascular sistêmica e pressão arterial acompanhada de aumento do débito cardíaco e nenhuma alteração na frequência cardíaca.
Infarto agudo do miocárdio
estudo Gruppo Italiano per lo Studio della Sopravvienza nell'Infarto Miocardico (GISSI-3) foi um ensaio clínico multicêntrico, controlado, randomizado e não cego realizado em 19.394 pacientes com infarto agudo do miocárdio (IM) admitidos em uma unidade coronariana. Ele foi projetado para examinar os efeitos do tratamento a curto prazo (6 semanas) com lisinopril, nitratos, sua combinação ou nenhuma terapia na mortalidade a curto prazo (6 semanas) e na morte a longo prazo e função cardíaca marcadamente prejudicada. Pacientes hemodinamicamente estáveis apresentando dentro de 24 horas do início dos sintomas foram randomizados, em um desenho fatorial 2 x 2, para 6 semanas de 1) PRINIVIL sozinho (n=4841), 2) nitratos sozinho (n=4869), 3 ) PRINIVIL 2,5mg mais nitratos (n=4841), ou 4) controle aberto (n=4843). Todos os pacientes receberam terapias de rotina, incluindo trombolíticos (72%), aspirina (84%) e um betabloqueador (31%), conforme apropriado, normalmente utilizado em pacientes com infarto agudo do miocárdio (IM).
protocolo excluiu pacientes com hipotensão (pressão arterial sistólica ≤ 100 mmHg), insuficiência cardíaca grave, choque cardiogênico e disfunção renal (creatinina sérica > 2 mg/dL e/ou proteinúria > 500 mg por 24 h). Os pacientes randomizados para PRINIVIL 5mg receberam 5 mg dentro de 24 horas após o início dos sintomas, 5 mg após 24 horas e depois 10 mg diariamente. Pacientes com pressão arterial sistólica inferior a 120 mmHg no início do estudo receberam 2,5 mg de PRINIVIL. Se ocorrer hipotensão, a dose de PRINIVIL 10mg foi reduzida ou se ocorrer hipotensão grave, PRINIVIL foi interrompido [ver DOSAGEM E ADMINISTRAÇÃO ].
Os desfechos primários do estudo foram a mortalidade geral em 6 semanas e um desfecho combinado em 6 meses após o infarto do miocárdio, consistindo no número de pacientes que morreram, tiveram insuficiência cardíaca congestiva clínica tardia (dia 4) ou tiveram dano definido como fração de ejeção ≤35%, ou um escore acinético-discinético [AD] ≥45%. Pacientes que receberam PRINIVIL (n=9646), sozinho ou com nitratos, tiveram um risco de morte 11% menor (p =0,04) em comparação com pacientes que não receberam PRINIVIL (n=9672) (6,4% vs. 7,2%, respectivamente) com 6 semanas. Embora os pacientes randomizados para receber PRINIVIL por até 6 semanas também tenham se saído numericamente melhor no desfecho combinado em 6 meses, a natureza aberta da avaliação da insuficiência cardíaca, perda substancial no ecocardiograma de acompanhamento e uso excessivo substancial de PRINIVIL 10mg, entre 6 semanas e 6 meses no grupo randomizado para 6 semanas de lisinopril impedem qualquer conclusão sobre este desfecho.
Pacientes com infarto agudo do miocárdio, tratados com PRINIVIL 10mg, apresentaram maior (9,0% versus 3,7%) incidência de hipotensão persistente (pressão arterial sistólica REAÇÕES ADVERSAS ].
INFORMAÇÃO DO PACIENTE
NOTA: Esta informação destina-se a auxiliar no uso seguro e eficaz deste medicamento. Não é uma divulgação de todos os possíveis efeitos adversos ou pretendidos.
Gravidez
Informe as pacientes do sexo feminino em idade fértil sobre as consequências da exposição a PRINIVIL 10mg durante a gravidez. Discuta as opções de tratamento com as mulheres que planejam engravidar. Diga aos pacientes para relatar a gravidez aos seus médicos o mais rápido possível.
Angioedema
Angioedema, incluindo edema laríngeo, pode ocorrer a qualquer momento durante o tratamento com inibidores da enzima de conversão da angiotensina, incluindo PRINIVIL. Diga aos pacientes para relatar imediatamente quaisquer sinais ou sintomas sugestivos de angioedema (inchaço da face, extremidades, olhos, lábios, língua, dificuldade em engolir ou respirar) e não tomar mais medicamento até consultar o médico prescritor.
Hipotensão sintomática
Diga aos pacientes para relatarem tontura, especialmente durante os primeiros dias de terapia. Se ocorrer síncope real, diga ao paciente para descontinuar o medicamento até consultar o médico prescritor.
Informe aos pacientes que a transpiração excessiva e a desidratação podem levar a uma queda excessiva da pressão arterial devido à redução do volume de líquidos. Outras causas de depleção de volume, como vômitos ou diarreia, também podem levar à queda da pressão arterial; aconselhar os pacientes adequadamente.
Hipercalemia
Diga aos pacientes para não usar substitutos de sal contendo potássio sem consultar seu médico.
Hipoglicemia
Informe aos pacientes diabéticos tratados com agentes antidiabéticos orais ou insulina iniciando um inibidor da ECA para monitorar de perto a hipoglicemia, especialmente durante o primeiro mês de uso combinado [ver INTERAÇÕES MEDICAMENTOSAS ].
Leucopenia/neutropenia
Diga aos pacientes para relatar imediatamente qualquer indicação de infecção (por exemplo, dor de garganta, febre), que pode ser um sinal de leucopenia/neutropenia.
