Zestoretic 5/12.5g/mg Lisinopril Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Zestoretic e como é usado?
Zestoretic é um medicamento de prescrição utilizado para tratar os sintomas de hipertensão (pressão arterial elevada) e retenção de líquidos. Zestoretic 5mg pode ser usado sozinho ou com outros medicamentos.
Não se sabe se Zestoretic 5mg é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Zestoretic 5mg?
Zestoretic pode causar efeitos colaterais graves, incluindo:
- sentindo-se tonto,
- dor nos olhos ou problemas de visão,
- pouca ou nenhuma micção,
- fraqueza,
- sonolência,
- sentindo-se inquieto,
- febre ,
- arrepios,
- dor de garganta,
- aftas,
- dificuldade para engolir,
- amarelecimento da pele e dos olhos (icterícia),
- náusea,
- vômito,
- sensação de formigamento,
- dor no peito,
- batimentos cardíacos irregulares ou vibração no peito,
- perda de movimento,
- cãibras nas pernas,
- constipação,
- sede extrema,
- aumento da micção,
- dormência ou formigamento,
- fraqueza muscular,
- dor de cabeça,
- perda ou coordenação, e
- sentindo-se instável
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Zestoretic incluem:
- tosse
- dor de cabeça
- tontura
- sentindo cansado
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Zestoretic. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
TOXICIDADE FETAL
- Quando a gravidez for detectada, descontinue ZESTORETIC o mais rápido possível.
- Drogas que atuam diretamente no sistema renina-angiotensina podem causar lesão e morte do feto em desenvolvimento. Ver AVISOS Toxicidade Fetal.
DESCRIÇÃO
ZESTORETIC® (Lisinopril e Hidroclorotiazida) combina um inibidor da enzima conversora de angiotensina, lisinopril, e um diurético, hidroclorotiazida.
O lisinopril, um derivado peptídico sintético, é um inibidor oral da enzima conversora da angiotensina de ação prolongada. É quimicamente descrito como dihidrato de (S)-1-[N2-(1-carboxi-3-fenilpropil)-L-lisil]-L-prolina. Sua fórmula empírica é C21H31N3O5. 2H2O e sua fórmula estrutural é:
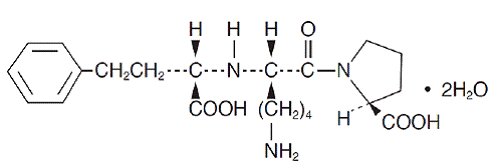
O lisinopril é um pó cristalino branco a esbranquiçado, com peso molecular de 441,53. É solúvel em água, pouco solúvel em metanol e praticamente insolúvel em etanol.
Hidroclorotiazida é 1,1-dióxido de 6-cloro-3,4-di-hidro-2H-1,2,4-benzotiadiazina-7-sulfonamida. Sua fórmula empírica é C7H8ClN3O4S2 e sua fórmula estrutural é:
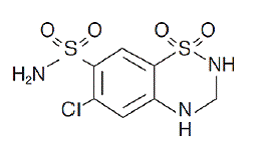
hidroclorotiazida é um pó cristalino branco, ou praticamente branco, com peso molecular de 297,72, que é ligeiramente solúvel em água, mas livremente solúvel em solução de hidróxido de sódio.
ZESTORETIC 5mg está disponível para uso oral em três combinações de comprimidos de lisinopril com hidroclorotiazida: ZESTORETIC 10-12.5 contendo 10 mg de lisinopril e 12,5 mg de hidroclorotiazida; ZESTORETIC 20 Referência 12.5 contendo 20 mg de lisinopril e 12,5 mg de hidroclorotiazida; e ZESTORETIC 20-25 contendo 20 mg de lisinopril e 25 mg de hidroclorotiazida.
Ingredientes inativos
10-12,5 Comprimidos - fosfato de cálcio, estearato de magnésio, manitol, óxido férrico vermelho, amido de milho, óxido férrico amarelo.
20-12,5 Comprimidos - fosfato de cálcio, estearato de magnésio, manitol, amido de milho.
20-25 comprimidos - fosfato de cálcio, estearato de magnésio, manitol, óxido férrico vermelho, amido de milho, óxido férrico amarelo.
INDICAÇÕES
ZESTORETIC é indicado para o tratamento da hipertensão, para baixar a pressão arterial. A redução da pressão arterial reduz o risco de eventos cardiovasculares fatais e não fatais, principalmente derrames e infartos do miocárdio. Esses benefícios foram observados em ensaios controlados de medicamentos anti-hipertensivos de uma ampla variedade de classes farmacológicas, incluindo lisinopril e hidroclorotiazida.
controle da hipertensão arterial deve fazer parte do gerenciamento abrangente do risco cardiovascular, incluindo, conforme apropriado, controle lipídico, controle do diabetes, terapia antitrombótica, cessação do tabagismo, exercícios e ingestão limitada de sódio. Muitos pacientes precisarão de mais de 1 medicamento para atingir as metas de pressão arterial. Para obter conselhos específicos sobre metas e gerenciamento, consulte as diretrizes publicadas, como as do Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) do National High Blood Pressure Education Program.
Numerosos medicamentos anti-hipertensivos, de várias classes farmacológicas e com diferentes mecanismos de ação, têm demonstrado em ensaios clínicos randomizados reduzir a morbimortalidade cardiovascular, podendo-se concluir que é a redução da pressão arterial, e não alguma outra propriedade farmacológica do medicamento. os medicamentos, que é o grande responsável por esses benefícios. O maior e mais consistente benefício de resultado cardiovascular tem sido a redução do risco de acidente vascular cerebral, mas reduções no infarto do miocárdio e na mortalidade cardiovascular também foram observadas regularmente.
pressão sistólica ou diastólica elevada causa aumento do risco cardiovascular, e o aumento do risco absoluto por mmHg é maior em pressões sanguíneas mais altas, de modo que mesmo reduções modestas da hipertensão grave podem proporcionar benefícios substanciais. A redução do risco relativo da redução da pressão arterial é semelhante em populações com risco absoluto variável, portanto, o benefício absoluto é maior em pacientes que estão em maior risco independentemente de sua hipertensão (por exemplo, pacientes com diabetes ou hiperlipidemia), e esses pacientes seriam esperados beneficiar de um tratamento mais agressivo para uma meta de pressão arterial mais baixa.
Alguns medicamentos anti-hipertensivos têm efeitos menores na pressão arterial (como monoterapia) em pacientes negros, e muitos medicamentos anti-hipertensivos têm indicações e efeitos adicionais aprovados (por exemplo, na angina, insuficiência cardíaca ou doença renal diabética). Essas considerações podem orientar a seleção da terapia.
Essas combinações de dose fixa não são indicadas para terapia inicial (ver DOSAGEM E ADMINISTRAÇÃO ).
Ao usar ZESTORETIC, deve-se considerar o fato de que um inibidor da enzima conversora de angiotensina, captopril, causou agranulocitose, particularmente em pacientes com insuficiência renal ou doença vascular do colágeno, e que os dados disponíveis são insuficientes para mostrar que o lisinopril não tem efeito risco semelhante (ver AVISOS ).
Ao considerar o uso de ZESTORETIC mg, deve-se notar que os inibidores da ECA foram associados a uma taxa mais alta de angioedema em pacientes negros do que em pacientes não negros (ver AVISOS , Lisinopril ).
DOSAGEM E ADMINISTRAÇÃO
monoterapia com lisinopril é eficaz no tratamento da hipertensão em doses diárias de 10 mg a 80 mg, enquanto a monoterapia com hidroclorotiazida é eficaz em doses de 12,5 mg por dia a 50 mg por dia. Em ensaios clínicos de terapia combinada de lisinopril/hidroclorotiazida usando doses de lisinopril de 10 mg a 80 mg e doses de hidroclorotiazida de 6,25 mg a 50 mg, as taxas de resposta anti-hipertensiva geralmente aumentaram com o aumento da dose de qualquer um dos componentes.
Os efeitos colaterais (ver AVISOS ) de lisinopril são geralmente raros e aparentemente independentes da dose; os da hidroclorotiazida são uma mistura de fenômenos dose-dependentes (principalmente hipocalemia) e fenômenos dose-independentes (p. ex., pancreatite), os primeiros muito mais comuns que os segundos. A terapia com qualquer combinação de lisinopril e hidroclorotiazida pode estar associada a um ou ambos os efeitos colaterais dose-dependentes ou dose-dependentes, mas a adição de lisinopril em ensaios clínicos atenuaram a hipocalemia normalmente observada com diuréticos.
Para minimizar os efeitos colaterais dependentes da dose, geralmente é apropriado iniciar a terapia combinada somente após o paciente não conseguir alcançar o efeito desejado com a monoterapia.
Titulação da Dose Guiada pelo Efeito Clínico
Um paciente cuja pressão arterial não esteja adequadamente controlada com monoterapia com lisinopril ou hidroclorotiazida pode ser trocado para lisinopril/HCTZ 10/12,5 ou lisinopril/HCTZ 20/12,5, dependendo da dose atual da monoterapia. Aumentos adicionais de um ou de ambos os componentes devem depender da resposta clínica com a pressão arterial medida no intervalo entre as doses para garantir que haja um efeito anti-hipertensivo adequado naquele momento. A dose de hidroclorotiazida geralmente não deve ser aumentada até que 2 a 3 semanas tenham decorrido. Após a adição do diurético, pode ser possível reduzir a dose de lisinopril. Pacientes cuja pressão arterial está adequadamente controlada com 25 mg de hidroclorotiazida por dia, mas que apresentam perda significativa de potássio com este regime, podem atingir um controle da pressão arterial semelhante ou maior sem distúrbios eletrolíticos se forem trocados para lisinopril/HCTZ 10/12.5.
Em pacientes que estão sendo tratados com um diurético, ocasionalmente pode ocorrer hipotensão sintomática após a dose inicial de lisinopril. O diurético deve, se possível, ser descontinuado por dois a três dias antes do início da terapia com lisinopril para reduzir a probabilidade de hipotensão (ver AVISOS ). Se a pressão arterial do paciente não for controlada apenas com lisinopril, a terapia diurética pode ser retomada.
Se o diurético não puder ser descontinuado, uma dose inicial de 5 mg de lisinopril deve ser usada sob supervisão médica por pelo menos duas horas e até que a pressão arterial se estabilize por pelo menos uma hora adicional. AVISOS e PRECAUÇÕES , INTERAÇÕES MEDICAMENTOSAS ).
A administração concomitante de ZESTORETIC com suplementos de potássio, substitutos do sal de potássio ou diuréticos poupadores de potássio pode levar a aumentos do potássio sérico (ver PRECAUÇÕES ).
Terapia de reposição
A combinação pode ser substituída pelos componentes individuais titulados.
Uso em Insuficiência Renal
Os regimes de terapia com lisinopril/HCTZ não precisam levar em consideração a função renal desde que a depuração de creatinina do paciente seja >30 mL/min/1,7m2 (creatinina sérica aproximadamente ≤3 mg/dL ou 265 μmol/L). Em pacientes com insuficiência renal mais grave, os diuréticos de alça são preferidos aos tiazídicos, portanto, lisinopril/HCTZ não é recomendado (consulte AVISOS , Reações anafilactóides durante a exposição da membrana ).
COMO FORNECIDO
ZESTORETIC 10-12,5 Comprimidos: Comprimidos não revestidos, redondos, cor de pêssego, biconvexos, identificados com "141" gravado de um lado e "ZESTORETIC" do outro lado, são fornecidos em frascos de 90 comprimidos ( NDC 52427-435-90) e frascos de 100 comprimidos ( NDC 52427-435-01).
ZESTORETIC 20-12,5 Comprimidos : Comprimidos brancos, redondos, biconvexos, não revestidos, identificados com "142" gravado em um lado e "ZESTORETIC" no outro lado são fornecidos em frascos de 90 comprimidos ( NDC 52427-436-90) e frascos de 100 comprimidos ( NDC 52427-436-01).
ZESTORETIC 20-25 Comprimidos Comprimidos não revestidos, redondos, cor de pêssego, biconvexos, identificados com “145” gravado em um lado e “ZESTORETIC” no outro lado, são fornecidos em frascos de 90 comprimidos ( NDC 52427-43790) e frascos de 100 comprimidos ( NDC 52427-437-01).
Armazenar
Armazenar em temperatura ambiente controlada, 20-25°C (68-77°F) [ver USP]. Proteger da luz e umidade excessivas.
Distribuído por: Almatica Pharma, Inc. Pine Brook, NJ 07058 EUA. Revisado: julho de 2017.
EFEITOS COLATERAIS
ZESTORETIC 12,5gmg foi avaliado quanto à segurança em 930 pacientes, incluindo 100 pacientes tratados por 50 semanas ou mais.
Em ensaios clínicos com ZESTORETIC não foram observadas experiências adversas peculiares a esta droga combinada. As experiências adversas que ocorreram foram limitadas àquelas que foram previamente relatadas com lisinopril ou hidroclorotiazida.
As experiências adversas clínicas mais frequentes em ensaios controlados (incluindo extensões de rótulo aberto) com qualquer combinação de lisinopril e hidroclorotiazida foram: tontura (7,5%), dor de cabeça (5,2%), tosse (3,9%), fadiga (3,7%) e efeitos ortostáticos (3,2%) todos os quais foram mais comuns do que em pacientes tratados com placebo. Geralmente, as experiências adversas foram de natureza leve e transitória, mas veja AVISOS quanto ao angioedema e hipotensão excessiva ou síncope. A descontinuação da terapia devido a efeitos adversos foi necessária em 4,4% dos pacientes, principalmente devido a tontura, tosse, fadiga e cãibras musculares.
As experiências adversas que ocorreram em mais de um por cento dos pacientes tratados com lisinopril mais hidroclorotiazida em ensaios clínicos controlados são mostradas abaixo.
Porcentagem de pacientes em estudos controlados
As experiências adversas clínicas que ocorreram em 0,3% a 1,0% dos pacientes em estudos controlados e eventos mais raros, graves e possivelmente relacionados ao medicamento relatados na experiência de marketing estão listados abaixo:
Corpo como um todo: Dor torácica, dor abdominal, síncope, desconforto torácico, febre, trauma, infecção por vírus. Cardiovascular: Palpitação, hipotensão ortostática. Digestivo: Cólicas gastrointestinais, boca seca, constipação, azia. Musculoesquelético: Dor nas costas, dor no ombro, dor no joelho, tensão nas costas, mialgia, dor no pé. Nervoso/Psiquiátrico: Diminuição da libido, vertigem, depressão, sonolência. Respiratório: Resfriado comum, congestão nasal, gripe, bronquite, dor faríngea, dispneia, congestão pulmonar, sinusite crônica, rinite alérgica, desconforto faríngeo. Pele: Rubor, prurido, inflamação da pele, diaforese, pseudolinfoma cutâneo. Sentidos Especiais: Visão turva, zumbido, otalgia. Urogenital: Infecção do trato urinário.
Angioedema: Angioedema da face, extremidades, lábios, língua, glote e/ou laringe foi relatado (ver AVISOS ).
Em casos raros, angioedema intestinal foi relatado na experiência pós-comercialização.
Hipotensão: Nos ensaios clínicos, os efeitos adversos relacionados à hipotensão ocorreram da seguinte forma: hipotensão (1,4%), hipotensão ortostática (0,5%), outros efeitos ortostáticos (3,2%). Além disso, a síncope ocorreu em 0,8% dos pacientes (consulte AVISOS ).
Tosse: Ver PRECAUÇÕES - Tosse .
Achados de Testes de Laboratório Clínico
Eletrólitos séricos
(Ver PRECAUÇÕES ).
Creatinina, Nitrogênio de Uréia no Sangue
Pequenos aumentos reversíveis no nitrogênio da ureia no sangue e na creatinina sérica foram observados em pacientes com hipertensão essencial tratados com ZESTORETIC. Aumentos mais acentuados também foram relatados e eram mais prováveis de ocorrer em pacientes com estenose da artéria renal (ver PRECAUÇÕES ).
Ácido úrico sérico, glicose, magnésio, colesterol, triglicerídeos e cálcio
(Ver PRECAUÇÕES ).
Hemoglobina e Hematócrito
Pequenas diminuições na hemoglobina e no hematócrito (diminuições médias de aproximadamente 0,5 g% e 1,5 vol%, respectivamente) ocorreram frequentemente em pacientes hipertensos tratados com ZESTORETIC 5mg, mas raramente tiveram importância clínica, a menos que outra causa de anemia coexistisse. Em ensaios clínicos, 0,4% dos pacientes interromperam a terapia devido à anemia.
Testes de função hepática
Raramente, ocorreram elevações das enzimas hepáticas e/ou bilirrubina sérica. (Ver AVISOS , Insuficiência Hepática ).
Outras reações adversas que foram relatadas com os componentes individuais estão listadas abaixo:
Lisinopril
Em ensaios clínicos, as reações adversas que ocorreram com lisinopril também foram observadas com ZESTORETIC. Além disso, e desde que o lisinopril foi comercializado, as seguintes reações adversas foram relatadas com lisinopril e devem ser consideradas reações adversas potenciais para ZESTORETIC: Corpo como um todo: Reações anafilactóides (ver AVISOS , Reações anafilactóides durante a exposição da membrana ), mal-estar, edema, edema facial, dor, dor pélvica, dor no flanco, calafrios; Cardiovascular: Parada cardíaca, infarto do miocárdio ou acidente vascular cerebral, possivelmente secundário a hipotensão excessiva em pacientes de alto risco (ver AVISOS , Hipotensão ), embolia e infarto pulmonar, piora da insuficiência cardíaca, arritmias (incluindo taquicardia, taquicardia ventricular, taquicardia atrial, fibrilação atrial, bradicardia e contrações ventriculares prematuras), angina pectoris, ataques isquêmicos transitórios, dispneia paroxística noturna, diminuição da pressão arterial, edema, vasculite; Digestivo: Pancreatite, hepatite (icterícia hepatocelular ou colestática) (ver AVISOS , Insuficiência Hepática ), gastrite, anorexia, flatulência, aumento da salivação; Endócrino: Diabetes mellitus, secreção inadequada de hormônio antidiurético; Hematologico: Casos raros de depressão da medula óssea, anemia hemolítica, leucopenia/neutropenia e trombocitopenia foram relatados nos quais uma relação causal com o lisinopril não pode ser excluída; Metabólico: Gota, perda de peso, desidratação, sobrecarga de líquidos, ganho de peso; Musculoesquelético: Artrite, artralgia, dor no pescoço, dor no quadril, dor nas articulações, dor nas pernas, dor no braço, lumbago; Sistema Nervoso/Psiquiátrico: Ataxia, comprometimento da memória, tremor, insônia, acidente vascular cerebral, nervosismo, confusão, neuropatia periférica (por exemplo, parestesia, disestesia), espasmo, hipersonia, irritabilidade; alterações de humor (incluindo sintomas depressivos); alucinações; Respiratório: Neoplasias pulmonares malignas, hemoptise, edema pulmonar, infiltrados pulmonares, broncoespasmo, asma, derrame pleural, pneumonia, pneumonite eosinofílica, sibilos, ortopnéia, respiração dolorosa, epistaxe, laringite, sinusite, faringite, rinite, rinorréia, anormalidades do som torácico; Pele: Urticária, alopecia, herpes zoster, fotossensibilidade, lesões cutâneas, infecções cutâneas, pênfigo, eritema, psoríase, casos raros de outras reações cutâneas graves, incluindo necrólise epidérmica tóxica e síndrome de Stevens-Johnson (relação causal não estabelecida); Sentidos Especiais: Perda visual, diplopia, fotofobia, alteração do paladar, distúrbio olfativo; Urogenital: Insuficiência renal aguda, oligúria, anúria, uremia, azotemia progressiva, disfunção renal (ver PRECAUÇÕES e DOSAGEM E ADMINISTRAÇÃO ), pielonefrite, disúria, dor mamária.
Diversos
Foi relatado um complexo de sintomas que pode incluir ANA positivo, velocidade de hemossedimentação elevada, artralgia/artrite, mialgia, febre, vasculite, eosinofilia e leucocitose. Erupção cutânea, fotossensibilidade ou outras manifestações dermatológicas podem ocorrer isoladamente ou em combinação com esses sintomas.
Hidroclorotiazida
Corpo como um todo: Fraqueza; Digestivo: Anorexia, irritação gástrica, cólicas, icterícia (icterícia colestática intra-hepática) (Ver AVISOS , Insuficiência Hepática ), pancreatite, sialoadenite, constipação; Hematologico: Leucopenia, agranulocitose, trombocitopenia, anemia aplástica, anemia hemolítica; Musculoesquelético: Espasmo muscular; Sistema Nervoso/Psiquiátrico: Inquietação; Renal: Insuficiência renal, disfunção renal, nefrite intersticial (ver AVISOS ); Pele: Eritema multiforme incluindo síndrome de Stevens-Johnson, dermatite esfoliativa incluindo necrólise epidérmica tóxica, alopecia; Sentidos Especiais: Xantopsia; Hipersensibilidade: Púrpura, fotossensibilidade, urticária, angeíte necrosante (vasculite e vasculite cutânea), dificuldade respiratória incluindo pneumonite e edema pulmonar, reações anafiláticas.
INTERAÇÕES MEDICAMENTOSAS
Lisinopril
Hipotensão - Pacientes em Terapia Diurética
Pacientes em uso de diuréticos e especialmente aqueles nos quais a terapia diurética foi instituída recentemente, podem ocasionalmente apresentar uma redução excessiva da pressão arterial após o início da terapia com lisinopril. A possibilidade de efeitos hipotensores com lisinopril pode ser minimizada pela descontinuação do diurético ou pelo aumento da ingestão de sal antes do início do tratamento com lisinopril. Se for necessário continuar o diurético, inicie a terapia com lisinopril na dose de 5 mg por dia e forneça supervisão médica rigorosa após a dose inicial por pelo menos duas horas e até que a pressão arterial se estabilize por pelo menos uma hora adicional (consulte AVISOS , e DOSAGEM E ADMINISTRAÇÃO ). Quando um diurético é adicionado à terapia de um paciente recebendo lisinopril, geralmente é observado um efeito anti-hipertensivo adicional (ver DOSAGEM E ADMINISTRAÇÃO ).
Agentes anti-inflamatórios não esteroides, incluindo inibidores seletivos de ciclooxigenase-2 (inibidores de COX-2)
Em pacientes idosos, com depleção de volume (incluindo aqueles em terapia diurética) ou com função renal comprometida, a coadministração de AINEs, incluindo inibidores seletivos de COX-2, com inibidores da ECA, incluindo lisinopril, pode resultar em deterioração da função renal , incluindo possível insuficiência renal aguda. Estes efeitos são geralmente reversíveis. Monitorar a função renal periodicamente em pacientes recebendo terapia com lisinopril e AINEs.
O efeito anti-hipertensivo dos inibidores da ECA, incluindo o lisinopril, pode ser atenuado pelos AINEs.
Duplo bloqueio do sistema renina-angiotensina (RAS)
O bloqueio duplo do SRA com bloqueadores dos receptores da angiotensina, inibidores da ECA ou alisquireno está associado a riscos aumentados de hipotensão, hipercalemia e alterações na função renal (incluindo insuficiência renal aguda) em comparação com a monoterapia.
estudo VA NEPHRON recrutou 1.448 pacientes com diabetes tipo 2, relação urina-albuminto-creatinina elevada e taxa de filtração glomerular estimada diminuída (TFG 30 a 89,9 ml/min), randomizou-os para lisinopril ou placebo em um histórico de terapia com losartana e seguiu por uma mediana de 2,2 anos. Os pacientes que receberam a combinação de losartana e lisinopril não obtiveram nenhum benefício adicional em comparação com a monoterapia para o desfecho combinado de declínio da TFG, doença renal terminal ou morte, mas experimentaram um aumento da incidência de hipercalemia e lesão renal aguda em comparação com o grupo de monoterapia .
Em geral, evite o uso combinado de inibidores do RAS, monitore de perto a pressão arterial, a função renal e os eletrólitos em pacientes em uso de ZESTORETIC e outros agentes que afetam o RAS.
Não coadministre alisquireno com ZESTORETIC em pacientes com diabetes. Evitar o uso de alisquireno com ZESTORETIC 5mg em pacientes com insuficiência renal (TFG
Outros agentes
lisinopril foi usado concomitantemente com nitratos e/ou digoxina sem evidência de interações adversas clinicamente significativas. Não ocorreram interações farmacocinéticas significativas clinicamente importantes quando o lisinopril foi usado concomitantemente com propranolol, digoxina ou hidroclorotiazida. A presença de alimentos no estômago não altera a biodisponibilidade do lisinopril.
Agentes que aumentam o potássio sérico
O lisinopril atenua a perda de potássio causada pelos diuréticos tiazídicos. O uso de lisinopril com diuréticos poupadores de potássio (por exemplo, espironolactona, eplerenona, triantereno ou amilorida), suplementos de potássio ou substitutos do sal contendo potássio pode levar a aumentos significativos no potássio sérico. Portanto, se o uso concomitante desses agentes for indicado, devido à hipocalemia demonstrada, eles devem ser usados com cautela e com monitoramento frequente do potássio sérico.
Lítio
toxicidade do lítio foi relatada em pacientes recebendo lítio concomitantemente com medicamentos que causam a eliminação de sódio, incluindo inibidores da ECA. A toxicidade do lítio foi geralmente reversível com a descontinuação do lítio e do inibidor da ECA. Recomenda-se que os níveis séricos de lítio sejam monitorados frequentemente se lisinopril for administrado concomitantemente com lítio.
Inibidores de mTOR (alvo de rapamicina de mamífero)
Pacientes recebendo coadministração de inibidor da ECA e inibidor de mTOR (por exemplo, temsirolimus, sirolimus, everolimus) podem apresentar risco aumentado de angioedema. (Vejo AVISOS )
Inibidores de Neprilisina
Pacientes em uso concomitante de inibidores de neprilisina podem apresentar risco aumentado de angioedema. (Vejo AVISOS )
Hidroclorotiazida
Quando administrados concomitantemente, os seguintes medicamentos podem interagir com os diuréticos tiazídicos.
Álcool, barbitúricos ou narcóticos -pode ocorrer potenciação da hipotensão ortostática.
Medicamentos antidiabéticos (agentes orais e insulina) -Pode ser necessário ajuste da dose do medicamento antidiabético.
Outros medicamentos anti-hipertensivos -efeito aditivo ou potenciação.
Resinas de colestiramina e colestipol -A absorção de hidroclorotiazida é prejudicada na presença de resinas de troca aniônica. Doses únicas de resinas de colestiramina ou colestipol ligam-se à hidroclorotiazida e reduzem sua absorção no trato gastrointestinal em até 85% e 43%, respectivamente.
Corticosteróides, ACTH - Depleção eletrolítica intensificada, particularmente hipocalemia.
Aminas pressoras (por exemplo, norepinefrina) - possível diminuição da resposta às aminas pressoras, mas não suficiente para impedir seu uso.
Relaxantes do músculo esquelético, não despolarizantes (por exemplo, tubocurarina) -possível aumento da capacidade de resposta ao relaxante muscular.
Lítio - geralmente não deve ser administrado com diuréticos. Os agentes diuréticos reduzem a depuração renal do lítio e aumentam o risco de toxicidade do lítio. Consulte o folheto informativo das preparações de lítio antes de usar essas preparações com ZESTORETIC.
Anti-inflamatórios não esteroides -Em alguns pacientes, a administração de um agente anti-inflamatório não esteroidal pode reduzir os efeitos diuréticos, natriuréticos e anti-hipertensivos dos diuréticos de alça, poupadores de potássio e tiazídicos. Portanto, quando ZESTORETIC e agentes anti-inflamatórios não esteroides são usados concomitantemente, o paciente deve ser observado atentamente para determinar se o efeito desejado de ZESTORETIC 5mg é obtido.
Ouro
Reações nitritóides (sintomas incluem rubor facial, náuseas, vômitos e hipotensão) foram relatadas raramente em pacientes em terapia com ouro injetável (aurotiomalato de sódio) e terapia concomitante com inibidores da ECA, incluindo ZESTORETIC.
AVISOS
Lisinopril
Reações Anafilactóides e Possivelmente Relacionadas
Presumivelmente, porque os inibidores da enzima conversora de angiotensina afetam o metabolismo de eicosanóides e polipeptídeos, incluindo bradicinina endógena, os pacientes que recebem inibidores da ECA (incluindo ZESTORETIC) podem estar sujeitos a uma variedade de reações adversas, algumas delas graves.
Angioedema de cabeça e pescoço
Angioedema da face, extremidades, lábios, língua, glote e/ou laringe foi relatado em pacientes tratados com inibidores da enzima conversora de angiotensina, incluindo lisinopril. Isso pode ocorrer a qualquer momento durante o tratamento. Os inibidores da ECA têm sido associados a uma taxa mais alta de angioedema em pacientes negros do que em pacientes não negros. ZESTORETIC 12,5gmg deve ser imediatamente descontinuado e a terapia e monitoramento apropriados devem ser fornecidos até que a resolução completa e sustentada dos sinais e sintomas tenha ocorrido. Mesmo nos casos em que o inchaço da língua está envolvido, sem dificuldade respiratória, os pacientes podem necessitar de observação prolongada, uma vez que o tratamento com anti-histamínicos e corticosteróides pode não ser suficiente. Muito raramente, foram relatadas fatalidades devido a angioedema associado a edema de laringe ou edema de língua. Pacientes com envolvimento da língua, glote ou laringe são propensos a apresentar obstrução das vias aéreas, especialmente aqueles com histórico de cirurgia das vias aéreas. Quando houver envolvimento da língua, glote ou laringe, com probabilidade de causar obstrução das vias aéreas, deve-se fornecer prontamente solução de epinefrina subcutânea 1:1000 (0,3 mL a 0,5 mL) e/ou medidas necessárias para garantir uma via aérea pérvia (consulte REAÇÕES ADVERSAS) .
Pacientes recebendo coadministração de inibidor da ECA e inibidor de mTOR (alvo de rapamicina em mamíferos) (por exemplo, temsirolimus, sirolimus, everolimus) ou um inibidor de neprilisina podem apresentar risco aumentado de angioedema (ver PRECAUÇÕES ).
Angioedema Intestinal
Foi relatado angioedema intestinal em pacientes tratados com inibidores da ECA. Esses pacientes apresentavam dor abdominal (com ou sem náusea ou vômito); em alguns casos não havia história prévia de angioedema facial e os níveis de C-1 esterase estavam normais. O angioedema foi diagnosticado por procedimentos incluindo tomografia computadorizada abdominal ou ultra-som, ou na cirurgia, e os sintomas foram resolvidos após a interrupção do inibidor da ECA. O angioedema intestinal deve ser incluído no diagnóstico diferencial de pacientes em uso de inibidores da ECA apresentando dor abdominal.
Pacientes com histórico de angioedema não relacionado à terapia com inibidores da ECA podem apresentar risco aumentado de angioedema enquanto estiverem recebendo um inibidor da ECA (ver INDICAÇÕES e CONTRA-INDICAÇÕES ).
Reações anafilactóides durante a dessensibilização
Dois pacientes submetidos a tratamento de dessensibilização com veneno de himenópteros enquanto recebiam inibidores da ECA sofreram reações anafilactóides com risco de vida.
Nos mesmos pacientes, essas reações foram evitadas quando os inibidores da ECA foram temporariamente suspensos, mas reapareceram após reintrodução inadvertida.
Reações anafilactóides durante a exposição da membrana
Produtos combinados contendo tiazidas não são recomendados em pacientes com disfunção renal grave. Reações anafilactóides súbitas e potencialmente fatais foram relatadas em alguns pacientes dialisados com membranas de alto fluxo (por exemplo, AN69®**) e tratados concomitantemente com um inibidor da ECA. Nesses pacientes, a diálise deve ser interrompida imediatamente e a terapia agressiva para reações anafilactóides deve ser iniciada. Os sintomas não foram aliviados por anti-histamínicos nessas situações. Nesses pacientes, deve-se considerar o uso de um tipo diferente de membrana de diálise ou uma classe diferente de agente anti-hipertensivo. Reações anafilactóides também foram relatadas em pacientes submetidos a aférese de lipoproteínas de baixa densidade com absorção de sulfato de dextrano.
Hipotensão e efeitos relacionados
Hipotensão excessiva foi raramente observada em pacientes hipertensos não complicados, mas é uma possível consequência do uso de lisinopril em pessoas com depleção de sal/volume, como aqueles tratados vigorosamente com diuréticos ou pacientes em diálise (ver INTERAÇÕES MEDICAMENTOSAS e REAÇÕES ADVERSAS ).
Síncope foi relatada em 0,8 por cento dos pacientes que receberam ZESTORETIC. Em pacientes com hipertensão recebendo apenas lisinopril, a incidência de síncope foi de 0,1 por cento. A incidência geral de síncope pode ser reduzida pela titulação adequada dos componentes individuais (consulte INTERAÇÕES MEDICAMENTOSAS , REAÇÕES ADVERSAS e DOSAGEM E ADMINISTRAÇÃO ).
Em pacientes com insuficiência cardíaca congestiva grave, com ou sem insuficiência renal associada, foi observada hipotensão excessiva e pode estar associada a oligúria e/ou azotemia progressiva e raramente a insuficiência renal aguda e/ou morte. Devido à potencial queda da pressão arterial nesses pacientes, a terapia deve ser iniciada sob supervisão médica muito próxima. Esses pacientes devem ser acompanhados de perto nas primeiras duas semanas de tratamento e sempre que a dose de lisinopril e/ou diurético for aumentada. Considerações semelhantes se aplicam a pacientes com doença isquêmica do coração ou doença cerebrovascular, nos quais uma queda excessiva da pressão arterial pode resultar em infarto do miocárdio ou acidente vascular cerebral.
Se ocorrer hipotensão, o paciente deve ser colocado em decúbito dorsal e, se necessário, receber infusão intravenosa de soro fisiológico. Uma resposta hipotensiva transitória não é uma contra-indicação para doses adicionais que geralmente podem ser administradas sem dificuldade, uma vez que a pressão arterial tenha aumentado após a expansão do volume.
Leucopenia/neutropenia/agranulocitose
Outro inibidor da enzima conversora de angiotensina, o captopril, demonstrou causar agranulocitose e depressão da medula óssea, raramente em pacientes não complicados, mas mais frequentemente em pacientes com insuficiência renal, especialmente se eles também tiverem uma doença vascular do colágeno. Os dados disponíveis de ensaios clínicos de lisinopril são insuficientes para mostrar que o lisinopril não causa agranulocitose em taxas semelhantes. A experiência de comercialização revelou casos raros de leucopenia/neutropenia e depressão da medula óssea nos quais não pode ser excluída uma relação causal com o lisinopril. Deve ser considerada a monitorização periódica das contagens de glóbulos brancos em doentes com doença vascular do colagénio e doença renal.
Insuficiência Hepática
Raramente, os inibidores da ECA têm sido associados a uma síndrome que começa com icterícia colestática ou hepatite e progride para necrose hepática fulminante e (às vezes) morte. O mecanismo desta síndrome não é compreendido. Pacientes recebendo inibidores da ECA que desenvolvem icterícia ou elevações acentuadas das enzimas hepáticas devem descontinuar o inibidor da ECA e receber acompanhamento médico adequado.
Toxicidade Fetal
Gravidez Categoria D
uso de drogas que atuam no sistema renina-angiotensina durante o segundo e terceiro trimestres de gestação reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal. O oligoidrâmnio resultante pode estar associado a hipoplasia pulmonar fetal e deformações esqueléticas. Os potenciais efeitos adversos neonatais incluem hipoplasia do crânio, anúria, hipotensão, insuficiência renal e morte. Quando a gravidez for detectada, descontinue ZESTORETIC o mais rápido possível. Esses desfechos adversos geralmente estão associados ao uso desses medicamentos no segundo e terceiro trimestre da gravidez. A maioria dos estudos epidemiológicos examinando anormalidades fetais após exposição ao uso de anti-hipertensivos no primeiro trimestre não distinguiu drogas que afetam o sistema renina-angiotensina de outros agentes anti-hipertensivos. O manejo adequado da hipertensão materna durante a gravidez é importante para otimizar os resultados tanto para a mãe quanto para o feto.
No caso incomum de não haver alternativa adequada à terapia com drogas que afetem o sistema reninaangiotensina para um paciente em particular, informar a mãe sobre o risco potencial para o feto. Realizar exames ultrassonográficos seriados para avaliar o ambiente intra-amniótico. Se for observado oligoidrâmnio, descontinuar ZESTORETIC, a menos que seja considerado vital para a mãe. O teste fetal pode ser apropriado, com base na semana de gravidez. Pacientes e médicos devem estar cientes, entretanto, de que o oligoidrâmnio pode não aparecer até que o feto tenha sofrido lesão irreversível. Observe atentamente os bebês com histórico de exposição in utero ao ZESTORETIC para hipotensão, oligúria e hipercalemia. (Ver PRECAUÇÕES, Uso Pediátrico ).
Não foram observados efeitos teratogênicos do lisinopril em estudos com ratas, camundongos e coelhas grávidas. Numa base mg/kg, as doses utilizadas foram até 625 vezes (em ratinhos), 188 vezes (em ratos) e 0,6 vezes (em coelhos) a dose humana máxima recomendada.
Lisinopril e Hidroclorotiazida
Estudos de teratogenicidade foram conduzidos em camundongos e ratos com até 90 mg/kg/dia de lisinopril (56 vezes a dose humana máxima recomendada) em combinação com 10 mg/kg/dia de hidroclorotiazida (2,5 vezes a dose humana máxima recomendada). Efeitos maternos ou fetotóxicos não foram observados em camundongos com a combinação. Em ratos, ocorreu diminuição do ganho de peso materno e diminuição do peso fetal até 3/10 mg/kg/dia (a dose mais baixa testada). Associado com a diminuição do peso fetal foi um atraso na ossificação fetal. A diminuição do peso fetal e o atraso na ossificação fetal não foram observados em animais suplementados com solução salina que receberam 90/10 mg/kg/dia.
Quando usados na gravidez, durante o segundo e terceiro trimestres, os inibidores da ECA podem causar lesões e até a morte do feto em desenvolvimento. Quando a gravidez for detectada, descontinue ZESTORETIC 5mg o mais rápido possível ( Veja Lisinopril, Toxicidade Fetal ).
Hidroclorotiazida
Miopia aguda e glaucoma secundário de ângulo fechado
hidroclorotiazida, uma sulfonamida, pode causar uma reação idiossincrática, resultando em miopia transitória aguda e glaucoma agudo de ângulo fechado. Os sintomas incluem início agudo de diminuição da acuidade visual ou dor ocular e geralmente ocorrem dentro de horas a semanas após o início da droga. O glaucoma agudo de ângulo fechado não tratado pode levar à perda permanente da visão. O tratamento primário é descontinuar a hidroclorotiazida o mais rápido possível. Tratamentos médicos ou cirúrgicos imediatos podem precisar ser considerados se a pressão intraocular permanecer descontrolada. Os fatores de risco para o desenvolvimento de glaucoma agudo de ângulo fechado podem incluir história de alergia à sulfonamida ou à penicilina.
Efeitos teratogênicos
Estudos de reprodução em coelhos, camundongos e ratos com doses de até 100 mg/kg/dia (50 vezes a dose humana) não mostraram evidência de anormalidades externas do feto devido à hidroclorotiazida. A hidroclorotiazida administrada em um estudo de dois litros em ratos em doses de 4 mg/kg/dia a 5,6 mg/kg/dia (aproximadamente 1 a 2 vezes a dose humana diária usual) não prejudicou a fertilidade ou produziu anormalidades de nascimento na prole. As tiazidas atravessam a barreira placentária e aparecem no sangue do cordão umbilical.
Efeitos não teratogênicos
Estes podem incluir icterícia fetal ou neonatal, trombocitopenia e possivelmente outras reações adversas ocorreram em adultos.
Hidroclorotiazida
As tiazidas devem ser usadas com cautela na doença renal grave. Em pacientes com doença renal, as tiazidas podem precipitar a azotemia. Os efeitos cumulativos da droga podem se desenvolver em pacientes com insuficiência renal.
As tiazidas devem ser usadas com cautela em pacientes com função hepática comprometida ou doença hepática progressiva, pois pequenas alterações do equilíbrio hidroeletrolítico podem precipitar o coma hepático.
Reações de sensibilidade podem ocorrer em pacientes com ou sem histórico de alergia ou asma brônquica.
A possibilidade de exacerbação ou ativação do lúpus eritematoso sistêmico foi relatada.
O lítio geralmente não deve ser administrado com tiazidas (consulte INTERAÇÕES MEDICAMENTOSAS , Lisinopril e Hidroclorotiazida ).
PRECAUÇÕES
Em geral
Lisinopril
Estenose Aórtica/Cardiomiopatia Hipertrófica
Tal como acontece com todos os vasodilatadores, o lisinopril deve ser administrado com precaução a doentes com obstrução na via de saída do ventrículo esquerdo.
Função Renal Prejudicada
Como consequência da inibição do sistema renina-angiotensina-aldosterona, podem ser antecipadas alterações na função renal em indivíduos susceptíveis. Em pacientes com insuficiência cardíaca congestiva grave cuja função renal pode depender da atividade do sistema renina-angiotensina-aldosterona, o tratamento com inibidores da enzima conversora de angiotensina, incluindo lisinopril, pode estar associado a oligúria e/ou azotemia progressiva e raramente a insuficiência renal aguda. falha e/ou morte.
Em pacientes hipertensos com estenose unilateral ou bilateral da artéria renal, podem ocorrer aumentos do nitrogênio ureico no sangue e da creatinina sérica. A experiência com outro inibidor da enzima conversora de angiotensina sugere que esses aumentos são geralmente reversíveis com a descontinuação do lisinopril e/ou terapia diurética. Nesses pacientes, a função renal deve ser monitorada durante as primeiras semanas de terapia.
Alguns pacientes hipertensos sem doença vascular renal pré-existente aparente desenvolveram aumentos na ureia sanguínea e creatinina sérica, geralmente menores e transitórios, especialmente quando o lisinopril foi administrado concomitantemente com um diurético. Isso é mais provável de ocorrer em pacientes com insuficiência renal pré-existente. Pode ser necessária a redução da dose de lisinopril e/ou descontinuação do diurético.
A avaliação do paciente hipertenso deve sempre incluir a avaliação da função renal (ver POSOLOGIA E ADMINISTRAÇÃO).
Hipercalemia
Em ensaios clínicos, ocorreu hipercalemia (potássio sérico superior a 5,7 mEq/L) em aproximadamente 1,4 por cento dos pacientes hipertensos tratados com lisinopril mais hidroclorotiazida. Na maioria dos casos, estes eram valores isolados que se resolveram apesar da terapia continuada. A hipercalemia não foi causa de descontinuação da terapia. Os fatores de risco para o desenvolvimento de hipercalemia incluem insuficiência renal, diabetes mellitus e o uso concomitante de diuréticos poupadores de potássio, suplementos de potássio e/ou substitutos do sal contendo potássio. A hipercalemia pode causar arritmias graves, às vezes fatais. ZESTORETIC deve ser usado com cautela, se for o caso, com esses agentes e com monitoramento frequente do potássio sérico (consulte INTERAÇÕES MEDICAMENTOSAS ).
Tosse
Presumivelmente devido à inibição da degradação da bradicinina endógena, tosse não produtiva persistente foi relatada com todos os inibidores da ECA, quase sempre desaparecendo após a descontinuação da terapia. A tosse induzida por inibidores da ECA deve ser considerada no diagnóstico diferencial da tosse.
Cirurgia/Anestesia
Em pacientes submetidos a cirurgias de grande porte ou durante anestesia com agentes que produzem hipotensão, o lisinopril pode bloquear a formação de angiotensina II secundária à liberação compensatória de renina. Se ocorrer hipotensão e for considerada decorrente desse mecanismo, ela pode ser corrigida pela expansão do volume.
Hidroclorotiazida
A determinação periódica dos eletrólitos séricos para detectar um possível desequilíbrio eletrolítico deve ser realizada em intervalos apropriados.
Todos os pacientes que recebem terapia com tiazida devem ser observados quanto a sinais clínicos de desequilíbrio hidroeletrolítico: ou seja, hiponatremia, alcalose hipoclorêmica e hipocalemia. As determinações de eletrólitos séricos e urinários são particularmente importantes quando o paciente está vomitando excessivamente ou recebendo fluidos parenterais. Sinais de alerta ou sintomas de desequilíbrio hidroeletrolítico, independentemente da causa, incluem secura da boca, sede, fraqueza, letargia, sonolência, inquietação, confusão, convulsões, dores musculares ou cãibras, fadiga muscular, hipotensão, oligúria, taquicardia e distúrbios gastrointestinais como náuseas e vômitos.
A hipocalemia pode se desenvolver, especialmente com diurese rápida, quando há cirrose grave ou após terapia prolongada.
interferência na ingestão adequada de eletrólitos orais também contribuirá para a hipocalemia. A hipocalemia pode causar arritmia cardíaca e também pode sensibilizar ou exagerar a resposta do coração aos efeitos tóxicos dos digitálicos (por exemplo, aumento da irritabilidade ventricular). Como o lisinopril reduz a produção de aldosterona, a terapia concomitante com lisinopril atenua a perda de potássio induzida por diuréticos (ver INTERAÇÕES MEDICAMENTOSAS , Agentes que Aumentam o Potássio Sérico ).
Embora qualquer déficit de cloreto seja geralmente leve e geralmente não requeira tratamento específico, exceto em circunstâncias extraordinárias (como na doença hepática ou doença renal), a reposição de cloreto pode ser necessária no tratamento da alcalose metabólica.
A hiponatremia dilucional pode ocorrer em pacientes edematosos em clima quente; a terapia apropriada é a restrição hídrica, em vez da administração de sal, exceto em casos raros quando a hiponatremia é fatal. Na depleção real de sal, a reposição apropriada é a terapia de escolha.
Hiperuricemia pode ocorrer ou gota franca pode ser precipitada em certos pacientes recebendo terapia com tiazida.
Em pacientes diabéticos, podem ser necessários ajustes de dosagem de insulina ou agentes hipoglicemiantes orais. Pode ocorrer hiperglicemia com diuréticos tiazídicos. Assim, o diabetes mellitus latente pode se manifestar durante a terapia com tiazidas.
Os efeitos anti-hipertensivos da droga podem ser aumentados no paciente pós-simpatectomia.
Se a insuficiência renal progressiva se tornar evidente, considerar a suspensão ou descontinuação da terapia diurética.
As tiazidas demonstraram aumentar a excreção urinária de magnésio; isso pode resultar em hipomagnesemia.
As tiazidas podem diminuir a excreção urinária de cálcio. As tiazidas podem causar elevação intermitente e discreta do cálcio sérico na ausência de distúrbios conhecidos do metabolismo do cálcio. Hipercalcemia acentuada pode ser evidência de hiperparatireoidismo oculto. As tiazidas devem ser descontinuadas antes da realização de testes de função da paratireoide.
Aumentos nos níveis de colesterol e triglicerídeos podem estar associados à terapia com diuréticos tiazídicos.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Lisinopril e Hidroclorotiazida
Lisinopril em combinação com hidroclorotiazida não foi mutagênico em um teste de mutagênico microbiano usando Salmonella typhimurium (teste de Ames) ou Escherichia coli com ou sem ativação metabólica ou em um teste de mutação direta usando células de pulmão de hamster chinês. O lisinopril e a hidroclorotiazida não produziram quebras de fita simples de DNA em um ensaio de hepatócitos de rato com eluição alcalina in vitro. Além disso, não produziu aumentos nas aberrações cromossômicas em um teste in vitro em células de ovário de hamster chinês ou em um estudo in vivo em medula óssea de camundongo.
Lisinopril
Não houve evidência de efeito tumorigénico quando o lisinopril foi administrado durante 105 semanas a ratos machos e fêmeas em doses até 90 mg/kg/dia (cerca de 56 ou 9 vezes* a dose máxima diária humana, com base no peso corporal e superfície corporal área, respectivamente). Não houve evidência de carcinogenicidade quando o lisinopril foi administrado por 92 semanas a camundongos (machos e fêmeas) em doses de até 135 mg/kg/dia (cerca de 84 vezes* a dose humana diária máxima recomendada). Esta dose foi 6,8 vezes a dose humana máxima com base na área de superfície corporal em camundongos.
*Os cálculos assumem um peso humano de 50 kg e uma área de superfície do corpo humano de 1,62m2.
lisinopril não foi mutagênico no teste de mutagênico microbiano de Ames com ou sem ativação metabólica. Também foi negativo em um ensaio de mutação direta usando células de pulmão de hamster chinês. O lisinopril não produziu quebras de DNA de fita simples em um ensaio de hepatócitos de rato com eluição alcalina in vitro. Além disso, o lisinopril não produziu aumentos nas aberrações cromossômicas em um teste in vitro em células de ovário de hamster chinês ou em um estudo in vivo em medula óssea de camundongo.
Não houve efeitos adversos no desempenho reprodutivo em ratos machos e fêmeas tratados com até 300 mg/kg/dia de lisinopril. Esta dose é 188 vezes e 30 vezes a dose humana diária máxima com base em mg/kg e mg/m2, respectivamente.
Hidroclorotiazida
Estudos de alimentação de dois anos em camundongos e ratos conduzidos sob os auspícios do Programa Nacional de Toxicologia (NTP) não revelaram evidência de potencial carcinogênico da hidroclorotiazida em camundongos fêmeas (em doses de até aproximadamente 600 mg/kg/dia) ou em machos e ratos fêmeas (em doses até aproximadamente 100 mg/kg/dia). Essas doses são 150 vezes e 12 vezes para camundongos e 25 vezes e 4 vezes para ratos a dose máxima diária humana baseada em mg/kg e mg/m2, respectivamente. O NTP, no entanto, encontrou evidências ambíguas de hepatocarcinogenicidade em camundongos machos.
hidroclorotiazida não foi genotóxica in vitro no ensaio de mutagenicidade de Ames das cepas de Salmonella typhimurium TA 98, TA 100, TA 1535, TA 1537 e TA 1538 e no teste de ovário de hamster chinês (CHO) para aberrações cromossômicas, ou in vivo em ensaios usando cromossomos de células germinais de camundongos, cromossomos de medula óssea de hamster chinês e o gene recessivo de traço letal ligado ao sexo de Drosophila. Os resultados positivos dos testes foram obtidos apenas nos ensaios in vitro CHO Sister Chromatid Exchange (clastogenicidade) e nos ensaios de células de linfoma de camundongo (mutagenicidade), usando concentrações de hidroclorotiazida de 43 mcg/mL a 1300 mcg/mL, e no ensaio de não disjunção de Aspergillus nidulans em uma concentração não especificada.
hidroclorotiazida não teve efeitos adversos na fertilidade de camundongos e ratos de ambos os sexos em estudos em que essas espécies foram expostas, por meio da dieta, a doses de até 100 mg/kg e 4 mg/kg, respectivamente, antes da concepção e durante a gestação . Em camundongos, esta dose é 25 vezes e 2 vezes a dose máxima diária humana com base em mg/kg e mg/m2, respectivamente. Em ratos, esta dose é 1 vez e 0,2 vezes a dose humana diária máxima com base em mg/kg e mg/m2, respectivamente.
Mães que amamentam
Não se sabe se o lisinopril é excretado no leite humano. No entanto, o leite de ratas lactantes contém radioatividade após a administração de 14C lisinopril. Em outro estudo, o lisinopril estava presente no leite de ratos em níveis semelhantes aos níveis plasmáticos nas mães. As tiazidas aparecem no leite humano. Devido ao potencial de reações adversas graves em lactentes de inibidores da ECA e hidroclorotiazida, deve-se decidir se deve descontinuar a amamentação e/ou descontinuar ZESTORETIC 12,5gmg, levando em consideração a importância do medicamento para a mãe.
Uso Pediátrico
Recém-nascidos com histórico de exposição in utero ao ZESTORETIC
Se ocorrer oligúria ou hipotensão, dirigir a atenção para o suporte da pressão arterial e perfusão renal. Transfusões de troca ou diálise podem ser necessárias como meio de reverter a hipotensão e/ou substituir a função renal desordenada. O lisinopril, que atravessa a placenta, foi retirado da circulação neonatal por diálise peritoneal com algum benefício clínico, e teoricamente pode ser removido por exsanguineotransfusão, embora não haja experiência com este último procedimento.
A segurança e eficácia em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Os estudos clínicos de ZESTORETIC mg não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente dos indivíduos mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os mais jovens. Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, geralmente começando no limite inferior da faixa de dosagem, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa.
Este fármaco é conhecido por ser substancialmente excretado pelos rins, e o risco de reações tóxicas a este fármaco pode ser maior em pacientes com função renal comprometida. Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se ter cuidado na seleção da dose. A avaliação do paciente hipertenso deve sempre incluir a avaliação da função renal.
SOBREDOSAGEM
Nenhuma informação específica está disponível sobre o tratamento de superdosagem com ZESTORETIC. O tratamento é sintomático e de suporte. A terapia com ZESTORETIC 12,5gmg deve ser descontinuada e o paciente observado atentamente. As medidas sugeridas incluem indução de vômitos e/ou lavagem gástrica e correção de desidratação, desequilíbrio eletrolítico e hipotensão por procedimentos estabelecidos.
Lisinopril
Após uma dose oral única de 20 g/kg não ocorreu letalidade em ratos e a morte ocorreu em um dos 20 camundongos que receberam a mesma dose. A manifestação mais provável de superdosagem seria a hipotensão, para a qual o tratamento usual seria a infusão intravenosa de solução salina normal.
O lisinopril pode ser removido por hemodiálise (ver AVISOS , Reação Anafilactóide Durante a Exposição da Membrana ).
Hidroclorotiazida
administração oral de uma dose oral única de 10 g/kg a camundongos e ratos não foi letal. Os sinais e sintomas mais comuns observados são aqueles causados por depleção eletrolítica (hipocalemia, hipocloremia, hiponatremia) e desidratação decorrente de diurese excessiva. Se digitálicos também foram administrados, a hipocalemia pode acentuar as arritmias cardíacas.
CONTRA-INDICAÇÕES
ZESTORETIC 12,5gmg é contraindicado em pacientes com hipersensibilidade a este produto e em pacientes com histórico de angioedema relacionado a tratamento anterior com um inibidor da enzima conversora de angiotensina e em pacientes com angioedema hereditário ou idiopático. Devido ao componente hidroclorotiazida, este produto é contraindicado em pacientes com anúria ou hipersensibilidade a outros medicamentos derivados de sulfonamidas.
ZESTORETIC 12,5gmg é contraindicado em combinação com um inibidor de neprilisina (por exemplo, sacubitril). Não administre ZESTORETIC 5mg dentro de 36 horas após a troca de sacubitril/valsartana, um inibidor da neprilisina (ver AVISOS ).
Não coadministre alisquireno com ZESTORETIC em pacientes com diabetes (ver INTERAÇÕES MEDICAMENTOSAS ).
FARMACOLOGIA CLÍNICA
Lisinopril e Hidroclorotiazida
Como resultado de seus efeitos diuréticos, a hidroclorotiazida aumenta a atividade da renina plasmática, aumenta a secreção de aldosterona e diminui o potássio sérico. A administração de lisinopril bloqueia o eixo reninaangiotensina aldosterona e tende a reverter a perda de potássio associada ao diurético.
Em estudos clínicos, a extensão da redução da pressão arterial observada com a combinação de lisinopril e hidroclorotiazida foi aproximadamente aditiva. A combinação ZESTORETIC 10-12.5 funcionou igualmente bem em pacientes negros e brancos. As combinações ZESTORETIC 20-12.5 e ZESTORETIC 20-25 pareceram um pouco menos eficazes em pacientes negros, mas relativamente poucos pacientes negros foram estudados. Na maioria dos pacientes, o efeito anti-hipertensivo de ZESTORETIC foi mantido por pelo menos 24 horas.
Em uma comparação randomizada e controlada, os efeitos anti-hipertensivos médios de ZESTORETIC 20-12.5 e ZESTORETIC 20-25 foram semelhantes, sugerindo que muitos pacientes que respondem adequadamente à última combinação podem ser controlados com ZESTORETIC 20-12.5 (ver DOSAGEM E ADMINISTRAÇÃO ).
A administração concomitante de lisinopril e hidroclorotiazida tem pouco ou nenhum efeito sobre a biodisponibilidade de qualquer um dos medicamentos. O comprimido combinado é bioequivalente à administração concomitante das entidades separadas.
Lisinopril
Mecanismo de ação
lisinopril inibe a enzima conversora da angiotensina (ECA) em humanos e animais. A ECA é uma peptidil dipeptidase que catalisa a conversão da angiotensina I na substância vasoconstritora, angiotensina II. A angiotensina II também estimula a secreção de aldosterona pelo córtex adrenal. A inibição da ECA resulta na diminuição da angiotensina II plasmática, o que leva à diminuição da atividade vasopressora e à diminuição da secreção de aldosterona. A última diminuição pode resultar em um pequeno aumento do potássio sérico. A remoção do feedback negativo da angiotensina II na secreção de renina leva ao aumento da atividade da renina plasmática. Em pacientes hipertensos com função renal normal tratados apenas com lisinopril por até 24 semanas, o aumento médio do potássio sérico foi inferior a 0,1 mEq/L; no entanto, aproximadamente 15 por cento dos pacientes tiveram aumentos superiores a 0,5 mEq/L e aproximadamente seis por cento tiveram uma diminuição superior a 0,5 mEq/L. No mesmo estudo, os pacientes tratados com lisinopril mais um diurético tiazídico não apresentaram praticamente nenhuma alteração no potássio sérico (consulte PRECAUÇÕES ).
ECA é idêntica à cininase, uma enzima que degrada a bradicinina. Se os níveis aumentados de bradicinina, um potente peptídeo vasodepressor, desempenham um papel nos efeitos terapêuticos do lisinopril ainda não foi elucidado.
Embora se acredite que o mecanismo pelo qual o lisinopril reduz a pressão arterial seja principalmente a supressão do sistema renina-angiotensina-aldosterona, o lisinopril é anti-hipertensivo mesmo em pacientes com hipertensão com baixo teor de renina. Embora o lisinopril tenha sido anti-hipertensivo em todas as raças estudadas, os pacientes hipertensos negros (geralmente uma população hipertensa com baixa renina) tiveram uma resposta média menor à monoterapia com lisinopril do que os pacientes não negros.
Farmacocinética e Metabolismo
Após a administração oral de lisinopril, as concentrações séricas máximas ocorrem em cerca de 7 horas. Concentrações séricas decrescentes exibem uma fase terminal prolongada que não contribui para o acúmulo do fármaco. Esta fase terminal provavelmente representa uma ligação saturável à ECA e não é proporcional à dose. O lisinopril não parece estar ligado a outras proteínas séricas.
O lisinopril não sofre metabolismo e é excretado totalmente inalterado na urina. Com base na recuperação urinária, a extensão média de absorção do lisinopril é de aproximadamente 25 por cento, com grande variabilidade interindividual (6 a 60%) em todas as doses testadas (5 mg a 80 mg). A absorção de lisinopril não é influenciada pela presença de alimentos no trato gastrointestinal.
Em doses múltiplas, o lisinopril exibe uma meia-vida efetiva de acumulação de 12 horas.
função renal prejudicada diminui a eliminação do lisinopril, que é excretado principalmente pelos rins, mas essa diminuição torna-se clinicamente importante apenas quando a taxa de filtração glomerular está abaixo de 30 mL/min. Acima desta taxa de filtração glomerular, a meia-vida de eliminação é pouco alterada. Com maior comprometimento, no entanto, os níveis de pico e vale de lisinopril aumentam, o tempo até a concentração de pico aumenta e o tempo para atingir o estado de equilíbrio é prolongado. Pacientes mais velhos, em média, têm (aproximadamente o dobro) níveis sanguíneos e área sob a curva de concentração plasmática (AUC) mais elevados do que pacientes mais jovens (ver DOSAGEM E ADMINISTRAÇÃO ). Em um estudo farmacocinético de doses múltiplas em pacientes idosos versus jovens hipertensos usando a combinação lisinopril/hidroclorotiazida, a AUC aumentou aproximadamente 120% para lisinopril e aproximadamente 80% para hidroclorotiazida em pacientes idosos. O lisinopril pode ser removido por hemodiálise.
Estudos em ratos indicam que o lisinopril atravessa mal a barreira hematoencefálica. Doses múltiplas de lisinopril em ratos não resultam em acúmulo em nenhum tecido; no entanto, o leite de ratas lactantes contém radioatividade após a administração de 14C lisinopril. Por autorradiografia de corpo inteiro, a radioatividade foi encontrada na placenta após a administração da droga marcada a ratas grávidas, mas nenhuma foi encontrada nos fetos.
Farmacodinâmica
A administração de lisinopril a pacientes com hipertensão resulta na redução da pressão arterial em posição supina e em pé aproximadamente na mesma extensão, sem taquicardia compensatória. Hipotensão postural sintomática geralmente não é observada, embora possa ocorrer e deva ser antecipada em pacientes com depleção de volume e/ou sal (ver AVISOS ).
Na maioria dos pacientes estudados, o início da atividade anti-hipertensiva foi observado uma hora após a administração oral de uma dose individual de lisinopril, com redução máxima da pressão arterial alcançada em seis horas.
Em alguns pacientes, a obtenção da redução ideal da pressão arterial pode exigir duas a quatro semanas de terapia.
Em doses únicas diárias recomendadas, os efeitos anti-hipertensivos foram mantidos por pelo menos 24 horas após a administração, embora o efeito em 24 horas tenha sido substancialmente menor do que o efeito seis horas após a administração.
Os efeitos anti-hipertensivos do lisinopril continuaram durante a terapia de longo prazo. A retirada abrupta de lisinopril não foi associada a um rápido aumento da pressão arterial; nem com um aumento significativo da pressão arterial pré-tratamento.
Em estudos hemodinâmicos em pacientes com hipertensão essencial, a redução da pressão arterial foi acompanhada por uma redução na resistência arterial periférica com pouca ou nenhuma alteração no débito cardíaco e na frequência cardíaca. Em um estudo em nove pacientes hipertensos, após a administração de lisinopril, houve um aumento no fluxo sanguíneo renal médio que não foi significativo. Os dados de vários pequenos estudos são inconsistentes em relação ao efeito do lisinopril na taxa de filtração glomerular em pacientes hipertensos com função renal normal, mas sugerem que as alterações, se houver, não são grandes.
Em doentes com hipertensão renovascular, o lisinopril demonstrou ser bem tolerado e eficaz no controlo da pressão arterial (ver PRECAUÇÕES ).
Hidroclorotiazida
O mecanismo do efeito anti-hipertensivo das tiazidas é desconhecido. As tiazidas geralmente não afetam a pressão arterial normal.
hidroclorotiazida é um diurético e anti-hipertensivo. Afeta o mecanismo tubular renal distal de reabsorção de eletrólitos. A hidroclorotiazida aumenta a excreção de sódio e cloreto em quantidades aproximadamente equivalentes. A natriurese pode ser acompanhada por alguma perda de potássio e bicarbonato.
Após o uso oral, a diurese começa em duas horas, atinge o pico em cerca de quatro horas e dura cerca de 6 a 12 horas.
A hidroclorotiazida não é metabolizada, mas é rapidamente eliminada pelo rim. Quando os níveis plasmáticos foram acompanhados por pelo menos 24 horas, observou-se que a meia-vida plasmática variou entre 5,6 e 14,8 horas. Pelo menos 61 por cento da dose oral é eliminada inalterada em 24 horas. A hidroclorotiazida atravessa a barreira placentária, mas não a barreira hematoencefálica.
INFORMAÇÃO DO PACIENTE
Angioedema
Angioedema, incluindo edema laríngeo, pode ocorrer a qualquer momento durante o tratamento com inibidores da enzima conversora de angiotensina, incluindo ZESTORETIC. Os pacientes devem ser aconselhados e instruídos a relatar imediatamente quaisquer sinais ou sintomas sugestivos de angioedema (inchaço da face, extremidades, olhos, lábios, língua, dificuldade em engolir ou respirar) e não tomar mais medicamento até consultarem o médico prescritor.
Hipotensão sintomática
Os pacientes devem ser alertados para relatar tontura, especialmente durante os primeiros dias de terapia. Se ocorrer síncope real, os pacientes devem ser instruídos a descontinuar o medicamento até consultarem o médico prescritor.
Todos os pacientes devem ser advertidos de que a transpiração excessiva e a desidratação podem levar a uma queda excessiva da pressão arterial devido à redução do volume de líquidos. Outras causas de depleção de volume, como vômitos ou diarreia, também podem levar à queda da pressão arterial; os pacientes devem ser aconselhados a consultar seu médico.
Hipercalemia
Os pacientes devem ser orientados a não usar substitutos do sal contendo potássio sem consultar seu médico.
Leucopenia/neutropenia
Os pacientes devem ser instruídos a relatar imediatamente qualquer indicação de infecção (por exemplo, dor de garganta, febre) que possa ser um sinal de leucopenia/neutropenia.
Gravidez
Pacientes do sexo feminino em idade fértil devem ser informadas sobre as consequências da exposição a ZESTORETIC durante a gravidez. Discuta as opções de tratamento com as mulheres que planejam engravidar. As pacientes devem ser solicitadas a relatar a gravidez aos seus médicos o mais rápido possível.
NOTA: Tal como acontece com muitos outros medicamentos, é necessário aconselhar certos pacientes em tratamento com ZESTORETIC 12,5gmg. Esta informação destina-se a auxiliar no uso seguro e eficaz deste medicamento. Não é uma divulgação de todos os possíveis efeitos adversos ou pretendidos.
