Avapro 150mg, 300mg Irbesartan Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Avapro 300mg e como é usado?
Avapro 300mg é um medicamento de prescrição usado para tratar os sintomas da pressão alta (hipertensão), dor nos nervos causada pelo diabetes tipo 2. Avapro pode ser usado sozinho ou com outros medicamentos.
Avapro 300mg pertence a uma classe de medicamentos BRA.
Não se sabe se Avapro 150mg é seguro e eficaz em crianças menores de 6 anos de idade.
Quais são os possíveis efeitos colaterais do Avapro 300mg?
Avapro pode causar efeitos colaterais graves, incluindo:
- dores musculares inexplicáveis,
- ternura ou fraqueza,
- febre,
- cansaço incomum,
- urina de cor escura,
- tontura,
- pouca ou nenhuma micção,
- inchaço,
- ganho de peso rápido,
- confusão,
- perda de apetite,
- vômito, e
- dor no seu lado ou na parte inferior das costas
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Avapro incluem:
- diarréia,
- azia,
- dor de estômago, e
- sensação de cansaço
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Avapro. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
AVISO
TOXICIDADE FETAL
- Quando a gravidez for detectada, interrompa o AVAPRO o mais rápido possível.
- Drogas que atuam diretamente no sistema renina-angiotens podem causar lesões e morte ao feto em desenvolvimento [ver ADVERTÊNCIAS E PRECAUÇÕES].
DESCRIÇÃO
AVAPRO (irbesartan) é um antagonista do receptor da angiotensina II (subtipo AT1).
Irbesartan é um composto não peptídico, quimicamente descrito como um 2-butil-3-[p-(o-1H-tetrazol-5-ilfenil)benzil]-1,3-diazaspiro[4.4]non-1-en-4 -1.
Sua fórmula empírica é C25H28N6O, e a fórmula estrutural:
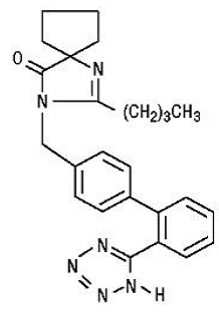
O irbesartan é um pó cristalino branco a esbranquiçado com um peso molecular de 428,5. É um composto apolar com coeficiente de partição (octanol/água) de 10,1 em pH de 7,4. O irbesartan é ligeiramente solúvel em álcool e cloreto de metileno e praticamente insolúvel em água.
AVAPRO está disponível para administração oral em comprimidos não sulcados contendo 75 mg, 150 mg ou 300 mg de irbesartan. Os ingredientes inativos incluem: lactose, celulose microcristalina, amido pré-gelatinizado, croscarmelose sódica, poloxâmero 188, dióxido de silício e estearato de magnésio.
INDICAÇÕES
Hipertensão
AVAPRO® é indicado para o tratamento da hipertensão, para baixar a pressão arterial. A redução da pressão arterial reduz o risco de eventos cardiovasculares (CV) fatais e não fatais, principalmente acidentes vasculares cerebrais e infarto do miocárdio. Esses benefícios foram observados em ensaios controlados de medicamentos anti-hipertensivos de uma ampla variedade de classes farmacológicas, incluindo esse medicamento.
controle da hipertensão arterial deve fazer parte do gerenciamento abrangente do risco cardiovascular, incluindo, conforme apropriado, controle lipídico, controle do diabetes, terapia antitrombótica, cessação do tabagismo, exercícios e ingestão limitada de sódio. Muitos pacientes precisarão de mais de 1 medicamento para atingir as metas de pressão arterial. Para obter conselhos específicos sobre metas e gerenciamento, consulte as diretrizes publicadas, como as do Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) do National High Blood Pressure Education Program.
Numerosos medicamentos anti-hipertensivos, de várias classes farmacológicas e com diferentes mecanismos de ação, têm demonstrado em ensaios clínicos randomizados reduzir a morbimortalidade cardiovascular, podendo-se concluir que é a redução da pressão arterial, e não alguma outra propriedade farmacológica do medicamento. os medicamentos, que é o grande responsável por esses benefícios. O maior e mais consistente benefício de resultado cardiovascular tem sido a redução do risco de acidente vascular cerebral, mas reduções no infarto do miocárdio e na mortalidade cardiovascular também foram observadas regularmente.
pressão sistólica ou diastólica elevada causa aumento do risco cardiovascular, e o aumento do risco absoluto por mmHg é maior em pressões sanguíneas mais altas, de modo que mesmo reduções modestas da hipertensão grave podem proporcionar benefícios substanciais. A redução do risco relativo da redução da pressão arterial é semelhante em populações com risco absoluto variável, portanto, o benefício absoluto é maior em pacientes que estão em maior risco independentemente de sua hipertensão (por exemplo, pacientes com diabetes ou hiperlipidemia), e esses pacientes seriam esperados beneficiar de um tratamento mais agressivo para uma meta de pressão arterial mais baixa.
Alguns medicamentos anti-hipertensivos têm efeitos menores na pressão arterial (como monoterapia) em pacientes negros, e muitos medicamentos anti-hipertensivos têm indicações e efeitos adicionais aprovados (por exemplo, na angina, insuficiência cardíaca ou doença renal diabética). Essas considerações podem orientar a seleção da terapia.
AVAPRO 300mg pode ser usado sozinho ou em combinação com outros agentes anti-hipertensivos.
Nefropatia em pacientes diabéticos tipo 2
AVAPRO é indicado para o tratamento da nefropatia diabética em pacientes com diabetes tipo 2 e hipertensão, creatinina sérica elevada e proteinúria (> 300 mg/dia). Nesta população, AVAPRO reduz a taxa de progressão da nefropatia medida pela ocorrência de duplicação da creatinina sérica ou doença renal terminal (necessidade de diálise ou transplante renal) [ver Estudos clínicos ].
DOSAGEM E ADMINISTRAÇÃO
considerações gerais
AVAPRO pode ser administrado com outros agentes anti-hipertensivos e com ou sem alimentos.
Hipertensão
A dose inicial recomendada de AVAPRO 300mg é de 150mg uma vez ao dia. A dosagem pode ser aumentada para uma dose máxima de 300 mg uma vez ao dia, conforme necessário para controlar a pressão arterial [ver Estudos clínicos ].
Nefropatia em pacientes diabéticos tipo 2
A dose recomendada é de 300 mg uma vez ao dia [ver Estudos clínicos ].
Ajuste de dose em pacientes com depleção de sal e volume
A dose inicial recomendada é de 75 mg uma vez ao dia em pacientes com depleção do volume intravascular ou sal (por exemplo, pacientes tratados vigorosamente com diuréticos ou em hemodiálise). AVISOS E PRECAUÇÕES ].
COMO FORNECIDO
Formas de dosagem e pontos fortes
AVAPRO 75 mg é um comprimido revestido por película branco a esbranquiçado, oval, biconvexo, gravado com um coração de um lado e “2871” do outro.
AVAPRO 150 mg é um comprimido revestido por película branco a esbranquiçado, oval, biconvexo, gravado com um coração de um lado e “2872” do outro.
AVAPRO 300 mg é um comprimido revestido por película branco a esbranquiçado, oval, biconvexo, gravado com um coração de um lado e “2873” do outro.
Armazenamento e manuseio
AVAPRO (irbesartan) está disponível na forma de comprimidos revestidos por película brancos a esbranquiçados, ovais, biconvexos, gravados com a forma de um coração numa das faces e um código na outra (ver Tabela abaixo). Os frascos de unidade de uso contêm 30 ou 90 comprimidos revestidos por película da seguinte forma:
Armazenar a 25°C (77°F); excursões permitidas para 15°C-30°C (59°F-86°F) [ver Temperatura ambiente controlada USP ].
sanofi-aventis US LLC, Bridgewater, NJ 08807, A SANOFI COMPANY. Revisado: setembro de 2021
EFEITOS COLATERAIS
As seguintes reações adversas importantes são descritas em outras partes da bula:
- Hipotensão em Pacientes com Depleção de Sal ou Volume [ver AVISOS E PRECAUÇÕES ]
- Função Renal Prejudicada [ver AVISOS E PRECAUÇÕES ]
Experiência de Ensaios Clínicos
Como os ensaios clínicos são conduzidos em condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática. As informações de reações adversas de ensaios clínicos, no entanto, fornecem uma base para identificar os eventos adversos que parecem estar relacionados ao uso de medicamentos e para aproximar as taxas.
Hipertensão
AVAPRO foi avaliado quanto à segurança em mais de 4.300 pacientes com hipertensão e cerca de 5.000 indivíduos em geral. Esta experiência inclui 1.303 pacientes tratados por mais de 6 meses e 407 pacientes por 1 ano ou mais.
Em ensaios clínicos controlados com placebo, as seguintes reações adversas foram relatadas em pelo menos 1% dos pacientes tratados com AVAPRO (n=1965) e com maior incidência versus placebo (n=641), excluindo aquelas muito gerais para serem informativas e aquelas não razoavelmente associados ao uso de medicamento porque estavam associados à condição em tratamento ou são muito comuns na população tratada, incluem: diarreia (3% vs 2%), dispepsia/azia (2% vs 1%) e fadiga (4% vs 3%).
O uso de irbesartana não foi associado a um aumento da incidência de tosse seca, como é tipicamente associado ao uso de inibidores da ECA. Em estudos controlados com placebo, a incidência de tosse em pacientes tratados com irbesartana foi de 2,8% versus 2,7% em pacientes que receberam placebo.
Nefropatia em pacientes diabéticos tipo 2
Hipercalemia
No Irbesartan Diabetic Nephropathy Trial (IDNT) (proteinúria ≥900 mg/dia e creatinina sérica variando de 1,0-3,0 mg/dL), a porcentagem de pacientes com potássio >6 mEq/L foi de 18,6% no grupo AVAPRO 300mg versus 6,0% no grupo placebo. As interrupções devido à hipercalemia no grupo AVAPRO 150mg foram 2,1% versus 0,4% no grupo placebo.
No IDNT, as reações adversas foram semelhantes às observadas em pacientes com hipertensão, com exceção do aumento da incidência de sintomas ortostáticos que ocorreram com mais frequência no grupo AVAPRO 150mg versus placebo: tontura (10,2% vs 6,0%), tontura ortostática (5,4 % vs 2,7%) e hipotensão ortostática (5,4% vs 3,2%).
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de AVAPRO. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Urticária; angioedema (envolvendo inchaço da face, lábios, faringe e/ou língua); reação anafilática incluindo choque anafilático; aumento dos testes de função hepática; icterícia; hepatite; hipercalemia; anemia; trombocitopenia; CPK aumentada; zumbido; e hipoglicemia em pacientes diabéticos.
INTERAÇÕES MEDICAMENTOSAS
Agentes que aumentam o potássio sérico
A coadministração de AVAPRO com outros medicamentos que elevam os níveis séricos de potássio pode resultar em hipercalemia, algumas vezes grave. Monitorar o potássio sérico nesses pacientes.
Lítio
Aumentos nas concentrações séricas de lítio e toxicidade do lítio foram relatados com o uso concomitante de irbesartana e lítio. Monitorar os níveis de lítio em pacientes recebendo irbesartana e lítio.
Anti-inflamatórios não esteroides (AINEs), incluindo inibidores seletivos da ciclooxigenase-2 (inibidores da COX-2)
Em pacientes idosos, com depleção de volume (incluindo aqueles em terapia diurética) ou com função renal comprometida, a coadministração de AINEs, incluindo inibidores seletivos da COX-2, com antagonistas dos receptores da angiotensina II (incluindo irbesartana) pode resultar em deterioração da função renal , incluindo possível insuficiência renal aguda. Estes efeitos são geralmente reversíveis. Monitorar a função renal periodicamente em pacientes recebendo terapia com irbesartana e AINEs.
O efeito anti-hipertensivo dos antagonistas dos receptores da angiotensina II, incluindo o irbesartan, pode ser atenuado por AINEs, incluindo inibidores seletivos da COX-2.
Duplo bloqueio do sistema renina-angiotensina (RAS)
bloqueio duplo do SRA com bloqueadores dos receptores da angiotensina, inibidores da ECA ou alisquireno está associado a riscos aumentados de hipotensão, hipercalemia e alterações na função renal (incluindo insuficiência renal aguda) em comparação com a monoterapia. A maioria dos pacientes que recebem a combinação de dois inibidores do RAS não obtém nenhum benefício adicional em comparação com a monoterapia. Em geral, evite o uso combinado de inibidores do RAS. Monitore de perto a pressão arterial, função renal e eletrólitos em pacientes em uso de AVAPRO 150mg e outros agentes que afetam o RAS.
Não coadministre alisquireno com AVAPRO em pacientes com diabetes. Evite o uso de alisquireno com AVAPRO em pacientes com insuficiência renal (TFG
AVISOS
Incluído como parte do PRECAUÇÕES seção.
PRECAUÇÕES
Toxicidade Fetal
AVAPRO 150mg pode causar dano fetal quando administrado a uma mulher grávida. O uso de drogas que atuam no sistema reninangiotensina durante o segundo e terceiro trimestres de gestação reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal. O oligoidrâmnio resultante pode estar associado a hipoplasia pulmonar fetal e deformações esqueléticas. Os potenciais efeitos adversos neonatais incluem hipoplasia do crânio, anúria, hipotensão, insuficiência renal e morte. Quando a gravidez for detectada, interrompa o AVAPRO assim que possível [ver Uso em populações específicas ].
Hipotensão em volume ou pacientes com depleção de sal
Em pacientes com um sistema renina-angiotensina ativado, como pacientes com depleção de sal ou volume (por exemplo, aqueles que estão sendo tratados com altas doses de diuréticos), pode ocorrer hipotensão sintomática após o início do tratamento com AVAPRO. Corrija o volume ou a depleção de sal antes da administração de AVAPRO 300mg ou use uma dose inicial mais baixa [ver DOSAGEM E ADMINISTRAÇÃO ].
Função Renal Prejudicada
Alterações na função renal, incluindo insuficiência renal aguda, podem ser causadas por drogas que inibem o sistema renina-angiotensina. Pacientes cuja função renal pode depender em parte da atividade do sistema renina-angiotensina (p. na AVAPRO. Monitore a função renal periodicamente nesses pacientes. Considere suspender ou descontinuar a terapia em pacientes que desenvolvem uma diminuição clinicamente significativa da função renal com AVAPRO [ver INTERAÇÕES MEDICAMENTOSAS ].
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Nenhuma evidência de carcinogenicidade foi observada quando o irbesartan foi administrado em doses de até 500/1000 mg/kg/dia (machos/fêmeas, respectivamente) em ratos e 1000 mg/kg/dia em camundongos por até 2 anos. Para ratos machos e fêmeas, 500 mg/kg/dia proporcionaram uma exposição sistêmica média ao irbesartan (AUC 0-24 horas, ligado e não ligado) cerca de 3 e 11 vezes, respectivamente, a exposição sistêmica média em humanos recebendo a dose máxima recomendada para humanos. (MRHD) de 300 mg de irbesartana/dia, enquanto 1.000 mg/kg/dia (administrado apenas para mulheres) proporcionou uma exposição sistêmica média cerca de 21 vezes maior do que a relatada para humanos na MRHD. Para camundongos machos e fêmeas, 1.000 mg/kg/dia proporcionaram uma exposição ao irbesartan cerca de 3 e 5 vezes, respectivamente, a exposição humana a 300 mg/dia.
irbesartana não foi mutagênica em uma bateria de testes in vitro (teste microbiano de Ames, teste de reparo de DNA de hepatócitos de rato, ensaio de mutação genética direta em células de mamíferos V79). O irbesartan foi negativo em vários testes para indução de aberrações cromossômicas (in vitro – ensaio de linfócitos humanos; in vivo – estudo de micronúcleo em camundongo).
O irbesartan não teve efeitos adversos na fertilidade ou acasalamento de ratos machos ou fêmeas em doses orais ≤ 650 mg/kg/dia, a dose mais alta proporcionando uma exposição sistêmica ao irbesartan (AUC 0-24 horas, ligado e não ligado) cerca de 5 vezes maior que encontrado em humanos recebendo a MRHD de 300 mg/dia.
Uso em populações específicas
Gravidez
Resumo do risco
AVAPRO pode causar dano fetal quando administrado a uma mulher grávida. O uso de drogas que atuam no sistema reninangiotensina durante o segundo e terceiro trimestres da gravidez reduz a função renal fetal e aumenta a morbidade e morte fetal e neonatal [ver Considerações Clínicas ]. A maioria dos estudos epidemiológicos examinando anormalidades fetais após exposição ao uso de anti-hipertensivos no primeiro trimestre não distinguiu drogas que afetam o sistema renina-angiotensina de outros agentes anti-hipertensivos. Quando a gravidez for detectada, descontinue AVAPRO 150mg o mais rápido possível.
Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos, independentemente da exposição ao medicamento. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Considerações Clínicas
Risco Materno e/ou Embrio-Fetal Associado à Doença
hipertensão na gravidez aumenta o risco materno de pré-eclâmpsia, diabetes gestacional, parto prematuro e complicações no parto (por exemplo, necessidade de cesariana e hemorragia pós-parto). A hipertensão aumenta o risco fetal de restrição de crescimento intrauterino e morte intrauterina. Mulheres grávidas com hipertensão devem ser cuidadosamente monitoradas e tratadas adequadamente.
Reações Adversas Fetais/Neonatais
Oligoidrâmnio em mulheres grávidas que usam drogas que afetam o sistema renina-angiotensina no segundo e terceiro trimestres de gravidez pode resultar no seguinte: redução da função renal fetal levando a anúria e insuficiência renal, hipoplasia pulmonar fetal, deformações esqueléticas, incluindo hipoplasia do crânio, hipotensão , e morte.
No caso incomum de não haver alternativa adequada à terapia com medicamentos que afetem o sistema renina-angiotensina para um paciente em particular, informar a mãe sobre o risco potencial para o feto.
Realizar exames ultrassonográficos seriados para avaliar o ambiente intra-amniótico. O teste fetal pode ser apropriado, com base na semana de gravidez. Pacientes e médicos devem estar cientes, entretanto, de que o oligoidrâmnio pode não aparecer até que o feto tenha sofrido lesão irreversível. Se for observado oligoidrâmnio, considerar tratamento alternativo. Observe atentamente os bebês com histórico de exposição in utero ao AVAPRO para hipotensão, oligúria e hipercalemia e outros sintomas de insuficiência renal. Em recém-nascidos com história de exposição in utero a AVAPRO 300mg, se ocorrer oligúria ou hipotensão, direcione a atenção para o suporte da pressão arterial e perfusão renal. A exsanguineotransfusão ou diálise pode ser necessária como meio de reverter a hipotensão e/ou substituir a função renal desordenada.
Dados
Dados de animais
Irbesartan atravessa a placenta em ratos e coelhos. Em ratas que receberam irbesartana antes do acasalamento durante a gestação e lactação em doses orais de 50, 180 ou 650 mg/kg/dia (1,6 a 21,1 vezes a dose humana máxima recomendada (MRHD) com base na área de superfície corporal), os fetos examinados O dia 20 de gestação mostrou incidências aumentadas de hidroureter e cavitação pélvica renal e/ou ausência de papila renal em todos os grupos tratados com irbesartana. Edema subcutâneo também ocorreu em fetos em doses maternas ≥180 mg/kg/dia (5,8 vezes a MRHD). Essas anomalias ocorreram quando as ratas receberam irbesartana desde antes do acasalamento até o dia 20 de gestação, mas não foram observadas em filhotes pós-natal no mesmo estudo, ou quando a irbesartana foi administrada a ratas grávidas apenas durante a organogênese (Dia 6 de Gestação até o Dia 15 de Gestação) no doses orais de 50 a 450 mg/kg/dia (até 14,6 vezes a MRHD). Além disso, nenhum efeito adverso no desenvolvimento renal foi observado em filhotes de mães que receberam irbesartana do 15º dia de gestação até o 24º dia de lactação em doses de 50, 180 ou 650 mg/kg/dia (até 21,1 vezes o MRHD). Acredita-se que os efeitos observados sejam efeitos gestacionais tardios da droga. Coelhas grávidas que receberam doses orais de irbesartana de 30 mg/kg/dia (1,9 vezes a MRHD com base na área de superfície corporal) apresentaram uma alta taxa de mortalidade materna e aborto. As fêmeas sobreviventes tiveram um ligeiro aumento nas reabsorções precoces e uma diminuição correspondente nos fetos vivos.
radioatividade estava presente nos fetos de ratos e coelhos durante o final da gestação após doses orais de irbesartana radiomarcada.
Lactação
Não há dados disponíveis sobre a presença de irbesartana no leite humano, efeitos na produção de leite ou no lactente. O irbesartan ou algum metabólito do irbesartan é secretado no leite de ratas lactantes [ver FARMACOLOGIA CLÍNICA ]. Devido ao potencial de efeitos adversos no lactente, o uso de AVAPRO 150mg em mulheres que amamentam não é recomendado.
Uso Pediátrico
A irbesartana, em um estudo com uma dose de até 4,5 mg/kg/dia, uma vez ao dia, não pareceu reduzir a pressão arterial de forma eficaz em pacientes pediátricos com idades entre 6 e 16 anos.
AVAPRO não foi estudado em pacientes pediátricos com menos de 6 anos de idade.
Uso Geriátrico
Dos 4.925 indivíduos que receberam AVAPRO em estudos clínicos controlados de hipertensão, 911 (18,5%) tinham 65 anos ou mais, enquanto 150 (3,0%) tinham 75 anos ou mais. Não foram observadas diferenças globais na eficácia ou segurança entre estes indivíduos e indivíduos mais jovens, mas não se pode excluir uma maior sensibilidade de alguns indivíduos mais velhos. [Ver FARMACOLOGIA CLÍNICA e Estudos clínicos ]
SOBREDOSAGEM
Não há dados disponíveis sobre superdosagem em humanos. No entanto, doses diárias de 900 mg por 8 semanas foram bem toleradas. Espera-se que as manifestações mais prováveis de superdosagem sejam hipotensão e taquicardia; bradicardia também pode ocorrer por overdose. O irbesartan não é removido por hemodiálise.
Estudos de toxicidade oral aguda com irbesartana em camundongos e ratos indicaram que as doses letais agudas foram superiores a 2.000 mg/kg, cerca de 25 vezes e 50 vezes a MRHD (300 mg) com base na área de superfície corporal, respectivamente.
CONTRA-INDICAÇÕES
AVAPRO 150mg é contraindicado em pacientes hipersensíveis a qualquer componente deste produto.
Não coadministrar alisquireno com AVAPRO 300mg em pacientes com diabetes.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
A angiotensina II é um potente vasoconstritor formado a partir da angiotensina I em uma reação catalisada pela enzima conversora da angiotensina (ECA, cininase II). A angiotensina II é o principal hormônio vasoativo do sistema reninangiotensina e um importante componente na fisiopatologia da hipertensão. Também estimula a secreção de aldosterona pelo córtex adrenal. A irbesartana bloqueia os efeitos vasoconstritores e secretores de aldosterona da angiotensina II por meio da ligação seletiva ao receptor AT1 da angiotensina II encontrado em muitos tecidos (p. ex., músculo liso vascular, glândula adrenal). Há também um receptor AT2 em muitos tecidos, mas não está envolvido na homeostase cardiovascular.
A irbesartana é um antagonista competitivo específico dos receptores AT1 com afinidade muito maior (mais de 8.500 vezes) para o receptor AT1 do que para o receptor AT2 e sem atividade agonista.
bloqueio do receptor AT1 remove o feedback negativo da angiotensina II sobre a secreção de renina, mas o resultante aumento da atividade da renina plasmática e da angiotensina II circulante não superam os efeitos do irbesartan na pressão arterial.
A irbesartana não inibe a ECA ou a renina nem afeta outros receptores hormonais ou canais iônicos conhecidos por estarem envolvidos na regulação cardiovascular da pressão arterial e na homeostase do sódio.
Farmacodinâmica
Em indivíduos saudáveis, doses orais únicas de irbesartana de até 300 mg produziram inibição dose-dependente do efeito pressor das infusões de angiotensina II. A inibição foi completa (100%) 4 horas após doses orais de 150 mg ou 300 mg e a inibição parcial foi mantida por 24 horas (60% e 40% em 300 mg e 150 mg, respectivamente).
Em pacientes hipertensos, a inibição do receptor de angiotensina II após administração crônica de irbesartana causa um aumento de 1,5 a 2 vezes na concentração plasmática de angiotensina II e um aumento de 2 a 3 vezes nos níveis de renina plasmática. As concentrações plasmáticas de aldosterona geralmente diminuem após a administração de irbesartana, mas os níveis séricos de potássio não são significativamente afetados nas doses recomendadas.
Em pacientes hipertensos, doses orais crônicas de irbesartana (até 300 mg) não tiveram efeito sobre a taxa de filtração glomerular, fluxo plasmático renal ou fração de filtração. Em estudos de dose múltipla em pacientes hipertensos, não houve efeitos clinicamente importantes nas concentrações de triglicerídeos em jejum, colesterol total ou HDL-colesterol. Não houve efeito no ácido úrico sérico durante a administração oral crônica e nenhum efeito uricosúrico.
Farmacocinética
Absorção
absorção oral do irbesartan é rápida e completa com uma biodisponibilidade absoluta média de 60% a 80%. Após a administração oral de AVAPRO, as concentrações plasmáticas máximas de irbesartana são atingidas 1,5 a 2 horas após a administração. Os alimentos não afetam a biodisponibilidade do irbesartan.
O irbesartan apresenta farmacocinética linear ao longo do intervalo de dose terapêutica.
Distribuição
O irbesartan liga-se 90% às proteínas séricas (principalmente albumina e α-glicoproteína ácida) com ligação insignificante aos componentes celulares do sangue. O volume médio de distribuição é de 53 a 93 litros.
Estudos em animais indicam que o irbesartan radiomarcado atravessa fracamente a barreira hematoencefálica e a placenta. O irbesartan é excretado no leite de ratas lactantes.
Eliminação
As depurações plasmática e renal totais estão na faixa de 157 a 176 mL/min e 3,0 a 3,5 mL/min, respectivamente. A meia-vida de eliminação terminal do irbesartan é em média de 11 a 15 horas. As concentrações no estado estacionário são alcançadas em 3 dias. A acumulação limitada de irbesartan (
Metabolismo
O irbesartan é um agente ativo por via oral que não requer biotransformação em uma forma ativa. A irbesartana é metabolizada por conjugação e oxidação de glicuronídeos. Após a administração oral ou intravenosa de Clabeled irbesartan, mais de 80% da radioatividade plasmática circulante é atribuível ao irbesartan inalterado. O metabólito circulante primário é o conjugado inativo de irbesartana glicuronídeo (aproximadamente 6%). Os metabólitos oxidativos restantes não aumentam significativamente a atividade farmacológica do irbesartan.
Estudos in vitro indicam que o irbesartan é oxidado principalmente pelo CYP2C9; metabolismo pelo CYP3A4 é insignificante.
Excreção
A irbesartana e seus metabólitos são excretados pelas vias biliar e renal. Após a administração oral ou intravenosa de irbesartana marcada com 14C, cerca de 20% da radioatividade é recuperada na urina e o restante nas fezes, como irbesartana ou irbesartana glicuronídeo.
Populações Específicas
Sexo
Não foram observadas diferenças na farmacocinética relacionadas com o sexo em indivíduos idosos saudáveis (idade 65-80 anos) ou em indivíduos jovens saudáveis (idade 18-40 anos). Em estudos de pacientes hipertensos, não há diferença sexual na meia-vida ou acúmulo, mas concentrações plasmáticas um pouco mais altas de irbesartana são observadas em mulheres (11%-44%). Não é necessário ajuste de dose relacionado ao sexo.
Geriatria
Em indivíduos idosos (65-80 anos), a meia-vida de eliminação do irbesartan não é significativamente alterada, mas os valores de AUC e Cmax são cerca de 20% a 50% maiores do que os de indivíduos jovens (18-40 anos). Não é necessário ajuste de dose em idosos.
Raça/etnia
Em indivíduos negros saudáveis, os valores de AUC do irbesartan são aproximadamente 25% superiores aos dos brancos; não há diferença nos valores de Cmax.
Insuficiência renal
A farmacocinética da irbesartana não é alterada em pacientes com insuficiência renal ou em pacientes em hemodiálise. O irbesartan não é removido por hemodiálise. Nenhum ajuste de dose é necessário em pacientes com insuficiência renal leve a grave, a menos que um paciente com insuficiência renal também esteja com depleção de volume [ver AVISOS E PRECAUÇÕES e DOSAGEM E ADMINISTRAÇÃO ].
Insuficiência Hepática
A farmacocinética da irbesartana após administração oral repetida não é significativamente afetada em pacientes com cirrose hepática leve a moderada. Não é necessário ajuste de dose em pacientes com insuficiência hepática.
Interações Medicamentosas
Os estudos in vitro mostram uma inibição significativa da formação de metabolitos oxidados de irbesartan com os conhecidos substratos/inibidores do citocromo CYP2C9 sulfenazol, tolbutamida e nifedipina. No entanto, em estudos clínicos, as consequências do irbesartan concomitante na farmacodinâmica da varfarina foram negligenciáveis. Com base em dados in vitro, nenhuma interação seria esperada com medicamentos cujo metabolismo depende das isoenzimas 1A1, 1A2, 2A6, 2B6, 2D6, 2E1 ou 3A4 do citocromo P450.
Em estudos separados de pacientes recebendo doses de manutenção de varfarina, hidroclorotiazida ou digoxina, a administração de irbesartana por 7 dias não teve efeito na farmacodinâmica da varfarina (tempo de protrombina) ou na farmacocinética da digoxina. A farmacocinética do irbesartan não é afetada pela coadministração de nifedipina ou hidroclorotiazida.
Estudos clínicos
Hipertensão
Os efeitos anti-hipertensivos do AVAPRO foram examinados em 7 estudos controlados por placebo de 8 a 12 semanas em pacientes com pressão arterial diastólica basal de 95 a 110 mmHg. Doses de 1 a 900 mg foram incluídas nesses estudos para explorar completamente a faixa de dose do irbesartan. Esses estudos permitiram a comparação de regimes de uma ou duas vezes ao dia de 150 mg/dia, comparações de efeitos de pico e vale e comparações de resposta por sexo, idade e raça. Dois dos sete ensaios controlados por placebo identificados acima examinaram os efeitos anti-hipertensivos do irbesartan e da hidroclorotiazida em combinação.
Os 7 estudos de monoterapia com irbesartana incluíram um total de 1.915 pacientes randomizados para irbesartana (1-900 mg) e 611 pacientes randomizados para placebo. Doses uma vez ao dia de 150 mg e 300 mg forneceram reduções estatisticamente e clinicamente significativas na pressão arterial sistólica e diastólica com efeitos mínimos (24 horas após a dose) após 6 a 12 semanas de tratamento em comparação com placebo, de cerca de 8-10/ 5–6 mmHg e 8–12/5–8 mmHg, respectivamente. Nenhum aumento adicional no efeito foi observado em dosagens superiores a 300 mg. As relações dose-resposta para efeitos na pressão sistólica e diastólica são mostradas nas Figuras 1 e 2.
Figura 1: Redução subtraída do placebo no vale SeSBP; análise integrada
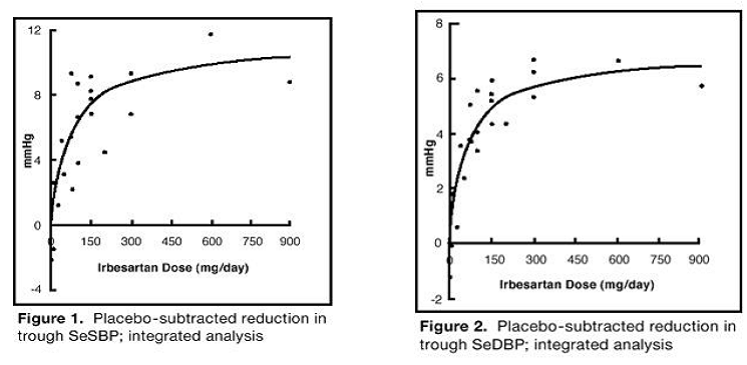
Figura 2: Redução subtraída de placebo no vale SeSBP; análise integrada
administração de doses terapêuticas de irbesartana uma vez ao dia produziu efeitos máximos em torno de 3 a 6 horas e, em um estudo de monitoramento ambulatorial da pressão arterial, novamente em torno de 14 horas. Isso foi observado com a dosagem de uma vez ao dia e duas vezes ao dia. As razões de vale-pico para resposta sistólica e diastólica foram geralmente entre 60% e 70%. Em um estudo de monitoramento ambulatorial contínuo da pressão arterial, a administração de 150 mg uma vez ao dia deu respostas mínimas e médias de 24 horas semelhantes às observadas em pacientes que receberam a administração de duas vezes ao dia na mesma dose diária total.
Em estudos controlados, a adição de irbesartana a doses de hidroclorotiazida de 6,25 mg, 12,5 mg ou 25 mg produziu reduções adicionais relacionadas à dose na pressão arterial semelhantes àquelas alcançadas com a mesma dose de monoterapia de irbesartana. HCTZ também teve um efeito aproximadamente aditivo.
análise dos subgrupos de idade, sexo e raça de pacientes mostrou que homens e mulheres, e pacientes acima e abaixo de 65 anos de idade, tiveram respostas geralmente semelhantes. O irbesartan foi eficaz na redução da pressão arterial independentemente da raça, embora o efeito tenha sido um pouco menor em negros (geralmente uma população com baixo teor de renina).
O efeito do irbesartan é aparente após a primeira dose e está próximo do seu efeito total observado em 2 semanas. Ao final de uma exposição de 8 semanas, cerca de 2/3 do efeito anti-hipertensivo ainda estava presente uma semana após a última dose. Hipertensão rebote não foi observada. Não houve essencialmente nenhuma alteração na frequência cardíaca média em pacientes tratados com irbesartana em estudos controlados.
Nefropatia em pacientes diabéticos tipo 2
Irbesartan Diabetic Nephropathy Trial (IDNT) foi um estudo multicêntrico, duplo-cego, randomizado, controlado por placebo e ativo, conduzido em todo o mundo em 1.715 pacientes com diabetes tipo 2, hipertensão (SeSBP > 135 mmHg ou SeDBP > 85 mmHg) e nefropatia (sérica creatinina 1,0 a 3,0 mg/dL em mulheres ou 1,2 a 3,0 mg/dL em homens e proteinúria ≥900 mg/dia). Os pacientes foram randomizados para receber AVAPRO 75 mg, amlodipina 2,5 mg ou placebo correspondente uma vez ao dia. Os pacientes foram titulados para uma dose de manutenção de AVAPRO 300 mg ou amlodipina 10 mg, conforme tolerado. Agentes anti-hipertensivos adicionais (excluindo inibidores da ECA, antagonistas dos receptores da angiotensina II e bloqueadores dos canais de cálcio) foram adicionados conforme necessário para atingir a meta de pressão arterial (≤ 135/85 ou redução de 10 mmHg na pressão arterial sistólica se superior a 160 mmHg) para pacientes em todos os grupos .
população do estudo era 66,5% do sexo masculino, 72,9% abaixo de 65 anos de idade e 72% de brancos (asiáticos/ilhas do Pacífico 5,0%, negros 13,3%, hispânicos 4,8%). As pressões arteriais sistólica e diastólica médias na linha de base foram de 159 mmHg e 87 mmHg, respectivamente. Os pacientes entraram no estudo com creatinina sérica média de 1,7 mg/dL e proteinúria média de 4.144 mg/dia.
A pressão arterial média alcançada foi de 142/77 mmHg para AVAPRO, 142/76 mmHg para amlodipina e 145/79 mmHg para placebo. No geral, 83,0% dos pacientes receberam a dose alvo de irbesartana em mais de 50% das vezes. Os pacientes foram acompanhados por uma duração média de 2,6 anos.
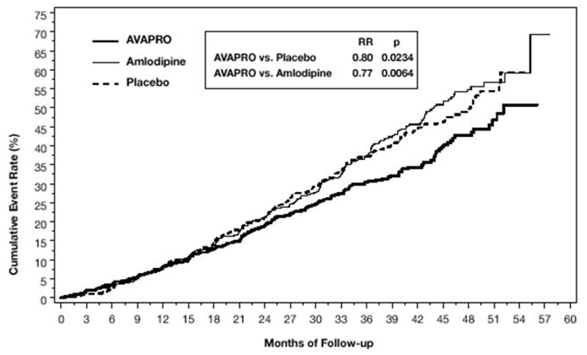
desfecho composto primário foi o tempo até a ocorrência de qualquer um dos seguintes eventos: duplicação da creatinina sérica basal, doença renal terminal (ESRD; definida por creatinina sérica ≥6 mg/dL, diálise ou transplante renal) ou morte . O tratamento com AVAPRO 150mg resultou em uma redução de risco de 20% versus placebo (p=0,0234) (ver Figura 3 e Tabela 1). O tratamento com AVAPRO 150mg também reduziu a ocorrência de duplicação sustentada da creatinina sérica como desfecho separado (33%), mas não teve efeito significativo somente na DRT e nenhum efeito na mortalidade geral (ver Tabela 1).
Figura 3: IDNT: Estimativas de Kaplan-Meier do desfecho primário (duplicação da creatinina sérica, doença renal terminal ou mortalidade por todas as causas)
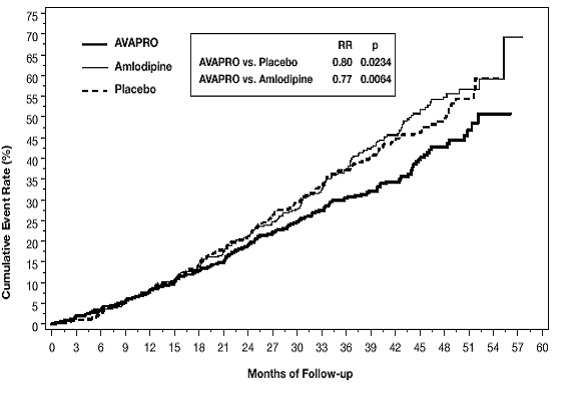
As porcentagens de pacientes que experimentaram um evento durante o curso do estudo podem ser vistas na Tabela 1 abaixo:
desfecho secundário do estudo foi um composto de mortalidade e morbidade cardiovascular (infarto do miocárdio, hospitalização por insuficiência cardíaca, acidente vascular cerebral com déficit neurológico permanente, amputação). Não houve diferenças estatisticamente significativas entre os grupos de tratamento nestes parâmetros. Comparado com placebo, AVAPRO 150mg reduziu significativamente a proteinúria em cerca de 27%, um efeito que ficou evidente dentro de 3 meses após o início da terapia. AVAPRO reduziu significativamente a taxa de perda da função renal (taxa de filtração glomerular), medida pelo recíproco da concentração de creatinina sérica, em 18,2%.
Tabela 2 apresenta os resultados para os subgrupos demográficos. As análises de subgrupo são difíceis de interpretar e não se sabe se essas observações representam diferenças verdadeiras ou efeitos do acaso. Para o desfecho primário, os efeitos favoráveis do AVAPRO foram observados em pacientes que também tomavam outros medicamentos anti-hipertensivos (antagonistas dos receptores da angiotensina II, inibidores da enzima de conversão da angiotensina e bloqueadores dos canais de cálcio não foram permitidos), agentes hipoglicemiantes orais e lipídios. agentes redutores.
INFORMAÇÃO DO PACIENTE
Gravidez
Aconselhar as pacientes do sexo feminino em idade fértil sobre as consequências da exposição ao AVAPRO durante a gravidez. Discuta as opções de tratamento com as mulheres que planejam engravidar. As pacientes devem ser solicitadas a relatar a gravidez aos seus médicos o mais rápido possível.
Suplementos de potássio
Aconselhe os pacientes recebendo AVAPRO a não usar suplementos de potássio ou substitutos do sal contendo potássio sem consultar seu médico [ver INTERAÇÕES MEDICAMENTOSAS ].
