Minipress 1mg, 2mg Prazosin Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Minipress e como é usado?
Minipress (cloridrato de prazosina) é um bloqueador alfa-adrenérgico usado para tratar a hipertensão (pressão alta).
Quais são os efeitos colaterais do Minipress 2mg?
Os efeitos colaterais comuns do Minipress 1mg incluem:
- dor de cabeça,
- sonolência,
- cansaço,
- fraqueza,
- visão embaçada,
- náusea,
- vômito,
- diarreia, ou
- constipação à medida que seu corpo se ajusta à medicação
Outros efeitos colaterais do Minipress 2mg incluem:
- tonturas ou tonturas ao levantar-se, especialmente após a primeira dose e logo após tomar uma dose do medicamento durante a primeira semana de tratamento.
Informe o seu médico se sentir efeitos secundários graves de Minipress 1 mg, incluindo batimentos cardíacos rápidos ou acelerados ou palpitações no peito, sensação de desmaio, dificuldade em respirar, inchaço nas mãos ou pés ou uma ereção dolorosa ou que dure 4 horas ou mais.
DESCRIÇÃO
MINIPRESS® (cloridrato de prazosina), um derivado da quinazolina, é o primeiro de uma nova classe química de anti-hipertensivos. É o sal cloridrato de 1-(4-amino-6,7-dimetoxi-2-quinazolinil)-4-(2-furoil)piperazina e sua fórmula estrutural é:
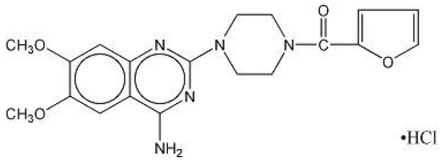
Fórmula molecular C19H21N5O4•HCl
É uma substância branca, cristalina, pouco solúvel em água e solução salina isotônica, com peso molecular de 419,87. Cada cápsula de 1 mg de MINIPRESS para uso oral contém fármaco equivalente a 1 mg de base livre.
Os ingredientes inertes nas formulações são: cápsulas de gelatina dura (que podem conter Blue 1, Red 3, Red 28, Red 40 e outros ingredientes inertes); estearato de magnesio; lauril sulfato de sódio; amido; sacarose.
INDICAÇÕES
MINIPRESS 1mg é indicado para o tratamento da hipertensão, para baixar a pressão arterial. A redução da pressão arterial reduz o risco de eventos cardiovasculares fatais e não fatais, principalmente derrames e infartos do miocárdio. Esses benefícios foram observados em ensaios controlados de medicamentos anti-hipertensivos de uma ampla variedade de classes farmacológicas, incluindo esse medicamento.
controle da hipertensão arterial deve fazer parte do gerenciamento abrangente do risco cardiovascular, incluindo, conforme apropriado, controle lipídico, controle do diabetes, terapia antitrombótica, cessação do tabagismo, exercícios e ingestão limitada de sódio. Muitos pacientes precisarão de mais de um medicamento para atingir as metas de pressão arterial. Para obter conselhos específicos sobre metas e gerenciamento, consulte as diretrizes publicadas, como as do Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) do National High Blood Pressure Education Program.
Numerosos medicamentos anti-hipertensivos, de várias classes farmacológicas e com diferentes mecanismos de ação, têm demonstrado em ensaios clínicos randomizados reduzir a morbimortalidade cardiovascular, podendo-se concluir que é a redução da pressão arterial, e não alguma outra propriedade farmacológica do medicamento. os medicamentos, que é o grande responsável por esses benefícios. O maior e mais consistente benefício de resultado cardiovascular tem sido a redução do risco de acidente vascular cerebral, mas reduções no infarto do miocárdio e na mortalidade cardiovascular também foram observadas regularmente.
pressão sistólica ou diastólica elevada causa aumento do risco cardiovascular, e o aumento do risco absoluto por mmHg é maior em pressões sanguíneas mais altas, de modo que mesmo reduções modestas da hipertensão grave podem proporcionar benefícios substanciais. A redução do risco relativo da redução da pressão arterial é semelhante em populações com risco absoluto variável, portanto, o benefício absoluto é maior em pacientes que estão em maior risco independentemente de sua hipertensão (por exemplo, pacientes com diabetes ou hiperlipidemia), e esses pacientes seriam esperados beneficiar de um tratamento mais agressivo para uma meta de pressão arterial mais baixa.
Alguns medicamentos anti-hipertensivos têm efeitos menores na pressão arterial (como monoterapia) em pacientes negros, e muitos medicamentos anti-hipertensivos têm indicações e efeitos adicionais aprovados (por exemplo, na angina, insuficiência cardíaca ou doença renal diabética). Essas considerações podem orientar a seleção da terapia.
MINIPRESS pode ser usado sozinho ou em combinação com outros medicamentos anti-hipertensivos, como diuréticos ou agentes bloqueadores beta-adrenérgicos.
DOSAGEM E ADMINISTRAÇÃO
A dose de MINIPRESS 1mg deve ser ajustada de acordo com a resposta individual da pressão arterial do paciente. A seguir, um guia para sua administração:
Dose inicial
1 mg duas ou três vezes ao dia (ver AVISOS .)
Dose de Manutenção
A dosagem pode ser aumentada lentamente até uma dose diária total de 20 mg administrada em doses divididas. As dosagens terapêuticas mais comumente empregadas têm variado de 6 mg a 15 mg diários administrados em doses divididas. Doses superiores a 20 mg geralmente não aumentam a eficácia, no entanto, alguns pacientes podem se beneficiar de aumentos adicionais até uma dose diária de 40 mg administrada em doses divididas. Após a titulação inicial, alguns pacientes podem ser mantidos adequadamente em um regime de dosagem de duas vezes ao dia.
Uso com outras drogas
Ao adicionar um diurético ou outro agente anti-hipertensivo, a dose de MINIPRESS 1 mg deve ser reduzida para 1 mg ou 2 mg três vezes ao dia e, em seguida, realizada a retração.
A administração concomitante de MINIPRESS 1mg com um inibidor de PDE-5 pode resultar em efeitos aditivos de redução da pressão arterial e hipotensão sintomática; portanto, a terapia com inibidor de PDE-5 deve ser iniciada com a dose mais baixa em pacientes tomando MINIPRESS.
COMO FORNECIDO
Distribuído por: Pfizer Labs, Divisão da Pfizer Inc., NY, NY 10017. Revisado: fevereiro de 2015
EFEITOS COLATERAIS
Os ensaios clínicos foram realizados em mais de 900 pacientes. Durante esses estudos e experiência de marketing subsequente, as reações mais frequentes associadas à terapia com MINIPRESS são: tontura 10,3%, dor de cabeça 7,8%, sonolência 7,6%, falta de energia 6,9%, fraqueza 6,5%, palpitações 5,3% e náusea 4,9%. Na maioria dos casos, os efeitos colaterais desapareceram com a continuação da terapia ou foram tolerados sem diminuição da dose do fármaco.
As reações adversas menos frequentes que ocorrem em 1-4% dos pacientes são:
Gastrointestinal: vômitos, diarréia, constipação.
Cardiovascular: edema, hipotensão ortostática, dispneia, síncope.
Sistema nervoso central: vertigem, depressão, nervosismo.
Dermatológico: irritação na pele.
Geniturinário: frequência urinária.
EENT: visão turva, esclera avermelhada, epistaxe, boca seca, congestão nasal.
Além disso, menos de 1% dos pacientes relataram o seguinte (em alguns casos, as relações causais exatas não foram estabelecidas):
Gastrointestinal: desconforto e/ou dor abdominal, anormalidades da função hepática, pancreatite.
Cardiovascular: taquicardia.
Sistema nervoso central: parestesia, alucinações.
Dermatológico: prurido, alopecia, líquen plano.
Geniturinário: incontinência, impotência, priapismo.
EENT: zumbido.
Outro: diaforese, febre, título de ANA positivo, artralgia.
Relatos únicos de manchas pigmentares e retinopatia serosa, e alguns relatos de desenvolvimento ou desaparecimento de catarata foram relatados. Nesses casos, a relação causal exata não foi estabelecida porque as observações da linha de base eram frequentemente inadequadas.
Em estudos mais específicos com lâmpada de fenda e fundoscopia, que incluíram exames de base adequados, não foram relatados achados oftalmológicos anormais relacionados ao medicamento.
Existem relatos na literatura associando a terapia com MINIPRESS 1mg com um agravamento de narcolepsia pré-existente. A relação causal é incerta nestes casos.
Na experiência pós-comercialização, os seguintes eventos adversos foram relatados:
Sistema nervoso autónomo: rubor.
Corpo como um todo: reação alérgica, astenia, mal-estar, dor.
Cardiovascular, Geral: angina de peito, hipotensão.
Endócrino: ginecomastia.
Frequência cardíaca/ritmo: bradicardia.
Psiquiátrico: insônia.
Pele/Apêndices: urticária.
Vascular (extracardíaco): vasculite.
Visão: dor nos olhos.
Sentidos Especiais: Durante a cirurgia de catarata, foi relatada uma variante da síndrome da pupila pequena conhecida como Síndrome da Íris Floppy Intraoperatória (IFIS) em associação com a terapia com alfa-1 bloqueador (ver PRECAUÇÕES ).
INTERAÇÕES MEDICAMENTOSAS
MINIPRESS 2mg foi administrado sem qualquer interação medicamentosa adversa em experiência clínica limitada até o momento com o seguinte: (1) glicosídeos-digital cardíacos e digoxina; (2) hipoglicemiantes-insulina, clorpropamida, fenformina, tolazamida e tolbutamida; (3) tranquilizantes e sedativos - clordiazepóxido, diazepam e fenobarbital; (4) antigout-alopurinol, colchicina e probenecida; (5) antiarrítmicos-procainamida, propranolol (ver AVISOS no entanto) e quinidina; e (6) analgésicos, antipiréticos e anti-inflamatórios-propoxifeno, aspirina, indometacina e fenilbutazona.
adição de um diurético ou outro agente anti-hipertensivo a MINIPRESS 2mg demonstrou causar um efeito hipotensor aditivo. Esse efeito pode ser minimizado reduzindo a dose de MINIPRESS para 1 a 2 mg três vezes ao dia, introduzindo medicamentos anti-hipertensivos adicionais com cautela e, em seguida, retraindo MINIPRESS com base na resposta clínica. A administração concomitante de MINIPRESS com um inibidor da fosfodiesterase-5 (PDE-5) pode resultar em efeitos aditivos de redução da pressão arterial e hipotensão sintomática (ver DOSAGEM E ADMINISTRAÇÃO ).
Interações Medicamentos/Testes Laboratoriais
Em um estudo em cinco pacientes que receberam de 12 a 24 mg de prazosina por dia durante 10 a 14 dias, houve um aumento médio de 42% no metabólito urinário da norepinefrina e um aumento médio no VMA urinário de 17%. Portanto, resultados falso-positivos podem ocorrer em testes de triagem para feocromocitoma em pacientes que estão sendo tratados com prazosina. Se for encontrado um VMA elevado, a prazosina deve ser descontinuada e o paciente testado novamente após um mês.
Testes laboratoriais
Em estudos clínicos nos quais os perfis lipídicos foram seguidos, geralmente não foram observadas alterações adversas entre os níveis lipídicos pré e pós-tratamento.
AVISOS
Tal como acontece com todos os bloqueadores alfa, MINIPRESS pode causar síncope com perda súbita de consciência. Na maioria dos casos, acredita-se que isso se deva a um efeito hipotensor postural excessivo, embora ocasionalmente a ode de síncopes tenha sido precedida por um ataque de taquicardia grave com frequências cardíacas de 120-160 batimentos por minuto. Os odes de síncopalepis geralmente ocorrem dentro de 30 a 90 minutos da dose inicial da droga; ocasionalmente, eles foram relatados em associação com o aumento rápido da idade da dose ou a introdução de outro medicamento anti-hipertensivo no regime de um paciente que toma altas doses de MINIPRESS. A incidência de sincolepis odes é de aproximadamente 1% em pacientes que receberam uma dose inicial de 2 mg ou mais. Ensaios clínicos realizados durante a fase de investigação deste medicamento sugerem que os episódios de síncope podem ser minimizados limitando a dose inicial do medicamento a 1 mg, aumentando subsequentemente a dosagem lentamente e introduzindo quaisquer medicamentos anti-hipertensivos adicionais no regime do paciente com cautela (ver POSOLOGIA E ADMINISTRAÇÃO). Hipotensão pode se desenvolver em pacientes que recebem MINIPRESS que também estão recebendo um betabloqueador, como propranolol.
Se ocorrer síncope, o paciente deve ser colocado em decúbito dorsal e tratado com suporte conforme necessário. Este efeito adverso é autolimitado e, na maioria dos casos, não se repete após o período inicial de terapia ou durante a titulação da dose subsequente.
Os pacientes devem sempre iniciar o tratamento com cápsulas de 1 mg de MINIPRESS. As cápsulas de 2 e 5 mg não são indicadas para terapia inicial.
Mais comuns do que a perda de consciência são os sintomas frequentemente associados à redução da pressão arterial, a saber, tonturas e vertigens. O paciente deve ser alertado sobre esses possíveis efeitos adversos e orientado sobre as medidas a serem tomadas caso ocorram. O paciente também deve ser alertado para evitar situações em que possa ocorrer lesão caso ocorra síncope durante o início da terapia com MINIPRESS 2mg.
Priapismo
Ereções prolongadas e priapismo foram relatados com bloqueadores alfa-1, incluindo prazosina, na experiência pós-comercialização. No caso de uma ereção que persista por mais de 4 horas, procure assistência médica imediata. Se o priapismo não for tratado imediatamente, pode ocorrer dano ao tecido peniano e perda permanente de potência.
PRECAUÇÕES
Em geral
Síndrome de Floppy Iris Intraoperatória (IFIS) foi observada durante a cirurgia de catarata em alguns pacientes tratados com alfa-1 bloqueadores. Esta variante da síndrome da pupila pequena é caracterizada pela combinação de uma íris flácida que ondula em resposta às correntes de irrigação intraoperatórias, miose intraoperatória progressiva apesar da dilatação pré-operatória com medicamentos midriáticos padrão e potencial prolapso da íris em direção às incisões de facoemulsificação. O oftalmologista do paciente deve estar preparado para possíveis modificações na técnica cirúrgica, como a utilização de ganchos de íris, anéis dilatadores de íris ou substâncias viscoelásticas. Não parece haver benefício em interromper a terapia com bloqueadores alfa-1 antes da cirurgia de catarata.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Nenhum potencial carcinogênico foi demonstrado em um estudo de 18 meses em ratos com MINIPRESS 1mg em níveis de dose superiores a 225 vezes a dose humana máxima usual recomendada de 20 mg por dia. MINIPRESS 2mg não foi mutagênico em estudos de toxicologia genética in vivo. Em um estudo de fertilidade e desempenho reprodutivo geral em ratos, tanto machos quanto fêmeas, tratados com 75 mg/kg (225 vezes a dose humana máxima usual recomendada), demonstraram diminuição da fertilidade, enquanto aqueles tratados com 25 mg/kg (75 vezes a dose usual dose humana máxima recomendada) não.
Em estudos crónicos (um ano ou mais) de MINIPRESS em ratos e cães, ocorreram alterações testiculares consistindo em atrofia e necrose com 25 mg/kg/dia (75 vezes a dose humana máxima habitualmente recomendada). Não foram observadas alterações testiculares em ratos ou cães com 10 mg/kg/dia (30 vezes a dose humana máxima recomendada usual). Em vista das alterações testiculares observadas em animais, 105 pacientes em terapia de longo prazo com MINIPRESS foram monitorados quanto à excreção de 17-cetosteroides e não foram observadas alterações indicando um efeito da droga. Além disso, 27 homens em uso de MINIPRESS 1mg por até 51 meses não apresentaram alterações na morfologia espermática sugestivas de efeito da droga.
Uso na gravidez
Gravidez Categoria C. MINIPRESS 1mg demonstrou estar associado à diminuição do tamanho da ninhada ao nascimento, 1, 4 e 21 dias de idade em ratos quando administrado em doses superiores a 225 vezes a dose humana máxima recomendada usual. Nenhuma evidência de anormalidades fetais externas, viscerais ou esqueléticas relacionadas à droga foi observada. Não foram observadas anormalidades externas, viscerais ou esqueléticas relacionadas ao medicamento em fetos de coelhas grávidas e macacas grávidas em doses superiores a 225 vezes e 12 vezes a dose máxima usual recomendada para humanos, respectivamente.
O uso de prazosina e betabloqueador para o controle da hipertensão grave em 44 gestantes não revelou anormalidades fetais ou efeitos adversos relacionados ao medicamento. A terapia com prazosina foi continuada por até 14 semanas.1
Prazosin também foi usado sozinho ou em combinação com outros agentes hipotensores na hipertensão grave da gravidez por outros investigadores. Nenhuma anormalidade fetal ou neonatal foi relatada com o uso de prazosina.2
Não existem estudos adequados e bem controlados que estabeleçam a segurança de MINIPRESS em mulheres grávidas. MINIPRESS deve ser usado durante a gravidez somente se o benefício potencial justificar o risco potencial para a mãe e o feto.
Mães que amamentam
MINIPRESS 1mg demonstrou ser excretado em pequenas quantidades no leite humano. Deve-se ter cautela quando MINIPRESS 2mg é administrado a uma lactante.
Uso em crianças
A segurança e eficácia em crianças não foram estabelecidas.
REFERÊNCIAS
1. Lubbe, WF e Hodge, JV: New Zealand Med J, 94 (691) 169-172, 1981.
2. Davey, DA e Dommisse, J: SA Med J, 4 de outubro de 1980 (551-556).
SOBREDOSAGEM
A ingestão acidental de pelo menos 50 mg de MINIPRESS em uma criança de dois anos resultou em sonolência profunda e reflexos deprimidos. Não foi observada diminuição da pressão arterial. A recuperação foi tranquila.
Caso a superdosagem leve à hipotensão, o suporte do sistema cardiovascular é de primeira importância. A restauração da pressão arterial e a normalização da frequência cardíaca podem ser conseguidas mantendo o paciente em decúbito dorsal. Se esta medida for inadequada, o choque deve ser tratado primeiro com expansores de volume. Se necessário, devem ser usados vasopressores. A função renal deve ser monitorada e apoiada conforme necessário. Dados laboratoriais indicam que MINIPRESS não é dialisável porque está ligado a proteínas.
CONTRA-INDICAÇÕES
MINIPRESS é contraindicado em pacientes com sensibilidade conhecida às quinazolinas, prazosina ou a qualquer um dos ingredientes inertes.
FARMACOLOGIA CLÍNICA
mecanismo exato da ação hipotensora da prazosina é desconhecido. A prazosina causa uma diminuição na resistência periférica total e foi originalmente pensado para ter uma ação relaxante direta no músculo liso vascular. Estudos recentes em animais, entretanto, sugeriram que o efeito vasodilatador da prazosina também está relacionado ao bloqueio de alfa-adrenoceptores pós-sinápticos. Os resultados de experimentos com membros anteriores de cães demonstram que o efeito vasodilatador periférico da prazosina está confinado principalmente ao nível dos vasos de resistência (arteríolas). Ao contrário dos alfabloqueadores convencionais, a ação anti-hipertensiva da prazosina geralmente não é acompanhada por uma taquicardia reflexa. Não se observou o desenvolvimento de tolerância na terapia de longo prazo.
Estudos hemodinâmicos foram realizados no homem após administração aguda de dose única e durante o curso da terapia de manutenção de longo prazo. Os resultados confirmam que o efeito terapêutico é uma queda na pressão arterial não acompanhada por uma alteração clinicamente significativa no débito cardíaco, frequência cardíaca, fluxo sanguíneo renal e taxa de filtração glomerular. Não há efeito cronotrópico negativo mensurável.
Em estudos clínicos até o momento, o cloridrato de prazosina não aumentou a atividade da renina plasmática.
No homem, a pressão arterial é reduzida tanto na posição supina quanto em pé. Este efeito é mais pronunciado na pressão arterial diastólica.
Após a administração oral, as concentrações plasmáticas humanas atingem um pico em cerca de três horas, com meia-vida plasmática de duas a três horas. O fármaco liga-se fortemente às proteínas plasmáticas. Estudos de biodisponibilidade demonstraram que a absorção total relativa ao fármaco em solução alcoólica a 20% é de 90%, resultando em níveis de pico de aproximadamente 65% do fármaco em solução. Estudos em animais indicam que o cloridrato de prazosina é extensivamente metabolizado, principalmente por desmetilação e conjugação, e excretado principalmente via bile e fezes. Estudos humanos menos extensos sugerem metabolismo e excreção semelhantes no homem.
Em estudos clínicos nos quais os perfis lipídicos foram seguidos, geralmente não foram observadas alterações adversas entre os níveis lipídicos pré e pós-tratamento.
INFORMAÇÃO DO PACIENTE
Tonturas ou sonolência podem ocorrer após a primeira dose deste medicamento. Evite dirigir ou realizar tarefas perigosas nas primeiras 24 horas após tomar este medicamento ou quando a dose for aumentada. Tonturas, vertigens ou desmaios podem ocorrer, especialmente ao se levantar de uma posição deitada ou sentada. Levantar-se devagar pode ajudar a diminuir o problema. Esses efeitos também podem ocorrer se você beber álcool, ficar em pé por longos períodos de tempo, se exercitar ou se o clima estiver quente. Enquanto estiver a tomar MINIPRESS, tenha cuidado com a quantidade de álcool que ingere. Além disso, tome cuidado extra durante o exercício ou clima quente, ou se ficar em pé por longos períodos. Verifique com seu médico se você tiver alguma dúvida.
