Coreg 3.12mg, 6.25mg, 12.5mg, 25mg Carvedilol Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Coreg 25mg e como é usado?
Coreg é um medicamento de prescrição utilizado para tratar os sintomas de insuficiência cardíaca e pressão arterial elevada (hipertensão). Coreg 25mg pode ser usado sozinho ou com outros medicamentos.
Coreg pertence a uma classe de medicamentos chamados Beta-Bloqueadores, Atividade Alfa.
Não se sabe se Coreg 25mg é seguro e eficaz em crianças.
Quais são os possíveis efeitos colaterais do Coreg?
Coreg pode causar efeitos colaterais graves, incluindo:
- tontura,
- batimentos cardíacos lentos ou irregulares,
- sensação de frio ou dormência nos dedos das mãos ou dos pés,
- dor no peito,
- tosse seca,
- chiado,
- aperto no peito,
- inchaço,
- ganho de peso rápido,
- sentindo falta de ar,
- aumento da sede,
- aumento da micção,
- boca seca e
- odor de hálito frutado
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Coreg 6,25mg incluem:
- tontura,
- batimentos cardíacos lentos,
- diarréia,
- ganho de peso,
- olhos secos e
- dificuldade em usar lentes de contato
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Coreg. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
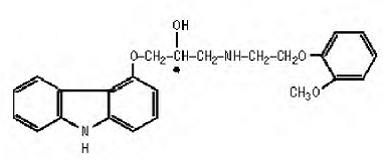
O carvedilol é um agente bloqueador β-adrenérgico não seletivo com atividade bloqueadora α1. É (±)-1(Carbazol-4-iloxi)-3-[[2-(o-metoxifenoxi)etil]amino]-2-propanol. O carvedilol é uma mistura racêmica com a seguinte estrutura:
COREG 6,25 mg é um comprimido revestido por película branco, oval, contendo 3,125 mg, 6,25 mg, 12,5 mg ou 25 mg de carvedilol. Os comprimidos de 6,25 mg, 12,5 mg e 25 mg são comprimidos TILTAB. Os ingredientes inativos consistem em dióxido de silício coloidal, crospovidona, hipromelose, lactose, estearato de magnésio, polietilenoglicol, polissorbato 80, povidona, sacarose e dióxido de titânio.
Carvedilol é um pó branco a esbranquiçado com um peso molecular de 406,5 e uma fórmula molecular de C24H26N2O4. É livremente solúvel em dimetilsulfóxido; solúvel em cloreto de metileno e metanol; pouco solúvel em etanol a 95% e isopropanol; ligeiramente solúvel em éter etílico; e praticamente insolúvel em água, fluido gástrico (simulado, TS, pH 1,1) e fluido intestinal (simulado, TS sem pancreatina, pH 7,5).
INDICAÇÕES
Insuficiência cardíaca
COREG é indicado para o tratamento de insuficiência cardíaca crônica leve a grave de origem isquêmica ou cardiomiopática, geralmente além de diuréticos, inibidores da ECA e digitálicos, para aumentar a sobrevida e, também, reduzir o risco de hospitalização [ver INTERAÇÕES MEDICAMENTOSAS , Estudos clínicos ].
Disfunção Ventricular Esquerda Após Infarto do Miocárdio
COREG é indicado para reduzir a mortalidade cardiovascular em pacientes clinicamente estáveis que sobreviveram à fase aguda de um infarto do miocárdio e têm uma fração de ejeção do ventrículo esquerdo menor ou igual a 40% (com ou sem insuficiência cardíaca sintomática) [ver Estudos clínicos ].
Hipertensão
COREG 25mg é indicado para o tratamento da hipertensão essencial [ver Estudos clínicos ]. Pode ser usado sozinho ou em combinação com outros agentes anti-hipertensivos, especialmente diuréticos do tipo tiazídico [ver INTERAÇÕES MEDICAMENTOSAS ].
DOSAGEM E ADMINISTRAÇÃO
COREG deve ser tomado com alimentos para diminuir a taxa de absorção e reduzir a incidência de efeitos ortostáticos.
Insuficiência cardíaca
DOSAGEM DEVE SER INDIVIDUALIZADA E ACOMPANHADA DE PERTO POR UM MÉDICO DURANTE A TITULAÇÃO. Antes do início do COREG 12,5mg, recomenda-se que a retenção de líquidos seja minimizada. A dose inicial recomendada de COREG é de 3,125 mg duas vezes ao dia por 2 semanas. Se tolerado, os pacientes podem ter sua dose aumentada para 6,25, 12,5 e 25 mg duas vezes ao dia em intervalos sucessivos de pelo menos 2 semanas. Os pacientes devem ser mantidos com doses mais baixas se doses mais altas não forem toleradas. Uma dose máxima de 50 mg duas vezes ao dia foi administrada a pacientes com insuficiência cardíaca leve a moderada com peso superior a 85 kg (187 lbs).
Os pacientes devem ser avisados de que o início do tratamento e (em menor grau) o aumento da dosagem podem estar associados a sintomas transitórios de tontura ou vertigem (e raramente síncope) na primeira hora após a administração. Durante esses períodos, os pacientes devem evitar situações como dirigir ou realizar tarefas perigosas, onde os sintomas podem resultar em lesões. Os sintomas vasodilatadores geralmente não requerem tratamento, mas pode ser útil separar o tempo de administração de COREG 6,25mg daquele do inibidor da ECA ou reduzir temporariamente a dose do inibidor da ECA. A dose de COREG 12,5mg não deve ser aumentada até que os sintomas de piora da insuficiência cardíaca ou vasodilatação tenham sido estabilizados.
A retenção de líquidos (com ou sem agravamento transitório dos sintomas de insuficiência cardíaca) deve ser tratada com um aumento da dose de diuréticos.
A dose de COREG deve ser reduzida se os pacientes apresentarem bradicardia (frequência cardíaca inferior a 55 batimentos por minuto).
Episódios de tontura ou retenção de líquidos durante o início de COREG 3,12mg geralmente podem ser controlados sem descontinuação do tratamento e não impedem a titulação subsequente bem-sucedida ou uma resposta favorável ao carvedilol.
Disfunção Ventricular Esquerda Após Infarto do Miocárdio
DOSAGEM DEVE SER INDIVIDUALIZADA E MONITORADA DURANTE A TITULAÇÃO. O tratamento com COREG pode ser iniciado como paciente internado ou ambulatorial e deve ser iniciado após o paciente estar hemodinamicamente estável e a retenção de líquidos ter sido minimizada. Recomenda-se que o COREG 3,12mg seja iniciado com 6,25mg duas vezes ao dia e aumentado após 3 a 10 dias, com base na tolerabilidade, para 12,5mg duas vezes ao dia, depois novamente para a dose alvo de 25 mg duas vezes ao dia. Uma dose inicial mais baixa pode ser usada (3,125 mg duas vezes ao dia) e/ou a taxa de titulação pode ser diminuída se clinicamente indicado (por exemplo, devido à baixa pressão arterial ou frequência cardíaca ou retenção de líquidos). Os pacientes devem ser mantidos com doses mais baixas se doses mais altas não forem toleradas. O regime de dosagem recomendado não precisa ser alterado em pacientes que receberam tratamento com β-bloqueador intravenoso ou oral durante a fase aguda do infarto do miocárdio.
Hipertensão
DOSAGEM DEVE SER INDIVIDUALIZADA. A dose inicial recomendada de COREG 6,25 mg é de 6,25 mg duas vezes ao dia. Se esta dose for tolerada, usando a pressão sistólica em pé medida cerca de 1 hora após a dosagem como guia, a dose deve ser mantida por 7 a 14 dias e depois aumentada para 12,5 mg duas vezes ao dia, se necessário, com base na pressão arterial mínima, novamente usando pressão sistólica em pé 1 hora após a dosagem como um guia para tolerância. Esta dose também deve ser mantida por 7 a 14 dias e pode então ser ajustada para 25 mg duas vezes ao dia, se tolerado e necessário. O efeito anti-hipertensivo completo de COREG 6,25mg é observado em 7 a 14 dias. A dose diária total não deve exceder 50 mg.
Pode-se esperar que a administração concomitante com um diurético produza efeitos aditivos e exagere o componente ortostático da ação do carvedilol.
Insuficiência hepática
COREG 25mg não deve ser administrado a pacientes com insuficiência hepática grave [ver CONTRA-INDICAÇÕES ].
COMO FORNECIDO
Dosagem e pontos fortes
Os comprimidos revestidos por película brancos, ovais estão disponíveis nas seguintes dosagens:
- 3,125 mg – gravado com “39” e “SB”
- 6,25 mg – gravado com “4140” e “SB”
- 12,5 mg – gravado com “4141” e “SB”
- 25 mg – gravado com “4142” e “SB”
Armazenamento e manuseio
Os comprimidos revestidos por película brancos, ovais estão disponíveis nas seguintes dosagens:
- 3,125 mg – gravado com “39” e “SB”
- 6,25 mg – gravado com “4140” e “SB”
- 12,5 mg – gravado com “4141” e “SB”
- 25 mg – gravado com “4142” e “SB”
Os comprimidos de 6,25 mg, 12,5 mg e 25 mg são comprimidos TILTAB.
- Frascos de 3,125 mg de 100: NDC 0007-4139-20
- Frascos de 6,25 mg de 100: NDC 0007-4140-20
- Frascos de 12,5 mg de 100: NDC 0007-4141-20
- Frascos de 25 mg de 100: NDC 0007-4142-20
Armazenar abaixo de 30°C (86°F). Proteger da umidade. Dispensar em um recipiente apertado e resistente à luz.
Fabricado para: GlaxoSmithKline Research Triangle Park, NC 27709. Revisado: setembro de 2017.
EFEITOS COLATERAIS
Experiência em Estudos Clínicos
Como os ensaios clínicos são conduzidos sob condições muito variadas, as taxas de reações adversas observadas nos ensaios clínicos de um medicamento não podem ser comparadas diretamente com as taxas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática.
COREG 25mg foi avaliado quanto à segurança em indivíduos com insuficiência cardíaca (leve, moderada e grave), em indivíduos com disfunção ventricular esquerda após infarto do miocárdio e em indivíduos hipertensos. O perfil de eventos adversos observado foi consistente com a farmacologia do medicamento e o estado de saúde dos indivíduos nos ensaios clínicos. Os eventos adversos relatados para cada uma dessas populações de pacientes são fornecidos abaixo. Excluem-se os eventos adversos considerados gerais demais para serem informativos e aqueles não razoavelmente associados ao uso do medicamento por estarem associados à condição em tratamento ou serem muito comuns na população tratada. As taxas de eventos adversos foram geralmente semelhantes entre os subgrupos demográficos (homens e mulheres, idosos e não idosos, negros e não negros).
Insuficiência cardíaca
COREG 12,5mg foi avaliado quanto à segurança na insuficiência cardíaca em mais de 4.500 indivíduos em todo o mundo, dos quais mais de 2.100 participaram de ensaios clínicos controlados por placebo. Aproximadamente 60% da população total tratada em ensaios clínicos controlados por placebo receberam COREG 3,12mg por pelo menos 6 meses e 30% receberam COREG por pelo menos 12 meses. No estudo COMET, 1.511 indivíduos com insuficiência cardíaca leve a moderada foram tratados com COREG por até 5,9 anos (média: 4,8 anos). Tanto em ensaios clínicos nos EUA em insuficiência cardíaca leve a moderada que compararam COREG 3,12mg em doses diárias de até 100 mg (n = 765) com placebo (n = 437), quanto em um ensaio clínico multinacional em insuficiência cardíaca grave (COPERNICUS ) que compararam o COREG em doses diárias de até 50 mg (n = 1.156) com placebo (n = 1.133), as taxas de descontinuação por experiências adversas foram semelhantes em pacientes com carvedilol e placebo. Em ensaios clínicos controlados com placebo, a única causa de descontinuação superior a 1% e ocorrendo mais frequentemente com carvedilol foi tontura (1,3% com carvedilol, 0,6% com placebo no estudo COPERNICUS).
Tabela 1 mostra os eventos adversos relatados em indivíduos com insuficiência cardíaca leve a moderada inscritos em ensaios clínicos controlados por placebo nos EUA e com insuficiência cardíaca grave inscritos no estudo COPERNICUS. São mostrados os eventos adversos que ocorreram com mais frequência em indivíduos tratados com drogas do que em indivíduos tratados com placebo, com incidência superior a 3% em indivíduos tratados com carvedilol, independentemente da causalidade. A exposição mediana à medicação do ensaio foi de 6,3 meses para os indivíduos com carvedilol e placebo nos ensaios de insuficiência cardíaca leve a moderada e 10,4 meses no ensaio de indivíduos com insuficiência cardíaca grave. O perfil de eventos adversos do COREG 3,12mg observado no estudo COMET de longo prazo foi geralmente semelhante ao observado nos EUA Heart Failure Trials.
Insuficiência cardíaca e dispnéia também foram relatadas nesses estudos, mas as taxas foram iguais ou maiores nos indivíduos que receberam placebo.
Os seguintes eventos adversos foram relatados com uma frequência maior que 1%, mas menor ou igual a 3% e mais frequentemente com COREG 3,12mg nos estudos controlados por placebo nos EUA em indivíduos com insuficiência cardíaca leve a moderada ou em indivíduos com insuficiência cardíaca grave no estudo COPERNICUS.
Incidência maior que 1% a menor ou igual a 3%
Corpo como um todo: Alergia, mal-estar, hipovolemia, febre, edema nas pernas.
Cardiovascular: Sobrecarga de líquidos, hipotensão postural, agravamento da angina pectoris, bloqueio AV, palpitação, hipertensão.
Sistema Nervoso Central e Periférico: Hipestesia, vertigem, parestesia.
Gastrointestinal: Melena, periodontite.
Fígado e Sistema Biliar: SGPT aumentou, SGOT aumentou.
Metabólico e Nutricional: Hiperuricemia, hipoglicemia, hiponatremia, fosfatase alcalina aumentada, glicosúria, hipervolemia, diabetes mellitus, GGT aumentada, emagrecimento, hipercalemia, creatinina aumentada.
Musculoesquelético: Cãibras musculares.
Plaquetas, Sangramento e Coagulação: Protrombina diminuída, púrpura, trombocitopenia.
Psiquiátrico: Sonolência.
Reprodutivo, macho: Impotência.
Sentidos Especiais: Visão embaçada.
Sistema urinário: Insuficiência renal, albuminúria, hematúria.
Disfunção Ventricular Esquerda Após Infarto do Miocárdio
O COREG foi avaliado quanto à segurança em sobreviventes de um infarto agudo do miocárdio com disfunção ventricular esquerda no estudo CAPRICORN que envolveu 969 indivíduos que receberam COREG 6,25mg e 980 que receberam placebo. Aproximadamente 75% dos indivíduos receberam COREG 25mg por pelo menos 6 meses e 53% receberam COREG 12,5mg por pelo menos 12 meses. Os indivíduos foram tratados por uma média de 12,9 meses e 12,8 meses com COREG 12,5mg e placebo, respectivamente.
Os eventos adversos mais comuns relatados com COREG 25mg no estudo CAPRICORN foram consistentes com o perfil do medicamento nos estudos de insuficiência cardíaca nos EUA e no estudo COPERNICUS. Os únicos eventos adversos adicionais relatados no CAPRICORN em mais de 3% dos indivíduos e mais comumente no carvedilol foram dispneia, anemia e edema pulmonar. Os seguintes eventos adversos foram relatados com frequência maior que 1%, mas menor ou igual a 3% e mais frequentemente com COREG: síndrome gripal, acidente vascular cerebral, distúrbio vascular periférico, hipotonia, depressão, dor gastrointestinal, artrite e gota. As taxas globais de descontinuações devido a eventos adversos foram semelhantes em ambos os grupos de indivíduos. Neste banco de dados, a única causa de descontinuação maior que 1% e ocorrendo mais frequentemente com carvedilol foi hipotensão (1,5% com carvedilol, 0,2% com placebo).
Hipertensão
COREG foi avaliado quanto à segurança na hipertensão em mais de 2.193 indivíduos em ensaios clínicos nos EUA e em 2.976 indivíduos em ensaios clínicos internacionais. Aproximadamente 36% da população total tratada recebeu COREG por pelo menos 6 meses. A maioria dos eventos adversos relatados durante a terapia com COREG 25mg foi de gravidade leve a moderada. Em ensaios clínicos controlados nos EUA comparando diretamente COREG 12,5 mg em doses de até 50 mg (n = 1.142) com placebo (n = 462), 4,9% dos indivíduos que receberam COREG 6,25 mg descontinuaram devido a eventos adversos versus 5,2% dos indivíduos que receberam placebo. Embora não tenha havido diferença geral nas taxas de descontinuação, as descontinuações foram mais comuns no grupo carvedilol por hipotensão postural (1% versus 0). A incidência geral de eventos adversos em estudos controlados por placebo nos EUA aumentou com o aumento da dose de COREG. Para eventos adversos individuais, isso só pôde ser distinguido para tontura, que aumentou em frequência de 2% para 5% à medida que a dose diária total aumentou de 6,25 mg para 50 mg.
Tabela 2 mostra eventos adversos em ensaios clínicos controlados por placebo nos EUA para hipertensão que ocorreram com uma incidência maior ou igual a 1%, independentemente da causalidade, e que foram mais frequentes em indivíduos tratados com drogas do que em indivíduos tratados com placebo.
Dispnéia e fadiga também foram relatadas nesses estudos, mas as taxas foram iguais ou maiores nos indivíduos que receberam placebo.
Os seguintes eventos adversos não descritos acima foram relatados como possivelmente ou provavelmente relacionados ao COREG 25mg em estudos abertos ou controlados em todo o mundo com COREG 12,5mg em indivíduos com hipertensão ou insuficiência cardíaca.
Incidência maior que 0,1% a menor ou igual a 1%
Cardiovascular: Isquemia periférica, taquicardia.
Sistema Nervoso Central e Periférico m: Hipocinesia.
Gastrointestinal: Bilirrubinemia, aumento das enzimas hepáticas (0,2% dos pacientes com hipertensão e 0,4% dos pacientes com insuficiência cardíaca foram descontinuados da terapia devido ao aumento das enzimas hepáticas) [ver Experiência pós-marketing ].
Psiquiátrico: Nervosismo, distúrbios do sono, depressão agravada, concentração prejudicada, pensamento anormal, paroniria, labilidade emocional.
Sistema respiratório: Asma [ver CONTRA-INDICAÇÕES ].
Reprodutivo, macho: Diminuição da libido.
Pele e anexos: Prurido, erupção cutânea eritematosa, erupção cutânea maculopapular, erupção cutânea psoriaforme, reação de fotossensibilidade.
Sentidos Especiais: Zumbido.
Sistema urinário: Frequência de micção aumentada.
Sistema nervoso autónomo: Boca seca, sudorese aumentada.
Metabólico e Nutricional: Hipocalemia, hipertrigliceridemia.
Hematologico: Anemia, leucopenia.
Os seguintes eventos foram relatados em menos ou igual a 0,1% dos indivíduos e são potencialmente importantes: bloqueio AV completo, bloqueio de ramo, isquemia miocárdica, distúrbio cerebrovascular, convulsões, enxaqueca, neuralgia, paresia, reação anafilactóide, alopecia, dermatite esfoliativa, amnésia, hemorragia GI, broncoespasmo, edema pulmonar, diminuição da audição, alcalose respiratória, aumento do BUN, diminuição do HDL, pancitopenia e linfócitos atípicos.
Anormalidades laboratoriais
Foram observadas elevações reversíveis nas transaminases séricas (ALT ou AST) durante o tratamento com COREG. As taxas de elevação das transaminases (2 a 3 vezes o limite superior do normal) observadas durante os ensaios clínicos controlados foram geralmente semelhantes entre indivíduos tratados com COREG e aqueles tratados com placebo. No entanto, elevações das transaminases, confirmadas por reexposição, foram observadas com COREG. Em um estudo de longo prazo controlado por placebo em insuficiência cardíaca grave, os indivíduos tratados com COREG 25mg apresentaram valores mais baixos de transaminases hepáticas do que os indivíduos tratados com placebo, possivelmente porque as melhorias na função cardíaca induzidas por COREG 6,25mg levaram a menos congestão hepática e/ou ou melhora do fluxo sanguíneo hepático.
COREG 25mg não foi associado a alterações clinicamente significativas no potássio sérico, triglicerídeos totais, colesterol total, colesterol HDL, ácido úrico, nitrogênio ureico no sangue ou creatinina. Não foram observadas alterações clinicamente relevantes na glicemia de jejum em pacientes hipertensos; a glicose sérica em jejum não foi avaliada nos ensaios clínicos de insuficiência cardíaca.
Experiência pós-marketing
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de COREG. Como essas reações são relatadas voluntariamente por uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
Distúrbios do Sangue e do Sistema Linfático
Anemia aplástica.
Distúrbios do sistema imunológico
Hipersensibilidade (por exemplo, reações anafiláticas, angioedema, urticária).
Distúrbios Renais e Urinários
Incontinencia urinaria.
Distúrbios Respiratórios, Torácicos e Mediastinais
Pneumonite intersticial.
Distúrbios da pele e tecido subcutâneo
Síndrome de Stevens-Johnson, necrólise epidérmica tóxica, eritema multiforme.
INTERAÇÕES MEDICAMENTOSAS
Inibidores de CYP2D6 e metabolizadores fracos
As interações do carvedilol com inibidores potentes da isoenzima CYP2D6 (como quinidina, fluoxetina, paroxetina e propafenona) não foram estudadas, mas espera-se que esses medicamentos aumentem os níveis sanguíneos do enantiômero R(+) do carvedilol [ver FARMACOLOGIA CLÍNICA ]. A análise retrospectiva dos efeitos colaterais em ensaios clínicos mostrou que metabolizadores fracos de 2D6 tiveram uma taxa mais alta de tontura durante a titulação, presumivelmente resultante dos efeitos vasodilatadores das concentrações mais altas do enantiômero R(+) bloqueador de α.
Agentes hipotensores
Pacientes em uso de betabloqueador e de um medicamento que pode depletar as catecolaminas (por exemplo, reserpina e inibidores da monoaminoxidase) devem ser observados atentamente quanto a sinais de hipotensão e/ou bradicardia grave.
administração concomitante de clonidina com um β-bloqueador pode causar hipotensão e bradicardia. Quando o tratamento concomitante com um β-bloqueador e clonidina deve ser interrompido, o β-bloqueador deve ser descontinuado primeiro. A terapia com clonidina pode então ser descontinuada vários dias depois, diminuindo gradualmente a dosagem.
Ciclosporina
Foram observados aumentos modestos nas concentrações médias mínimas de ciclosporina após o início do tratamento com carvedilol em 21 indivíduos transplantados renais que sofriam de rejeição vascular crónica. Em cerca de 30% dos indivíduos, a dose de ciclosporina teve que ser reduzida para manter as concentrações de ciclosporina dentro da faixa terapêutica, enquanto no restante não foi necessário ajuste. Na média do grupo, a dose de ciclosporina foi reduzida em cerca de 20% nesses indivíduos. Devido à ampla variabilidade interindividual no ajuste de dose necessário, recomenda-se que as concentrações de ciclosporina sejam monitoradas de perto após o início da terapia com carvedilol e que a dose de ciclosporina seja ajustada conforme apropriado.
Glicosídeos Digitais
Tanto os glicosídeos digitálicos quanto os betabloqueadores retardam a condução atrioventricular e diminuem a frequência cardíaca. O uso concomitante pode aumentar o risco de bradicardia. As concentrações de digoxina aumentam cerca de 15% quando digoxina e carvedilol são administrados concomitantemente. Portanto, recomenda-se aumentar o monitoramento da digoxina ao iniciar, ajustar ou descontinuar o COREG [ver FARMACOLOGIA CLÍNICA ].
Indutores/Inibidores do Metabolismo Hepático
A rifampicina reduziu as concentrações plasmáticas de carvedilol em cerca de 70% [ver FARMACOLOGIA CLÍNICA ]. A cimetidina aumentou a AUC em cerca de 30%, mas não causou alteração na Cmáx. FARMACOLOGIA CLÍNICA ].
Amiodarona
Amiodarona e seu metabólito desetil amiodarona, inibidores de CYP2C9 e glicoproteína-P aumentaram as concentrações do enantiômero S(-) do carvedilol em pelo menos 2 vezes [ver FARMACOLOGIA CLÍNICA ]. A administração concomitante de amiodarona ou outros inibidores do CYP2C9, como o fluconazol com COREG, pode aumentar a atividade do β-bloqueador, resultando em maior desaceleração da frequência cardíaca ou da condução cardíaca. Os pacientes devem ser observados quanto a sinais de bradicardia ou bloqueio cardíaco, particularmente quando um agente é adicionado ao tratamento preexistente com o outro.
Bloqueadores dos canais de cálcio
Distúrbio de condução (raramente com comprometimento hemodinâmico) foi observado quando COREG 25mg é coadministrado com diltiazem. Assim como com outros betabloqueadores, se COREG 25mg for administrado com bloqueadores dos canais de cálcio do tipo verapamil ou diltiazem, recomenda-se que o ECG e a pressão arterial sejam monitorados.
Insulina ou hipoglicemiantes orais
Os betabloqueadores podem aumentar o efeito redutor de açúcar no sangue da insulina e dos hipoglicemiantes orais. Portanto, em pacientes em uso de insulina ou hipoglicemiantes orais, recomenda-se o monitoramento regular da glicemia [ver AVISOS E PRECAUÇÕES ].
Anestesia
Se o tratamento com COREG deve ser continuado no perioperatório, deve-se ter cuidado especial quando são usados agentes anestésicos que deprimem a função miocárdica, como éter, ciclopropano e tricloroetileno [ver SOBREDOSAGEM ].
AVISOS
Incluído como parte do "PRECAUÇÕES" Seção
PRECAUÇÕES
Cessação da Terapia
Pacientes com doença arterial coronariana, que estão sendo tratados com COREG, devem ser advertidos contra a descontinuação abrupta da terapia. Exacerbação grave de angina e ocorrência de infarto do miocárdio e arritmias ventriculares foram relatadas em pacientes com angina após a descontinuação abrupta da terapia com betabloqueadores. As duas últimas complicações podem ocorrer com ou sem exacerbação anterior da angina pectoris. Assim como com outros betabloqueadores, quando a descontinuação de COREG é planejada, os pacientes devem ser cuidadosamente observados e aconselhados a limitar a atividade física ao mínimo. COREG deve ser descontinuado em 1 a 2 semanas sempre que possível. Se a angina piorar ou se desenvolver insuficiência coronariana aguda, recomenda-se que o COREG seja prontamente reinstituído, pelo menos temporariamente. Como a doença arterial coronariana é comum e pode não ser reconhecida, pode ser prudente não descontinuar a terapia com COREG 3,12 mg abruptamente, mesmo em pacientes tratados apenas para hipertensão ou insuficiência cardíaca.
Bradicardia
Em ensaios clínicos, COREG 25mg causou bradicardia em cerca de 2% dos indivíduos hipertensos, 9% dos indivíduos com insuficiência cardíaca e 6,5% dos indivíduos com infarto do miocárdio e disfunção ventricular esquerda. Se a pulsação cair abaixo de 55 batimentos por minuto, a dosagem deve ser reduzida.
Hipotensão
Em ensaios clínicos de insuficiência cardíaca principalmente leve a moderada, hipotensão e hipotensão postural ocorreram em 9,7% e síncope em 3,4% dos indivíduos que receberam COREG em comparação com 3,6% e 2,5% dos indivíduos que receberam placebo, respectivamente. O risco para esses eventos foi maior durante os primeiros 30 dias de dosagem, correspondendo ao período de titulação ascendente e foi causa de descontinuação da terapia em 0,7% dos indivíduos que receberam COREG 12,5 mg, em comparação com 0,4% dos indivíduos que receberam placebo. Em um estudo de longo prazo controlado por placebo em insuficiência cardíaca grave (COPERNICUS), hipotensão e hipotensão postural ocorreram em 15,1% e síncope em 2,9% dos indivíduos com insuficiência cardíaca recebendo COREG em comparação com 8,7% e 2,3% dos indivíduos placebo, respectivamente. Esses eventos foram causa de descontinuação da terapia em 1,1% dos indivíduos que receberam COREG, em comparação com 0,8% dos indivíduos que receberam placebo.
Hipotensão postural ocorreu em 1,8% e síncope em 0,1% dos indivíduos hipertensos, principalmente após a dose inicial ou no momento do aumento da dose e foi causa de descontinuação da terapia em 1% dos indivíduos.
No estudo CAPRICORN de sobreviventes de um infarto agudo do miocárdio, ocorreu hipotensão ou hipotensão postural em 20,2% dos indivíduos que receberam COREG em comparação com 12,6% dos indivíduos que receberam placebo. Síncope foi relatada em 3,9% e 1,9% dos indivíduos, respectivamente. Esses eventos foram causa de descontinuação da terapia em 2,5% dos indivíduos que receberam COREG, em comparação com 0,2% dos indivíduos que receberam placebo.
Começar com uma dose baixa, a administração com alimentos e o aumento gradual da titulação devem diminuir a probabilidade de síncope ou hipotensão excessiva. DOSAGEM E ADMINISTRAÇÃO ]. Durante o início da terapia, o paciente deve ser alertado para evitar situações como dirigir ou realizar tarefas perigosas, onde podem ocorrer lesões caso ocorra síncope.
Insuficiência Cardíaca/Retenção de Líquidos
Pode ocorrer agravamento da insuficiência cardíaca ou retenção de líquidos durante a titulação de carvedilol. Se tais sintomas ocorrerem, os diuréticos devem ser aumentados e a dose de carvedilol não deve ser aumentada até que a estabilidade clínica seja restabelecida. DOSAGEM E ADMINISTRAÇÃO ]. Ocasionalmente é necessário diminuir a dose de carvedilol ou descontinuar temporariamente. Esses episódios não impedem a titulação subsequente bem-sucedida ou uma resposta favorável ao carvedilol. Em um estudo controlado por placebo de indivíduos com insuficiência cardíaca grave, o agravamento da insuficiência cardíaca durante os primeiros 3 meses foi relatado em grau semelhante com carvedilol e placebo. Quando o tratamento foi mantido além de 3 meses, o agravamento da insuficiência cardíaca foi relatado com menos frequência em indivíduos tratados com carvedilol do que com placebo. A piora da insuficiência cardíaca observada durante a terapia de longo prazo está mais provavelmente relacionada à doença de base do paciente do que ao tratamento com carvedilol.
Broncoespasmo Não Alérgico
Pacientes com doença broncoespástica (por exemplo, bronquite crônica, enfisema) não devem, em geral, receber β-bloqueadores. COREG pode ser usado com cautela, no entanto, em pacientes que não respondem ou não toleram outros agentes anti-hipertensivos. É prudente, se o COREG for usado, usar a menor dose eficaz, de modo que a inibição de β-agonistas endógenos ou exógenos seja minimizada.
Em ensaios clínicos de indivíduos com insuficiência cardíaca, indivíduos com doença broncoespástica foram incluídos se não necessitassem de medicação oral ou inalatória para tratar a doença broncoespástica. Nesses pacientes, recomenda-se que o carvedilol seja usado com cautela. As recomendações de dosagem devem ser seguidas de perto e a dose deve ser reduzida se qualquer evidência de broncoespasmo for observada durante a titulação ascendente.
Controle glicêmico no diabetes tipo 2
Em geral, os betabloqueadores podem mascarar algumas das manifestações da hipoglicemia, particularmente a taquicardia. Os betabloqueadores não seletivos podem potencializar a hipoglicemia induzida pela insulina e retardar a recuperação dos níveis séricos de glicose. Pacientes sujeitos a hipoglicemia espontânea ou pacientes diabéticos recebendo insulina ou agentes hipoglicemiantes orais devem ser alertados sobre essas possibilidades.
Em pacientes com insuficiência cardíaca e diabetes, a terapia com carvedilol pode levar ao agravamento da hiperglicemia, que responde à intensificação da terapia hipoglicêmica. Recomenda-se que a glicemia seja monitorada quando a dosagem de carvedilol for iniciada, ajustada ou descontinuada. Não foram realizados ensaios para examinar os efeitos do carvedilol no controle glicêmico em pacientes com diabetes e insuficiência cardíaca.
Em um estudo projetado para examinar os efeitos do carvedilol no controle glicêmico em uma população com hipertensão leve a moderada e diabetes mellitus tipo 2 bem controlada, o carvedilol não teve efeito adverso no controle glicêmico, com base nas medições de HbA1c [ver Estudos clínicos ].
Doença vascular periférica
Os betabloqueadores podem precipitar ou agravar os sintomas de insuficiência arterial em pacientes com doença vascular periférica. Deve-se ter cautela em tais indivíduos.
Deterioração da função renal
Raramente, o uso de carvedilol em pacientes com insuficiência cardíaca resultou em deterioração da função renal. Os pacientes em risco parecem ser aqueles com pressão arterial baixa (pressão arterial sistólica inferior a 100 mm Hg), doença cardíaca isquêmica e doença vascular difusa e/ou insuficiência renal subjacente. A função renal voltou à linha de base quando o carvedilol foi interrompido. Em pacientes com esses fatores de risco, recomenda-se que a função renal seja monitorada durante a titulação de carvedilol e o medicamento descontinuado ou a dosagem reduzida se ocorrer piora da função renal.
Cirurgia de grande porte
A terapia β-bloqueadora administrada cronicamente não deve ser retirada rotineiramente antes de uma cirurgia de grande porte; entretanto, a capacidade prejudicada do coração de responder a estímulos adrenérgicos reflexos pode aumentar os riscos da anestesia geral e dos procedimentos cirúrgicos.
Tireotoxicose
bloqueio β-adrenérgico pode mascarar sinais clínicos de hipertireoidismo, como taquicardia. A retirada abrupta do β-bloqueio pode ser seguida por uma exacerbação dos sintomas de hipertireoidismo ou pode precipitar uma tempestade tireoidiana.
Feocromocitoma
Em pacientes com feocromocitoma, um agente α-bloqueador deve ser iniciado antes do uso de qualquer agente β-bloqueador. Embora o carvedilol tenha atividades farmacológicas bloqueadoras α e β, não há experiência com seu uso nessa condição. Portanto, deve-se ter cautela na administração de carvedilol a pacientes com suspeita de feocromocitoma.
Angina Variante de Prinzmetal
Agentes com atividade β-bloqueadora não seletiva podem provocar dor torácica em pacientes com angina variante de Prinzmetal. Não houve experiência clínica com carvedilol nesses pacientes, embora a atividade α-bloqueadora possa prevenir tais sintomas. No entanto, deve-se ter cautela na administração de carvedilol a pacientes com suspeita de angina variante de Prinzmetal.
Risco de reação anafilática
Durante o uso de betabloqueadores, os pacientes com histórico de reação anafilática grave a uma variedade de alérgenos podem ser mais reativos a repetidos desafios, sejam acidentais, diagnósticos ou terapêuticos. Esses pacientes podem não responder às doses usuais de epinefrina usadas para tratar a reação alérgica.
Síndrome da íris flácida intraoperatória
Síndrome da Íris Floppy Intraoperatória (IFIS) foi observada durante a cirurgia de catarata em alguns pacientes tratados com bloqueadores alfa-1 (COREG é um bloqueador alfa/beta). Esta variante da síndrome da pupila pequena é caracterizada pela combinação de uma íris flácida que ondula em resposta às correntes de irrigação intraoperatórias, miose intraoperatória progressiva apesar da dilatação pré-operatória com medicamentos midriáticos padrão e potencial prolapso da íris em direção às incisões de facoemulsificação. O oftalmologista do paciente deve estar preparado para possíveis modificações na técnica cirúrgica, como utilização de ganchos de íris, anéis dilatadores de íris ou substâncias viscoelásticas. Não parece haver benefício em interromper a terapia com bloqueadores alfa-1 antes da cirurgia de catarata.
Informações de Aconselhamento do Paciente
Aconselhe o paciente a ler o rótulo do paciente aprovado pela FDA ( INFORMAÇÃO DO PACIENTE ).
Os pacientes que tomam COREG devem ser avisados do seguinte:
- Os pacientes devem tomar COREG com alimentos.
- Os pacientes não devem interromper ou descontinuar o uso de COREG 25mg sem orientação médica.
- Pacientes com insuficiência cardíaca devem consultar seu médico se apresentarem sinais ou sintomas de agravamento da insuficiência cardíaca, como ganho de peso ou aumento da falta de ar.
- Os pacientes podem experimentar uma queda na pressão arterial quando em pé, resultando em tontura e, raramente, desmaio. Os doentes devem sentar-se ou deitar-se quando ocorrerem estes sintomas de diminuição da pressão arterial.
- Se sentir tontura ou fadiga, os pacientes devem evitar dirigir ou realizar tarefas perigosas.
- Os pacientes devem consultar um médico se sentirem tontura ou desmaio, caso a dosagem deva ser ajustada.
- Pacientes diabéticos devem relatar quaisquer alterações nos níveis de açúcar no sangue ao seu médico.
- Os usuários de lentes de contato podem apresentar diminuição do lacrimejamento.
COREG 25mg, COREG 3.12mg CR e TILTAB são marcas registradas de propriedade ou licenciadas para o grupo de empresas GSK.
outra marca listada é uma marca registrada de propriedade ou licenciada para seu proprietário e não é de propriedade ou licenciada para o grupo de empresas GSK. O fabricante desta marca não é afiliado e não endossa o grupo de empresas GSK ou seus produtos.
Toxicologia não clínica
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
Em estudos de 2 anos realizados em ratos que receberam carvedilol em doses de até 75 mg por kg por dia (12 vezes o MRHD em mg por m2) ou em camundongos que receberam até 200 mg por kg por dia (16 vezes o MRHD em mg por m2), o carvedilol não teve efeito carcinogênico.
O carvedilol foi negativo quando testado em uma bateria de ensaios de genotoxicidade, incluindo os ensaios de Ames e CHO/HGPRT para mutagenicidade e o micronúcleo de hamster in vitro e testes de células de linfócitos humanos in vivo para clastogenicidade.
Em um estudo combinado de fertilidade/desenvolvimento/toxicidade pós-natal, os ratos receberam carvedilol (12, 60, 300 mg por kg por dia) por gavagem por 2 semanas antes do acasalamento e através do acasalamento, gestação e desmame para fêmeas e por 62 dias antes e durante o acasalamento para os machos. Na dosagem de 300 mg por kg por dia (maior ou igual a 50 vezes a MRHD em mg por m2), o carvedilol foi tóxico para ratos adultos (sedação, ganho de peso reduzido) e foi associado a um número reduzido de acasalamentos bem-sucedidos, tempo de acasalamento, menos corpos lúteos e implantes por mãe, menos filhotes vivos por ninhada e atrasos no crescimento/desenvolvimento físico. O nível sem efeito para toxicidade evidente e comprometimento da fertilidade foi de 60 mg por kg por dia (10 vezes o MRHD como mg por m2).
Uso em populações específicas
Gravidez
Resumo do risco
Os dados disponíveis sobre o uso de COREG 12,5mg em mulheres grávidas são insuficientes para determinar se existem riscos associados ao medicamento de resultados adversos no desenvolvimento. Existem riscos para a mãe e o feto associados à hipertensão mal controlada na gravidez. O uso de betabloqueadores durante o terceiro trimestre de gravidez pode aumentar o risco de hipotensão, bradicardia, hipoglicemia e depressão respiratória no neonato. veja Considerações Clínicas ]. Em estudos de reprodução em animais, não houve evidência de resultados adversos no desenvolvimento em doses clinicamente relevantes. ver dados ]. A administração oral de carvedilol a ratas grávidas durante a organogênese resultou em perda pós-implantação, diminuição do peso corporal fetal e aumento da frequência de atraso no desenvolvimento esquelético fetal em doses maternas tóxicas que foram 50 vezes a dose humana máxima recomendada (MRHD). Além disso, a administração oral de carvedilol a coelhas grávidas durante a organogênese resultou em aumento da perda pós-implantação em doses 25 vezes maiores que a MRHD. ver dados ].
O risco de fundo estimado de defeitos congênitos graves e aborto espontâneo para as populações indicadas é desconhecido. Todas as gestações têm um risco histórico de defeitos congênitos, perda ou outros resultados adversos. Na população geral dos EUA, o risco de fundo estimado de defeitos congênitos graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2% a 4% e 15% a 20%, respectivamente.
Considerações Clínicas
Risco Materno e/ou Embrio/Fetal Associado à Doença
A hipertensão na gravidez aumenta o risco materno de pré-eclâmpsia, diabetes gestacional, parto prematuro e complicações no parto (por exemplo, necessidade de cesariana e hemorragia pós-parto). A hipertensão aumenta o risco fetal de restrição de crescimento intrauterino e morte intrauterina. Mulheres grávidas com hipertensão devem ser cuidadosamente monitoradas e tratadas adequadamente.
Reações Adversas Fetais/Neonatais
Os recém-nascidos de mulheres com hipertensão que são tratadas com betabloqueadores durante o terceiro trimestre de gravidez podem apresentar risco aumentado de hipotensão, bradicardia, hipoglicemia e depressão respiratória. Observar os recém-nascidos quanto a sintomas de hipotensão, bradicardia, hipoglicemia e depressão respiratória e manejar adequadamente.
Dados
Dados de animais
Estudos realizados em ratos e coelhos que receberam carvedilol durante a organogênese fetal revelaram aumento da perda pós-implantação em ratos com uma dose tóxica materna de 300 mg por kg por dia (50 vezes a MRHD em mg por m2) e em coelhos (na ausência de toxicidade) em doses de 75 mg por kg por dia (25 vezes o MRHD como mg por m2). Nos ratos, houve também uma diminuição do peso corporal fetal em 300 mg por kg por dia (50 vezes a MRHD em mg por m2) acompanhada por um aumento da incidência de fetos com atraso no desenvolvimento esquelético. Em ratos, o nível sem efeito para toxicidade embriofetal foi de 60 mg por kg por dia (10 vezes o MRHD como mg por m2); em coelhos, foi de 15 mg por kg por dia (5 vezes o MRHD como mg por m2). Em um estudo de desenvolvimento pré e pós-natal em ratos administrados com carvedilol desde o final da gestação até a lactação, observou-se aumento da letalidade embrionária com uma dose tóxica materna de 200 mg por kg por dia (aproximadamente 32 vezes a MRHD em mg por m2), e mortalidade de filhotes e atrasos no crescimento/desenvolvimento físico foram observados com 60 mg por kg por dia (10 vezes o MRHD como mg por m2) na ausência de toxicidade materna. O nível sem efeito foi de 12 mg por kg por dia (2 vezes o MRHD como mg por m2). O carvedilol estava presente em tecido fetal de rato.
Lactação
Resumo do risco
Não existem dados sobre a presença de carvedilol no leite humano, os efeitos no lactente ou os efeitos na produção de leite. O carvedilol está presente no leite de ratas lactantes. Os benefícios do aleitamento materno para o desenvolvimento e para a saúde devem ser considerados juntamente com a necessidade clínica da mãe de COREG e quaisquer potenciais efeitos adversos no bebê amamentado de COREG 3,12mg ou da condição materna subjacente.
Uso Pediátrico
A eficácia do COREG 3,12mg em pacientes com menos de 18 anos não foi estabelecida.
Em um estudo duplo-cego, 161 crianças (média de idade: 6 anos; faixa: 2 meses a 17 anos; 45% menores de 2 anos) com insuficiência cardíaca crônica [NYHA classe II-IV, fração de ejeção do ventrículo esquerdo menor que 40% para crianças com ventrículo esquerdo sistêmico (VE) e disfunção ventricular moderada-grave qualitativamente por eco para aquelas com ventrículo sistêmico que não era VE] que estavam recebendo tratamento de base padrão foram randomizados para placebo ou para 2 níveis de dose de carvedilol. Esses níveis de dose produziram redução da frequência cardíaca corrigida por placebo de 4 a 6 batimentos cardíacos por minuto, indicativa de atividade de β-bloqueio. A exposição pareceu ser menor em indivíduos pediátricos do que em adultos. Após 8 meses de acompanhamento, não houve efeito significativo do tratamento sobre os resultados clínicos. As reações adversas neste estudo que ocorreram em mais de 10% dos indivíduos tratados com COREG e com o dobro da taxa de indivíduos tratados com placebo incluíram dor no peito (17% versus 6%), tontura (13% versus 2%) e dispneia ( 11% versus 0%).
Uso Geriátrico
Dos 765 indivíduos com insuficiência cardíaca randomizados para COREG 6,25mg em ensaios clínicos nos EUA, 31% (235) tinham 65 anos ou mais e 7,3% (56) tinham 75 anos ou mais. Dos 1.156 indivíduos randomizados para COREG 3,12mg em um estudo de longo prazo controlado por placebo em insuficiência cardíaca grave, 47% (547) tinham 65 anos ou mais e 15% (174) tinham 75 anos ou mais. Dos 3.025 indivíduos que receberam COREG 6,25mg em ensaios de insuficiência cardíaca em todo o mundo, 42% tinham 65 anos ou mais.
Dos 975 indivíduos com infarto do miocárdio randomizados para COREG no estudo CAPRICORN, 48% (468) tinham 65 anos ou mais e 11% (111) tinham 75 anos ou mais.
Dos 2.065 indivíduos hipertensos em ensaios clínicos de eficácia ou segurança nos EUA que foram tratados com COREG 25mg, 21% (436) tinham 65 anos ou mais. Dos 3.722 indivíduos que receberam COREG em ensaios clínicos de hipertensão realizados em todo o mundo, 24% tinham 65 anos ou mais.
Com exceção da tontura em indivíduos hipertensos (incidência de 8,8% em idosos versus 6% em indivíduos mais jovens), não foram observadas diferenças gerais na segurança ou eficácia (ver Figuras 2 e 4) entre os indivíduos mais velhos e os mais jovens em cada um dos essas populações. Da mesma forma, outras experiências clínicas relatadas não identificaram diferenças nas respostas entre idosos e indivíduos mais jovens, mas não se pode descartar maior sensibilidade de alguns indivíduos mais velhos.
SOBREDOSAGEM
A superdosagem pode causar hipotensão grave, bradicardia, insuficiência cardíaca, choque cardiogênico e parada cardíaca. Problemas respiratórios, broncoespasmos, vômitos, lapsos de consciência e convulsões generalizadas também podem ocorrer.
O paciente deve ser colocado em decúbito dorsal e, quando necessário, mantido sob observação e tratado em condições de terapia intensiva. Os seguintes agentes podem ser administrados:
Para bradicardia excessiva : Atropina, 2 mg IV.
Para apoiar a função cardiovascular Glucagon, 5 a 10 mg IV rapidamente em 30 segundos, seguido de infusão contínua de 5 mg por hora; simpaticomiméticos (dobutamina, isoprenalina, adrenalina) em doses de acordo com o peso corporal e efeito.
Se a vasodilatação periférica dominar, pode ser necessário administrar adrenalina ou noradrenalina com monitoramento contínuo das condições circulatórias. Para bradicardia resistente à terapia, a terapia com marcapasso deve ser realizada. Para broncoespasmo, β-simpaticomiméticos (como aerossol ou IV) ou aminofilina IV devem ser administrados. Em caso de convulsões, recomenda-se a injeção intravenosa lenta de diazepam ou clonazepam.
NOTA: Em caso de intoxicação grave com sintomas de choque, o tratamento com antídotos deve ser continuado por um período de tempo suficientemente longo compatível com a meia-vida de 7 a 10 horas do carvedilol.
Casos de superdosagem com COREG 3,12mg isoladamente ou em combinação com outras drogas foram relatados. As quantidades ingeridas em alguns casos ultrapassaram 1.000 miligramas. Os sintomas experimentados incluíram pressão arterial baixa e frequência cardíaca. O tratamento de suporte padrão foi fornecido e os indivíduos se recuperaram.
CONTRA-INDICAÇÕES
COREG 25mg é contraindicado nas seguintes condições:
- Asma brônquica ou condições broncoespásticas relacionadas. Mortes por estado de mal asmático foram relatadas após doses únicas de COREG.
- Bloqueio AV de segundo ou terceiro grau.
- Síndrome do nódulo sinusal.
- Bradicardia grave (a menos que um marcapasso permanente esteja instalado).
- Pacientes com choque cardiogênico ou com insuficiência cardíaca descompensada que necessitem do uso de terapia inotrópica intravenosa. Esses pacientes devem primeiro ser desmamados da terapia intravenosa antes de iniciar o COREG.
- Pacientes com insuficiência hepática grave.
- Pacientes com histórico de reação de hipersensibilidade grave (por exemplo, síndrome de Stevens-Johnson, reação anafilática, angioedema) a qualquer componente deste medicamento ou outros medicamentos que contenham carvedilol.
FARMACOLOGIA CLÍNICA
Mecanismo de ação
COREG 3,12mg é uma mistura racêmica na qual a atividade bloqueadora não seletiva dos β-adrenoreceptores está presente no enantiômero S(-) e a atividade bloqueadora α1-adrenérgica está presente nos enantiômeros R(+) e S(-) em igual potência. COREG 6,25mg não tem atividade simpaticomimética intrínseca.
Farmacodinâmica
Insuficiência cardíaca
A base para os efeitos benéficos do COREG na insuficiência cardíaca não está estabelecida.
Dois estudos controlados por placebo compararam os efeitos hemodinâmicos agudos do COREG com medições basais em 59 e 49 indivíduos com insuficiência cardíaca classe II-IV da NYHA recebendo diuréticos, inibidores da ECA e digitálicos. Houve reduções significativas na pressão arterial sistêmica, pressão arterial pulmonar, pressão capilar pulmonar e frequência cardíaca. Os efeitos iniciais no débito cardíaco, índice de volume sistólico e resistência vascular sistêmica foram pequenos e variáveis.
Esses ensaios mediram os efeitos hemodinâmicos novamente em 12 a 14 semanas. COREG 25mg reduziu significativamente a pressão arterial sistêmica, a pressão da artéria pulmonar, a pressão atrial direita, a resistência vascular sistêmica e a frequência cardíaca, enquanto o índice de volume sistólico aumentou.
Entre 839 indivíduos com insuficiência cardíaca classe II-III da NYHA tratados por 26 a 52 semanas em 4 estudos controlados por placebo nos EUA, a fração de ejeção do ventrículo esquerdo (FE) média medida por ventriculografia radionuclídica aumentou 9 unidades EF (%) em indivíduos que receberam COREG 6.25 mg e por 2 unidades EF em indivíduos placebo em uma dose alvo de 25 a 50 mg duas vezes ao dia. Os efeitos do carvedilol na fração de ejeção foram relacionados à dose. Doses de 6,25 mg duas vezes ao dia, 12,5 mg duas vezes ao dia e 25 mg duas vezes ao dia foram associadas a aumentos corrigidos por placebo na FE de 5 unidades EF, 6 unidades EF e 8 unidades EF, respectivamente; cada um desses efeitos foi nominalmente estatisticamente significativo.
Disfunção Ventricular Esquerda Após Infarto do Miocárdio
A base para os efeitos benéficos de COREG 25mg em pacientes com disfunção ventricular esquerda após infarto agudo do miocárdio não está estabelecida.
Hipertensão
O mecanismo pelo qual o β-bloqueio produz um efeito anti-hipertensivo não foi estabelecido.
atividade de bloqueio de β-adrenorreceptores foi demonstrada em estudos em animais e humanos mostrando que o carvedilol (1) reduz o débito cardíaco em indivíduos normais, (2) reduz a taquicardia induzida por exercício e/ou isoproterenol e (3) reduz a taquicardia ortostática reflexa. Efeito significativo de bloqueio de β-adrenorreceptores geralmente é observado dentro de 1 hora após a administração do fármaco.
A atividade bloqueadora de α1-adrenorreceptores foi demonstrada em estudos em humanos e animais, mostrando que o carvedilol (1) atenua os efeitos pressores da fenilefrina, (2) causa vasodilatação e (3) reduz a resistência vascular periférica. Esses efeitos contribuem para a redução da pressão arterial e geralmente são observados dentro de 30 minutos após a administração do medicamento.
Devido à atividade bloqueadora do receptor α1 do carvedilol, a pressão arterial diminui mais na posição em pé do que na posição supina, e podem ocorrer sintomas de hipotensão postural (1,8%), incluindo casos raros de síncope. Após a administração oral, quando ocorreu hipotensão postural, ela foi transitória e é incomum quando COREG é administrado com alimentos na dose inicial recomendada e os incrementos de titulação são acompanhados de perto [ver DOSAGEM E ADMINISTRAÇÃO ].
Em pacientes hipertensos com função renal normal, doses terapêuticas de COREG diminuíram a resistência vascular renal sem alteração na taxa de filtração glomerular ou fluxo plasmático renal. Alterações na excreção de sódio, potássio, ácido úrico e fósforo em pacientes hipertensos com função renal normal foram semelhantes após COREG e placebo.
COREG 3,12mg tem pouco efeito sobre as catecolaminas plasmáticas, aldosterona plasmática ou níveis de eletrólitos, mas reduz significativamente a atividade da renina plasmática quando administrado por pelo menos 4 semanas. Também aumenta os níveis de peptídeo natriurético atrial.
Farmacocinética
COREG é rápida e extensamente absorvido após administração oral, com biodisponibilidade absoluta de aproximadamente 25% a 35% devido a um grau significativo de metabolismo de primeira passagem. Após a administração oral, a meia-vida de eliminação terminal média aparente do carvedilol varia geralmente de 7 a 10 horas. As concentrações plasmáticas alcançadas são proporcionais à dose oral administrada. Quando administrado com alimentos, a taxa de absorção é retardada, como evidenciado por um atraso no tempo para atingir os níveis plasmáticos máximos, sem diferença significativa na extensão da biodisponibilidade. Tomar COREG com alimentos deve minimizar o risco de hipotensão ortostática.
carvedilol é extensamente metabolizado. Após a administração oral de carvedilol radiomarcado a voluntários saudáveis, o carvedilol representou apenas cerca de 7% da radioatividade total no plasma medida pela área sob a curva (AUC). Menos de 2% da dose foi excretada inalterada na urina. O carvedilol é metabolizado principalmente por oxidação do anel aromático e glucuronidação.
Os metabólitos oxidativos são posteriormente metabolizados por conjugação via glucuronidação e sulfatação. Os metabólitos do carvedilol são excretados principalmente através da bile nas fezes. A desmetilação e a hidroxilação no anel fenol produzem 3 metabólitos ativos com atividade bloqueadora do receptor β. Com base em estudos pré-clínicos, o metabólito 4'-hidroxifenil é aproximadamente 13 vezes mais potente que o carvedilol para β-bloqueio.
Em comparação com o carvedilol, os 3 metabólitos ativos apresentam atividade vasodilatadora fraca. As concentrações plasmáticas dos metabólitos ativos são cerca de um décimo daquelas observadas para o carvedilol e têm farmacocinética semelhante à do original.
O carvedilol sofre metabolismo de primeira passagem estereosseletivo com níveis plasmáticos de R(+)-carvedilol aproximadamente 2 a 3 vezes maiores do que S(-)-carvedilol após administração oral em indivíduos saudáveis. As meias-vidas médias de eliminação terminal aparente para R(+)-carvedilol variam de 5 a 9 horas em comparação com 7 a 11 horas para o S(-)-enantiômero.
As enzimas P450 primárias responsáveis pelo metabolismo de R(+) e S(-)-carvedilol em microssomas hepáticos humanos foram CYP2D6 e CYP2C9 e, em menor grau, CYP3A4, 2C19, 1A2 e 2E1. Acredita-se que o CYP2D6 seja a principal enzima na hidroxilação 4' e 5' do carvedilol, com uma contribuição potencial do 3A4. Acredita-se que o CYP2C9 seja de importância primária na via de O-metilação do S(-)-carvedilol.
carvedilol está sujeito aos efeitos do polimorfismo genético com metabolizadores fracos de debrisoquina (um marcador para citocromo P450 2D6) exibindo concentrações plasmáticas 2 a 3 vezes maiores de R(+)-carvedilol em comparação com metabolizadores extensos. Em contraste, os níveis plasmáticos de S(-)-carvedilol aumentam apenas cerca de 20% a 25% em metabolizadores fracos, indicando que este enantiômero é metabolizado em menor extensão pelo citocromo P450 2D6 do que R(+)-carvedilol. A farmacocinética do carvedilol não parece ser diferente em metabolizadores fracos de S-mefenitoína (pacientes deficientes em citocromo P450 2C19).
O carvedilol liga-se mais de 98% às proteínas plasmáticas, principalmente à albumina. A ligação às proteínas plasmáticas é independente da concentração no intervalo terapêutico. O carvedilol é um composto lipofílico básico com volume de distribuição no estado de equilíbrio de aproximadamente 115 L, indicando distribuição substancial nos tecidos extravasculares. A depuração plasmática varia de 500 a 700 mL/min.
Populações Específicas
Insuficiência cardíaca
As concentrações plasmáticas em estado estacionário de carvedilol e seus enantiômeros aumentaram proporcionalmente na faixa de dose de 6,25 a 50 mg em indivíduos com insuficiência cardíaca. Em comparação com indivíduos saudáveis, indivíduos com insuficiência cardíaca apresentaram valores médios de AUC e Cmax aumentados para carvedilol e seus enantiômeros, com valores até 50% a 100% mais altos observados em 6 indivíduos com insuficiência cardíaca classe IV da NYHA. A meia-vida média de eliminação terminal aparente para o carvedilol foi semelhante à observada em indivíduos saudáveis.
Geriátrico
Os níveis plasmáticos de carvedilol são, em média, cerca de 50% mais altos nos idosos em comparação com os jovens. Insuficiência hepática Em comparação com indivíduos saudáveis, os pacientes com insuficiência hepática grave (cirrose) apresentam um aumento de 4 a 7 vezes nos níveis de carvedilol. Carvedilol é contraindicado em pacientes com insuficiência hepática grave.
Insuficiência renal
Embora o carvedilol seja metabolizado principalmente pelo fígado, foi relatado que as concentrações plasmáticas de carvedilol estão aumentadas em pacientes com insuficiência renal. Com base nos dados médios de AUC, foram observadas concentrações plasmáticas de carvedilol aproximadamente 40% a 50% mais altas em indivíduos com hipertensão e insuficiência renal moderada a grave em comparação com um grupo controle de indivíduos com hipertensão e função renal normal. No entanto, os intervalos dos valores de AUC foram semelhantes para ambos os grupos. As alterações nos níveis plasmáticos de pico médios foram menos pronunciadas, aproximadamente 12% a 26% maiores em indivíduos com função renal comprometida.
Consistente com seu alto grau de ligação às proteínas plasmáticas, o carvedilol não parece ser eliminado significativamente pela hemodiálise.
Interações Medicamentosas
Como o carvedilol sofre metabolismo oxidativo substancial, o metabolismo e a farmacocinética do carvedilol podem ser afetados pela indução ou inibição das enzimas do citocromo P450.
Amiodarona
Em um estudo farmacocinético realizado em 106 indivíduos japoneses com insuficiência cardíaca, a coadministração de pequenas doses de carga e manutenção de amiodarona com carvedilol resultou em um aumento de pelo menos 2 vezes nas concentrações mínimas de S(-)-carvedilol no estado de equilíbrio [ver INTERAÇÕES MEDICAMENTOSAS ].
Cimetidina
Em um estudo farmacocinético realizado em 10 indivíduos saudáveis do sexo masculino, a cimetidina (1.000 mg por dia) aumentou a AUC no estado de equilíbrio do carvedilol em 30% sem alteração na Cmáx. INTERAÇÕES MEDICAMENTOSAS ].
Digoxina
Após a administração concomitante de carvedilol (25 mg uma vez ao dia) e digoxina (0,25 mg uma vez ao dia) por 14 dias, a AUC no estado de equilíbrio e as concentrações mínimas de digoxina aumentaram 14% e 16%, respectivamente, em 12 indivíduos com hipertensão [ver INTERAÇÕES MEDICAMENTOSAS ].
Gliburida
Em 12 indivíduos saudáveis, a administração combinada de carvedilol (25 mg uma vez ao dia) e uma dose única de gliburida não resultou em uma interação farmacocinética clinicamente relevante para nenhum dos compostos.
Hidroclorotiazida
Uma dose oral única de 25 mg de carvedilol não alterou a farmacocinética de uma dose oral única de 25 mg de hidroclorotiazida em 12 indivíduos com hipertensão. Da mesma forma, a hidroclorotiazida não teve efeito sobre a farmacocinética do carvedilol.
Rifampina
Em um estudo farmacocinético realizado em 8 indivíduos saudáveis do sexo masculino, a rifampicina (600 mg diariamente por 12 dias) diminuiu a AUC e a Cmax do carvedilol em cerca de 70% [ver INTERAÇÕES MEDICAMENTOSAS ].
Torsemida
Em um estudo com 12 indivíduos saudáveis, a administração oral combinada de carvedilol 25 mg uma vez ao dia e torsemida 5 mg uma vez ao dia por 5 dias não resultou em diferenças significativas em sua farmacocinética em comparação com a administração dos medicamentos isoladamente.
Varfarina
O carvedilol (12,5 mg duas vezes ao dia) não teve efeito sobre as razões do tempo de protrombina no estado de equilíbrio e não alterou a farmacocinética da R(+)- e S(-)-varfarina após administração concomitante com varfarina em 9 voluntários saudáveis.
Estudos clínicos
Insuficiência cardíaca
Um total de 6.975 indivíduos com insuficiência cardíaca leve a grave foram avaliados em ensaios controlados por placebo de carvedilol.
Insuficiência Cardíaca Leve a Moderada
O carvedilol foi estudado em 5 estudos multicêntricos controlados por placebo e em 1 estudo controlado por ativo (estudo COMET) envolvendo indivíduos com insuficiência cardíaca leve a moderada.
Quatro estudos multicêntricos, duplo-cegos e controlados por placebo nos EUA envolveram 1.094 indivíduos (696 randomizados para carvedilol) com insuficiência cardíaca classe II-III da NYHA e fração de ejeção menor ou igual a 0,35. A grande maioria estava em digitálicos, diuréticos e um inibidor da ECA no início do estudo. Os pacientes foram designados para os ensaios com base na capacidade de exercício. Um estudo duplo-cego, controlado por placebo, Austrália-Nova Zelândia envolveu 415 indivíduos (metade randomizados para carvedilol) com insuficiência cardíaca menos grave. Todos os protocolos excluíram indivíduos com expectativa de transplante cardíaco durante os 7,5 a 15 meses de acompanhamento duplo-cego. Todos os indivíduos randomizados toleraram um curso de 2 semanas com carvedilol 6,25 mg duas vezes ao dia.
Em cada estudo, houve um desfecho primário, ou progressão da insuficiência cardíaca (1 estudo nos EUA) ou tolerância ao exercício (2 estudos nos EUA que atingiram as metas de inscrição e o estudo Austrália-Nova Zelândia). Havia muitos desfechos secundários especificados nesses estudos, incluindo classificação da NYHA, avaliações globais de pacientes e médicos e hospitalização cardiovascular. Outras análises não planejadas prospectivamente incluíram a soma de óbitos e total de internações cardiovasculares. Em situações em que os desfechos primários de um estudo não mostram um benefício significativo do tratamento, a atribuição de valores de significância aos outros resultados é complexa e esses valores precisam ser interpretados com cautela.
Os resultados dos estudos nos EUA e Austrália-Nova Zelândia foram os seguintes:
Retardando a Progressão da Insuficiência Cardíaca
Um estudo multicêntrico americano (366 indivíduos) teve como desfecho primário a soma da mortalidade cardiovascular, hospitalização cardiovascular e aumento sustentado de medicamentos para insuficiência cardíaca. A progressão da insuficiência cardíaca foi reduzida, durante um seguimento médio de 7 meses, em 48% (P = 0,008).
No estudo Austrália-Nova Zelândia, a morte e o total de hospitalizações foram reduzidos em cerca de 25% ao longo de 18 a 24 meses. Nos 3 maiores estudos dos EUA, a morte e o total de hospitalizações foram reduzidos em 19%, 39% e 49%, nominalmente estatisticamente significantes nos últimos 2 estudos. Os resultados Austrália-Nova Zelândia foram estatisticamente limítrofes.
Medidas Funcionais
Nenhum dos estudos multicêntricos teve a classificação da NYHA como desfecho primário, mas todos esses estudos tiveram como desfecho secundário. Houve pelo menos uma tendência de melhora na classe NYHA em todos os ensaios. A tolerância ao exercício foi o desfecho primário em 3 ensaios; em nenhum foi encontrado um efeito estatisticamente significativo.
Medidas subjetivas
qualidade de vida relacionada à saúde, medida com um questionário padrão (um desfecho primário em 1 estudo), não foi afetada pelo carvedilol. No entanto, as avaliações globais de pacientes e pesquisadores mostraram melhora significativa na maioria dos estudos.
Mortalidade
A morte não foi um desfecho pré-especificado em nenhum estudo, mas foi analisado em todos os estudos. No geral, nesses 4 estudos nos EUA, a mortalidade foi reduzida, nominalmente significativamente em 2 estudos.
O julgamento do COMETA
Neste estudo duplo-cego, 3.029 indivíduos com insuficiência cardíaca classe II-IV da NYHA (fração de ejeção do ventrículo esquerdo menor ou igual a 35%) foram randomizados para receber carvedilol (dose alvo: 25 mg duas vezes ao dia) ou metoprolol de liberação imediata tartarato (dose alvo: 50 mg duas vezes ao dia). A idade média dos indivíduos foi de aproximadamente 62 anos, 80% eram do sexo masculino e a fração de ejeção média do ventrículo esquerdo no início do estudo foi de 26%. Aproximadamente 96% dos indivíduos tinham insuficiência cardíaca classe II ou III da NYHA. O tratamento concomitante incluiu diuréticos (99%), inibidores da ECA (91%), digitálicos (59%), antagonistas da aldosterona (11%) e agentes hipolipemiantes “estatinas” (21%). A duração média do seguimento foi de 4,8 anos. A dose média de carvedilol foi de 42 mg por dia.
estudo teve 2 desfechos primários: mortalidade por todas as causas e o composto de morte mais hospitalização por qualquer motivo. Os resultados do COMET são apresentados na Tabela 3 abaixo. A mortalidade por todas as causas teve a maior parte do peso estatístico e foi o principal determinante do tamanho do estudo. A mortalidade por todas as causas foi de 34% nos indivíduos tratados com carvedilol e foi de 40% no grupo metoprolol de liberação imediata (P = 0,0017; taxa de risco = 0,83, IC 95%: 0,74 a 0,93). O efeito sobre a mortalidade foi principalmente devido a uma redução na morte cardiovascular. A diferença entre os 2 grupos em relação ao ponto final composto não foi significativa (P = 0,122). A sobrevida média estimada foi de 8,0 anos com carvedilol e 6,6 anos com metoprolol de liberação imediata.
Não se sabe se esta formulação de metoprolol em qualquer dose ou esta baixa dose de metoprolol em qualquer formulação tem algum efeito na sobrevida ou hospitalização em pacientes com insuficiência cardíaca. Assim, este estudo estende o tempo durante o qual o carvedilol manifesta benefícios na sobrevida na insuficiência cardíaca, mas não é evidência de que o carvedilol melhore o resultado em relação à formulação do metoprolol (TOPROL-XL) com benefícios na insuficiência cardíaca.
Insuficiência Cardíaca Grave (COPERNICUS)
Em um estudo duplo-cego (COPERNICUS), 2.289 indivíduos com insuficiência cardíaca em repouso ou com esforço mínimo e fração de ejeção do ventrículo esquerdo inferior a 25% (média de 20%), apesar de digitálicos (66%), diuréticos (99%) e Os inibidores da ECA (89%), foram randomizados para placebo ou carvedilol. O carvedilol foi titulado a partir de uma dose inicial de 3,125 mg duas vezes ao dia até a dose máxima tolerada ou até 25 mg duas vezes ao dia por um período mínimo de 6 semanas. A maioria dos indivíduos atingiu a dose alvo de 25 mg. O julgamento foi realizado na Europa Oriental e Ocidental, Estados Unidos, Israel e Canadá. Números semelhantes de indivíduos por grupo (cerca de 100) retiraram-se durante o período de titulação.
desfecho primário do estudo foi a mortalidade por todas as causas, mas a mortalidade por causa específica e o risco de morte ou hospitalização (total, cardiovascular [CV] ou insuficiência cardíaca [IC]) também foram examinados. Os dados do estudo em desenvolvimento foram seguidos por um comitê de monitoramento de dados e as análises de mortalidade foram ajustadas para esses múltiplos olhares. O estudo foi interrompido após um acompanhamento médio de 10 meses devido a uma redução observada de 35% na mortalidade (de 19,7% por paciente-ano com placebo para 12,8% com carvedilol; taxa de risco 0,65, IC 95%: 0,52 a 0,81, P = 0,0014, ajustado) (ver Figura 1). Os resultados do COPERNICUS são mostrados na Tabela 4.
Figura 1. Análise de sobrevivência para COPERNICUS (intenção de tratar) 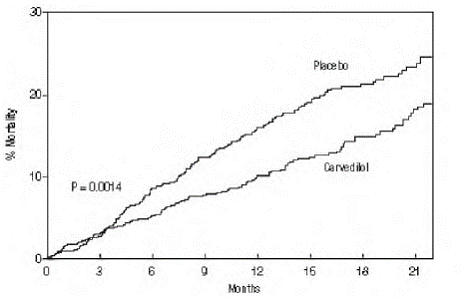
O efeito sobre a mortalidade foi principalmente o resultado de uma redução na taxa de morte súbita entre os indivíduos sem agravamento da insuficiência cardíaca.
As avaliações globais dos pacientes, nas quais os indivíduos tratados com carvedilol foram comparados com placebo, foram baseadas em autoavaliações periódicas e pré-especificadas dos pacientes sobre se o estado clínico pós-tratamento apresentou melhora, piora ou nenhuma alteração em comparação com o valor basal. Os indivíduos tratados com carvedilol apresentaram melhorias significativas nas avaliações globais em comparação com aqueles tratados com placebo no COPERNICUS.
O protocolo também especificava que as internações seriam avaliadas. Menos indivíduos em COREG 6,25mg do que em placebo foram hospitalizados por qualquer motivo (372 versus 432, P = 0,0029), por razões cardiovasculares (246 versus 314, P = 0,0003) ou por piora da insuficiência cardíaca (198 versus 268, P = 0,0001 ).
COREG 6,25mg teve um efeito consistente e benéfico na mortalidade por todas as causas, bem como nos desfechos combinados de mortalidade por todas as causas mais hospitalização (total, CV ou por insuficiência cardíaca) na população geral do estudo e em todos os subgrupos examinados, incluindo homens e mulheres, idosos e não idosos, negros e não negros, diabéticos e não diabéticos (ver Figura 2).
Figura 2. Efeitos sobre a mortalidade para subgrupos em COPERNICUS 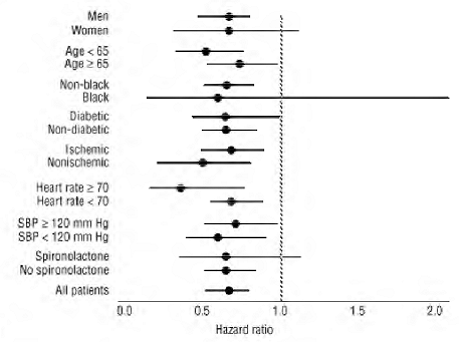
Disfunção Ventricular Esquerda Após Infarto do Miocárdio
CAPRICORN foi um estudo duplo-cego comparando carvedilol e placebo em 1.959 indivíduos com infarto do miocárdio recente (dentro de 21 dias) e fração de ejeção do ventrículo esquerdo menor ou igual a 40%, com (47%) ou sem sintomas de insuficiência cardíaca. Os indivíduos que receberam carvedilol receberam 6,25 mg duas vezes ao dia, titulado conforme tolerado para 25 mg duas vezes ao dia. Os indivíduos tinham que ter pressão arterial sistólica maior que 90 mm Hg, frequência cardíaca sentada maior que 60 batimentos por minuto e nenhuma contraindicação ao uso de β-bloqueador. O tratamento do infarto índice incluiu aspirina (85%), β-bloqueadores intravenosos ou orais (37%), nitratos (73%), heparina (64%), trombolíticos (40%) e angioplastia aguda (12%). O tratamento de base inclui inibidores da ECA ou bloqueadores dos receptores da angiotensina (97%), anticoagulantes (20%), agentes hipolipemiantes (23%) e diuréticos (34%). As características da população basal incluíram uma idade média de 63 anos, 74% do sexo masculino, 95% caucasianos, pressão arterial média de 121/74 mm Hg, 22% com diabetes e 54% com histórico de hipertensão. A dosagem média alcançada de carvedilol foi de 20 mg duas vezes ao dia; a duração média do seguimento foi de 15 meses.
mortalidade por todas as causas foi de 15% no grupo placebo e 12% no grupo carvedilol, indicando uma redução de risco de 23% em indivíduos tratados com carvedilol (IC 95%: 2% a 40%, P = 0,03), conforme mostrado na Figura 3. Os efeitos sobre a mortalidade em vários subgrupos são mostrados na Figura 4. Quase todas as mortes foram cardiovasculares (que foram reduzidas em 25% pelo carvedilol), e a maioria dessas mortes foi súbita ou relacionada à falha da bomba (ambos os tipos de morte foram reduzidos por carvedilol). Outro desfecho do estudo, mortalidade total e hospitalização por todas as causas, não apresentou melhora significativa.
Houve também uma redução significativa de 40% no infarto do miocárdio fatal ou não fatal observada no grupo tratado com carvedilol (IC 95%: 11% a 60%, P = 0,01). Uma redução semelhante no risco de infarto do miocárdio também foi observada em uma meta-análise de ensaios controlados por placebo de carvedilol na insuficiência cardíaca.
Figura 3. Análise de Sobrevivência para CAPRICÓRNIO (Intenção de Tratar) 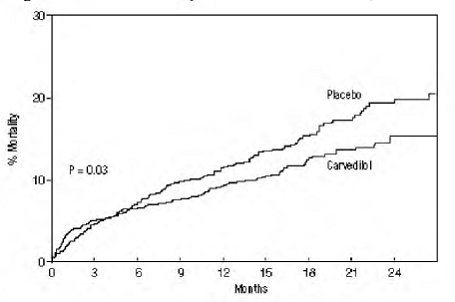
Figura 4. Efeitos sobre a mortalidade para subgrupos em CAPRICÓRNIO 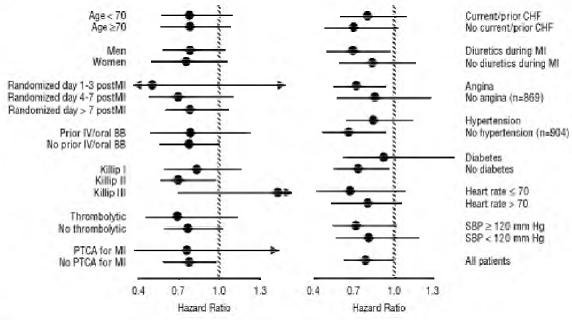
Hipertensão
COREG 25mg foi estudado em 2 ensaios controlados por placebo que utilizaram a dosagem duas vezes ao dia em doses diárias totais de 12,5 a 50 mg. Nestes e em outros ensaios, a dose inicial não excedeu 12,5 mg. Com 50 mg por dia, o COREG reduziu a pressão arterial de vale sentado (12 horas) em cerca de 9/5,5 mm Hg; a 25 mg por dia o efeito foi de cerca de 7,5/3,5 mm Hg. As comparações da pressão arterial de vale a pico mostraram uma razão de vale a pico para a resposta da pressão arterial de cerca de 65%. A frequência cardíaca caiu cerca de 7,5 batimentos por minuto com 50 mg por dia. Em geral, como acontece com outros β-bloqueadores, as respostas foram menores em negros do que em não-negros. Não houve diferenças relacionadas à idade ou sexo na resposta.
O pico do efeito anti-hipertensivo ocorreu 1 a 2 horas após a dose. A resposta da pressão arterial relacionada à dose foi acompanhada por um aumento dos efeitos adversos relacionados à dose [ver REAÇÕES ADVERSAS ].
Hipertensão com Diabetes Mellitus tipo 2
Em um estudo duplo-cego (GEMINI), COREG 25mg, adicionado a um inibidor da ECA ou bloqueador do receptor de angiotensina, foi avaliado em uma população com hipertensão leve a moderada e diabetes mellitus tipo 2 bem controlada. A HbA1c média no início do estudo foi de 7,2%. COREG foi titulado para uma dose média de 17,5 mg duas vezes ao dia e mantido por 5 meses. O COREG não teve nenhum efeito adverso no controle glicêmico, com base nas medições de HbA1c (alteração média da linha de base de 0,02%, IC de 95%: -0,06 a 0,10, P = NS) [ver AVISOS E PRECAUÇÕES ].
INFORMAÇÃO DO PACIENTE
CORREG (Co-REG) (carvedilol) Comprimidos
Leia as informações do paciente que acompanham o COREG antes de começar a tomá-lo e sempre que receber uma recarga. Pode haver novas informações. Esta informação não substitui a conversa com seu médico sobre sua condição médica ou seu tratamento. Se você tiver alguma dúvida sobre COREG 3,12mg, pergunte ao seu médico ou farmacêutico.
O que é COREG 3,12mg?
COREG é um medicamento sujeito a receita médica que pertence a um grupo de medicamentos denominados “betabloqueadores”. COREG 6,25mg é usado, muitas vezes com outros medicamentos, para as seguintes condições:
- para tratar pacientes com certos tipos de insuficiência cardíaca
- para tratar pacientes que tiveram um ataque cardíaco que piorou o quão bem o coração bombeia
- para tratar pacientes com pressão alta (hipertensão)
COREG não está aprovado para uso em crianças menores de 18 anos.
Quem não deve tomar COREG?
Não tome COREG 6,25mg se você:
- têm insuficiência cardíaca grave e são hospitalizados na unidade de terapia intensiva ou necessitam de certos medicamentos intravenosos que ajudam a manter a circulação (medicamentos inotrópicos).
- são propensos a asma ou outros problemas respiratórios.
- tem um batimento cardíaco lento ou um coração que salta uma batida (batimento cardíaco irregular).
- tem problemas de fígado.
- são alérgicos a qualquer um dos ingredientes do COREG. O ingrediente ativo é o carvedilol. Consulte o final deste folheto para obter uma lista de todos os ingredientes do COREG.
que devo dizer ao meu médico antes de tomar COREG?
Informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem asma ou outros problemas pulmonares (como bronquite ou enfisema).
- tem problemas com o fluxo sanguíneo nos pés e pernas (doença vascular periférica). COREG 3,12mg pode piorar alguns dos seus sintomas.
- tem diabetes.
- tem problemas de tireóide.
- tem uma condição chamada feocromocitoma.
- tiveram reações alérgicas graves.
- está grávida ou tentando engravidar. Não se sabe se COREG é seguro para o feto. Você e seu médico devem conversar sobre a melhor maneira de controlar sua pressão alta durante a gravidez.
- estão amamentando. Não se sabe se COREG passa para o leite materno. Fale com o seu médico sobre a melhor forma de alimentar o seu bebé se estiver a tomar COREG.
- estão programados para cirurgia e receberão agentes anestésicos.
- estão programados para cirurgia de catarata e tomaram ou estão tomando COREG.
- estão tomando medicamentos prescritos ou de venda livre, vitaminas e suplementos de ervas. COREG e alguns outros medicamentos podem afetar uns aos outros e causar efeitos colaterais graves. COREG 3,12 mg pode afetar a forma como outros medicamentos funcionam. Além disso, outros medicamentos podem afetar o funcionamento de COREG 25mg.
Mantenha uma lista de todos os medicamentos que você toma. Mostre esta lista ao seu médico e farmacêutico antes de iniciar um novo medicamento.
Como devo tomar COREG?
É importante que tome o medicamento todos os dias conforme indicado pelo seu médico. Se você parar de tomar COREG repentinamente, poderá ter dor no peito e/ou ataque cardíaco. Se o seu médico decidir que deve parar de tomar COREG 6,25 mg, o seu médico pode diminuir lentamente a sua dose ao longo de um período de tempo antes de parar completamente.
- Tome COREG exatamente como prescrito. O seu médico irá dizer-lhe quantos comprimidos deve tomar e com que frequência. Para minimizar possíveis efeitos colaterais, seu médico pode começar com uma dose baixa e depois aumentar lentamente a dose.
- Não pare de tomar COREG e não altere a quantidade de COREG que você toma sem falar com seu médico.
- Informe o seu médico se ganhar peso ou tiver dificuldade em respirar enquanto estiver a tomar COREG.
- Tome COREG com alimentos.
- Se você perder uma dose de COREG 3,12 mg, tome a dose assim que se lembrar, a menos que seja hora de tomar a próxima dose. Tome a sua próxima dose à hora habitual. Não tome 2 doses ao mesmo tempo.
- Se você tomar muito COREG 25mg, ligue para o seu médico ou centro de controle de envenenamento imediatamente.
O que devo evitar ao tomar COREG 3,12mg?
- COREG pode causar tonturas, cansaço ou desmaio. Não dirija um carro, use máquinas ou faça qualquer coisa que precise que você esteja alerta se tiver esses sintomas.
Quais são os possíveis efeitos colaterais do COREG?
- Pressão arterial baixa (que pode causar tonturas ou desmaios quando você se levanta). Se isso acontecer, sente-se ou deite-se imediatamente e informe o seu médico.
- Cansaço. Se se sentir cansado ou com tonturas, não deve conduzir, utilizar máquinas ou fazer qualquer coisa que necessite de estar alerta.
- Batimento cardíaco lento.
- Alterações no seu açúcar no sangue. Se você tem diabetes, informe o seu médico se tiver alguma alteração nos níveis de açúcar no sangue.
- COREG pode ocultar alguns dos sintomas de baixo nível de açúcar no sangue, especialmente batimentos cardíacos acelerados.
- COREG pode mascarar os sintomas de hipertireoidismo (tireoide hiperativa).
- Agravamento de reações alérgicas graves.
- Reações alérgicas raras, mas graves (incluindo urticária ou inchaço da face, lábios, língua e/ou garganta que podem causar dificuldade em respirar ou engolir) ocorreram em pacientes que estavam em COREG. Essas reações podem ser fatais.
Outros efeitos colaterais do COREG incluem falta de ar, ganho de peso, diarréia e menos lágrimas ou olhos secos que se tornam incômodos se você usar lentes de contato.
Ligue para o seu médico se você tiver quaisquer efeitos colaterais que o incomodem ou não desapareçam.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA1088.
Como devo armazenar COREG 6,25mg?
- Armazene o COREG a menos de 30°C (86°F). Mantenha os comprimidos secos.
- Com segurança, jogue fora o COREG que está desatualizado ou não é mais necessário.
- Mantenha COREG 6,25mg e todos os medicamentos fora do alcance das crianças.
Informações Gerais sobre o COREG
Os medicamentos às vezes são prescritos para condições diferentes das descritas nos folhetos informativos do paciente. Não use COREG 3,12mg para uma condição para a qual não foi prescrito. Não dê COREG a outras pessoas, mesmo que tenham os mesmos sintomas que você. Pode prejudicá-los.
Este folheto resume as informações mais importantes sobre o COREG. Se você quiser mais informações, converse com seu médico. Você pode pedir ao seu médico ou farmacêutico informações sobre COREG 6,25mg que foi escrito para profissionais de saúde.
Quais são os ingredientes do COREG?
Princípio ativo: carvedilol.
Ingredientes inativos: dióxido de silício coloidal, crospovidona, hipromelose, lactose, estearato de magnésio, polietilenoglicol, polissorbato 80, povidona, sacarose e dióxido de titânio.
Os comprimidos de carvedilol vêm nas seguintes dosagens: 3,125 mg, 6,25 mg, 12,5 mg, 25 mg.
O que é pressão alta (hipertensão)?
A pressão arterial é a força do sangue nos vasos sanguíneos quando o coração bate e quando o coração descansa. Você tem pressão alta quando a força é demais. A pressão alta faz com que o coração trabalhe mais para bombear o sangue pelo corpo e causa danos aos vasos sanguíneos. COREG pode ajudar seus vasos sanguíneos a relaxarem para que sua pressão arterial seja mais baixa. Medicamentos que baixam a pressão arterial podem diminuir sua chance de ter um acidente vascular cerebral ou ataque cardíaco.
