Adalat 10mg, 20mg, 30mg Nifedipine Uso, efeitos colaterais e dosagem. Preço na farmácia online. Medicamentos genericos sem receita.
O que é Adalat e como é usado?
Adalat é um medicamento de prescrição usado para tratar os sintomas de dor no peito (angina), pressão alta (hipertensão) e hipertensão pulmonar. Adalat 30mg pode ser usado sozinho ou com outros medicamentos.
Adalat 20mg pertence a uma classe de medicamentos chamados bloqueadores dos canais de cálcio; Bloqueadores dos canais de cálcio, dihidropiridina.
Não se sabe se Adalat 30mg é seguro e eficaz em crianças menores de 6 anos de idade.
Quais são os possíveis efeitos colaterais do Adalat 10mg?
Adalat pode causar efeitos colaterais graves, incluindo:
- urticária,
- dificuldade para respirar,
- inchaço no rosto ou na garganta,
- febre,
- dor de garganta,
- Olhos queimando,
- dor de pele,
- erupção cutânea vermelha ou roxa com bolhas e descamação,
- agravamento da dor no peito,
- batimentos cardíacos acelerados,
- vibrando em seu peito,
- tontura,
- inchaço nas mãos ou na parte inferior das pernas,
- dor de estômago superior e
- amarelecimento da pele ou dos olhos (icterícia)
Obtenha ajuda médica imediatamente, se tiver algum dos sintomas listados acima.
Os efeitos colaterais mais comuns do Adalat incluem:
- inchaço,
- rubor (calor, vermelhidão ou sensação de formigamento),
- dor de cabeça,
- tontura,
- náusea,
- azia, e
- sentindo-se fraco ou cansado
Informe o médico se tiver algum efeito colateral que o incomode ou que não desapareça.
Estes não são todos os possíveis efeitos colaterais do Adalat. Para mais informações, consulte seu médico ou farmacêutico.
Ligue para o seu médico para aconselhamento médico sobre os efeitos colaterais. Você pode relatar efeitos colaterais ao FDA em 1-800-FDA-1088.
DESCRIÇÃO
Adalat® CC é uma forma de dosagem em comprimido de liberação prolongada do bloqueador dos canais de cálcio nifedipina. Nifedipina é ácido 3,5-piridinadicarboxílico, 1,4-di-hidro-2,6-dimetil-4-(2-nitrofenil)-dimetil éster, C17H18N2O6, e tem a fórmula estrutural:
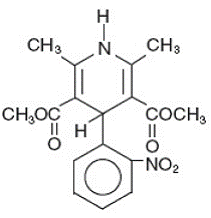
A nifedipina é uma substância cristalina amarela, praticamente insolúvel em água, mas solúvel em etanol. Tem um peso molecular de 346,3. Os comprimidos Adalat CC consistem em um revestimento externo e um núcleo interno. Ambos contêm nifedipina, o revestimento como formulação de liberação lenta e o núcleo como formulação de liberação rápida. Os comprimidos de Adalat CC contêm: 30, 60 ou 90 mg de nifedipina para administração oral uma vez ao dia.
Os ingredientes inertes da formulação são: hidroxipropilcelulose, lactose, amido de milho, crospovidona, celulose microcristalina, dióxido de silício e estearato de magnésio. Os ingredientes inertes do revestimento de filme para Adalat 30mg CC 30 e 60 são: hipromelose, polietilenoglicol, óxido férrico e dióxido de titânio. Os ingredientes inertes no revestimento de filme para Adalat 20mg CC 90 são: hipromelose, polietilenoglicol e óxido férrico
INDICAÇÕES
Adalat 10mg CC é indicado para o tratamento da hipertensão. Pode ser usado sozinho ou em combinação com outros agentes anti-hipertensivos.
DOSAGEM E ADMINISTRAÇÃO
dosagem deve ser ajustada de acordo com as necessidades de cada paciente. Recomenda-se que Adalat 20mg CC seja administrado por via oral uma vez ao dia com o estômago vazio. Adalat 10mg CC é uma forma farmacêutica de liberação prolongada e os comprimidos devem ser engolidos inteiros, não mordidos ou divididos. Em geral, a titulação deve prosseguir por um período de 7 a 14 dias, começando com 30 mg uma vez ao dia. A titulação ascendente deve ser baseada na eficácia e segurança terapêuticas. A dose de manutenção usual é de 30 mg a 60 mg uma vez ao dia. A titulação para doses acima de 90 mg por dia não é recomendada.
Se for necessária a descontinuação de Adalat 30mg CC, a prática clínica sólida sugere que a dosagem deve ser diminuída gradualmente com supervisão médica rigorosa.
A coadministração de nifedipina com sumo de toranja deve ser evitada (ver FARMACOLOGIA CLÍNICA e PRECAUÇÕES ).
Deve-se ter cuidado ao dispensar Adalat CC para assegurar que a forma farmacêutica de liberação prolongada foi prescrita.
COMO FORNECIDO
Adalat CC Os comprimidos de libertação prolongada são fornecidos como comprimidos revestidos por película redonda de 30 mg, 60 mg e 90 mg. Os diferentes pontos fortes podem ser identificados da seguinte forma:
Comprimidos Adalat® CC são fornecidos em:
Os comprimidos devem ser protegidos da luz e da umidade e armazenados abaixo de 30°C (86°F). Dispensar em recipientes apertados e resistentes à luz.
Fabricado para: Bayer HealthCare Pharmaceuticals Inc., Wayne, NJ 07470. Fabricado na Alemanha. Revisado: dezembro de 2015
EFEITOS COLATERAIS
Experiências Adversas
A incidência de eventos adversos durante o tratamento com Adalat CC em doses de até 90 mg por dia foi derivada de ensaios clínicos multicêntricos controlados por placebo em 370 pacientes hipertensos. Atenolol 50 mg uma vez ao dia foi usado concomitantemente em 187 dos 370 pacientes que receberam Adalat CC e em 64 dos 126 pacientes que receberam placebo. Todos os eventos adversos relatados durante a terapia com Adalat 30mg CC foram tabulados independentemente de sua relação causal com a medicação.
evento adverso mais comum relatado com Adalat 10mg CC foi edema periférico. Esta foi relacionada com a dose e a frequência foi de 18% com Adalat 30mg CC 30 mg por dia, 22% com Adalat 30mg CC 60 mg por dia e 29% com Adalat 10mg CC 90 mg por dia versus 10% com placebo.
Outros eventos adversos comuns relatados nos estudos controlados por placebo acima incluem:
Quando a frequência de eventos adversos com Adalat 20mg CC e placebo é semelhante, a relação causal não pode ser estabelecida.
Os seguintes eventos adversos foram relatados com uma incidência de 3% ou menos em doses diárias de até 90 mg:
Corpo como um todo/sistêmico: dor no peito, dor nas pernas
Sistema nervoso central: parestesia, vertigem
Dermatológico: irritação na pele
Gastrointestinal: constipação
Musculoesquelético: cãibras nas pernas
Respiratório: epistaxe, rinite
Urogenital: impotência, frequência urinária
Outros eventos adversos relatados com incidência inferior a 1,0% foram:
Corpo como um todo/sistêmico: reação alérgica, astenia, celulite, dor torácica subesternal, calafrios, edema facial, exame laboratorial anormal, mal-estar, dor no pescoço, dor pélvica, dor, reação de fotossensibilidade Cardiovascular: fibrilação atrial, bradicardia, parada cardíaca, extrassístole, hipotensão, enxaqueca, palpitações , flebite, hipotensão postural, taquicardia, angiectasias cutâneas
Sistema nervoso central: ansiedade, confusão, diminuição da libido, depressão, hipertonia, hipestesia, insônia, sonolência
Dermatológico: angioedema, erupção petequial, prurido, sudorese
Gastrointestinal: dor abdominal, diarreia, boca seca, disfagia, dispepsia, eructação, esofagite, flatulência, distúrbio gastrointestinal, hemorragia gastrointestinal, aumento de GGT, distúrbio gengival, hemorragia gengival, vômito
Hematologico: eosinofilia, linfadenopatia
Metabólico: gota, perda de peso
Musculoesquelético: artralgia, artrite, distúrbio articular, mialgia, miastenia
Respiratório: dispneia, tosse aumentada, estertores, faringite, estridor
Sentidos Especiais: visão anormal, ambliopia, conjuntivite, diplopia, distúrbio ocular, hemorragia ocular, zumbido
Urogenital/Reprodutivo: disúria, cálculo renal, noctúria, ingurgitamento mamário, poliúria, distúrbio urogenital, disfunção erétil (DE)
Os seguintes eventos adversos foram relatados raramente em pacientes que receberam nifedipina no núcleo da pelagem ou outras formulações: hepatite alergênica, alopecia, reação anafilática, anemia, artrite com ANA (+), depressão, eritromelalgia, dermatite esfoliativa, febre, hiperplasia gengival, ginecomastia, hiperglicemia, icterícia, leucopenia, alterações de humor, cãibras musculares, nervosismo, síndrome paranoide, púrpura, tremores, distúrbios do sono, síndrome de Stevens-Johnson, síncope, alteração do paladar, trombocitopenia, necrólise epidérmica tóxica, cegueira transitória no pico do nível plasmático, tremor e urticária.
INTERAÇÕES MEDICAMENTOSAS
nifedipina é eliminada principalmente por metabolismo e é um substrato do CYP3A. Inibidores e indutores do CYP3A podem afetar a exposição à nifedipina e, consequentemente, seus efeitos desejáveis e indesejáveis. Dados in vitro e in vivo indicam que a nifedipina pode inibir o metabolismo de medicamentos que são substratos do CYP3A, aumentando assim a exposição a outros medicamentos. A nifedipina é um vasodilatador e a coadministração de outros medicamentos que afetam a pressão arterial pode resultar em interações farmacodinâmicas.
Inibidores de CYP3A
Inibidores do CYP3A, como cetoconazol, fluconazol, itraconazol, claritromicina, eritromicina (a azitromicina, embora estruturalmente relacionada à classe de antibiótico macrolídeo não tem inibição clinicamente relevante do CYP3A4), toranja, nefazodona, fluoxetina, saquinavir, indinavir, nelfinavir e ritonavir podem resultar no aumento da exposição à nifedipina quando coadministrada. Monitoramento cuidadoso e ajuste de dose podem ser necessários; considerar iniciar nifedipina na dose mais baixa disponível se administrada concomitantemente com esses medicamentos.
Indutores fortes de CYP3A
Indutores fortes de CYP3A, como rifampicina, rifabutina, fenobarbital, fenitoína, carbamazepina e Erva de São João reduzem a biodisponibilidade e eficácia da nifedipina; portanto, a nifedipina não deve ser usada em combinação com indutores fortes do CYP3A, como a rifampicina (ver CONTRA-INDICAÇÕES ).
Medicamentos Cardiovasculares
Antiarrítmicos
Quinidina: quinidina é um substrato do CYP3A e demonstrou inibir o CYP3A in vitro. A coadministração de doses múltiplas de sulfato de quinidina, 200 mg tid, e nifedipina, 20 mg tid, aumentou Cmax e AUC de nifedipina em voluntários saudáveis por fatores de 2,30 e 1,37, respectivamente. A frequência cardíaca no intervalo inicial após a administração do medicamento foi aumentada em até 17,9 batimentos/minuto. A exposição à quinidina não foi alterada de forma importante na presença de nifedipina. A monitorização da frequência cardíaca e o ajuste da dose de nifedipina, se necessário, são recomendados quando a quinidina é adicionada a um tratamento com nifedipina.
Flecainida: Há muito pouca experiência com a coadministração de Tambocor com nifedipina para recomendar o uso concomitante.
Bloqueadores dos canais de cálcio
Diltiazem: pré-tratamento de voluntários saudáveis com 30 mg ou 90 mg tid de diltiazem VO aumentou a AUC da nifedipina após uma dose única de 20 mg de nifedipina por fatores de 2,2 e 3,1, respectivamente. Os valores de Cmax correspondentes de nifedipina aumentaram por fatores de 2,0 e 1,7, respectivamente. Deve-se ter cautela ao co-administrar diltiazem e nifedipina e uma redução da dose de nifedipina deve ser considerada.
Verapamil: O verapamil, um inibidor do CYP3A, pode inibir o metabolismo da nifedipina e aumentar a exposição à nifedipina durante a terapia concomitante. A pressão arterial deve ser monitorizada e considerada a redução da dose de nifedipina.
Inibidores da ECA
Benazepril: Em voluntários saudáveis que receberam dose única de 20 mg de nifedipina ER e benazepril 10 mg, as concentrações plasmáticas de benazeprilato e nifedipina na presença e ausência um do outro não foram estatisticamente significativamente diferentes. Um efeito hipotensor só foi observado após a co-administração das duas drogas. O efeito taquicárdico da nifedipina foi atenuado na presença de benazepril.
Bloqueadores de Angiotensina-II
Irbesartana: Estudos in vitro mostram inibição significativa da formação de metabólitos oxidados de irbesartana pela nifedipina. No entanto, em estudos clínicos, a nifedipina concomitante não teve efeito na farmacocinética do irbesartan.
Candesartana: Nenhuma interação medicamentosa significativa foi relatada em estudos com candesartana cilexitila administrado em conjunto com nifedipina. Como a candesartana não é significativamente metabolizada pelo sistema do citocromo P450 e em concentrações terapêuticas não tem efeito sobre as enzimas do citocromo P450, não seriam esperadas interações com drogas que inibem ou são metabolizadas por essas enzimas.
Bloqueadores beta
Adalat 10mg CC foi bem tolerado quando administrado em combinação com betabloqueadores em 187 pacientes hipertensos em um ensaio clínico controlado por placebo. No entanto, houve relatos ocasionais na literatura sugerindo que a combinação de nifedipina e drogas bloqueadoras beta-adrenérgicas pode aumentar a probabilidade de insuficiência cardíaca congestiva, hipotensão grave ou exacerbação de angina em pacientes com doença cardiovascular. Recomenda-se monitorização clínica e deve ser considerado um ajuste da dose de nifedipina.
Timolol: hipotensão é mais provável de ocorrer se os antagonistas do cálcio da di-hidropriridina, como a nifedipina, forem coadministrados com timolol.
Central Alpha1-Bloqueadores
Doxazosina: Voluntários saudáveis que participaram de um estudo de interação de dose múltipla de doxazosina-nifedipina receberam 2 mg de doxazosina qd isoladamente ou combinado com 20 mg de nifedipina ER bid A coadministração de nifedipina resultou em uma diminuição na AUC e Cmax da doxazosina para 83% e 86% dos valores na ausência de nifedipina, respectivamente. Na presença de doxazosina, a AUC e Cmax da nifedipina foram aumentadas por fatores de 1,13 e 1,23, respectivamente. Em comparação com a monoterapia com nifedipina, a pressão arterial foi menor na presença de doxazosina. A pressão arterial deve ser monitorada quando a doxazosina é coadministrada com nifedipina, e a redução da dose de nifedipina deve ser considerada.
Digital
Digoxina: administração simultânea de nifedipina e digoxina pode levar à redução da depuração resultando em aumento nas concentrações plasmáticas de digoxina. Uma vez que há relatos isolados de pacientes com níveis elevados de digoxina e existe uma possível interação entre digoxina e Adalat CC, recomenda-se que os níveis de digoxina sejam monitorados ao iniciar, ajustar e descontinuar Adalat 10mg CC para evitar possível super ou subestimação. digitalização.
Antitrombóticos
Cumarinas: Houve relatos raros de aumento do tempo de protrombina em pacientes tomando anticoagulantes cumarínicos aos quais nifedipina foi administrada. No entanto, a relação com a terapia com nifedipina é incerta.
Inibidores de Agregação de Plaquetas
Clopidogrel: Não foram observadas interações farmacodinâmicas clinicamente significativas quando o clopidrogrel foi coadministrado com nifedipina.
Tirofiban: A coadministração de nifedipina não alterou significativamente a exposição ao tirofiban.
Outro
Diuréticos, inibidores de PDE5, alfa-metildopa: A nifedipina pode aumentar o efeito de redução da pressão arterial destes agentes administrados concomitantemente.
Medicamentos Não Cardiovasculares
Medicamentos antifúngicos
Cetoconazol, itraconazol e fluconazol são inibidores do CYP3A e podem inibir o metabolismo da nifedipina e aumentar a exposição à nifedipina durante a terapia concomitante. A pressão arterial deve ser monitorizada e considerada uma redução da dose de nifedipina.
Drogas Antisecretoras
Omeprazol: Em voluntários saudáveis que receberam uma dose única de 10 mg de nifedipina, a AUC e Cmax de nifedipina após pré-tratamento com omeprazol 20 mg qd por 8 dias foram 1,26 e 0,87 vezes maiores que após o pré-tratamento com placebo. O pré-tratamento ou coadministração de omeprazol não afetou o efeito da nifedipina na pressão arterial ou na frequência cardíaca. O impacto do omeprazol na nifedipina provavelmente não tem relevância clínica.
Pantoprazol: Em voluntários saudáveis, a exposição a nenhuma das drogas foi alterada significativamente na presença da outra droga.
Ranitidina: Cinco estudos em voluntários saudáveis investigaram o impacto de doses múltiplas de ranitidina na farmacocinética de dose única ou múltipla de nifedipina. Dois estudos investigaram o impacto da ranitidina coadministrada na pressão arterial em indivíduos hipertensos em uso de nifedipina. A coadministração de ranitidina não teve efeitos relevantes sobre a exposição à nifedipina que afetou a pressão arterial ou a frequência cardíaca em indivíduos normotensos ou hipertensos.
Cimetidina: Cinco estudos em voluntários saudáveis investigaram o impacto de doses múltiplas de cimetidina na farmacocinética de dose única ou múltipla de nifedipina. Dois estudos investigaram o impacto da cimetidina coadministrada na pressão arterial em indivíduos hipertensos em uso de nifedipina. Em indivíduos normotensos que receberam doses únicas de 10 mg ou doses múltiplas de até 20 mg de nifedipina três vezes ao dia isoladamente ou em conjunto com cimetidina até 1000 mg/dia, os valores de AUC de nifedipina na presença de cimetidina foram entre 1,52 e 2,01 vezes aqueles no ausência de cimetidina. Os valores de Cmax da nifedipina na presença de cimetidina foram aumentados por fatores que variaram entre 1,60 e 2,02. O aumento da exposição à nifedipina pela cimetidina foi acompanhado por alterações relevantes na pressão arterial ou frequência cardíaca em indivíduos normotensos. Indivíduos hipertensos recebendo 10 mg qd de nifedipina isoladamente ou em combinação com cimetidina 1.000 mg qd também apresentaram alterações relevantes na pressão arterial quando a cimetidina foi adicionada à nifedipina. A interação entre cimetidina e nifedipina é de relevância clínica e a pressão arterial deve ser monitorada e uma redução da dose de nifedipina considerada.
Cisaprida: A administração simultânea de cisaprida e nifedipina pode levar ao aumento das concentrações plasmáticas de nifedipina.
Medicamentos Antibacterianos
Quinupristina/Dalfopristina: Estudos de interação medicamentosa in vitro demonstraram que a quinupristina/dalfopristina inibe significativamente o metabolismo do CYP3A da nifedipina. A administração concomitante de quinupristina/dalfopristina e nifedipina (dose oral repetida) em voluntários saudáveis aumentou a AUC e a Cmax da nifedipina por fatores de 1,44 e 1,18, respectivamente, em comparação com a monoterapia com nifedipina. Após a coadministração de quinupristina/dalfopristina com nifedipina, a pressão arterial deve ser monitorizada e considerada uma redução da dose de nifedipina.
Eritromicina: A eritromicina, um inibidor do CYP3A, pode inibir o metabolismo da nifedipina e aumentar a exposição à nifedipina durante a terapia concomitante. A pressão arterial deve ser monitorizada e considerada a redução da dose de nifedipina.
Medicamentos Antituberculose
Rifampina: Indutores fortes de CYP3A, como rifampicina, rifapentina e rifabutina, reduzem a biodisponibilidade da nifedipina, o que pode reduzir a eficácia da nifedipina; portanto, a nifedipina não deve ser usada em combinação com indutores fortes do CYP3A, como a rifampicina (ver CONTRA-INDICAÇÕES ). O impacto de doses orais múltiplas de 600 mg de rifampicina na farmacocinética da nifedipina após uma dose oral única de 20 mg cápsula de nifedipina foi avaliado em um estudo clínico. Doze voluntários saudáveis do sexo masculino receberam uma dose oral única de 20 mg de nifedipina cápsula no dia 1 do estudo. A partir do dia 2 do estudo, os indivíduos receberam 600 mg de rifampicina uma vez ao dia durante 14 dias. No dia 15 do estudo, uma segunda dose oral única de 20 mg de nifedipina cápsula foi administrada juntamente com a última dose de rifampicina. Em comparação com o Dia 1 do estudo, o pré-tratamento de 14 dias com rifampicina reduziu a Cmax e a AUC da nifedipina administrada concomitantemente em média em 95% e 97%, respectivamente.

Medicamentos antivirais
Amprenavir, atanazavir, delavirina, fosamprinavir, indinavir, nelfinavir e ritonavir, como inibidores do CYP3A, podem inibir o metabolismo da nifedipina e aumentar a exposição à nifedipina. Recomenda-se precaução e recomenda-se a monitorização clínica dos doentes.
Drogas do SNC
A nefazodona, um inibidor do CYP3A, pode inibir o metabolismo da nifedipina e aumentar a exposição à nifedipina durante a terapia concomitante. A pressão arterial deve ser monitorizada e considerada uma redução da dose de nifedipina.
A fluoxetina, um inibidor do CYP3A, pode inibir o metabolismo da nifedipina e aumentar a exposição à nifedipina durante a terapia concomitante. A pressão arterial deve ser monitorizada e considerada uma redução da dose de nifedipina.
O ácido valpróico pode aumentar a exposição à nifedipina durante o tratamento concomitante. A pressão arterial deve ser monitorizada e considerada uma redução da dose de nifedipina.
Fenitoína, Fenobarbital e Carbamazepina: nifedipina é metabolizada pelo CYP3A. A coadministração de 10 mg de nifedipina cápsula e 60 mg de nifedipina comprimido revestido com fenitoína, um indutor do CYP3A, reduziu a AUC e Cmax da nifedipina em aproximadamente 70%. O fenobarbital e a carbamazepina também são indutores do CYP3A. Terapia anti-hipertensiva alternativa deve ser considerada em pacientes em uso de fenitoína, fenobarbital e carbamazepina.
Drogas antieméticas
Dolasetron: Em pacientes tomando dolasetrona por via oral ou intravenosa e nifedipina, nenhum efeito foi demonstrado na depuração de hidrodolasetrona.
Drogas imunossupressoras
Tacrolimo: tacrolimus demonstrou ser metabolizado através do sistema CYP3A. A nifedipina demonstrou inibir o metabolismo do tacrolimus in vitro. Pacientes transplantados em tacrolimus e nifedipina necessitaram de doses de 26% a 38% menores do que os pacientes que não receberam nifedipina. A nifedipina pode aumentar a exposição ao tacrolimus. Quando a nifedipina é coadministrada com tacrolimus, as concentrações sanguíneas de tacrolimus devem ser monitorizadas e deve ser considerada uma redução da dose de tacrolimus.
Sirolimus: Uma dose única de 60 mg de nifedipina e uma dose única de 10 mg de solução oral de sirolimus foram administradas a 24 voluntários saudáveis. Não foram observadas interações farmacocinéticas clinicamente significativas.
Medicamentos para baixar a glicose
Pioglitazona: coadministração de pioglitazona por 7 dias com 30 mg de nifedipina ER administrado por via oral qd por 4 dias a voluntários do sexo masculino e feminino resultou em valores de média quadrada (IC 90%) para nifedipina inalterada de 0,83 (0,73-0,95) para Cmax e 0,88 ( 0,80-0,96) para AUC em relação à monoterapia com nifedipina. Tendo em vista a alta variabilidade da farmacocinética da nifedipina, o significado clínico deste achado é desconhecido.
Rosiglitazona: A coadministração de rosiglitazona (4 mg duas vezes ao dia) demonstrou não ter efeito clinicamente relevante sobre a farmacocinética da nifedipina.
Metformina: Um estudo de interação de dose única de metformina-nifedipina em voluntários saudáveis normais demonstrou que a coadministração de nifedipina aumentou a Cmax e a AUC plasmática da metformina em 20% e 9%, respectivamente, e aumentou a quantidade de metformina excretada na urina. Tmax e meia-vida não foram afetados. A nifedipina parece aumentar a absorção da metformina.
Miglitol: Nenhum efeito do miglitol foi observado na farmacocinética e farmacodinâmica da nifedipina.
Repaglinida: A coadministração de 10 mg de nifedipina com uma dose única de 2 mg de repaglinida (após 4 dias nifedipina 10 mg tid e repaglinide 2 mg tid) resultou em valores inalterados de AUC e Cmax para ambos os medicamentos.
Acarbose: A nifedipina tende a produzir hiperglicemia e pode levar à perda do controle da glicose. Se a nifedipina for coadministrada com acarbose, os níveis de glicose no sangue devem ser monitorados cuidadosamente e um ajuste de dose de nifedipina deve ser considerado.
Medicamentos que interferem na absorção de alimentos
Orlistato: Em 17 indivíduos de peso normal recebendo orlistat 120 mg três vezes ao dia por 6 dias, orlistat não alterou a biodisponibilidade de 60 mg de nifedipina (comprimidos de liberação prolongada).
Suplementos dietéticos
Suco de toranja: Em voluntários saudáveis, a coadministração de dose única de 250 mL de sumo de toranja com dose dupla com 10 mg de nifedipina aumentou a AUC e a Cmax por fatores de 1,35 e 1,13, respetivamente. A ingestão de doses repetidas de sumo de toranja (5 x 200 mL em 12 horas) após a administração de 20 mg de nifedipina ER aumentou a AUC e Cmax da nifedipina por um fator de 2. O sumo de toranja deve ser evitado por doentes a tomar nifedipina. A ingestão de sumo de toranja deve ser interrompida pelo menos 3 dias antes do início do tratamento com nifedipina.
Ervas
Erva de São João: Erva de São João é um indutor do CYP3A e pode diminuir a exposição à nifedipina. Terapia anti-hipertensiva alternativa deve ser considerada em pacientes nos quais a terapia com Erva de São João é necessária.
Droga Sonda CYP2D6
Debrisoquina: Em voluntários saudáveis, o pré-tratamento com nifedipina 20 mg três vezes ao dia por 5 dias não alterou a proporção metabólica de hidroxidebrisoquina para debrisoquina medida na urina após uma dose única de 10 mg de debrisoquina. Assim, é improvável que a nifedipina iniba in vivo o metabolismo de outras drogas que são substratos do CYP2D6.
AVISOS
Hipotensão excessiva
Embora na maioria dos pacientes o efeito hipotensor da nifedipina seja modesto e bem tolerado, alguns pacientes tiveram hipotensão excessiva e mal tolerada. Essas respostas geralmente ocorreram durante a titulação inicial ou no momento do ajuste posológico subsequente e podem ser mais prováveis em pacientes usando betabloqueadores concomitantes.
Hipotensão grave e/ou aumento da necessidade de volume de líquidos foram relatados em pacientes que receberam cápsulas de liberação imediata juntamente com um agente betabloqueador e que foram submetidos a cirurgia de revascularização do miocárdio usando altas doses de anestesia com fentanil. A interação com altas doses de fentanil parece ser devido à combinação de nifedipina e betabloqueador, mas a possibilidade de que possa ocorrer com nifedipina isoladamente, com baixas doses de fentanil, em outros procedimentos cirúrgicos ou com outros analgésicos narcóticos não pode ser descartado. Em pacientes tratados com nifedipina nos quais a cirurgia com altas doses de anestesia com fentanil é contemplada, o médico deve estar ciente desses problemas potenciais e, se a condição do paciente permitir, deve haver tempo suficiente (pelo menos 36 horas) para que a nifedipina seja removida do o corpo antes da cirurgia.
Aumento da Angina e/ou Infarto do Miocárdio
Raramente, os pacientes, particularmente aqueles com doença arterial coronariana obstrutiva grave, desenvolveram um aumento bem documentado da frequência, duração e/ou gravidade de angina ou infarto agudo do miocárdio ao iniciar nifedipina ou no momento do aumento da dose. O mecanismo deste efeito não está estabelecido.
Retirada do Beta-Bloqueador
Ao descontinuar um betabloqueador, é importante diminuir a dose, se possível, em vez de interromper abruptamente antes de iniciar a nifedipina. Pacientes recentemente retirados de betabloqueadores podem desenvolver uma síndrome de abstinência com aumento da angina, provavelmente relacionada ao aumento da sensibilidade às catecolaminas. O início do tratamento com nifedipina não previne esta ocorrência e, ocasionalmente, foi relatado que a aumenta.
Insuficiência Cardíaca Congestiva
Raramente, os pacientes (geralmente enquanto recebem um betabloqueador) desenvolveram insuficiência cardíaca após o início da nifedipina. Pacientes com estenose aórtica apertada podem estar em maior risco para tal evento, pois o efeito de descarga da nifedipina seria menos benéfico para esses pacientes, devido à sua impedância fixa para fluir através da válvula aórtica.
PRECAUÇÕES
Em geral
Hipotensão
Como a nifedipina diminui a resistência vascular periférica, sugere-se o monitoramento cuidadoso da pressão arterial durante a administração inicial e a titulação de Adalat CC. A observação cuidadosa é especialmente recomendada para pacientes que já estão tomando medicamentos que são conhecidos por baixar a pressão arterial (consulte AVISOS ).
Edema periférico
Edema periférico leve a moderado ocorre de maneira dose-dependente com Adalat CC. A taxa de subtração do placebo é de aproximadamente 8% com 30 mg, 12% com 60 mg e 19% com 90 mg por dia. Este edema é um fenômeno localizado, que se acredita estar associado à vasodilatação de arteríolas dependentes e pequenos vasos sanguíneos e não devido à disfunção ventricular esquerda ou retenção generalizada de líquidos. Em pacientes cuja hipertensão é complicada por insuficiência cardíaca congestiva, deve-se ter cuidado para diferenciar esse edema periférico dos efeitos da disfunção ventricular esquerda crescente.
Uso em pacientes cirróticos
A depuração da nifedipina é reduzida e a exposição sistêmica aumentada em pacientes com cirrose. Não se sabe como a exposição sistêmica pode ser alterada em pacientes com insuficiência hepática moderada ou grave. Monitoramento cuidadoso e redução da dose podem ser necessários; considerar iniciar a terapia com a menor dose disponível.
Testes laboratoriais
Foram observadas elevações raras, geralmente transitórias, mas ocasionalmente significativas de enzimas como fosfatase alcalina, CPK, LDH, SGOT e SGPT. A relação com a terapia com nifedipina é incerta na maioria dos casos, mas provável em alguns. Essas anormalidades laboratoriais raramente foram associadas a sintomas clínicos; entretanto, colestase com ou sem icterícia foi relatada. Um pequeno aumento (
nifedipina, como outros bloqueadores dos canais de cálcio, diminui a agregação plaquetária in vitro. Estudos clínicos limitados demonstraram uma diminuição moderada, mas estatisticamente significativa, na agregação plaquetária e aumento no tempo de sangramento em alguns pacientes com nifedipina. Acredita-se que isso seja uma função da inibição do transporte de cálcio através da membrana plaquetária. Nenhum significado clínico para esses achados foi demonstrado.
Teste de Coombs direto positivo com ou sem anemia hemolítica foi relatado, mas não foi possível determinar uma relação causal entre a administração de nifedipina e a positividade deste teste laboratorial, incluindo hemólise.
Embora a nifedipina tenha sido usada com segurança em pacientes com disfunção renal e tenha sido relatado que exerce um efeito benéfico em certos casos, raras elevações reversíveis no BUN e na creatinina sérica foram relatadas em pacientes com insuficiência renal crônica pré-existente. A relação com a terapia com nifedipina é incerta na maioria dos casos, mas provável em alguns.
Carcinogênese, Mutagênese, Prejuízo da Fertilidade
A nifedipina foi administrada por via oral a ratos durante dois anos e não se mostrou cancerígena. Quando administrado a ratos antes do acasalamento, a nifedipina causou redução da fertilidade em uma dose de aproximadamente 30 vezes a dose humana máxima recomendada. Há um relato na literatura de redução reversível na capacidade do esperma humano obtido de um número limitado de homens inférteis tomando as doses recomendadas de nifedipina para se ligar e fertilizar um óvulo in vitro. Os estudos de mutagenicidade in vivo foram negativos.
Gravidez
Gravidez Categoria C
Em roedores, coelhos e macacos, a nifedipina demonstrou ter uma variedade de efeitos embriotóxicos, placentotóxicos, teratogênicos e fetotóxicos, incluindo fetos atrofiados (ratos, camundongos e coelhos), anomalias digitais (ratos e coelhos), deformidades nas costelas (camundongos), fenda palatina (camundongos), placentas pequenas e vilosidades coriônicas subdesenvolvidas (macacos), mortes embrionárias e fetais (ratos, camundongos e coelhos), gravidez prolongada (ratos; não avaliada em outras espécies) e diminuição da sobrevida neonatal (ratos; não avaliada em outras espécies). Com base em mg/kg ou mg/m², algumas das doses associadas a esses vários efeitos são mais altas do que a dose humana máxima recomendada e algumas são mais baixas, mas todas estão dentro de uma ordem de magnitude dela.
As anomalias digitais observadas em filhotes de coelho expostos à nifedipina são notavelmente semelhantes àquelas observadas em filhotes expostos à fenitoína, e estas, por sua vez, são semelhantes às deformidades das falanges que são as malformações mais comuns observadas em crianças humanas com exposição in utero à fenitoína.
A partir das evidências clínicas disponíveis, não foi identificado um risco pré-natal específico. No entanto, um aumento na asfixia perinatal, parto cesáreo, prematuridade e retardo do crescimento intrauterino foram relatados.
A monitorização cuidadosa da pressão arterial deve ser realizada em mulheres grávidas, quando se administra nifedipina em combinação com sulfato de magnésio IV devido à possibilidade de uma queda excessiva da pressão arterial que pode prejudicar a mãe e o feto.
Não existem estudos adequados e bem controlados em mulheres grávidas.
Mães que amamentam
A nifedipina é excretada no leite humano. As mães que amamentam são aconselhadas a não amamentar seus bebês ao tomar o medicamento.
Uso Pediátrico
segurança e eficácia de Adalat 30mg CC em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Embora pequenos estudos farmacocinéticos tenham identificado um aumento da meia-vida e aumento da Cmax e AUC (ver FARMACOLOGIA CLÍNICA : Farmacocinética e Metabolismo ), os estudos clínicos da nifedipina não incluíram um número suficiente de indivíduos com 65 anos ou mais para determinar se eles respondem de forma diferente dos indivíduos mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os mais jovens. Em geral, a seleção da dose para um paciente idoso deve ser cautelosa, geralmente começando no limite inferior da faixa de dosagem, refletindo a maior frequência de diminuição da função hepática, renal ou cardíaca e de doença concomitante ou outra terapia medicamentosa.
Pacientes com intolerância à galactose
Uma vez que este medicamento contém lactose, os doentes com problemas hereditários raros de intolerância à galactose, deficiência de lactase de Lapp ou má absorção de glucose-galactose não devem tomar este medicamento.
SOBREDOSAGEM
experiência com superdosagem de nifedipina é limitada. Os sintomas associados à superdosagem grave de nifedipina incluem perda de consciência, queda da pressão arterial, distúrbios do ritmo cardíaco, acidose metabólica, hipóxia, choque cardiogênico com edema pulmonar. Geralmente, a superdosagem com nifedipina levando a hipotensão pronunciada requer suporte cardiovascular ativo, incluindo monitoramento da função cardiovascular e respiratória, elevação das extremidades, uso criterioso de infusão de cálcio, agentes vasopressores e fluidos. Após ingestão oral, é indicada lavagem gástrica completa, se necessário em combinação com irrigação do intestino delgado. Em casos envolvendo superdosagem de um produto de liberação lenta como a nifedipina, a eliminação deve ser tão completa quanto possível, inclusive do intestino delgado, para evitar a absorção subsequente da substância ativa. Líquido ou volume adicional deve ser administrado com cautela devido ao risco de sobrecarga de líquidos.
Espera-se que a depuração da nifedipina seja prolongada em pacientes com função hepática prejudicada. Como a nifedipina é altamente ligada às proteínas, a diálise provavelmente não trará nenhum benefício; no entanto, a plasmaférese pode ser benéfica.
Houve um caso relatado de superdosagem maciça com comprimidos de outra formulação de liberação prolongada de nifedipina. Os principais efeitos da ingestão de aproximadamente 4.800 mg de nifedipina em um jovem que tentou suicídio como resultado de depressão induzida por cocaína foram tonturas iniciais, palpitações, rubor e nervosismo. Algumas horas após a ingestão, desenvolveram-se náuseas, vômitos e edema generalizado. Nenhuma hipotensão significativa foi aparente na apresentação, 18 horas após a ingestão. As anormalidades da química do sangue consistiram em uma elevação leve e transitória da creatinina sérica e elevações modestas de LDH e CPK, mas TGO normal. Os sinais vitais permaneceram estáveis, nenhuma anormalidade eletrocardiográfica foi observada e a função renal voltou ao normal dentro de 24 a 48 horas apenas com medidas de suporte de rotina. Não foram observadas sequelas prolongadas.
efeito de uma única ingestão de 900 mg de cápsulas de nifedipina em um paciente anginoso deprimido em uso de antidepressivos tricíclicos foi perda de consciência dentro de 30 minutos após a ingestão e hipotensão profunda, que respondeu à infusão de cálcio, agentes vasopressores e reposição de fluidos. Uma variedade de anormalidades no ECG foi observada neste paciente com história de bloqueio de ramo, incluindo bradicardia sinusal e graus variados de bloqueio AV. Estes ditaram a colocação profilática de um marcapasso ventricular temporário, mas resolveram espontaneamente. Hiperglicemia significativa foi observada inicialmente neste paciente, mas os níveis plasmáticos de glicose rapidamente se normalizaram sem tratamento adicional.
Um paciente jovem hipertenso com insuficiência renal avançada ingeriu 280 mg de cápsulas de nifedipina de uma só vez, resultando em hipotensão acentuada em resposta à infusão de cálcio e líquidos. Não foram observadas anormalidades de condução AV, arritmias ou alterações pronunciadas na frequência cardíaca, nem houve qualquer deterioração adicional da função renal.
Os distúrbios bradicárdicos do ritmo cardíaco podem ser tratados sintomaticamente com ß-simpaticomiméticos e, nos distúrbios bradicárdicos do ritmo cardíaco com risco de vida, a terapia com marcapasso temporário pode ser aconselhável.
CONTRA-INDICAÇÕES
A administração concomitante com indutores fortes de P450, como a rifampicina, é contraindicada, pois a eficácia dos comprimidos de nifedipina pode ser significativamente reduzida. (Ver INTERAÇÕES MEDICAMENTOSAS )
A nifedipina não deve ser utilizada em caso de choque cardiogénico.
Adalat é contraindicado em pacientes com hipersensibilidade conhecida a qualquer componente do comprimido.
FARMACOLOGIA CLÍNICA
nifedipina é um inibidor do influxo de iões de cálcio (bloqueador dos canais lentos ou antagonista do ião de cálcio) que inibe o influxo transmembranar de iões de cálcio no músculo liso vascular e no músculo cardíaco. Os processos contráteis do músculo liso vascular e do músculo cardíaco dependem do movimento de íons cálcio extracelulares para dentro dessas células através de canais iônicos específicos. A nifedipina inibe seletivamente o influxo de íons cálcio através da membrana celular do músculo liso vascular e do músculo cardíaco sem alterar as concentrações séricas de cálcio.
Mecanismo de ação
O mecanismo pelo qual a nifedipina reduz a pressão arterial envolve a vasodilatação arterial periférica e, consequentemente, a redução da resistência vascular periférica. O aumento da resistência vascular periférica, uma causa subjacente da hipertensão, resulta de um aumento da tensão ativa no músculo liso vascular. Estudos demonstraram que o aumento da tensão ativa reflete um aumento do cálcio livre citosólico.
nifedipina é um vasodilatador arterial periférico que atua diretamente no músculo liso vascular. A ligação da nifedipina a canais dependentes de voltagem e possivelmente operados por receptor no músculo liso vascular resulta na inibição do influxo de cálcio através desses canais. As reservas de cálcio intracelular no músculo liso vascular são limitadas e, portanto, dependem do influxo de cálcio extracelular para que ocorra a contração. A redução do influxo de cálcio pela nifedipina causa vasodilatação arterial e diminuição da resistência vascular periférica, o que resulta em redução da pressão arterial.
Farmacocinética e Metabolismo
nifedipina é completamente absorvida após administração oral. A biodisponibilidade da nifedipina como Adalat CC em relação à nifedipina de liberação imediata está na faixa de 84%-89%. Após a ingestão dos comprimidos de Adalat CC em jejum, as concentrações plasmáticas atingem o pico em cerca de 2,5-5 horas com um segundo pequeno pico ou ombro evidente aproximadamente 6-12 horas após a dose. A meia-vida de eliminação da nifedipina administrada como Adalat CC é de aproximadamente 7 horas, em contraste com a meia-vida de eliminação conhecida de 2 horas da nifedipina administrada como cápsula de liberação imediata.
Quando Adalat CC é administrado como múltiplos de comprimidos de 30 mg em uma faixa de dose de 30 mg a 90 mg, a área sob a curva (AUC) é proporcional à dose; no entanto, a concentração plasmática máxima para a dose de 90 mg administrada como 3 x 30 mg é 29% maior do que o previsto para as doses de 30 mg e 60 mg.
Dois comprimidos de Adalat CC de 30 mg podem ser trocados por um comprimido de Adalat CC de 60 mg. Três comprimidos de Adalat CC de 30 mg, no entanto, resultam em valores de Cmax substancialmente mais altos do que aqueles após um único comprimido de 90 mg de Adalat 20 mg CC. Três comprimidos de 30 mg não devem, portanto, ser considerados intercambiáveis com um comprimido de 90 mg.
administração de Adalat CC uma vez ao dia em condições de jejum resulta em flutuações diminuídas na concentração plasmática de nifedipina quando comparada à dosagem tid com cápsulas de nifedipina de liberação imediata. O pico médio da concentração plasmática de nifedipina após um comprimido de 90 mg de Adalat 30 mg CC, administrado em jejum, é de aproximadamente 115 ng/mL. Quando Adalat CC é administrado imediatamente após uma refeição rica em gordura em voluntários saudáveis, há um aumento médio de 60% na concentração plasmática máxima de nifedipina, um prolongamento no tempo até a concentração máxima, mas nenhuma alteração significativa na AUC. As concentrações plasmáticas de nifedipina quando Adalat 20mg CC é administrado após uma refeição gordurosa resulta em picos ligeiramente mais baixos em comparação com a mesma dose diária da formulação de liberação imediata administrada em três doses divididas. Isso pode ser, em parte, porque Adalat CC é menos biodisponível do que a formulação de liberação imediata.
nifedipina é extensivamente metabolizada em metabólitos inativos altamente solúveis em água, representando 60% a 80% da dose excretada na urina. Apenas vestígios (menos de 0,1% da dose) da forma inalterada podem ser detectados na urina. O restante é excretado nas fezes na forma metabolizada, provavelmente como resultado da excreção biliar.
A nifedipina é metabolizada através do sistema citocromo P450 3A4. Os fármacos que inibem ou induzem este sistema enzimático podem alterar a primeira passagem ou a depuração da nifedipina.
Não foram realizados estudos com Adalat 30mg CC em pacientes com insuficiência renal; no entanto, não foram relatadas alterações significativas na farmacocinética das cápsulas de liberação imediata de nifedipina em pacientes submetidos à hemodiálise ou diálise peritoneal ambulatorial crônica. Uma vez que a absorção de nifedipina de Adalat CC pode ser modificada por doença renal, deve-se ter cautela no tratamento de tais pacientes.
Como a nifedipina é metabolizada pelo sistema citocromo P450 3A4, sua farmacocinética pode ser alterada em pacientes com doença hepática crônica. Adalat 20mg CC não foi estudado em pacientes com doença hepática; no entanto, em pacientes com insuficiência hepática (cirrose hepática), a nifedipina tem uma meia-vida de eliminação mais longa e maior biodisponibilidade do que em voluntários saudáveis.
O grau de ligação proteica da nifedipina é alto (92%-98%). A ligação às proteínas pode ser bastante reduzida em pacientes com insuficiência renal ou hepática.
Após a administração de Adalat 30mg CC a homens e mulheres idosos saudáveis (idade > 60 anos), a Cmax média é 36% maior e a concentração plasmática média é 70% maior do que em pacientes mais jovens.
Em indivíduos saudáveis, a meia-vida de eliminação de uma formulação diferente de nifedipina de liberação sustentada foi maior em indivíduos idosos (6,7 h) em comparação com indivíduos jovens (3,8 h) após administração oral. Uma diminuição da depuração também foi observada em idosos (348 mL/min) em comparação com indivíduos jovens (519 mL/min) após administração intravenosa.
A coadministração de nifedipina com sumo de toranja resulta num aumento de até 2 vezes na AUC e Cmax devido à inibição do metabolismo de primeira passagem relacionado com CYP3A. A ingestão de toranja e sumo de toranja deve ser evitada enquanto estiver a tomar nifedipina.
Estudos clínicos
Adalat 10mg CC produziu reduções relacionadas à dose na pressão arterial sistólica e diastólica, conforme demonstrado em dois estudos duplo-cegos, randomizados e controlados por placebo nos quais mais de 350 pacientes foram tratados com Adalat CC 30, 60 ou 90 mg uma vez ao dia por 6 semanas. No primeiro estudo, Adalat 10mg CC foi administrado como monoterapia e no segundo estudo, Adalat 20mg CC foi adicionado a um betabloqueador em pacientes não controlados apenas com betabloqueador. Os resultados da pressão arterial média de vale (24 horas após a dose) desses estudos são mostrados abaixo:
REDUÇÕES MÉDIAS NA PRESSÃO ARTERIAL SUPINA DE CALHA (mmHg) SISTÓLICA/DIASTÓLICA
As razões vale/pico estimadas a partir do monitoramento da pressão arterial de 24 horas variaram de 41%-78% para a pressão arterial diastólica e 46%-91% para a pressão arterial sistólica.
Hemodinâmica
Como outros bloqueadores de canais lentos, a nifedipina exerce um efeito inotrópico negativo no tecido miocárdico isolado. Isso raramente, ou nunca, é visto em animais intactos ou no homem, provavelmente devido a respostas reflexas aos seus efeitos vasodilatadores. No homem, a nifedipina diminui a resistência vascular periférica, o que leva a uma queda nas pressões sistólica e diastólica, geralmente mínima em voluntários normotensos (menos de 5-10 mmHg sistólica), mas às vezes maior. Com Adalat 30mg CC, essas diminuições na pressão arterial não são acompanhadas por nenhuma alteração significativa na frequência cardíaca. Estudos hemodinâmicos da formulação de nifedipina de liberação imediata em pacientes com função ventricular normal geralmente encontraram um pequeno aumento no índice cardíaco sem grandes efeitos na fração de ejeção, pressão diastólica final do ventrículo esquerdo (LVEDP) ou volume (LVEDV). Em pacientes com função ventricular prejudicada, a maioria dos estudos agudos mostrou algum aumento na fração de ejeção e redução na pressão de enchimento do ventrículo esquerdo.
Efeitos eletrofisiológicos
Embora, como outros membros de sua classe, a nifedipina cause uma leve depressão da função do nó sinoatrial e da condução atrioventricular em preparações miocárdicas isoladas, tais efeitos não foram observados em estudos em animais intactos ou no homem. Em estudos eletrofisiológicos formais, predominantemente em pacientes com sistemas de condução normais, a nifedipina administrada como cápsula de liberação imediata não teve tendência a prolongar a condução atrioventricular ou o tempo de recuperação do nódulo sinusal, ou a diminuir a frequência sinusal.
INFORMAÇÃO DO PACIENTE
Adalat CC é um comprimido de liberação prolongada e deve ser engolido inteiro e tomado com o estômago vazio. Não deve ser administrado com alimentos. Não mastigue, divida ou esmague os comprimidos.
